Дерматология
Ключевые слова: регуляторные Т-клетки, псориаз, врожденный иммунитет.
Для цитирования: Маттоцци К., Салви М., Д`Эпиро С. и др. Роль регуляторных Т-клеток в патогенезе псориаза: обзор литературы // РМЖ. Дерматология. 2016. № 10. С. 642–650.
Для цитирования: Маттоцци К., Салви М., ДЭпиро С., Жанкристофоро С., Макалузо Л., Лучи С., Лал К., Калвиери С., Ричетта А.Д. Роль регуляторных Т-клеток в патогенезе псориаза: обзор литературы // РМЖ. 2016. №10. С. 642-650
C. Mattozzi, M. Salvi, S. D’Epiro, S. Giancristoforo, L. Macaluso, C. Luci, K. Lal, S. Calvieri, A. G. Richetta
Department of Dermatology and Venereology, University of Rome, Italy
Psoriasis is a common chronic relapsing inflammatory cutaneous disease; the main role in the inflammation of this conditionis played by lymphocyte Th1, Th17 and their cytokines. The activity of these cells is modulated by a particularkind of T cells recently described: the T regulatory cells (Treg). These are able to inhibit the immunological response and to maintain the cutaneous immunological homeostasis, thus preventing autoimmunity against self antigens. Few data are available in the literature as to Treg in psoriasis; several studies demonstrate that the function of these cells is impaired in this condition and treatments for psoriasis may increase the number and activity of Treg. The role of these cells in the pathogenesis of psoriasis is very important to understand how they may contribute to the development of this cutaneous disorder. In the near future it would be possible to target therapies at these defects, improving the activity of these cells and maintaining cutaneous homeostasis, preventing psoriasis or other inflammatory cutaneous conditions.
Key words: regulatory T cells, psoriasis, innate immunity.
For citation: C. Mattozzi, M. Salvi, S. D’Epiro et al. Importance of Regulatory T Cells in the Pathogenesis of Psoriasis: Review of the Literature // RMJ. Dermatology. 2016. № 10. P. 642–650.
Обзор литературы посвящен роли регуляторных Т-клеток в патогенезе псориаза
Введение
Псориаз является распространенным хроническим рецидивирующим воспалительным кожным заболеванием, связанным с аномальной пролиферацией кератиноцитов, гиперплазией сосудов и инфильтрацией дермы и эпидермиса воспалительными клетками [1], что приводит к значительному ухудшению качества жизни пациентов. Распространенность псориаза варьирует от 1 до 4% в популяции, генез заболевания определяется как многофакторный [2].
Было предложено несколько гипотез патогенеза псориаза. Ранее псориаз считался заболеванием, вызванным повышенной активностью кератиноцитов; однако недавние исследования указывают на ключевую роль лимфоцитов в патогенезе этого заболевания [3].
Элементы врожденного иммунитета, такие как дендритные клетки, естественные киллеры (NK), Т-клетки, нейтрофильные гранулоциты и макрофаги, а также Т-лимфоциты, CD8+ и CD4+ (Т-хелперы 1, (Th1), Th17), представляющие приобретенный иммунитет, в равной мере участвуют в иммунном ответе при псориазе [4, 5].
Не ясно, связано ли развитие заболевания с кератиноцитами или лимфоцитами, но эффективность иммунодепрессантов и иммуномодулирующих препаратов, таких как циклоспорин, метотрексат, и биологической терапии [6] свидетельствует о важной роли этих клеток и их цитокинов в патогенезе псориаза.
В патофизиологии воспаления при этом заболевании ведущую роль играют лимфоциты Th1, Th17 и их цитокины [фактор некроза опухоли (ФНО) α, интерферон (ИФН) –γ, интерлейкин (ИЛ) -6, ИЛ-8, ИЛ-12, ИЛ-22 и ИЛ-23], а также взаимодействие между этими клетками, кератиноцитами и антигенпрезентирующими клетками (AПК), что способствует возникновению и поддержанию патологического эпидермального роста [7].
Активность этих клеток модулируется недавно описанными Т-лимфоцитами определенного типа – регуляторными Т-клетками (Treg-клетки). Treg-клетки способны ингибировать иммунологические ответы и поддерживать кожный иммунологический гомеостаз, предотвращая аутоиммунные реакции против аутоантигенов. Они играют роль при нескольких аутоиммунных заболеваниях, таких как рассеянный склероз (РС), аутоиммунный диабет 1-го типа, воспалительные заболевания кишечника (ВЗК), тяжелые формы аллергии (в т. ч. атопический дерматит), ревматоидный артрит, полигландулярный синдром (ПГС) 2-го типа, иммунная дисрегуляция, полиэндокринопатии, энтеропатии, Х-хромосомный синдром и псориаз [8].
В настоящем обзоре анализируется роль Treg-клеток в патогенезе псориаза.
Регуляторные Т-клетки
CD4+Foxp3+ регуляторные Т-лимфоциты (Treg-клетки) имеют важное значение для иммунного гомеостаза и представляют собой подкласс CD4+T-клеточных рецепторов (ТКР) αβ+. Отсутствие Treg-клеток или фактора транскрипции Foxp3, экспрессируемого ими, приводит к развитию молниеносного аутоиммунного полиорганного поражения, что было продемонстрировано на мышах, у которых отсутствовали или присутствовали в значительно меньшем количестве Treg-клетки, что привело к развитию аутоиммунного гастрита, тиреоидита, сахарного диабета и ВЗК [9, 10].
Несколько исследований на животных моделях продемонстрировали, что дефекты в CD4+CD25+Foxp3+Т-клетках ответственны за развитие аутоиммунных реакций, а восстановление Treg-клеток может обратить вспять эту реакцию [11]. Поддержание иммунного гомеостаза в организме человека играет особенно важную роль при тяжелых воспалительных и аутоиммунных процессах, возникающих у пациентов, которые страдают иммунной дисрегуляцией, полиэндокринопатией, энтеропатией и Х-сцепленным синдромом. На самом деле у этих пациентов развивается несколько аутоантител и аутоиммунных заболеваний, в связи с нарушенной регуляцией иммунной системы Treg-клетками, и без пересадки костного мозга они умирают в молодом возрасте [9].
В отличие от других CD4+Т-клеток, которые дифференцируются вне тимуса из обычных CD4+Т-клеток, Treg-клетки могут развиваться в качестве отдельной популяции в тимусе. По этой причине Treg-клетки часто рассматриваются в качестве отдельной клеточной линии. Тем не менее степень, в которой эти клетки являются независимыми от обычных Т-клеток, в настоящее время не до конца определена [12, 13].
Treg-клетки продемонстрировали высокую степень устойчивости к сохранению фенотипических и функциональных свойств и способность адаптироваться к окружающей среде.
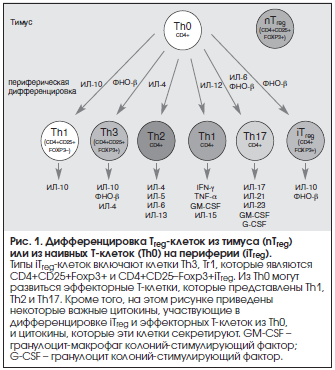
Циркулирующие Treg-клетки состоят из 2-х основных групп (популяций): 1) тимической, которая, как представляется, отвечает критериям клеточной линии, и 2) образующейся адаптивно и, по всей видимости, не обладающей специфическими характеристиками.
Первая группа представлена естественными Treg-клетками (nTreg), которые формируются в тимусе на ранних стадиях развития плода (14-я неделя гестации). Клетки nTreg дифференцируются от тимоцитов, которые экспрессируют TCRs с повышенным сродством к главному комплексу гистосовместимости; там они дифференцируются и экспрессируют CD25, α-цепь рецептора ИЛ-2 и Foxp3. Вторая группа индуцируется внешними антигенами и экстратимическими сигналами, которые могут регулироваться Foxp3 в обычных Т–клетках, превращая их в индуцированные Treg-клетки (iTreg), CD4+CD25+клетки, которые переходят из предшественников CD25 в периферические лимфоидные органы [14, 15].
Клетки nTreg и iTreg имеют сходный фенотип и способны модулировать воспаление несколькими механизмами действия, которые еще не полностью изучены. iTreg, индуцированный ИЛ-2 и трансформирующий фактор роста β (TGF-β) имеют сходный фенотип, но они отличаются от nTreg, т. к. генерируются из наивных CD4+клеток (не имевших контакта с антигеном) и требуют дополнительной стимуляции для разработки маркеров памяти. CD4+CD45RA+CD25+клеток в наивных фракциях мало, однако они обладают самым высоким регенеративным потенциалом [16] и могут значительно повышать число клеток CD4+CD25, которые станут CD25+iTreg.
Несмотря на то что ИЛ-2 и TGF-β требуются только для генерации iTreg-клеток, оба этих цитокина необходимы для поддержания Foxp3, экспрессируемого nTreg и iTreg-клетками [17]; экспрессия Foxp3 nTreg-клетками тем не менее более стабильна, чем экспрессия iTreg-клетками, возможно, потому, что эти клетки непрерывно стимулируются аутоантигенами. Foxp3 экспрессируется человеческими и мышиными iTreg-клетками[18, 19].
Действие Treg-клеток направлено главным образом против Т-клеток и/или дендритных клеток – эти клетки могут быть ингибированы 3-мя основными моделями регуляторных процессов: 1) цитокинами; 2) прямым ингибированием (от контакта клетки с клеткой); 3) конкуренцией за факторы роста.
Рассмотрим подробнее примеры механизмов, с помощью которых Treg-клетки могут модулировать иммунную систему путем контактного ингибирования от клетки к клетке. ФНО-β вызывает прямой подавляющий эффект эффекторных Т-клеток, в то время как ИЛ-10 косвенно ингибирует созревание АПК [20]. Фибриногеноподобный белок-2 способен индуцировать апоптоз эффекторных Т-клеток и предотвращать созревание дендритных клеток [21]. Гранзим A/B и перфорин вызывают апоптоз эффекторных Т–клеток [22], а продукция аденозина CD39/73 – расщепление аденозинтрифосфата (АТФ), что приводит к остановке клеточного цикла в эффекторных Т-клетках и предотвращает их созревание. Кроме того, он уменьшает антигенпрезентирующую способность дендритных клеток путем связывания с A2A-рецепторами этих типов клеток [23]. Связывание галектина-1 с эффекторными Т-клетками и дендритными клетками может остановить клеточный цикл и/или вызвать апоптоз [24], CTLA-4 и CD80/86 связываются с дендритными клетками, в результате чего снижается костимуляция и презентация антигенов [25]; ген активации лимфоцитов-3 (CD223, гомолог CD4) предотвращает созревание и снижает способность представлять антиген в дендритных клетках, связанный с молекулой главного комплекса гистосовместимости II [26]; нейропилин-1, по всей видимости, уменьшает антигенную презентацию на дендритных клетках [27].
Treg-клетки также могут предотвращать контакт между растворимыми факторами и другими воспалительными клетками, такими как Т-клетки и дендритные клетки, путем связывания и депривации растворимых модуляторов, ведущих к ингибированию иммунной системы [28]. Таким образом, Treg-клетки обладают различными механизмами подавления иммунного ответа (табл. 1).
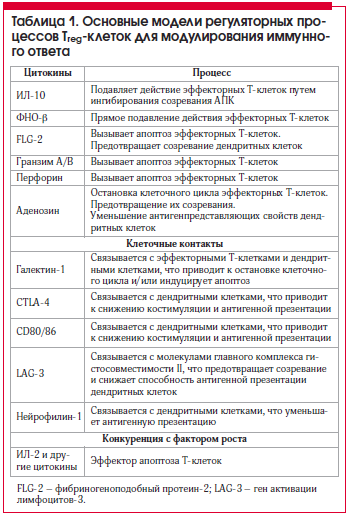
Клетки nTreg тимусного происхождения CD4+CD25+FOXP3+Т-клетки способны подавлять следующие типы клеток: CD4+Т-клетки, дендритные клетки, CD8+Т-клетки, NK Т-клетки, NK-клетки, моноциты/макрофаги, В-клетки, тучные клетки, базофилы, эозинофилы и остеобласты [29, 30].
Клетки iTreg разделены на два общих клеточных типа: Т–регуляторные клетки 1-го типа (Tr1) и клетки Th3Treg. Tr1–клетки способны продуцировать значительное количество ИЛ-10 и ФНО-β у человека и у мышей, а также секретировать в небольшом объеме ИЛ-2, ИЛ-5, IFN-γ и ИЛ–15, которые могут поддерживать Tr1-клеточную пролиферацию даже без активации ТКР [31, 32].
Ингибирующая активность Tr1 осуществляется посредством растворимых медиаторов, что может быть нивелировано в присутствии анти-ИЛ-10 антител in vitro [31, 32].
Th3-клетки секретируют в основном ФНО-β, который имеет основополагающее значение для трансформации их из CD4+наивных Т-клеток и для пролиферации. Они играют ключевую роль в оральной толерантности к чужеродным антигенам и аутоиммунных состояниях [33, 34]. Их регуляторная активность обусловлена главным образом производством цитокина (т. е. ФНО-β), также они взаимодействуют с Th17-клетками (рис. 1) [35].
Другие представленные популяции Т-клеток демонстрируют наличие регуляторной функции. В последнее время также были описаны определенные типы В-клеток с регуляторной функцией – регуляторные В-клетки [36].
Ключевую роль в развитии и функционировании Treg-клеток играет Foxp3 – транскрипционный фактор семейства Forkhead, молекулярный маркер и фактор спецификации последовательности клеточных поколений для Treg-клеток. Foxp3 имеет фундаментальное значение при дифференцировке nTreg-клеток в тимусе, а продукт его трансляции регулирует множество генов, необходимых для супрессорной активности, пролиферативной и метаболической функции Treg-клеток и вытесняет альтернативные пути Т-клеточной дифференцировки [10, 37].
Уровни Foxp3 увеличиваются под действием нескольких цитокинов, таких как ИЛ-2, ФНО-β, ретиноевая кислота, 17-β-эстрадиол, и путем передачи сигнала посредством сфингазина-1-фосфат рецептора 1 [38].
Отсутствие функциональных Treg-клеток у мышей с мутацией со сдвигом рамки гена Foxp3, ответственной за фенотип «scurfy», который является фатальным для гомозиготных самцов сразу после рождения из-за гиперпродукции CD4+Т-лимфоцитов и других типов клеток, приводит к неконтролируемой секреции цитокинов с обширной полиорганной инфильтрацией [39].
Treg-клетки впервые были выявлены при их экспрессии из CD25. Кроме того, CD25 также экспрессируют недавно активированные Т-клетки, что приводит к включению CD4+CD25+эффекторных Т-клеток в популяцию Treg-клеток. Иcпользование проточной цитометрии на основе анализа экспрессии Foxp3 в Т-клетках стало «золотым стандартом» для определения Treg-клеток после открытия того факта, что экспрессия Foxp3 играет ключевую роль в дифференцировке и поддержании Treg-клеток [40]. Тем не менее стало очевидным, что Foxp3 также может быть экспрессирован и эффекторными Т-клетками после активации [41], повышая вероятность того, что при любой оценке числа или функции Treg-клеток в анализ могут быть включены недавно активированные эффекторные Т-клетки в Treg-клеточной популяции. Кроме того, Foxp3 является ядерным белком и для оценки его экспрессии в Т-клетках необходима фиксация и пермебилизации клеток, что приводит к невозможности получения жизнеспособных клеток для проведения дальнейшего функционального анализа.
Недостатки Т-клеточной супрессии
Изменение функции Treg-клеток приводит к невозможности подавления иммунного ответа при аутоиммунных заболеваниях, т. к. эти клетки являются основными в иммунном гомеостазе. Существует несколько механизмов, с помощью которых Treg-клетки влияют на активацию Т-клеток и дендритных клеток.
Регулирование Treg-клетками при аутоиммунитете может быть осуществлено путем изменения количества Т–клеток, нарушения модели регуляторного процесса и механизмами, с помощью которых эффекторные Т-клетки противостоят Treg-клеткам.
Доказательства того, что неадекватное количество Treg-клеток может способствовать развитию аутоиммунных заболеваний, были получены на модели у мышей «scurfy» с возникновением агрессивной аутоиммунной реакции, что косвенно может свидетельствовать о возможном успешном лечении аутоиммунных заболеваний у мышей посредством адаптивной передачи Treg-клеток дикого типа [9, 11].
Число Treg-клеток зависит от их развития, персистирования и пролиферации на периферии и их миграции в места воспаления. Генетические факторы, по всей видимости, играют важную роль для Treg-клеток тимического происхождения. Выход из тимуса и дальнейшее существование Treg-клеток регулируются факторами, которые увеличивают экспрессию Foxp3, связанную с CD28, ФНО-β, дендритными клетками и общим рецептором γ-цепи цитокина (ИЛ-2, ИЛ-4, ИЛ-7 и ИЛ-15) [42–44].
Дисфункцию Treg-клеток трудно проанализировать и продемонстрировать in vivo, в связи с чем необходимо создание моделей для оценки активности этих клеток при воспалении in vivo. Как уже упоминалось ранее, нарушенная активность Treg-клеток является результатом дефекта одного или нескольких из многочисленных механизмов действия этих клеток. Это может происходить в условиях, в которых имеется неадекватная экспрессия молекул клеточной поверхности, участвующих в ответе на действие ингибирующих цитокинов или межклеточных модуляций (например, CTLA-4, CD39, ген активации лимфоцитов 3, гранзим А и CD95, также известный как FAS), или в результате снижения способности продуцировать растворимые факторы (такие как ФНО-β, ИЛ-10 и ИЛ-35), которые участвуют в некоторых аспектах супрессии [45]. Генетические факторы также могут быть вовлечены в эти механизмы, а местные иммунные условия могут влиять на действие Treg-клеток.
Другой механизм, с помощью которого происходит нарушение функции Treg-клеток, основан на резистентности эффекторных Т-клеток к сигналам ингибирования. Внутриклеточная резистентность к супрессии была показана в CD4+Т-клетках памяти и клетках Th17 [46]. ИЛ-2, ИЛ-4, ИЛ-7 и ИЛ-15, поддерживающие пролиферацию эффекторных Т-клеток, избегая ингибирующие сигналы Treg-клеток, приводят к тому, что эти цитокины в краткосрочной перспективе позволяют эффекторным Т-клеткам обойти супрессию Treg-клеток. Кроме того, несколько членов семейства рецепторов ФНО также вовлечены в этот процесс.
Treg-клетки и аутоиммунные заболевания
Нарушенная активность Treg-клеток наблюдается при нескольких аутоиммунных заболеваниях. При данной патологии обычно изменяется количество Treg-клеток или происходят изменения в системе ингибирования, при этом аутореактивные Т- и В-клетки способствуют иммунологической реакции против аутоантигенов и развитию аутоиммунных заболеваний. Нарушение функции Treg-клеток может быть связано с полиорганным иммунным ответом, что способствует чрезмерному повреждению тканей.
Роль количества Treg-клеток при аутоиммунных расстройствах была продемонстрирована при нескольких иммуноопосредованных заболеваниях. Значимость функциональной активности этих клеток была показана в нескольких исследованиях, в которых иммуносупрессивная терапия увеличивала их количество.
Нарушение функции Treg-клеток имеет значение при многих аутоиммунных заболеваниях, таких как: диабет 1-го типа, РС, системная красная волчанка (СКВ), ревматоидный артрит, ВЗК и некоторые кожные аутоиммунные заболевания.
Сахарный диабет 1-го типа является аутоиммунным заболеванием, при котором происходит постепенная деструкция панкреатических островков поджелудочной железы. У NOD мышей (мыши с диабетом без ожирения) было показано, что количество Treg-клеток уменьшается по мере прогрессирования заболевания и что эффекторные Т-клетки становятся резистентными к супрессии, а введение Treg-клеток или лечение с помощью ИЛ-2 улучшает течение болезни [47–49].
Количество Treg-клеток у больных диабетом является предметом дискуссий. По результатам первоначальных исследований регистрировалось значительное уменьшение количества CD4+CD25+Treg-клеток при диабете [50], в то время как по результатам других исследований не выявлено каких-либо различий в количестве Treg-клеток[51, 52]. В работах было показано снижение способности Treg-клеток реагировать на ИЛ-2 (дефект сигнального рецептора ИЛ-2 на CD4+CD25+Т-клетках) [53] и недостаточное количество Treg-клеток в поджелудочной железе пациентов с диабетом 1-го типа [54]. Также было продемонстрировано, что имеется внутриклеточная резистентность эффекторных Т-клеток к подавлению Treg-клетками при диабете 1-го типа [55, 56].
РС является аутоиммунным заболеванием, которое характеризуется воспалительным поражением и дегенерацией центральной нервной системы. На модели РС у мышей было показано, что при отсутствии Treg-клеток их введение снижало частоту возникновения этого заболевания [40, 57]. В большинстве исследований не было обнаружено различий, касаемых количества Treg-клеток в крови пациентов, страдающих РС, и пациентов контрольной группы [58–60], однако было выявлено увеличение количества Treg-клеток в цереброспинальной жидкости [60]. В некоторых исследованиях было показано, что количество Treg-клеток при РС в процессе лечения с использованием IFN-β менялось [61–63]. В некоторых работах продемонстрировано нарушение супрессивной способности Treg-клеток, хотя корреляции между их функцией и активностью заболевания не выявлено [64, 65]. Кроме того, отмечается, что при РС способность Treg-клеток продуцировать ИЛ-10 нарушена [65], а эффекторные Т-клетки устойчивы к супрессии [64].
СКВ – аутоиммунное заболевание, которое характеризуется наличием аутоантител и иммунных комплексов, направленных против нескольких органов, в том числе кожи, суставов, почек и центральной нервной системы. Ряд исследований продемонстрировали, что у пациентов с СКВ процент CD4+CD25hi-клеток снижается и что это снижение обратно коррелирует с активностью болезни [66–68]. Несмотря на то что в исследованиях не обнаружено нарушение функции Treg–клеток [69], некоторые авторы показали снижение активности этих клеток [70]. Была изучена резистентность эффекторных Т-клеток к Treg-клеткам при СКВ, но полученные результаты носят противоречивый характер, поскольку некоторые исследования не обнаружили нарушений [71, 72], а два последних исследования продемонстрировали, что эффекторные Т-клетки могут избегать супрессии при СКВ [73, 74].
Ревматоидный артрит является аутоиммунным заболеванием, при котором в основном поражаются синовиальные оболочки. В нескольких исследованиях было показано, что Treg-клетки в периферической крови больных исследуемой группы не отличаются от таковых у пациентов контрольной группы [75–77], однако имеются данные о том, что процент Treg-клеток выше в синовиальной жидкости у пациентов с ревматоидным артритом, чем у пациентов контрольной группы [75–77]. Несмотря на результаты исследований, в которых не было выявлено различий в функции Treg-клеток у пациентов с ревматоидным артритом [76, 77], у них был выявлен фокальный дефект в продукции IFN-γ и ФНО [78] и в сигнальном рецепторе CTLA-4-опосредованного ингибирования Т-клеток [79]. У пациентов, получающих лечение анти-ФНО-α-терапией, было выявлено увеличение числа периферических Treg-клеток [78].
ВЗК относятся к группе воспалительных заболеваний толстой и тонкой кишки. Два основных типа ВЗК – это неспецифический язвенный колит и болезнь Крона. В исследованиях описано увеличение количества CD4+CD25+Foxp3+Т-клеток у лиц с болезнью Крона [80, 81], в то время как, по данным других авторов, было показано, что число CD4+CD25hiFoxp3+Т-клеток было ниже у больных с активными формами ВЗК [82–84]. Исследования кишечника продемонстрировали увеличение количества Treg-клеток в собственной пластинке слизистой оболочки и в брыжеечных лимфатических узлах, особенно при наличии воспалительной реакции [82, 83]. Функциональные исследования Treg-клеток и реакции эффекторных Т-клеток на супрессию показали результаты, аналогичные таковым в контрольной группе [85–87].
В нескольких исследованиях была проанализирована роль Treg-клеток при кожных заболеваниях, предполагалось, что они могут быть вовлечены в патогенез воспаления кожи при аутоиммунных поражениях.
Quaglino и соавт. [88] продемонстрировали, что абсолютные значения и доля CD4+CD25brightFoxp3+клеток значительно снижаются при буллезном пемфигоиде по сравнению со здоровой группой контроля, а также показали снижение ФНО-β и ИЛ-10 в сыворотке крови и уменьшение циркулирующих CD4+CD25brightFoxp3+клеток у пациентов с системной и локализованной склеродермией, по сравнению с контрольной группой. Уменьшение количества Treg-клеток, ФНО-β и ИЛ-10 в сыворотке крови может быть причиной снижения толерантности и регистрируется как при системной, так и при локализованной склеродермии [89].
Дерматомиозит (ДМ) – аутоиммунное заболевание, этиопатогенез которого до сих пор неизвестен. При данном заболевании поражаются в первую очередь кожа и мышцы; однако в патологический процесс могут вовлекаться и другие органы, в том числе сердце и легкие. В исследованиях было изучено и охарактеризовано количество Treg-клеток в периферической крови пациентов с ДМ, и полученный результат сравнили с количеством этих клеток при других заболеваниях соединительной ткани, таких как СКВ, системная склеродермия, синдром Шегрена, а также у здоровых добровольцев. Было выявлено уменьшение доли Treg-клеток в периферической крови у больных по сравнению с контролем, независимо от конкретного заболевания соединительной ткани [90]. В работе Antiga и соавт. [91] было исследовано количество CD4+CD25+Treg-клеток в периферической крови, их основных эффекторных цитокинов в повреждениях кожи и в сыворотке у больных ДМ, полученные результаты сравнили с результатами при СКВ, псориазе, атопическом дерматите и у здоровых добровольцев. В результате было продемонстрировано, что количество CD4+CD25+Foxp3+Treg-клеток в периферической крови пациентов с ДМ было значительно меньше по сравнению с таковыми у здоровых людей, в то время как в других клеточных популяциях значимых различий не выявлено. Уровень ФНО-β и ИЛ-10 в сыворотке крови был значительно ниже у пациентов с ДМ по сравнению с таковым у здоровых добровольцев в контрольной группе [91].
Treg-клетки и псориаз
В литературе представлено лишь небольшое количество данных, посвященных роли Treg-клеток в патогенезе псориаза. Анализируя роль приобретенного иммунитета и активности эффекторных Т-клеток при данном заболевании, можно сделать вывод, что нарушенная активность и/или сниженное количество Treg-клеток могут иметь значение в патогенезе этого заболевания, нарушая гомеостаз кожи и регуляцию иммунного ответа.
У предрасположенных лиц некоторые воспалительные триггеры, возможно, не могут в должной степени нивелироваться Treg-клетками, что благоприятствует развитию воспаления и, следовательно, формированию псориатических бляшек.
Цитокины производятся различными иммунными клетками кожи, в том числе дендритными клетками и макрофагами, они могут быть ответственны за разные виды Т-клеток (в коже и циркулирующих), таких как Th17-клетки, которые синтезируют ИЛ-17 и ФНО-α, и Th22-клетки, которые, в свою очередь, синтезируют ИЛ-22 [92]; в псориатических бляшках в дополнение к вовлечению воспалительных видов Т-клеток, было выявлено увеличение количества Foxp3+клеточной инфильтрации. Было показано, что повышение их уровня коррелирует с тяжестью заболевания (рис. 2) [93]. В этом же исследовании продемонстрировано, что в дополнение к повышенному уровню Treg-клеток имеется также увеличение отношения Th17/Treg, которое, как было установлено, коррелирует с тяжестью заболевания, что свидетельствует о том, что дисбаланс этих видов Т-клеток может лимитировать эффективность Treg-клеток [93].

Выявлено, что секреция ИЛ-17 CD4+Т-клетками не регулируется Treg-клетками, несмотря на то, что они ответственны за значимое ингибирование пролиферации CD4+T-клеток и продукцию IFN-γ [93]. Эти результаты открывают новую информацию о связи между Th17- и Treg-клетками, понимание которой будет способствовать дальнейшему осознанию патогенеза псориаза.
Zhang и соавт. [94] продемонстрировали, что CD4+CD25+Т-клетки, дифференцированные in vitro из гематопоэтических клеток пациентов с псориазом, обладали регуляторной дисфункцией. Дисфункция CD4+CD25+Т-клеток при псориазе может быть вызвана внутриклеточной генетической программой, переданной из гемопоэтических клеток костномозгового происхождения [94].
В отличие от результатов приведенного выше исследования, в 2-х других работах не выявлено статистически значимых различий между количеством CD4+CD25+Treg-клеток в периферической крови у пациентов с псориазом по сравнению с таковым в контрольной группе [93] и даже показано увеличение числа Treg-клеток в псориатических поражениях кожи и в периферической крови [95]. Вполне возможно, что фаза псориаза (активное распространение заболевания по сравнению со стабилизацией процесса), тяжесть клинической картины (легкая, средняя, тяжелая) и место биопсии (центр или края бляшки) связаны с полученными несоответствиями [96].
Treg-клетки были обнаружены преимущественно в верхних слоях дермы и эпидермиса, и было показано, что экспрессия этих клеток при псориазе такая же или несколько меньше, чем при экземе [97, 98].
Treg-клетки были изучены в периферической крови и в измененной коже пациентов с псориазом. В ряде исследований получены различные данные о количестве этих клеток в крови. Yan et al. [98] показали, что количество Treg-клеток в периферической крови увеличивается при псориазе и что их уровень положительно коррелирует с тяжестью болезни. Chen et al. [99] обнаружили, что относительный дисбаланс в пользу эффекторных Т-клеток присутствует как в периферической крови, так и в псориатически пораженной коже.
По результатам выполненных нами исследований выявлено, что число Treg-клеток в периферической крови пациентов, страдающих псориазом, уменьшается, а на фоне анти-ФНО-α лечения их количество увеличивается [100]. Результаты исследований Treg-клеток у пациентов, получающих инфликсимаб, показали, что их количество увеличивается [101]. Quaglino et al. [101] проанализировали экспрессию нескольких генов, связанных с различным Т-клеточным иммунным ответом (Th1, Th2, Th17 и Treg), и сопоставили их с клиническим течением заболевания. Исходно они обнаружили повышение клеток Th1 и Th17 вместе с понижением Treg-клеток, в то время как после лечения этанерцептом существенно уменьшилось отношение Th1/Th17 [102]. Эти данные, а также результаты, полученные in vitro, демонстрируют, что ФНО-α значимо ингибирует подавляющую функцию CD4+CD25 клеток. Chen et al. [99], проанализировав уровни Treg-клеток периферической крови и кожи, выявили их более высокий уровень в стабильных или регрессирующих поражениях и в редуцирующихся или стабильных бляшках.
В настоящее время не существует общепринятого мнения о влиянии циклоспорина на Treg-клетки при псориазе, однако мы располагаем результатами 3-х наблюдений, в которых регистрировалось снижение количества этих клеток в периферической крови, что обратно коррелировало с тяжестью заболевания. Данный факт можно объяснить механизмом действия самого циклоспорина на Т-клетки. Этот препарат не является селективным и действует не только на Treg-клетки, но и на Th1 и Th17, ингибируя Т-клеточный ответ и приводя к клиническому улучшению псориатических поражений [103]. Кроме того, циклоспорин уменьшает выработку ИЛ-2, а также может предотвращать экспрессию рецептора ИЛ-2 на предшественник Т-лимфоцита [104].
В результате применения узкополосной ультрафиолетовой терапии и ванн с псораленами + ультрафиолет А было продемонстрировано увеличение локальных уровней CD4+CD25brightFoxp3+клеток, что способствовало модуляции воспаления и улучшению клинического течения псориаза [105, 106].
Sugiyama et al. [107] продемонстрировали, что пролиферативная способность эффекторных Т-клеток у пациентов с псориазом возрастает по сравнению с таковой у пациентов контрольной группы и может способствовать резистентности Т-лимфоцитов к ингибированию Treg-клеток. Эффекторные Т-клетки и популяции Treg-клеток в поврежденной коже обладают повышенной экспрессией рецептора ИЛ-6 на клеточной поверхности, при этом уровень этого цитокина увеличивается в псориатических бляшках, что свидетельствует о том, что нарушение регуляции воспаления может быть связано с ИЛ-6 [108]. Данное предположение подтверждено исследованием совместной культуры Treg и эффекторных Т-клеток от пациентов, страдающих псориазом, с антителами против ИЛ-6 [109]. Можно сделать вывод, что этот цитокин способен усилить резистентность эффекторных Т-клеток к супрессии опосредованной Treg-клетками, возможно, также ингибируя функцию Treg-клеток.
Таким образом, можно обозначить 2 основные причины нарушения супрессии Treg-клетками при псориазе: нарушение функции Treg-клеток и резистентность эффекторных Т-клеток к супрессии.
Последние данные указывают на возможность того, что Treg-клетки пациентов, страдающих псориазом, могут дифференцироваться in vivo в Th17-клетки в провоспалительных условиях.
ИЛ-23 значимо повышает клеточную дифференцировку Treg-клеток у пациентов, страдающих псориазом, что связано со снижением уровня Foxp3 [110]. Эти данные позволяют предположить, что Treg-клетки пациентов с тяжелыми формами псориаза особенно склонны к дифференцировке в ИЛ-17A-продуцирующие клетки, что может быть использовано для создания новых методов иммунотерапии.
Заключение
Псориаз – кожное хроническое воспалительное заболевание. Новые аспекты патогенеза псориаза заключаются в открытии важной роли Treg-клеток в развитии этого заболевания, что коррелирует с уменьшением ингибирующей активности этих клеток. Они естественным образом образуются в тимусе и содержат около 5–10% зрелых CD4+Т-хелперов, что было выявлено как у мышей, так и у людей. Treg-клетки играют фундаментальную роль в иммунном гомеостазе и в патогенезе нескольких аутоиммунных заболеваний, таких как диабет 1-го типа, РС, СКВ, ревматоидный артрит, ВЗК и псориаз.
Имеется лишь небольшое количество противоречивых данных о роли Treg-клеток при псориазе.
Уменьшение количества этих клеток с понижением способности продуцировать подавляющие цитокины, по всей видимости, вносит свой вклад в формирование псориатических поражений, также возможно наличие «резистентных» эффекторных Т-клеток к ингибированию Treg-клетками.
На животных моделях продемонстрировано, что увеличение числа Treg-клеток в месте воспаления, вероятно, является терапевтическим при аутоиммунном ответе. Это может быть достигнуто в организме человека путем адаптивного переноса in vitro аутологичных Treg-клеток или путем использования агентов, которые способствуют пролиферации Тreg-клеток, их выживанию и индукции.
В настоящее время отсутствует согласованное мнение о роли этих клеток в патогенезе псориаза. Важно понимать, каким образом они вносят свой вклад в развитие этого заболевания. Вот почему необходимо проведение дальнейших исследований, которые будут направлены на определение роли Treg-клеток в индуцировании псориаза, изменении гомеостаза кожи или возможности подавления воспалительных реакций.
Будущие исследования крайне важны для формирования возможности разработать таргетную терапию псориаза, способствующую улучшению функции Treg-клеток и поддерживающую гомеостаз кожи. Создание такой терапии, возможно, помогло бы предотвратить развитие псориаза и других воспалительных кожных поражений, улучшить клиническое течение и уменьшить прогрессирование заболевания.
Реферат подготовлен по материалам статьи Carlo Mattozzi, Monica Salvi Sara, D’Epiro Simona, Giancristoforo Laura, Macaluso Cecilia, Luci Karan, Lal Stefano, Calvieri Antonio, Giovanni Richetta. Dermatology. 2013. Vol. 227. P. 134–145. DOI: 10.1159/000353398
Литература
1. Lowes M.A., Bowcock A.M., Krueger J.G. Pathogenesis and therapy of psoriasis // Nature 2007. Vol. 445. P. 886–873.
2. Salgo R., Thaçi D. Treatment of moderate-to-severe plaque psoriasis // G Ital Dermatol Venereol. 2009. Vol. 144. Р. 701–711.
3. Monteleone G., Pallone F., MacDonald T.T. et al. Psoriasis: from pathogenesis to novel therapeutic approaches // Clin Sci (Lond) 2010 . Vol. 120. Р. 1–11.
4. Mattozzi C., Richetta A.G., Cantisani C. et al. Psoriasis: new insight about pathogenesis, role of barrier organ integrity, NLR/CATER- PILLER family genes and microbial flora // J Dermatol. 2012. Vol. 39. Р. 752–760.
5. Gaspari A.A. Innate and adaptive immunity and the pathophysiology of psoriasis // J Am Acad Dermatol. 2006 . Vol. 54. Р. S67–S80.
6. Gisondi P., Girolomoni G. Biologic therapy in psoriasis: a new therapeutic approach // Autoimmun Rev. 2007. Vol. 6. Р. 515–519.
7. Lima HC., Kimball A.B. Targeting IL-23: insights into the pathogenesis and the treatment of psoriasis // Indian J Dermatol. 2010. Vol. 55. Р. 171– 175.
8. Buckner J.H. Mechanisms of impaired regulation by CD4(+)CD25(+)FOXP3(+) regulatory T cells in human autoimmune diseases // Nat Rev Immunol. 2010. Vol. 10. Р. 849–859.
9. Ochs H.D., Gambineri E., Torgerson TR. IPEX, FOXP3 and regulatory T-cells: a model for autoimmunity // Immunol Res. 2007. Vol. 38. Р. 112– 121.
10. Brunkow M.E., Jeffery E.W., Hjerrild K.A. et al. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse // Nat Genet. 2001. Vol. 27. Р. 68–73.
11. Sakaguchi S., Ono M., Setoguchi R. et al. Foxp3+ CD25+ CD4+ natural regulatory T-cells in dominant self-tolerance and autoimmune disease // Immunol Rev. 2006. Vol. 212. Р. 8–27.
12. Zhou X., Bailey-Bucktrout S., Jeker L.T., Bluestone J.A. Plasticity of CD4(+) FoxP3(+) T cell // Curr Opin Immunol 2009. Vol. 21. Р. 281–285.
13. Komatsu N., Mariotti-Ferrandiz M.E., Wang Y., Malissen B., Waldmann H., Hori S. Heterogeneity of natural Foxp3+T cells: a committed regulatory T-cell lineage and an uncommitted minor population retaining plasticity // Proc Natl Acad Sci USA. 2009. Vol. 106. Р. 1903–1908.
14. Curotto de Lafaille M.A., Lafaille J.J. Natural and adaptive foxp3+ regulatory T cells: more of the same or a division of labor? // Immunity. 2009. Vol. 30. Р. 626–635.
15. Horwitz DA., Zheng SG., Gray JD. Natural and TGF-beta-induced Foxp3(+)CD4(+) CD25(+) regulatory T cells are not mirror images of each other // Trends Immunol. 2008. Vol. 29. Р. 429–435.
16. Hoffmann P., Eder R., Boeld T.J. et al. Only the CD45RA+ subpopulation of CD4+CD25high T cells gives rise to homogeneous regulatory T-cell lines upon in vitro expansion // Blood 2006. Vol. 108. Р. 4260–4267.
17. Zheng SG., Wang J., Wang P. et al. IL-2 is essential for TGF-beta to convert naïve CD4+CD25– cells to CD25+Foxp3+ regulatory T cells and for expansion of these cells // J Immunol 2007. Vol. 178. Р. 2018–2027.
18. Selvaraj R.K., Geiger T.L. A kinetic and dynamic analysis of Foxp3 induced in T cells by TGF-beta // J Immunol. 2007. Vol. 179. Р. 1390ff.
19. Fontenot J.D., Rasmussen J.P., Gavin M.A. et al. A function for interleukin 2 in Foxp3-ex- pressing regulatory T cells // Nat Immunol. 2005. Vol. 6. Р. 1142–1151.
20. Joetham A. et al. Naturally occurring lung CD4(+)CD25(+) T cell regulation of airway allergic responses depends on IL-10 induction of TGF-beta // J Immunol. 2007. Vol. 178. Р. 1433–1442.
21. Shalev I., Wong KM., Foerster K., Zhu Y., Chan C., Maknojia A., Zhang J., Levy G. The novel CD4+CD25+ regulatory T-cell effector molecule fibrinogen-like protein-2 contributes to the outcome of murine fulminant viral hepatitis // Hepatology. 2009. Vol. 49. Р. 387–397.
22. Grossman W.J. et al. Differential expression of granzymes A and B in human cytotoxic lymphocyte subsets and T regulatory cells // Blood 2004. Vol. 104. Р. 2840–2848.
23. Deaglio S. et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression // J Exp Med. 2007. Vol. 204 Р. 1257–65.
24. Garin M.I., Chu C.C., Golshayan D. et al. Galectin-1: a key effector of regulation mediated by CD4+CD25+ T cells // Blood 2007. Vol. 109. Р. 2058–2065.
25. Read S., Malstrom V., Powrie F. Cytotoxic T lymphocyte associated antigen-4 plays an essential role in the function of CD25+CD4+ regulatory cells that control intestinal inflammation // J Exp Med. 2000. Vol. 192. Р. 295–302.
26. Workman C.J., Vignali D.A.A. Negative regulation of T cell homeostasis by LAG-3 (CD223) // J Immunol. 2004. Vol. 174. Р. 688–695.
27. Sarris M., Andersen K.G., Randow F. et al. Neuropilin-1 expression on regulatory T cells enhances their interactions with dendritic cells during antigen recognition // Immunity 2008. Vol. 28. Р. 402–413.
28. Pandiyan P., Zheng L., Ishihara S. et al. CD4+CD25+FOXP3+ regulatory T cells in- duce cytokine deprivation-mediated apoptosis of effector CD4+ T cells // Nat Immunol. 2007. Vol. 8. Р. 1353–1362.
29. Shevach E.M. Mechanisms of FOXP3+ T regulatory cell-mediated suppression // Immunity. 2009. Vol. 30. Р. 636–645.
30. Lim H.W., Broxmeyer H.E., Kim C.H. Regulation of trafficking receptor expression in human forkhead box P3+ regulatory T cells // J Immunol. 2006. Vol. 177. Р. 840–851.
31. Fujio K., Okamura T., Yamamoto K. The family of IL-10-secreting CD4+ T-cells // Adv Immunol. 2010. Vol. 105. Р. 99–129.
32. Roncarolo M.G., Gregori S., Battaglia M., Bacchetta R., Fleischhauer K., Levings MK. Interleukin-10-secreting type 1 regulatory T cells in rodents and humans // Immunol Rev. 2006. Vol. 212. Р. 28–50.
33. Beissert S., Schwartz A., Schwartz T. Regulatory T cells // J Invest Dermatol. 2006. Vol. 126. Р. 15– 24.
34. Wan Y.Y., Flavell R.A. ‘Yin-yang’ functions of transforming growth factor-β and T regulatory cells in immune regulation // Immunol Rev. 2007. Vol. 220. Р. 199–213.
35. Korn T., Bettelli E., Oukka M. et al. IL-17 and TH 17 cells // Annu Rev Immunol. 2009. Vol. 27. Р. 485–517.
36. Peterson R.A. Regulatory T-cells: diverse phenotypes integral to immune homeostasis and suppression // Toxicol Pathol. 2012. Vol. 40. Р. 186–204.
37. Sakaguchi S., Yamaguchi T., Nomura T. et al. Regulatory T cells and immune tolerance // Cell. 2008. Vol. 133. Р. 775–787.
38. Lourenco E.V., La Cava A. Natural regulatory T cells in autoimmunity // Autoimmunity 2011. Vol. 44. Р. 33–42.
39. Ochs H.D., Khattri R., Bennett C.L. et al. Immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome and the Scurfy mutant mouse // Immunol Allergy Clin North Am. 2002. Vol. 22 Р. 357–368.
40. Hori S., Nomura T., Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3 // Science. 2003. Vol. 299. Р. 1057–1061.
41. Walker M.R., Kasprowicz D.J., Gersuk VH. et al. Induction of FoxP3 and acquisition of T regulatory activity by stimulated human CD4+CD25– T cells // J Clin Invest. 2003. Vol. 112. Р. 1437–1443.
42. Liston A., Rudensky A.Y. Thymic development and peripheral homeostasis of regulatory T cells // Curr Opin Immunol. 2007. Vol. 19. Р. 176–185.
43. Darrasse-Jeze G., Deroubaix S., Mouquet H. et al. Feedback control of regulatory T cell homeostasis by dendritic cells in vivo // J Exp Med. 2009. Vol. 206. Р. 1853–1862.
44. Yates J., Rovis F., Mitchell P. et al. The maintenance of human CD4+ CD25+ regulatory T cell function: IL-2, IL-4, IL-7 and IL-15 preserve optimal suppressive potency in vitro // Int Immunol. 2007. Vol. 19. Р. 785–799.
45. Vignali D.A., Collison L.W., Workman C.J. How regulatory T cells work // Nat Rev Immunol. 2008. Vol. 8. Р. 523–532.
46. Yang J., Brook M.O., Carvalho-Gaspar M. et al. Allograft rejection mediated by memory T cells is resistant to regulation // Proc Natl Acad Sci USA. 2007. Vol. 104. Р. 19954–19959.
47. Tang Q., Adams JY., Penaranda C. et al. Central role of defective interleukin-2 production in the triggering of islet autoimmune destruction // Immunity. 2008. Vol. 28. Р. 687–697.
48. Clough L.E., Wang C.J., Schmidt E.M. et al. Release from regulatory T cell-mediated suppression during the onset of tissue specific autoimmunity is associated with elevated IL-21 // J Immunol. 2008. Vol. 180. Р. 5393–5401.
49. Tang Q., Henriksen K.J., Bi M. et al. In vitro- expanded antigen-specific regulatory T cells suppress autoimmune diabetes // J Exp Med. 2004. Vol. 199. Р. 1455–1465.
50. Kukreja A., Cost G., Marker J. et al. Multiple immune-regulatory defects in type-1 diabetes // J Clin Invest. 2002. Vol. 109. Р. 131–140.
51. Putnam AL., Vendrame F., Dotta F. et al. CD4+CD25high regulatory T cells in human autoimmune diabetes // J Autoimmun. 2005. Vol. 24. Р. 55–62.
52. Lindley S., Dayan C.M., Bishop A. et al. Defective suppressor function in CD4+CD25+ T- cells from patients with type 1 diabetes // Diabetes. 2005. Vol. 54. Р. 92–99.
53. Long S.A., Cerosaletti K., Bollyky P.L. et al. Defects in IL-2R signaling contribute to diminished maintenance of FOXP3 expression in CD4+CD25+ regulatory T cells of type 1 diabetic subjects // Diabetes. 2010. Vol. 59. Р. 407–415.
54. Willcox A., Richardson SJ., Bone AJ. et al. Analysis of islet inflammation in human type 1 diabetes // Clin Exp Immunol. 2009. Vol. 155. Р. 173– 181.
55. Schneider A., Rieck M., Sanda S. et al. The effector T cells of diabetic subjects are resistant to regulation via CD4+FOXP3+ regulatory T cells // J Immunol. 2008. Vol. 181. Р. 7350–7355.
56. Lawson J.M., Tremble J., Dayan C. et al. Increased resistance to CD4+CD25hi regulatory T cell-mediated suppression in patients with type 1 diabetes // Clin Exp Immunol. 2008. Vol. 154. Р. 353–359.
57. Kohm A.P., Carpentier P.A., Anger H.A. et al. Cutting edge: CD4+CD25+ regulatory T cells suppress antigen-specific autoreactive immune responses and central nervous system inflammation during active experimental autoimmune encephalomyelitis // J Immunol. 2002. Vol. 169. Р. 4712–4716.
58. Viglietta V., Baecher-Allan C., Weiner H.L. et al. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis // J Exp Med. 2004. Vol. 199. Р. 971–979.
59. Putheti P., Pettersson A., Soderstrom M. et al. Circulating CD4+CD25+ T regulatory cells are not altered in multiple sclerosis and unaffected by disease-modulating drugs // J Clin Immunol. 2004. Vol. 24. Р. 155–161.
60. Feger U., Luther C., Poeschel S. et al. Increased frequency of CD4+ CD25+ regulatory T cells in the cerebrospinal fluid but not in the blood of multiple sclerosis patients // Clin Exp Immunol. 2007. Vol. 147. Р. 412–418.
61. Kumar M., Putzki N., Limmroth V. et al. CD4+CD25+FoxP3+ T lymphocytes fail to suppress myelin basic protein-induced proliferation in patients with multiple sclerosis // J Neuroimmunol. 2006. Vol. 180. Р. 178–184.
62. De Andrés C., Aristimuño C., de Las Heras V. et al. Interferon β-1a therapy enhances CD4+ regulatory T-cell function: an ex vivo and in vitro longitudinal study in relapsing-remitting multiple sclerosis // J Neuroimmunol. 2007. Vol. 182. Р. 204–211.
63. Venken K., Hellings N., Thewissen M. et al. Compromised CD4+ CD25high regulatory T-cell function in patients with relapsing-remitting multiple sclerosis is correlated with a reduced frequency of FOXP3-positive cells and reduced FOXP3 expression at the single- cell level // Immunology. 2007. Vol. 123. Р. 79–89.
64. Haas J., Hug A., Viehöver A. et al. Reduced suppressive effect of CD4+CD25high regula- tory T cells on the T cell immune response against myelin oligodendrocyte glycoprotein in patients with multiple sclerosis // Eur J Immunol. 2005. Vol. 35. Р. 3343–3352.
65. Astier AL., Meiffren G., Freeman S. et al. Alterations in CD46-mediated Tr1 regulatory T cells in patients with multiple sclerosis // J Clin Invest. 2006. Vol. 116. Р. 3252–3257.
66. Gerli R., Nocentini G., Alunno A. et al. Identification of regulatory T cells in systemic lupus erythematosus // Autoimmun Rev. 2009. Vol. 8 Р. 426– 430.
67. Crispin J.C., Martinez A., Alcocer-Varela J. Quantification of regulatory T cells in pa- tients with systemic lupus erythematosus // J Autoimmun. 2003. Vol. 21. Р. 273–276.
68. Miyara M., Amoura Z., Parizot C. et al. Global natural regulatory T cell depletion in active systemic lupus erythematosus // J Immunol. 2005. Vol. 175. Р. 8392–8400.
69. Suen J.L., Li H.T., Jong Y.J. et al. Altered homeostasis of CD4+ FoxP3+ regulatory T-cell sub- populations in systemic lupus erythematosus // Immunology. 2009. Vol. 127. Р. 196–205.
70. Valencia X., Yarboro C., Illei G. et al. Deficient CD4+CD25high T regulatory cell function in patients with active systemic lupus erythematosus // J Immunol. 2007. Vol. 178. Р. 2579–2588.
71. Yan B., Ye S., Chen G. et al. Dysfunctional CD4+, CD25+ regulatory T cells in untreated active systemic lupus erythematosus secondary to interferon-producing antigen-presenting cells // Arthritis Rheum. 2008. Vol. 58. Р. 801– 812.
72. Yates J., Whittington A., Mitchell P. et al. Natural regulatory T cells: number and function are normal in the majority of patients with lupus nephritis // Clin Exp Immunol. 2008. Vol. 153. Р. 44–55.
73. Venigalla R.K., Tretter T., Krienke S. et al. Reduced CD4+, CD25– T cell sensitivity to the suppressive function of CD4+, CD25high, CD127–/low regulatory T cells in patients with active systemic lupus erythematosus // Arthritis Rheum. 2008. Vol. 58. Р. 2120–2130.
74. Vargas-Rojas M.I., Crispín J.C., Richaud-Patin Y. et al. Quantitative and qualitative normal regulatory T cells are not capable of inducing suppression in SLE patients due to T-cell resistance // Lupus 2008. Vol. 17. Р. 289–294.
75. Cao D., Malmström V., Baecher-Allan C. et al. Isolation and functional characterization of regulatory CD25brightCD4+ T cells from the target organ of patients with rheumatoid arthritis // Eur J Immuno. 2003. Vol. 33. Р. 215–223.
76. Mottonen M., Heikkinen J., Mustonen L. et al. CD4+ CD25+ T cells with the phenotypic and functional characteristics of regulatory T cells are enriched in the synovial fluid of patients with rheumatoid arthritis // Clin Exp Immunol. 2005. Vol. 140. Р. 360–367.
77. Lawson C.A., Brown A.K., Bejarano V. et al. Early rheumatoid arthritis is associated with a deficit in the CD4+CD25high regulatory T cell population in peripheral blood // Rheumatology. 2006. Vol. 4.5 Р. 1210–1217.
78. Ehrenstein M.R., Evans JG., Singh A. et al. Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti- TNFα therapy // J Exp Med. 2004. Vol. 200. Р. 277–285.
79. Flores-Borja F., Jury EC., Mauri C, et al. Defects in CTLA-4 are associated with abnormal regulatory T cell function in rheumatoid arthritis // Proc Natl Acad Sci USA 2008. Vol. 105 Р. 19396–19401.
80. Saruta M., Yu Q.T., Fleshner P.R. et al. Characterization of FOXP3+CD4+ regulatory T cells in Crohn’s disease // Clin Immunol. 2007. Vol. 12. 5Р. 281–290.
81. Takahashi M., Nakamura K., Honda K. et al. An inverse correlation of human peripheral blood regulatory T cell frequency with the disease activity of ulcerative colitis // Dig Dis Sci. 2006. Vol. 51. Р. 677–686.
82. Maul J., Mabarrack N., Barbour A. et al. Peripheral and intestinal regulatory CD4+ CD- 25high T cells in inflammatory bowel disease // Gastroenterology. 2005. Vol. 128 Р. 1868–1878.
83. Li Z., Arijs I., De Hertogh G. et al. Reciprocal changes of Foxp3 expression in blood and intestinal mucosa in IBD patients responding to infliximab // Inflamm Bowel Dis. 2010. Vol. 16. Р. 1299–1310.
84. Eastaff-Leung N., Mabarrack N., Barbour A. et al. Foxp3+ regulatory T cells, Th17 effector cells, and cytokine environment in inflammatory bowel disease // J Clin Immunol. 2010. Vol. 30. Р. 80–89.
85. Kelsen J., Agnholt J., Hoffmann H.J. et al. FoxP3+CD4+CD25+ T cells with regulatory properties can be cultured from colonic mucosa of patients with Crohn’s disease // Clin Exp Immunol. 2005. Vol. 14. Р. 549–557.
86. Makita S., Kanai T., Nemoto Y. et al. Intestinal lamina propria retaining CD4+CD25+ regulatory T cells is a suppressive site of intestinal inflammation // J Immunol. 2007. Vol. 178. Р. 4937–4946.
87. Fantini M.C., Rizzo A., Fina D. et al. Smad7 controls resistance of colitogenic T cells to regulatory T cell-mediated suppression // Gastroenterology. 2009. Vol. 136. Р. 1308–1316.
88. Quaglino P., Antiga E., Comessatti A. et al. Circulating CD4+ CD25brightFOXP3+ regulatory T-cells are significantly reduced in bullous pemphigoid patients // Arch Derma- tol Res. 2012. Vol. 30.4 Р. 639–645.
89. Antiga E., Quaglino P., Bellandi S. et al. Regulatory T cells in the skin lesions and blood of patients with systemic sclerosis and morphoea // Br J Dermatol. 2010. Vol. 162. Р. 1056–1063.
90. Banica L., Besliu A., Pistol G. et al. Quantification and molecular characterization of regulatory T cells in connective tissue diseases // Autoimmunity 2009. Vol. 42. Р. 41–49.
91. Antiga E., Kretz CC., Klembt R. Characterization of regulatory T cells in patients with dermatomyositis // J Autoimmun. 2010. Vol. 35. Р. 342–350.
92. Kagami S., Rizzo H.L., Lee J.J. et al. Circulating Th17, Th22, and Th1 cells are increased in psoriasis // J Invest Dermatol. 2010. Vol. 130. Р. 1373– 1383.
93. Zhang L., Yang X.Q., Cheng J. et al. Increased Th17 cells are accompanied by FoxP3(+) Treg cell accumulation and correlated with psoriasis disease severity // Clin Immunol. 2010. Vol. 135. Р. 108–117.
94. Zhang K., Li X., Yin G. et al. Functional characterization of CD4+CD25+ regulatory T cells differentiated in vitro from bone marrow-derived haematopoietic cells of psoriasis patients with a family history of the disorder // Br J Dermatol. 2008. Vol. 158 Р. 298–305.
95. Shehata I.H., Elghandour T.M. A possible pathogenic role of CD4+ CD25+ T-regulatory cells in psoriasis // Egypt J Immunol. 2007. Vol. 14. Р. 21–31.
96. Bovenschen H.J., van Vlijmen-Willems .IM., van de Kerkhof P.C. et al. Identification of lesional CD4+ CD25+ Foxp3+ regulatory T cells in psoriasis // Dermatology. 2006. Vol. 213. Р. 111–117.
97. Fujimura T., Okuyama R., Ito Y. Aiba S. Profiles of Foxp3+ regulatory T cells in eczematous dermatitis, psoriasis vulgaris and mycosis fungoides // Br J Dermatol. 2008. Vol. 158. Р. 1256– 1263.
98. Yan K.X., Fang X., Han L. et al. Foxp3+ regulatory T cells and related cytokines differentially expressed in plaque vs guttate psoriasis vulgaris // Br J Dermatol. 2010. Vol. 163. Р. 48–56.
99. Chen L., Shen Z., Wang G. et al. Dynamic frequency of CD4+CD25+Foxp3+ Treg cells in psoriasis vulgaris // J Dermatol Sci. 2008. Vol. 51. Р. 200–203.
100. Richetta A.G., Mattozzi C., Salvi M. et al. CD4+ CD25+ T-regulatory cells in psoriasis. Correlation between their numbers and biologics-induced clinical improvement // Eur J Dermatol. 2011. Vol. 21. Р. 344–348.
101. Quaglino P., Ortoncelli M., Comessatti A. et al. Circulating CD4+CD25brightFOXP3+ T cells are upregulated by biological therapies and correlate with the clinical response in psoriasis patients // Dermatology. 2009. Vol. 219. Р. 250–258.
102. Diluvio L., Romiti M.L., Angelini F. et al. Infliximab therapy induces increased polyclonality of CD4+CD25+ regulatory T cells in psoriasis // Br J Dermatol. 2010. Vol. 162. Р. 895– 897.
103. Richetta A.G., Mattozzi C., Salvi M. et al. Downregulation of circulating CD4(+) CD25(bright) Foxp3(+) T cells by cyclosporine therapy and correlation with clinical response in psoriasis patients: report of three cases // Int J Dermatol, E-pub ahead of print.
104. Hess A.D., Colombani P.M., Esa A.H. Cyclosporine and the immune response: basic aspects // Crit Rev Immunol. 1986. Vol. 6. Р. 123–149.
105. Shintani Y., Yasuda Y., Kobayashi K. et al. Narrowband ultraviolet B radiation suppresses contact hypersensitivity // Photodermatol Photoimmunol Photomed. 2008. Vol. 24. Р. 32–37.
106. Saito C., Maeda A., Morita A. Bath-PUVA therapy induces circulating regulatory T cells in patients with psoriasis // J Dermatol Sci. 2009. Vol. 53. Р. 231–233.
107. Sugiyama H., Gyulai R., Toichi E. et al. Dysfunctional blood and target tissue CD4+CD25high regulatory T cells in psoriasis: mechanism underlying unrestrained pathogenic effector T cell proliferation // J Immunol. 2005. Vol. 174. Р. 164–173.
108. Goodman W.A., Levine A.D., Massari J.V. et al. IL-6 signaling in psoriasis prevents immune suppression by regulatory T cells // J Immunol. 2009. Vol. 183. Р. 3170–3176.
109. Pasare C., Medzhitov R. Toll pathway-dependent blockade of CD4+CD25+ T cell- mediated suppression by dendritic cells // Science. 2003. Vol. 299. Р. 1033–1036.
110. Yang X.O., Nurieva R., Martinez G.J. et al. Molecular antagonism and plasticity of regulatory and inflammatory T cell programs // Immunity. 2008. Vol. 29. Р. 44–56.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






