Роль дофаминомиметиков в лечении и профилактике рецидивов аденомы гипофиза
А. С. Скотников
М. А. Фельдман
МГМСУ, Москва
Гипофиз и гипоталамус в функциональном отношении представляют собой единое целое. Гипоталамус является частью промежуточного мозга, а гипофиз развивается из двух эктодермальных зачатков различного происхождения: выпячивания первичного ротового углубления (карман Ратке) и выпячивания дна III желудочка мозга (воронка). Гипофиз, нижний мозговой придаток, или питуитарная железа (hypophysis cerebri, glandula pituitaris), представляет собой сложный эндокринный орган, расположенный в основании черепа в турецком седле основной кости и анатомически связанный ножкой с дном III мозгового желудочка промежуточного мозга. Он состоит из трех долей: передней доли, средней доли и задней доли. Передняя и средняя доли объединяются под названием аденогипофиз, а задняя доля называется нейрогипофизом. К нейрогипофизу относят также срединное возвышение (медиальная эминенция, расположенная на границе между аденогипофизом и гипоталамусом промежуточного мозга).
Ложе гипофиза — турецкое седло, как и гипофиз, имеет овальную форму. Оно выстлано твердой мозговой оболочкой, между листками которой располагается гипофиз. Вход в турецкое седло прикрыт листком твердой мозговой оболочки, который носит название диафрагмы турецкого седла. Через отверстие в диафрагме проходит ножка гипофиза. В норме арахноидальная оболочка располагается по верхней поверхности диафрагмы турецкого седла и не опускается в его полость. При наличии врожденных дефектов диафрагмы турецкого седла арахноидальная оболочка распространяется в полость турецкого седла, позволяя проникать сюда спинномозговой жидкости, что приводит к развитию синдрома пустого турецкого седла.
В передней доле гипофиза вырабатываются белковые гормоны (соматотропный гормон (СТГ) и пролактин), гликопротеины (фолликулостимулирующий, лютеинизирующий и тиреотропный (ТТГ)), а также адренокортикотропный гормон (АКТГ), эндорфины, липотропины и меланоцитстимулирующие гормоны. Задняя доля гипофиза служит резервуаром для хранения нейрогормонов — вазопрессина и окситоцина, которые поступают сюда по аксонам нейронов, расположенных в гипоталамических ядрах.
Причинами дефицита гормонов гипофиза могут быть: дефекты кровоснабжения, кровоизлияние, врожденное недоразвитие гипофиза, менингит или энцефалит, сдавление гипофиза опухолью, черепно-мозговая травма, воздействие некоторых лекарств, облучение, хирургическое вмешательство.
Недостаток гормонов гипофиза может приводить к вторичному недостатку гормонов других эндокринных желез (вторичный гипотиреоз, несахарный диабет), а также к тяжелым физическим нарушениям (гипофизарный нанизм, гипопитуитаризм).
Причиной избытка гормонов гипофиза в большинстве случаев является опухоль самого гипофиза — аденома. При этом повышается уровень тех гормонов, которые производят клетки аденомы, тогда как уровень всех остальных гормонов может значительно снижаться из-за сдавления оставшейся части гипофиза.
Среди всех опухолей, поражающих гипофиз, аденома занимает первое место. Обычно аденома гипофиза встречается у взрослых, но иногда опухоль обнаруживается и в детском возрасте [1]. Половина всех случаев заболевания приходится на средний возраст 30–50 лет, с одинаковой частотой для мужчин и женщин, что составляет до 15% всех внутричерепных новообразований [2]. Истинную распространенность этой опухоли установить трудно, т. к. многие из них долгое время существуют бессимптомно. Выявляемость составляет всего лишь 2 человека на 100 000 населения. На аутопсии аденомы гипофиза обнаруживают у 10–20% пациентов, умерших от не связанных с поражением гипофиза болезней [3].
До недавнего времени аденомы гипофиза подразделялись на ацидофильные (эозинофильные), сопровождающиеся гиперсекрецией СТГ (акромегалия или гигантизм), базофильные, секретирующие АКТГ, а также хромофобные, протекающие без нарушения секреции гормонов, и смешанные. Однако во многих случаях не было достаточной корреляции между клинической картиной заболевания и гистологической структурой аденомы гипофиза. Однако в 1995 году E. Horvath и K. Kovacs, применив гистологические и другие виды исследований при изучении 1700 аденом гипофиза, предложили модифицированную классификацию с учетом частоты встречаемости различных видов аденом. Согласно их классификации, существуют соматотрофная, лактотрофная, маммосоматотрофная, кортикотрофная, тиротрофная, гонадотрофная, плюригормональная, «немая» и другие виды аденомы.
Аденома гипофиза (adenoma hypophysis) — доброкачественная опухоль, исходящая из железистых клеток передней доли гипофиза (аденогипофиза) и локализующаяся в полости турецкого седла клиновидной кости основания черепа (рис. 1).
Само понятие «аденома гипофиза» собирательное и включает в себя целую группу опухолей, вызывающих различные по проявлению заболевания. Как и все опухоли, аденомы гипофиза разделяют по размерам, направлению роста, гистологическим особенностям, а также по гормональной активности. Современная классификация аденом гипофиза основывается на сопоставлении клинической симптоматики и величин концентрации тропных гормонов в крови с иммунно-гистохимической и электронно-микроскопической характеристикой опухоли.
Существует несколько видов классификаций аденом гипофиза. Одна из них — по гормональной активности опухолей, которая стала активно применяться с начала 70-х годов XX столетия. Согласно этой классификации аденомы делят на гормонально-неактивные (25–30%) и гормонально-активные (70–75%) [4].
Аденомы гипофиза, протекающие без клинических проявлений гиперсекреции гипофизарных гормонов, называют «неактивными» аденомами гипофиза, разрастание которых приводит к снижению функции гипофиза — гипопитуитаризму. До появления неврологических симптомов, таких как головная боль, нарушение зрения, связанных с воздействием большой опухоли на окружающие ее структуры, гормонально-неактивные аденомы гипофиза являются клинически «немыми» или «молчащими» опухолями. В литературе применяются также термины «клинически нефункционирующие» аденомы [5]. Однако существуют и гормонально активные аденомы, к которым относятся АКТГ-продуцирующая, пролактинсекретирующая, СТГ-продуцирующая, ТТГ-продуцирующая, а также гонадотропные аденомы. Частота встречаемости соматотропином составляет 20–25%, пролактином — 40%, кортикотропином — 7%, тиротропином — 3% от общего количества аденом гипофиза. Относительно нечасто встречаются смешанные опухоли — пролактосоматотропиномы и пролактокортикотропиномы. Остальные виды аденом гипофиза относятся к редко встречающимся опухолям.
Кроме того, существует классификация аденом гипофиза по направлению роста. Характер роста аденомы гипофиза определяется по отношению опухоли к турецкому седлу, в котором располагается нормальный гипофиз, и к окружающим его структурам. На ранней стадии аденомы гипофиза развиваются в полости турецкого седла (эндоселлярные опухоли). Постепенно увеличиваясь, опухоль может распространяться книзу, в клиновидную пазуху (инфраселлярно), кверху — в направлении диафрагмы турецкого седла и перекреста зрительных нервов (супраселлярно), латерально, оказывая воздействие на структуры кавернозного синуса, базальные отделы височных долей головного мозга и магистральные сосуды головы, кзади — в направлении ствола мозга (ретроселлярно) и кпереди — в направлении лобных долей, глазницы, решетчатого лабиринта и полости носа (антеселлярно). Очень часто направление роста аденомы гипофиза бывает различным (вверх, в сторону, вниз) — тогда опухоль называют эндо/супра/инфра/латероселлярной. По размерам опухоли гипофиза разделяют на микроаденомы (менее 1 см в диаметре) и макроаденомы (диаметр более 1 см).
Причины развития аденом гипофиза до настоящего времени полностью не выяснены, хотя известно, что некоторые из них могут быть обусловлены генетически. В число факторов, предрасполагающих к развитию опухолей гипофиза, входят нейроинфекции, хронические синуситы, черепно-мозговые травмы, гормональный дисбаланс, неблагоприятное внутриутробное воздействие на плод. В последнее время этиологическая роль частично отводится длительному применению оральных контрацептивов.
Развитие опухоли гипофиза — многоэтапный процесс, в который вовлекаются, наряду с соматическими мутациями в гипофизарных клетках, многие другие дополнительные факторы — гормональные, аутокринные и паракринные. Важными патогенетическими факторами, участвующими в туморогенезе в гипофизе, являются гормоны гипоталамуса, нейромедиаторы и факторы роста [6]. Вместе с тем следует подчеркнуть, что нарушения гипоталамической регуляции и другие указанные факторы в отличие от онкогенных мутаций лишь способствуют развитию опухоли гипофиза, но не являются ее непосредственной причиной [7].
Существует концепция первичного поражения гипоталамуса с вторичным вовлечением в процесс ткани аденогипофиза [8], а также концепция первичного поражения гипофиза, следствием которого является возникновение аденомы [9]. Образование некоторых форм аденом гипофиза (тиротропином, гонадотропином) на фоне первичного снижения активности периферических желез внутренней секреции (при первичном гипотиреозе, гипогонадизме) происходит вследствие гиперстимуляции гипофиза гипоталамическими рилизинг-гормонами. Это указывает на существование различных механизмов формирования аденомы гипофиза.
Доказано, что клетки гипофиза способны вырабатывать различные ростовые факторы, в том числе основной фактор роста фибробластов, обладающий мощным митогенным и ангиогенным потенциалом, и имеют соответствующие рецепторы [3].
Клиническая картина аденом гипофиза полиморфна и представлена различными группами симптомов, появления которых определяются функциями гормонов, секретируемыми той или иной формой опухоли (табл. 1).
![]()
Клинические проявления гормонально-активных аденом гипофиза состоят из эндокринно-обменного синдрома, офтальмоневрологических и рентгенологических симптомов. Выраженность эндокринно-обменного синдрома отражает уровень избыточно вырабатываемого гормона гипофиза и степень повреждения ткани, окружающей опухоль.
При некоторых аденомах гипофиза (кортикотропиномах, некоторых тиротропиномах) клиническая картина обусловлена не столько избыточной выработкой самого тропного гормона, сколько связанной с этим активацией органа-мишени, выражающейся гиперкортицизмом, тиреотоксикозом. Офтальмоневрологические симптомы, свидетельствующие о наличии аденомы гипофиза (первичная атрофия зрительных нервов, изменения поля зрения по типу битемпоральной гемианопсии, гипоксии и др.), зависят от супраселлярного роста опухоли. Из-за давления опухоли на диафрагму турецкого седла возникает головная боль, которая обычно локализуется в лобной, височной и позадиглазничной областях. Эта боль обычно тупого характера, не сопровождается тошнотой, не зависит от положения тела и далеко не всегда купируется обезболивающими препаратами. Дальнейший рост опухоли кверху приводит к повреждению гипоталамических структур. Рост аденомы гипофиза в латеральном направлении вызывает сдавление III, IV, VI и ветвей V черепных нервов с развитием офтальмоплегии и диплопии. Рост опухоли книзу, в направлении дна турецкого седла, и распространение процесса в пазуху клиновидной кости, решетчатые пазухи может сопровождаться чувством заложенности носа и ликвореей [17].
Внезапное усиление головной боли и офтальмоневрологической симптоматики у больных с аденомой гипофиза связано чаще всего либо с ускорением роста опухоли, например, в период беременности, либо с кровоизлиянием в опухоль. Кровоизлияние в опухоль считают тяжелым, но не фатальным осложнением. Кровоизлияния в аденому гипофиза происходят довольно часто и могут приводить, помимо усиления головной боли, зрительных нарушений и развития гипопитуитаризма, к спонтанному «излечению» от гормонально-активной аденомы гипофиза. Спонтанные «излечения» наиболее присущи пролактиномам. Увеличение опухоли во время беременности, возможно, связано с неизбежным увеличением аденогипофиза в этот период; отмечено, что у большинства больных с пролактиномами после родоразрешения опухоль уменьшается [18].
Симптомами аденомы гипофиза, выявляемыми при рентгенологическом исследовании, являются изменение формы и размеров турецкого седла, истончение и деструкция костных структур, образующих его, и др. При компьютерной томографии может быть визуализирована и сама опухоль.
Для отдельных гормонально-активных аденом гипофиза характерны специфические клинические симптомы. Пролактиномы у женщин проявляются синдромом галактореи-аменореи. Нередко основным эндокринным проявлением этих опухолей является только галакторея, или только нарушение менструального цикла, или бесплодие, но чаще отмечают сочетание этих симптомов.
Примерно у трети женщин с пролактиномами наблюдаются умеренное ожирение, нерезко выраженный гипертрихоз, акне, себорея волосистой части головы, нарушения половой функции — снижение либидо, аноргазмия и др. У мужчин основными эндокринными проявлениями пролактиномы являются нарушения половой функции (снижение либидо, импотенция), гинекомастия и галакторея сравнительно редки. У женщин с пролактиномами к моменту выявления опухоли офтальмоневрологические нарушения встречаются не более чем в 26% случаев, у мужчин офтальмоневрологическая симптоматика доминирует. Это связано, по-видимому, с тем, что у женщин пролактиномы чаще выявляют еще на стадии микроаденомы, а у мужчин из-за медленного нарастания таких неспецифических симптомов, как половая слабость и др., почти всегда обнаруживают опухоль уже больших размеров [19].
Соматотропиномы клинически проявляются синдромом акромегалии или гигантизмом у детей. При акромегалии помимо типичных для этой болезни изменений скелета и мягких тканей может повышаться артериальное давление, развиваться ожирение и симптомы сахарного диабета. Нередко наблюдается увеличение щитовидной железы, чаще без нарушения функции. Часто отмечают гирсутизм, появление папиллом, невусов, бородавок на коже, выраженную сальность кожи, усиленное потоотделение; работоспособность больных снижена. Офтальмоневрологическая симптоматика при соматотропиномах развивается на определенной стадии при экстраселлярном росте опухоли. Кроме перечисленных выше симптомов отмечают периферическую полиневропатию, проявляющуюся парестезиями, снижением чувствительности в дистальных отделах конечностей, болями в конечностях [20].
Диагностика опухолей гипофиза сводится к осмотру специалистами (нейрохирург, эндокринолог, офтальмолог), а также к проведению рентгенографии черепа, гормонального исследования крови, компьютерной томографии головного мозга и магнитно-резонансной томографии. Диагностика аденомы гипофиза обязательно должна быть комплексной. Выраженная эмоциональная лабильность больных с аденомой гипофиза, трудности диагностического поиска, вероятность гипердиагностики, медленный рост и доброкачественное клиническое течение многих аденом гипофиза требуют тактичного и бережного ознакомления больных с результатами обследования.
Дифференциальный диагноз проводят с гормонально-неактивными опухолями, расположенными в области турецкого седла, с опухолями негипофизарной локализации, продуцирующими пептидные гормоны, и с гипоталамо-гипофизарной недостаточностью неопухолевого генеза. Дифференцировать аденому гипофиза необходимо с синдромом пустого турецкого седла, для которого также характерно развитие офтальмоневрологического синдрома.
Кроме того, необходимо доказать, что эндокринно-обменный синдром не явился результатом приема некоторых лекарственных средств или нервно-рефлекторных воздействий. Так, нейролептики, ряд антидепрессантов и противоязвенных препаратов могут вызывать развитие галактореи, а кортикостероиды способствуют появлению кушингоидизма. Частая самопальпация молочных желез, наличие внутриматочного контрацептива, хронический аднексит вызывают возникновение рефлекторной галактореи.
Для выявления аномальной реакции аденоматозной ткани на фармакологическое воздействие используют также специальные нагрузочные фармакологические пробы. При подозрении на аденому гипофиза больного следует направить на консультацию к специалисту-офтальмологу. Исследование остроты и полей зрения, осмотр глазного дна позволяют диагностировать зрительные нарушения (хиазмальный синдром), иногда поражение глазодвигательного нерва.
На сегодняшний день существуют три основных вида лечения больных с аденомами гипофиза: нейрохирургическое (трансфеноидальное, транскраниальное удаление опухолей), лучевое (протонотерапия, гамма-терапия, гамма-нож) и медикаментозное. Среди последних выделяют агонисты дофамина (бромокриптин, каберголин, леводопа, хинаголид), аналоги соматостатина (ланреотид, октреотид) и блокаторы рецепторов к соматотропину.
Выбор метода лечения аденомы гипофиза зависит от типа опухоли (гормонально-неактивная или гормонально-активная), ее размеров, выраженности и тяжести клинических проявлений. Эффективность оперативного лечения, дистанционной и внутритканевой лучевой терапии, а также медикаментозного лечения зависит от стадии развития опухоли и тяжести клинической симптоматики (табл. 2).
![]()
Пролактиномы, независимо от размеров, при отсутствии нарастающих нарушений зрительных функций сначала лечат консервативно агонистами дофаминовых рецепторов, при этом на фоне длительного лечения женщинам можно разрешить беременность. Лечение рефракторных к медикаментозной терапии эндоселлярных пролактином оперативное. Используют также прецизионное протонное облучение. Предпочтение отдается микрохирургическим методам лечения. При больших опухолях, распространяющихся на параселлярные структуры, проводят нейрохирургическую операцию с последующей послеоперационной лучевой терапией [21].
Для соматотропином и пролактосоматотропином при эндоселлярной локализации опухоли оперативное лечение и протонная лучевая терапия являются альтернативными методами. При невозможности радикального оперативного лечения из-за прорастания опухоли в решетчатые пазухи и глазницу или при крайне больших размерах опухоли в послеоперационном периоде для профилактики роста опухоли проводят дистанционную гамма-терапию, используют агонисты дофаминовых рецепторов.
Кортикотропиномы у больных молодого возраста, проявляющиеся синдромом Нелсона или болезнью Иценко–Кушинга легкой или средней тяжести, чаще подвергают дистанционной лучевой терапии. При небольших размерах опухоли предпочтение отдают протонному облучению. В тяжелых случаях целью первого этапа лечения является ликвидация или уменьшение степени гиперкортицизма с помощью химиотерапии и оперативного удаления одного или обоих надпочечников, а дистанционное облучение гипофиза, предпочтительно протонное, проводят на следующем этапе лечения [21].
Тиротропиномы и гонадотропиномы лечат в зависимости от их величины и распространенности, начиная с заместительной гормонотерапии. В дальнейшем, при необходимости, присоединяют оперативное лечение и лучевую терапию. Для лечения гормонально-неактивных аденом гипофиза применяется комплексное воздействие (оперативное лечение и лучевая терапия), а в последующем больным назначают корригирующую гормонотерапию [21].
Сущность медикаментозного лечения аденомы гипофиза сводится к уменьшению действия гормонов, вырабатывающихся опухолью. Однако длительное (зачастую пожизненное) медикаментозное лечение эффективно далеко не у всех пациентов, а кроме того, оно нецелесообразно в случаях, когда размер опухоли достаточно велик. Чаще всего лечение препаратами используется на этапах подготовки к операции и в послеоперационном периоде. Спектр препаратов для лечения аденомы гипофиза представлен в табл. 3.

Не вызывает сомнения целесообразность патогенетического подхода в решении проблемы лечения аденомы гипофиза, а поэтому отдельного внимания заслуживает группа дофаминомиметиков (агонистов D2-рецепторов дофамина). Они существенно снижают уровень продуцируемых опухолью гормонов, одновременно уменьшая размеры опухоли [22]. Дофаминомиметики стали известны в 1972 году, когда была показана эффективность бромокриптина в терапии больных аденомой гипофиза, секретирующей одновременно СТГ и пролактин. Однако последние годы в лечении гормонально-активных аденом гипофиза используют агонисты дофамина нового поколения — квинаголид и каберголин. Более того, последний препарат сегодня является препаратом выбора для лечения аденомы гипофиза (Physicians Desk Reference, 2005) [10].
Каберголин способен уменьшать уровень пролактина, восстанавливать половую функцию и замедлять опухолевый рост у большинства пациентов, обладая минимумом побочных эффектов [23]. Так, в 4-недельном двойном слепом, плацебо-контролируемом исследовании 900 пациентов с гиперпролактинемией, вызванной гормонально-активной аденомой гипофиза, получали каберголин в фиксированных дозах 0,125, 0,5, 0,75 и 1,0 мг два раза в неделю [24]. Выраженность большинства побочных эффектов была слабой или умеренной. Спектр нежелательных явлений, возникших на фоне приема каберголина, представлен на рис. 2.
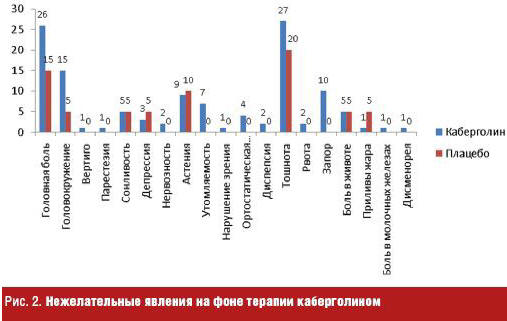
У этих пациентов дополнительно были выявлены такие нежелательные явления, как галлюцинации, спутанность сознания, периферические отеки. Редко отмечались сердечная недостаточность, плевральный выпот, легочный фиброз, язва желудка или двенадцатиперстной кишки, имеется сообщение об одном случае констриктивного перикардита. Именно поэтому у пациентов, получающих долгосрочное лечение каберголином, необходимо периодическое проведение эхокардиографии.
В ряде исследований установлена связь повышенного уровня пролактина и ухудшения показателей спермограммы [15, 16]. Лечение гиперпролактинемии, обусловленной аденомой гипофиза, каберголином дает положительный эффект в отношении параметров спермы [11, 12]. При анализе исследований восстановления показателей спермы после лечения различными дофаминомиметиками (каберголином, квинаголидом или бромокриптином) в группе каберголина были отмечены более значимые положительные изменения в количестве, подвижности, поступательном движении и нормализации морфологии спермы [13, 14].
Таким образом, доказательная база дофаминомиметиков, их высокая эффективность и широкий профиль безопасности позволяют назначать препараты, содержащие каберголин, в составе комплексного лечения и профилактики рецидивов аденомы гипофиза.
Литература
- Wilson T. M., Yu-Lee L. Y., Kelley M. R. Coordinate gene expression of luteinizing hormone-releasing hormone (LHRH) and the LHRH-receptor after prolactin stimulation in the rat Nb2 T-cell line: implications for a role in immunomodulation and cell cycle gene expression // Mol Endocrinol. 1995; 9: 44–53.
- Кушель Ю. В. Гормонально-неактивные аденомы гипофиза // Проблемы эндокринологии. 1993, № 1.
- Thapar K., Kovacs K., Laws E. R. Pituitary Adenomas: current concepts in classification, histopathology and molecular biology // The Endocrinologist. 1993, 3 (1): 39–57.
- Katznelson U., Alexander J. M., Klibanski A. J. Clinical review 45: clinically nonfunctioning pituitary adenomas // Clin Endocrinol Metab. 1993; 76: 5: 1089–1094.
- Molitch M. E. Clinical review 65. Evaluation and treatment of the patient with a pituitary incidentaloma // J Clin Endocrinol Metab. 1995; 80: 1: 3–6.
- Thapar К., Stefaneanu L., Kovacs K., Scheithauer B. W., Lloyd R. V., Muller P. J., Laws E. R. Jr. Estrogen receptor gene expression in craniopharyngiomas: an in situ hybridization study // Neurosurgery. 1994; 35 (6): 1012–1017.
- Reichlin S. In: Faglia G., Beck-Peccoz P., Ambrosi B., Travaglini P., Spada A. Pituitary adenomas: new trends in basic and clinical research // Elsevier. 1991; 113–121.
- Asa S. L., Kovacs K., Stefaneanu L. Pituitary adenomas in mice transgenic for growth hormone-releasing hormone // Endocrinology. 1992; 131: 2083–2089.
- Ezzat S., Melmed S. The role of growth factors in the pituitary // J Endocrinol Invest. 1990, 13: 691–698.
- 57-th Physicians’ Desk Reference, 2005, p. 2740–2742.
- Merino G., Carranza-Lira S., Martinez-Chequer J. C. Hyperprolactinemia in men with asthenozoospermia, oligozoospermia, or azoospermia // Arch Androl. 1997, 38 (3): 201–206.
- Saie D. J. Hyperprolactinemia presenting with encephalomalacia-associated seizure disorder and infertility: a novel application for bromocriptine therapy in reproductive endocrinology // Neuro Endocrinol Lett. 2005; 26 (5): 533–535.
- De Rosa M., Colao A., Di Sarno A., Ferone D., Landi M. L., Zarrilli S. Cabergoline treatment rapidly improves gonadal function in hyperprolactinemic males: a comparison with bromocriptine // Eur J Endocrinol. 1998, 138 (3): 286–293.
- De Rosa M., Ciccarelli A., Zarrilli S. The treatment with cabergoline for 24 month normalizes the quality of seminal fluid in hyperprolactinaemic males // Clin Endocrinol. 2006; 64 (3): 307–313.
- Vandekerckhove P., Lilford R., Vail A. Androgens versus placebo or no treatment for idiopathic oligo/asthenospermia // Cochrane Database Syst Rev. 2000; 2: CD00015.
- Ciccarelli A., Guerra E., De Rosa M., Milone F., Zarrilli S., Lombardi G., Colao A. PRL secreting adenomas in male patients // Pituitary. 2005; 8 (1): 39–42.
- Касумова С. Ю. Функциональная морфология аденом гипофиза. Дис. д.м.н. М., 1985, с. 360.
- Дедов И. И., Мельниченко Г. А. Персистирующая галакторея-аменорея. M., 1985; с. 166–180.
- Вакс В. В., Кадашев С. Ю., Касумова С. Ю. Отдаленные результаты послеоперационного лечения при «неактивных» аденомах гипофиза // Проблемы эндокринологии. 2001, № 1, с. 16–19.
- Abdel Gadir A., Khatim M. S., Mowafi R. S., Alnaser H. M. I., Alzaid H. G. N., Shaw R. W. Hormonal changes in patients with polycystic ovarian disease after ovarian electrocautery or pituitary desensitization // Clin Endocrinol. 1990, 32: 749–754.
- Kovacs K., Black P. M., Zervas N. T., Ridgway E. C. Secretory tumors of the pituitary gland // Raven Press, New York, 1985; 365–376.
- Кулаков В. И., Серов В. Н. Рациональная фармакотерапия. М., 2005, с. 587.
- Dos Santos Nunes V., El Dib R., Boguszewski C. L., Nogueira C. R. Cabergoline versus bromocriptine in the treatment of hyperprolactinemia: a systematic review of randomized controlled trials and meta-analysis // Pituitary. 2011.
- Шмаков Р. Г., Емельянова А. И., Полушкина Е. С. Современные аспекты подавления лактации // Лечащий Врач. 2009, № 11, с. 24–28.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru





