Функция и выживаемость почечного трансплантата у детей с хроническим гломерулонефритом
Е. А. Молчанова*, кандидат медицинских наук
А. В. Малкоч**, кандидат медицинских наук, доцент
Е. В. Неудахин***, доктор медицинских наук, профессор
*Российская детская клиническая больница, **РМАПО, ***РГМУ, Москва
Хронический гломерулонефрит (ХГН) — это гетерогенная группа гломерулопатий, различных по морфологическим, клиническим и иммунологическим вариантам, характеризующихся прогрессирующим течением с развитием склероза гломерул с последующим тубуло-интерстициальным склерозом и частым исходом в хроническую почечную недостаточность (ХПН). ХГН является одной из центральных проблем нефрологии, что связано с тяжестью течения заболевания, вовлечением многочисленных патофизиологических механизмов, обусловливающих общее страдание организма [1].
В последние десятилетия достигнут значительный прогресс в терапии ХГН, в том числе и у детей, однако в большом проценте случаев не удается добиться стойкой ремиссии заболевания, замедлить темпы его прогрессирования в терминальную стадию ХПН (тХПН). Особенно тяжелым течением отличаются варианты ХГН, протекающие с нефротическим синдромом (НС), резистентным к глюкокортикоидной терапии. Наибольший вклад в прогрессирование этих вариантов ХГН вносит высокая протеинурия, приводящая к деструкции эпителия канальцев нефронов и их гибели, и гиперлипидемия, способствующая атеросклеротическому поражению стенки сосудов, в том числе и почечных. Присоединение артериальной гипертензии усугубляет тяжесть течения заболевания и ускоряет темпы прогрессирования в тХПН [1, 2].
Все это обусловливает высокий процент детей с ХГН в структуре тХПН. По данным Российского регистра детей с ХПН, доля детей с ХГН в структуре ХПН составляет 12%, а среди детей с тХПН — 22,6% [3, 4].
Еще одной важной проблемой является возможность возврата ХГН в пересаженную почку. Частота рецидивирования ХГН в трансплантате во многом зависит от морфологического варианта ХГН и его активности. Наиболее часто у детей рецидивирует фокально-сегментарный гломерулосклероз (ФСГС) [1, 5–8].
В настоящей статье представлены данные по результатам пересадок почки детям с ХГН, выполненных в отделении по пересадке почки Российской детской клинической больницы за период с 1990 по 2005 годы.
Цель исследования — оценить функцию и выживаемость почечного трансплантата у детей с ХГН и влияние на них рецидива основного заболевания.
Материалы и методы
В исследование были включены 330 детей (168 мальчиков и 162 девочки) в возрасте от 6 до 18 лет. Этим детям была выполнена 361 операция пересадки почки: 305 первых, 52 — вторых и 4 — третьих.
Дети были разделены на группы в зависимости от заболевания, приведшего к формированию терминальной ХПН.
В большинстве случаев диагноз ХГН был поставлен на основании клинико-лабораторных данных, биопсия собственных почек проведена только у части пациентов, но даже при этом конкретная морфологическая форма ХГН не всегда могла быть определена. Поэтому анализ проводился без разделения ХГН на морфологические подгруппы (исключение составили 14 пациентов с ФСГС).
Всем детям проводилось комплексное клинико-лабораторное обследование, включающее определение суточной протеинурии, скорости клубочковой фильтрации, УЗИ и рентгенологические данные, а также морфологическое исследование биоптатов собственных почек и трансплантатов. Обследование проводилось как до пересадки почки, так и в ранние (через 2 месяца) и отдаленные сроки (через 1, 2, 3 года) после пересадки.
Результаты
ХГН явился причиной развития тХПН у 21,8% пациентов (табл. 1). В структуре причин тХПН это была вторая по численности группа. Помимо ХГН наибольшее число больных с тХПН составили группы с врожденной гипоплазией почек (34,6%) и врожденной урологической патологией (20,6%).
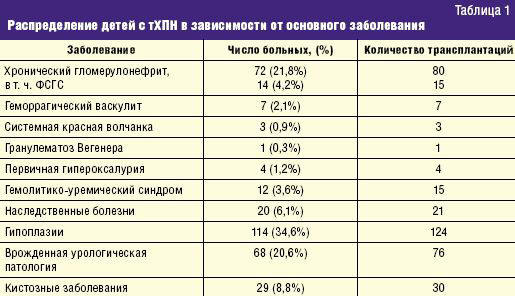
Ухудшение функции трансплантата выявлялось у 31 ребенка с ХГН (43% от численности группы больных с ХГН). Причинами нарушения функционирования трансплантата были: рецидив ХГН — у 14 детей (45,2%), хроническая трансплантационная нефропатия — у 8 (25,8%), отказ от терапии — у 5 (16,1%), острое отторжение трансплантата — у 3 (9,7%), цитомегаловирусная инфекция — у 1 ребенка (3,2%).
В целом в группе детей с ХГН рецидив основного заболевания в пересаженной почке имел место у 19 пациентов (23,7% от численности всей группы детей с ХГН). Причем чаще всего (в 14 случаях) наблюдалось раннее (до одного месяца после операции) развитие рецидива. Клинически он характеризовался НС с высокой (до 9 г в сутки) протеинурией. Ответ на терапию рецидива был получен только у двух детей.
У двух детей мы наблюдали развитие возврата в отдаленные сроки — через один и три года после операции. Оба случая характеризовались НС, резистентным к терапии.
Еще у трех детей возврат гломерулонефрита в трансплантате был морфологической находкой при плановой биопсии и не сопровождался ни клиническими проявлениями, ни лабораторными изменениями. Рецидивы были выявлены рано — на первом году после операции и, несмотря на отсутствие терапии, все трансплантаты длительно хорошо функционировали.
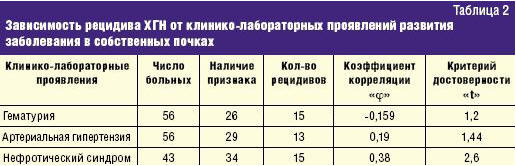
Оценка связи клинико-лабораторных проявлений заболевания в собственных почках с рецидивом в трансплантате показала, что ни гематурия, ни артериальная гипертензия, наблюдавшиеся при развитии заболевания в собственных почках, не являются достоверными факторами риска рецидивирования болезни при последующей пересадке почки. Достоверная связь рецидива ХГН в трансплантате определялась только с НС. При этом не у всех детей с НС возникал рецидив, но у всех детей, у которых наблюдался возврат ХГН в трансплантате, при развитии заболевания в собственных почках был НС (табл. 2).
Была выявлена прямая корреляция между развитием рецидива ХГН в трансплантате и исходной протеинурией: чем выше был уровень протеинурии при течении заболевания в собственных почках, тем чаще отмечался его рецидив в трансплантате (R = 0,60, t = 5,7). Особенно часто рецидив отмечался в группе детей (19 пациентов) с исходным уровнем протеинурии более 6 г/сутки — 12 рецидивов (63%). В группе детей с исходным уровнем протеинурии менее 6 г/сутки (41 пациент) выявлено всего четыре случая рецидива (9,8%), причем у двоих из них отмечались только морфологические изменения без каких-либо клинико-лабораторных признаков возврата заболевания. Математически вероятность возникновения рецидива значительно выше при протеинурии более 6 г/сутки (от 41% до 82%), тогда как при протеинурии менее 6 г/сут этот диапазон составляет 4–22%.
У детей с рецидивом при развитии заболевания в собственных почках уровень протеинурии был более чем в 2 раза выше, чем у детей без рецидива (6014,0 ± 3094,7 и 2683,8 ± 2037,1 мг/сутки соответственно, р = 0,0023). Достоверно различался в этих группах и уровень протеинурии после пересадки почки, причем как в раннем послеоперационном периоде — через 2 месяца после пересадки (2831,3 ± 2710,8 и 107,1 ± 183,5 мг/сутки соответственно, р = 0,0016), так и в отдаленном послеоперационном периоде — через 1 год (1796,2 ± 2044,2 и 116,9 ± 324,9 мг/сутки соответственно, р = 0,027). Появление протеинурии после пересадки было первым и самым ранним признаком развития возврата заболевания.
Таким образом, между развитием рецидива и уровнем протеинурии в раннем послеоперационном периоде существует прямая положительная корреляция. Более того, если у детей с протеинурией менее 1 г/сутки из 59 случаев рецидив имел место только в 7 (11,9%), то среди 12 больных с уровнем протеинурии в раннем послеоперационном периоде более 2,5 г/сутки рецидив был у всех (100%).
Функциональное состояние трансплантатов через 2 месяца после пересадки существенно не отличалось у больных с рецидивом и без рецидива ХГН: у пациентов с рецидивом креатинин сыворотки составил 110,5 ± 24,7 мкмоль/л, скорость клубочковой фильтрации — 69,3 ± 53,3 мл/мин; у пациентов без рецидива — 107,3 ± 28,7 и 75,0 ± 37,5 соответственно.
При сравнении уровня выживаемости трансплантатов у детей с рецидивом и без рецидива гломерулонефрита было установлено, что достоверные различия в показателях появляются уже через 1 год после операции (76% и 98% соответственно, р < 0,001). Эта тенденция сохраняется и в течение всех последующих лет наблюдения: через 2 года — 51% и 78%, через 3 года — 43% и 73%, через 4 года — 36% и 55% соответственно. Поскольку эти группы не различались между собой по другим факторам, влияющим на выживаемость пересаженных почек (длительность диализного лечения, возраст донора, срок консервации органа, число эпизодов острого отторжения), мы можем считать, что именно возврат основного заболевания повлиял на ухудшение выживаемости трансплантатов у детей с ХГН.
Морфологическое исследование биоптатов собственных почек было проведено у 35 больных (табл. 3). При анализе рецидивирования гломерулонефрита было установлено, что у детей с ФСГС из 15 трансплантаций рецидив развился после 8 (53%). Не было ни одного рецидива ни у одного из 5 детей с мезангио-капиллярным гломерулонефритом, также как и у 4 детей с экстракапиллярным гломерулонефритом. У детей с мезангиопролиферативным гломерулонефритом рецидив развился у 3 из 6 (50%).
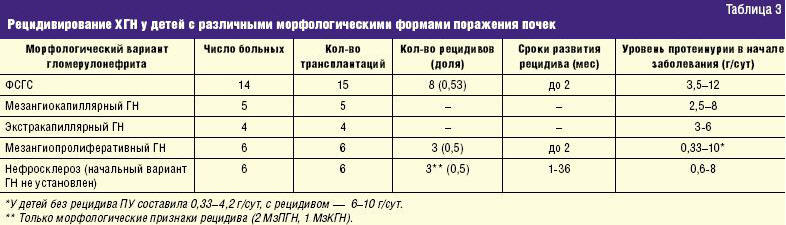
В тех же случаях, когда в биоптатах определялся только нефросклероз и морфологическая форма болезни осталась неизвестной, возвратов также было 3 из 6. Именно эти 3 рецидива были случайно выявленными морфологическими без клинических проявлений: 2 мезангиопролиферативных (МзПГН) и 1 мезангиокапиллярный ГН (МзКГН).
Группа детей с ФСГС была самой многочисленной, что дало возможность провести более детальный анализ. У детей с ФСГС возврат заболевания развился в 53% случаев. Во всех случаях признаки рецидива появлялись очень рано: протеинурия регистрировалась с первых дней восстановления диуреза и быстро достигала высоких цифр — от 5 до 9 г/сутки. Терапия рецидива была успешной только у 2 больных, у остальных функция трансплантата прекратилась в течение последующих 2 лет.
В начале заболевания уровень протеинурии был высоким у всех детей: у пациентов, развивших впоследствии рецидив, — 6881,6 ± 2523,1 мг/сутки; у детей без рецидива — 5748,0 ± 1907,2 мг/сутки (р > 0,05). Иная картина наблюдалась после трансплантации. В группе детей с возвратом уровень протеинурии был высоким как в раннем (3514,6 ± 2189,0 мг/сут), так и в отдаленном послеоперационном периоде (через 1 год — 2153,3 ± 1225,8 мг/сутки), тогда как у детей без возврата болезни белок в моче не определялся совсем в течение всего периода наблюдения.
Выявились достоверные различия между группами по возрасту манифестации заболевания. Все дети, у которых в дальнейшем развился возврат ФСГС в трансплантате, заболели в возрасте старше 6 лет (в среднем в 8,8 ± 2,0), средний возраст начала заболевания у детей без рецидива составил 4,2 ± 2,1 года (p = 0,0008). Также достоверным оказалось различие в длительности болезни до формирования терминальной ХПН. В группе детей без рецидива заболевание в среднем длилось 6 лет (71,0 ± 36,9 месяца), а с рецидивом — 3 года (37,2 ± 13,7 месяца, p = 0,0310).
При сравнении функции пересаженных почек обнаружилось, что уже через 2 месяца после пересадки у детей с рецидивом ФСГС наблюдается некоторое повышение уровня креатинина (114,0 ± 46,3 мкмоль/л против 77,6 ± 23,0 мкмоль/л у детей без рецидива, p = 0,0826) и снижение скорости клубочковой фильтрации (70,1 ± 27,0 мл/мин против 95,6 ± 37,7 мл/мин соответственно, p = 0,1521).
Выживаемость трансплантатов у детей с рецидивом ФСГС через один год после пересадки была уже значительно ниже, чем у детей без рецидива, — 71% и 100% соответственно, через два года — 43% и 83% соответственно. В последующие годы эта тенденция нарастала.
Выводы
- ХГН является одной из основных причин тХПН у детей. Доля ХГН в этиологической структуре тХПН составляет более 20%.
- Рецидив ХГН в трансплантате является причиной нарушения его функционирования почти в 50% случаев. Другими значимыми причинами являются хроническая трансплантационная нефропатия (25,8%) и отказ от терапии (16,1%).
- Маркерами высокого риска возврата ХГН в трансплантате являются НС и высокая протеинурия (более 6 г/сутки) при развитии заболевания в собственных почках.
- Наличие ФСГС значительно повышает риск развития рецидива в трансплантате, который выявляется у 53% детей после пересадки. При ФСГС маркерами высокого риска рецидива являются возраст ребенка в момент возникновения болезни старше 6 лет и быстрые темпы прогрессирования болезни до тХПН.
- Ранним признаком развития в трансплантате рецидива основного заболевания после пересадки почки у ребенка с ХГН является появление высокой протеинурии (более 2,5 г/сутки).
- Рецидивирование ХГН в почечном аллотрансплантате приводит к снижению функции и сокращению сроков его выживаемости, особенно при рецидиве ФСГС.
Литература
- Хасабов Н. Н., Малкоч А. В. Современные представления о гломерулонефритах / Нефрология детского возраста (под ред. В. А. Таболина и др.) / Практическое руководство по детским болезням (под ред. В. Ф. Коколиной и А. Г. Румянцева). М.: ИД Медпрактика-М, 2005, т. VI, с. 306–390.
- Папаян А. В., Савенкова Н. Д. Клиническая нефрология детского возраста. Руководство для врачей. СПб: «Сотис». 1997, с. 347–426, 637–690.
- Молчанова Е. А., Валов А. Л. Причины хронической почечной недостаточности у детей в России / Современные проблемы стационарной помощи детям. Материалы научно-практической конференции, посвященной 20-летию РДКБ. 25 ноября 2005 года, Москва. С. 64.
- Молчанова Е. А. О состоянии заместительной почечной терапии детей с хронической почечной недостаточностью в Российской Федерации в 2000–2003 гг. (По данным Российского регистра детей с ХПН) // Нефрология и диализ. 2005, т. 7, № 3, с. 278.
- Floege J. Recurrent glomerulonephritis following renal transplantation: an update // Nephrol Dial Transplant. 2003, v. 18, p. 1260–1265.
- Ghiggeri G. M., Carraro M., Vincenti F. Recurrent focal glomerulosclerosis in the era of genetics of podocyte proteins: theory and therapy // Nephrol Dial Transplant. 2004, v. 19 (5), p. 1036–1040.
- Hariharan S., Savin V. J. Recurrent and de novo disease after renal transplantation: a report from Renal Allograft Disease Registry // Pediatr Transplant. 2004, v. 8 (4), p. 349–350.
- Newstead C. G. Recurrent disease in renal transplants // Nephrol Dial Transplant. 2003, v. 18 (suppl 6), p. 68–74.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru






