Введение
Желудочно-кишечные заболевания различной этиологии (воспалительной, инфекционной, генетической и др.) могут приводить к изменениям в твердых и мягких тканях полости рта. Одним из таких заболеваний является целиакия, или глютеновая энтеропатия, — хроническое ауто-иммунное заболевание, характеризующееся иммунной энтеропатией при приеме глютена [1]. При целиакии имеет место атрофия ворсинок слизистой оболочки (СО) тонкого кишечника, вследствие чего развивается синдром мальабсорбции [2]. Целиакия может появиться в любом возрасте и характеризуется широким разнообразием клинических признаков и симптомов: от тяжелой мальабсорбции до минимальных проявлений или бессимптомного течения [3]. В большинстве случаев желудочно-кишечные симптомы определяют клиническую картину заболевания, у многих пациентов оральные проявления отмечаются до появления желудочно-кишечных симптомов [4].
В настоящее время признается влияние множества факторов на развитие целиакии, таких как качественные и количественные изменения микробиоты кишечника, частота и время начального контакта с глютеном, инфекции и продолжительность грудного вскармливания [3].
Целиакия обычно поражает мужчин на третьем десятилетии жизни, однако она может появиться в любом возрасте, в том числе в раннем [5]. Распространенность этого состояния может достигать 1% среди взрослого населения [6].
В представленном обзоре мы рассмотрели вопросы этиологии и патогенеза целиакии и на основании данных литературных источников оценили встречаемость, выраженность и структурность изменений со стороны полости рта при целиакии. Обзор был составлен на основе данных статей из PudMed за период с сентября 1967 г. по январь 2021 г. Было проанализировано 156 статей по запросу «celiac disease», «gluten enteropaty». В окончательный анализ включены 47 работ, соответствующих цели исследования.
Этиология и патогенез целиакии
Целиакия — многофакторное заболевание, которое является результатом взаимодействия генетических и экологических факторов [3]. Взаимосвязи между развитием целиакии и подтипами человеческих лейкоцитарных антигенов (HLA), локализующихся в 6-й хромосоме, подтверждают роль генетической предрасположенности в развитии целиакии. HLA с DQ2 и DQ8 генотипами описан в литературе как важный предрасполагающий фактор развития целиакии [3]. HLA-DQ2 выявляется почти у 90% пациентов с целиакией, в то время как остальные пациенты имеют HLA-DQ8 [6].
Поляризация антигенпрезентирующих клеток, в основном макрофагов, дендритных клеток и В-лимфоцитов, во II тип (провоспалительная поляризация молекул) может явиться одной из патогенетических основ развития целиакии [7].
Почти у всех пациентов с глютеновой энтеропатией развиваются аутоиммунные реакции. Это можно выявить по превышающему значению IgА (аутоантитела) к ферменту ткани трансглутаминазе (TG2) [7, 8]. Этот тканевый фермент экспрессируется многими типами клеток и ассоциируется с внеклеточным матриксом (волокна эндомизия или ретикулина). TG2 нацелен на определенные остатки глутамина в некоторых тканях [7]. TG2 трансформирует определенные пептиды глютена, увеличивая их сродство к HLA-DQ2 или HLA-DQ8. Это вызывает значительную активацию клеток CD4+ (T-helper 1), что может привести к воспалению СО кишечника, мальабсорбции и многочисленным вторичным симптомам и к аутоиммунным проявлениям целиакии [7]. Изучено влияние вида HLA на развитие и клиническую форму целиакии [6, 8, 9].
Целиакия является генетически детерминированным заболеванием, имеющим тенденцию к появлению симптомов со стороны полости рта. В исследование J. Sanchez-Solares et al. [1] были включены 6 пациентов с диагнозом «целиакия», поставленным de novo, и 7 пациентов с целиакией, проходивших лечение и находившихся на безглютеновой диете как минимум 1 год. Пациенты, не страдавшие данным заболеванием (n=8), составили контрольную группу. Истории болезни всех субъектов были проверены гастроэнтерологом, ответственным за набор пациентов. Все пациенты с недавно перенесенным заболеванием носоглотки или тяжелыми респираторными аллергическими заболеваниями были исключены из исследования. Каждому участнику исследования дважды выполняли биопсию СО щеки для анализа мРНК методом ПЦР и иммуногистохимического исследования. Образцы СО полости рта окрашивали на общие маркеры Т-лимфоцитов и антигенпрезентирующих клеток, такие как CD3, CD4, CD8, FoxP3, лангерин и CD11c [1].
В ходе исследования не было обнаружено существенных различий в абсолютном количестве CD3+, CD4+ или CD8+ Т-клеток ни в эпителии, ни в собственной пластинке. Однако когда было исследовано расположение этих клеток у набранных пациентов, обнаружились значительные различия между исследуемыми группами. Доля CD3+ клеток, расположенных в эпителии, была статистически значимо ниже у пациентов с целиакией по сравнению с показателем у лиц из контрольной группы (-15,60±5,86%, p<0,05) и с пациентами, у которых диагноз был поставлен de novo (-20,32±6,30%, p<0,05). Присутствие CD4+ в эпителии также было значительно ниже у пациентов с целиакией, но только по сравнению с показателем у лиц из контрольной группы (-28,91±7,27%, p<0,01). В отношении CD8+ не выявлено значительных различий между экспериментальными группами.
Регуляторные Т-клетки (Tregs) участвуют в поддержании иммунного гомеостаза и предотвращении реакций аутоиммунитета. Treg-клетки включают Treg-клетки тимуса и периферические Treg-клетки, которые могут подавлять иммунный ответ посредством множества механизмов. На дифференцировку, пролиферацию, подавляющую функцию и выживаемость Treg-клеток влияют различные программы энергетического метаболизма. Фактор транскрипции Foxp3 является главным регулятором клонов для развития и подавляющей активности Treg-клеток [10].
Количество клеток FoxP3+ в эпителии в большинстве случаев было незначительным. Количество FoxP3+ Treg во всей СО было значительно выше у пациентов с целиакией с диагнозом de novo (+11,54 клеток/мм2, p<0,001) и у тех, кто проходил лечение как минимум 1 год (+8,04 клеток/мм2, p<0,05), по сравнению с участниками исследования без целиакии (контрольная группа). Когда исследовали популяцию Treg среди всех CD3+ и CD4+ клеток, наблюдались аналогичные результаты. Соотношение FoxP3+/CD4+ увеличивалось в группе пациентов, у которых диагноз был поставлен de novo (+11,00%, p<0,01), и у пациентов, которые в течение 1 года находились на безглютеновой диете (+9,00%, p<0,05). Соотношение FoxP3+/CD3+ также увеличивалось в группах пациентов с диагнозом de novo (+27,11±4,58%, p<0,0001) и пациентов, находившихся в течение 1 года на безглютеновой диете (+16,01±4,58%, p<0,01). Наблюдали значительное снижение экспрессии белков эпителиальных соединений у всех пациентов с целиакией, что указывает на нарушение целостности барьера СО полости рта. У данных пациентов была значительно увеличена популяция FoxP3+ [1]. Это позволяет предположить, что Tregs транспортируются в поврежденную СО даже после отказа от глютена.
Уровни мРНК амфирегулина из мононуклеарных клеток периферической крови и повреждение эпителия СО полости рта коррелировали с инфильтрацией Treg во всех экспериментальных группах. Это позволяет предположить, что привлеченные Treg могут демонстрировать фенотип «восстановления». На основании полученных результатов предполагается, что СО полости рта при целиакии поражается, что может быть использовано в диагностике этого заболевания. Кроме того, из-за своей толерогенной природы СО может быть важной мишенью для пероральной иммунотерапии [1].
В ходе исследования оценивали, имеет ли набор Treg СО полости рта характерные особенности при целиакии. Авторами была обнаружена значительная положительная корреляция между экспрессией E-кадгерина и экспрессией лангерина в оральном эпителии (r=0,57, p<0,01) для всех групп [1]. E-кадгерин — кальций-зависимая молекула межклеточной адгезии, играющая ключевую роль в поведении эпителиальных клеток, формировании тканей и подавлении рака [11]. Напротив, уровни E-кадгерина отрицательно коррелировали с количеством FoxP3+ Treg (r=-0,65, p<0,01), т. е. чем выше уровень повреждения эпителия (чем ниже экспрессия E-кадгерина), тем более выражена инфильтрация Treg в СО ротовой полости [1].
Целиакия влечет за собой синдром мальабсорбции [2]. Так, при целиакии нарушается всасывание железа в организме, с чем связана неэффективность пероральной терапии железом при железодефицитной анемии, которая, в свою очередь, проявляется в полости рта характерными симптомами [12]. Железодефицитная анемия — наиболее частое проявление целиакии [13]. Пациент может ощущать жжение в СО полости рта (76,0%), сухость во рту (49,3%), могут наблюдаться варикозное расширение вен языка (56,0%), красный плоский лишай (33,3%) и атрофический глоссит (26,7%) — это ведущие оральные проявления у больных ЖДА [14]. Нередко отмечаются также бледность СО и угловой хейлит [15].
Целиакия может являться причиной дефицита В12 в организме. Признаки такого дефицита со стороны полости рта рассматриваются как часть мегалобластических изменений во всем желудочно-кишечном тракте, которые хорошо морфологически определяются в костном мозге [16, 17]. Наиболее частые симптомы В12-дефицитной анемии в полости рта — это эритема СО, угловой хейлит, атрофия сосочков языка, жжение в полости рта и рецидивирующий афтозный стоматит [18]. Еще одним характерным признаком дефицита витамина В12 в полости рта является «пурпурный язык» [16].
За последние 50 лет произошло существенное увеличение распространенности целиакии, причем зачастую диагноз устанавливается довольно поздно по причине гиподиагностики. Это может быть связано с тем, что часто врачи недооценивают внекишечные симптомы и признаки данного заболевания [12], такие как герпетиформный дерматит, анемия, низкий рост, остеопороз, артрит, неврологические проблемы, необъяснимое повышение уровня транс-аминаз и даже женское бесплодие [3], а также проявления со стороны полости рта [19].
Специфические стоматологические проявления целиакии
В настоящее время широко признано, что целиакия может поражать полость рта и зубы, что проявляется в виде дефектов зубной эмали и рецидивирующих афтозных язв [20–23]. Оральные поражения при целиакии могут вызвать значительные функциональные и эстетические нарушения, а также ухудшить качество жизни пациента [4].
Дефекты эмали зубов. Дефекты зубной эмали могут проявляться в виде как функциональных нарушений (гипоплазия), так и качественных нарушений (гипоминерализация) [24].
Локализованная гипоплазия эмали может быть в виде ямок, бороздок или глубоких линий на вестибулярных поверхностях, которые в норме блестящие и твердые. Неповрежденная гладкая поверхность эмали с непрозрачными белыми или желтыми пятнами или линиями указывает на менее серьезное гипокальцифицированное нарушение [20]. Дефект в виде ямки в среднем имеет размер 80 микрон. Поражается только эмаль, повреждение дентина отсутствует [25]. Гипоплазия является некариозным поражением эмали, появляется в одноименной группе зубов во всех 4 квадрантах [21, 24]. Единичные и асимметричные изменения считаются крайне неспецифичными для целиакии [24].
Для оценки всех изменений эмали широко используется 4-уровневая классификация по L. Aine et al. [26]:
I. Одно или несколько кремовых, желтых или коричневых пятен (отметин) с четкой или размытой границей, часть зубной эмали может быть непрозрачной.
II. Незначительные структурные дефекты эмали, шероховатая вестибулярная поверхность с горизонтальными бороздками или ямками, искажение цвета и нарушение прозрачности эмали.
III. Явные структурные дефекты эмали зуба, часть поверхности эмали шероховатая, с глубокими бороздками различной глубины либо с глубокими вертикальными ямами, крупными очагами помутнения разных оттенков.
IV. Сильно изменена структура эмали. Изменена форма зуба: кончики бугров заострены, режущие кромки и/или режущий край неровно истончены. Истончение эмалевого материала легко обнаруживается [26].
При изучении изменений эмали под электронным микроскопом видно, что эмалевые призмы укорочены и расположены неровно, слабо распределено межпризматическое вещество [24].
Общая распространенность системных дефектов зубной эмали у пациентов с глютеновой болезнью со сменным или постоянным прикусом колеблется от 9,5% до 95,9% (в среднем 51,1%); у пациентов с молочными зубами распространенность составляет от 5,8% до 13,3% (в среднем 9,6%) [27]. Это различие можно объяснить тем фактом, что коронки постоянных зубов образуются в период с первых месяцев жизни до 7-го года (т. е. после введения глютена в рацион), тогда как развитие временных зубов происходит в основном в утробе матери [28]. Поражение молочных зубов в некоторых случаях подтверждает гипотезу о том, что иммунологические и генетические факторы играют более важную роль в этиологии дефектов, чем дефицит питательных веществ. Дефекты зубной эмали также обнаруживаются у здоровых родственников первой степени родства пациентов с глютеновой болезнью, что дополнительно подтверждает иммуногенетическую основу болезни [29]. Причиной дефектов зубной эмали может быть и нарушение питания, включая недостаточное поступление кальция [30]. Также была выдвинута гипотеза о том, что глютен напрямую может стимулировать лимфоциты в СО полости рта, приводя к различным ее повреждениям [27].
Дефекты зубной эмали часто встречаются у детей, у которых до 7 лет развиваются симптомы целиакии [21]. Основными зубами, пораженными гипоплазией, являются второй коренной зуб и клыки временных зубов, а также первый коренной зуб, центральный резец и боковые резцы постоянных зубов [21].
Кариес при целиакии. В нескольких исследованиях изучалась распространенность кариеса у пациентов с глютеновой болезнью [28]. Было выявлено, что различий в распространенности кариеса между людьми с целиакией и здоровыми людьми из контрольной группы нет [31–33]. Также исследователи отмечали, что значение индексов распространенности кариеса значительно ниже у пациентов с глютеновой энтеропатией, чем в контрольной группе [34–37]. Ни в одном исследовании не сообщалось о более высокой распространенности кариеса среди пациентов с глютеновой болезнью. Возможное объяснение этих результатов состоит в том, что необходимость в тщательном контроле диеты у пациентов с целиакией обусловливает ограниченное употребление углеводов [28].
Зубная эмаль детей с целиакией отличается более низким соотношением кальция и фосфора (р=0,0136), но разницы в соотношении карбонатов и фосфатов обычно не выявляют (р=0,5862). В ходе анализа можно сделать вывод, что глютеновая энтеропатия может являться фактором защиты от кариеса (отношение шансов (ОШ) 0,74; 95% доверительный интервал (ДИ) 0,61–0,91; p=0,0042) и фактором риска развития рецидивирующего афтозного стоматита (ОШ 3,23; 95% ДИ 1,30–8,01; p=0,0164) [34].
Изменения СО полости рта. Наиболее частыми изменениями СО полости рта являются рецидивирующий афтозный стоматит (РАС) и атрофический глоссит [21, 24, 28].
Точная причина развития афтозных язв при глютеновой болезни неизвестна. Вероятными причинами стоматита являются гематиновая недостаточность, низкий уровень сывороточного железа, фолиевой кислоты и витамина B12 из-за мальабсорбции у пациентов с нелеченой глютеновой болезнью [28].
Рецидивирующий афтозный стоматит — это одно из наиболее распространенных заболеваний ротовой полости, поражающее от 5% до 60% населения [28]. Термин РАС применяют для описания клинической картины у пациентов без системных заболеваний. Язвы, которые напоминают РАС, но обнаруживаются при системных расстройствах, следует обозначать как афтозные язвы [28]. РАС характеризуется болезненными рецидивирующими единичными или множественными язвами СО полости рта, которые имеют округлую или яйцевидную форму с эритематозными ореолами и желтым или серым дном. Язвы могут превышать 1 см в диаметре и сохраняться в течение нескольких недель. Наименее распространенный тип РАС — герпетиформный, он характеризуется совокупностью (до 100 и более) небольших язв диаметром от 1 до 3 мм, которые имеют тенденцию сливаться, образуя большие нерегулярные язвы. Собственное клиническое наблюдение РАС и кариеса при целиакии представлено на рис. 1.
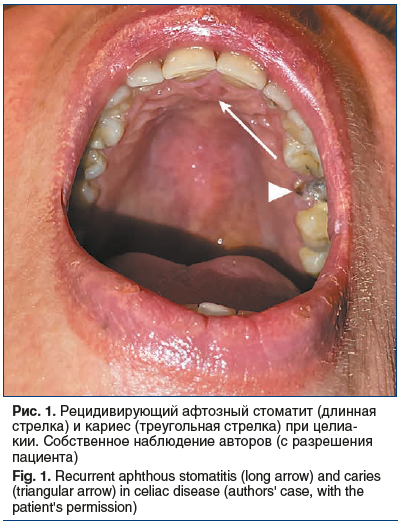
Связь между язвами во рту и целиакией изучается довольно давно [38]. Все проведенные исследования не смогли продемонстрировать статистически значимую разницу между глютеновой энтеропатией и проявлениями РАС в полости рта у пациентов с данным заболеванием и контрольными группами, хотя стоит отметить, что значения распространенности РАС у пациентов с глютеновой болезнью постоянно были выше, чем в контрольной группе [28, 36, 39–41]. Однако следует обратить внимание на то, что при целиакии РАС чаще всего сопровождается другими поражениями СО полости рта, такими как эритема, атрофический глоссит, и связанными с ними симптомами: болью и чувством жжения [24].
Атрофический глоссит и угловой хейлит могут возникнуть вторично по отношению к целиакии в результате дефицита питательных веществ или анемии [42].
При глоссите происходит атрофия нитевидных сосочков языка, вследствие которой он становится гладким и блестящим [42]. Атрофический глоссит может имитировать мигрирующий глоссит. Мигрирующий глоссит, также известный как географический язык, является заболеванием неизвестной этиологии, им страдают 12% населения [15]. При мигрирующем глоссите наблюдаются эритематозные незатвердевшие атрофические поражения языка, со слегка приподнятым отчетливым краем, цвет которого варьируется от серого до белого. При атрофическом глоссите эти области не имеют белой кератотической границы, и они увеличиваются в размерах, а не меняют положение. В более тяжелых случаях отмечается болезненность языка.
Угловой хейлит (болезненные трещины в углах рта) часто бывает связан с грибковыми инфекциями (Candida albicans), обезвоживанием и другими факторами [43]. Угловой стоматит и хейлоз (сухое шелушение губ и углов рта) также являются частыми проявлениями железодефицитной анемии [15].
Еще одним характерным проявлением целиакии в полости рта является задержка прорезывания зубов [21]. Было проведено исследование, в ходе которого изучался стоматологический возраст детей с целиакией и здоровых детей. Задержка прорезывания зубов была отмечена у 28,57% обследованных пациентов [28, 44]. Задержку прорезывания зубов при глютеновой непереносимости связывают с задержкой развития организма в целом [24].
В другом исследовании была осмотрена полость рта детей, имеющих временный или смешанный прикус. У детей с целиакией было значительно больше дефектов эмали и наличие РАС, но не наблюдалось задержки прорезывания зубов [21, 45].
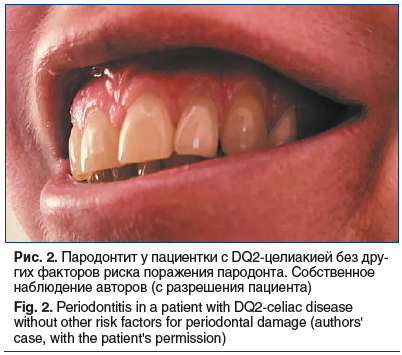
Совокупное неблагоприятное влияние целиакии на полость рта может проявляться пародонтитом, для которого характерно резистентное к лечению прогрессирующее течение [46, 47] (рис. 2).
Лечение заболеваний полости рта при целиакии. Специфических рекомендаций по лечению заболеваний полости рта при целиакии не разработано. Тем не менее представляется перспективным комплексное лечение, включающее применение малоглютеновой диеты, коррекцию типичных для целиакии нарушений обмена основных питательных веществ (белки, жиры, углеводы), витаминов и микроэлементов, системную цитопротективную терапию, а также стоматологическое лечение. Особенностью лечения поражений полости рта при целиакии является то, что местное лечение оказывается мало- или неэффективным без коррекции нарушений обмена веществ и цитопротективной терапии. Восстановление нормальных функций СО ротовой полости без коррекции защитных свойств СО всего желудочно-кишечного тракта также может оказаться малоэффективным в большинстве случаев. В этой связи при рецидивирующих формах поражения СО полости рта и зубов требуется дополнительное обследование для исключения целиакии.
Заключение
Таким образом, в настоящее время широко признано, что при целиакии могут поражаться СО полости рта и зубы, что приводит к значительным функциональным и эстетическим нарушениям, а также ухудшает качество жизни пациента. Наиболее часто встречающимися заболеваниями полости рта при целиакии являются РАС, задержка прорезывания зубов, дефекты эмали зубов, в частности гипоплазия. Наиболее редкими считаются угловой хейлит и атрофический глоссит. Распространенность кариеса у пациентов с целиакией либо не отличается от таковой у здоровых людей, либо значение индексов распространенности кариеса значительно ниже у пациентов с глютеновой энтеропатией, чем в контрольной группе.
Сведения об авторах:
Мазуров Вадим Иванович — д.м.н., академик РАН, заслуженный деятель науки РФ, профессор, главный научный консультант, директор НИИ ревматологии и заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; руководитель центра аутоиммунных заболеваний СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0002-0797-2051.
Гайдукова Инна Зурабиевна — д.м.н., заместитель директора НИИ ревматологии, профессор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0003-3500-7256.
Инамова Оксана Владимировна — к.м.н., заместитель директора по работе с клиническими базами НИИ ревматологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, доцент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; главный врач СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0001-9126-3639.
Таманькова Екатерина Сергеевна — студентка 4-го курса стоматологического факультета ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-1581-0175.
Догова Варвара Ивановна — студентка 5-го курса лечебного факультета ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-2656-8468.
Пилипенко Анастасия Игоревна — врач-ревматолог СПб ГБУЗ «Городская поликлиника № 19»; 192238, Россия, г. Санкт-Петербург, ул. Пражская, д. 11; ORCID iD 0000-0003-1369-4593.
Контактная информация: Гайдукова Инна Зурабиевна, e-mail: ubp1976@list.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.07.2022.
Поступила после рецензирования 03.08.2022.
Принята в печать 26.08.2022.
About the authors:
Vadim I. Mazurov — Dr. Sc. (Med.), Academician of the Russian Academy of Sciences, Honored Scientist of the Russian Federation, Professor, Chief Scientific Consultant, Director of the Research Institute of Rheumatology, Head of the Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Head of the Center of Autoimmune Diseases, Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0002-0797-2051.
Inna Z. Gaydukova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Rheumatology, Professor of the Department of Internal Medicine, Rheumatology, Examination of Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0003-3500-7256.
Oksana V. Inamova — C. Sc. (Med.), Deputy Director for Work with Clinical Bases of the Research Institute of Rheumatology, I.I. Mechnikov North-Western State Medical University; Associate Professor of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Chief Medical Officer of the Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyakskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0001-9126-3639.
Ekaterina S. Tamankova — 4th-year student of the Faculty of Dentistry, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-1581-0175.
Varvara I. Dogova — 5th-year student of the Faculty of General Medicine, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-2656-8468.
Anastasia I. Pilipenko — rheumatologist of the City Outpatient Clinic No. 19; 11, Prazhskaya str., St. Petersburg, 192238, Russian Federation; ORCID iD 0000-0003-1369-4593.
Contact information: Inna Z. Gaydukova, e-mail: ubp1976@list.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 11.07.2022.
Revised 03.08.2022.
Accepted 26.08.2022.
Информация с rmj.ru
