Содержание статьи
Введение
Рак матки является наиболее распространенным гинекологическим раком в странах с высоким уровнем жизни [1–6]. В России его частота составляет 8% [1, 2]. Ежегодно в мире выявляют примерно 382 069 новых случаев болезни и 42 000 женщин умирают от нее. Пик заболеваемости приходится на возраст 65–69 лет и составляет 68,7 случая на 100 000 женщин. У 20–25% пациенток рак эндометрия (РЭ) диагностируют в возрасте до 45 лет, у 5% — до 40 лет [7]. Согласно результатам обзора европейского и американского реестров опухолей за 18-летний период частота РЭ у пациенток в возрасте до 40 лет составляет 4,5% [8], из них до 70% — нерожавшие женщины [9].
Возможности консервативного лечения РЭ
В связи со смещением деторождения на четвертую декаду жизни вероятность выявления РЭ у пациенток, не успевших реализовать свои репродуктивные планы, возрастает.
Согласно современным представлениям при выявлении онкологического заболевания у пациенток репродуктивного возраста и желании в будущем реализовать свою детородную функцию такая опция должна быть рассмотрена на этапе планирования лечения [10–13].
Обсуждение вопроса о допустимости и безопасности консервативного лечения РЭ крайне актуально в сложившихся демографических условиях. Оптимальными кандидатами для консервативного лечения РЭ являются пациентки с высокодифференцированной (G1) аденокарциномой эндометрия, РЭ I типа, опухолью, ограниченной эндометрием, стадия IA, с отсутствием противопоказаний к гормональной терапии, информированные о нестандартном подходе к терапии и рисках рецидивирующего и/или персистирующего рака [14].
При развитии РЭ II типа или наследственных формах органосохраняющий подход и сохранение фертильности нецелесообразны в связи с иным патогенезом развития болезни и отсутствием чувствительности опухоли к прогестерону [15].
На рисунке 1 отображен алгоритм принятия решения при выявлении онкологического заболевания у пациентки репродуктивного возраста с нереализованной детородной функцией [16].
![Рис. 1. Алгоритм принятия решения о возможности проведения консервативного лечения [16] Fig. 1. Decision-making algorithm concerning concervative treatment [16] Рис. 1. Алгоритм принятия решения о возможности проведения консервативного лечения [16] Fig. 1. Decision-making algorithm concerning concervative treatment [16]](https://medblog.su/wp-content/uploads/2023/12/Vozmozhnosti-sohraneniya-reproduktivnoj-funktsii-u-patsientok-s-atipicheskoj-giperplaziej-i.png)
Варианты консервативного лечения РЭ
Стандартное лечение РЭ включает тотальную гистерэктомию и двустороннюю сальпингоофорэктомию с лимфаденэктомией или без таковой [17]. Консервативные подходы включают лечение пероральными прогестинами (медроксипрогестерона ацетат (МПА), мегестрола ацетат (МА)), аналогами гонадотропин-рилизинг-гормона (аГтРГ) и внутриматочным средством (ВМС), высвобождающим левоноргестрел (табл. 1) [18].

Терапия прогестинами является основной при консервативной тактике.
K. Ushijima et al. [19] представили обобщенные результаты проспективного многоцентрового исследования II фазы, метаанализа наблюдательных ретроспективных исследований и тематических отчетов. Было показано, что минимально эффективной дозой МПА являются 10 мг, для МА — 160 мг, а непрерывный режим предпочтительней циклического.
В метаанализе 25 наблюдательных когортных исследований, включивших 445 пациенток с ранней стадией РЭ и пероральной терапией прогестинами, регресс заболевания достигнут у 82,4%, а рецидивы отмечены у 25%. Беременность наступила у 56 (53,1%) из 129 женщин [20]. Полный регресс при пероральном введении гестагенов достигается у 80% больных [21].
В настоящее время при гормонотерапии рака тела матки в России используются 3 группы препаратов: гестагены (17α-оксипрогестерон капронат, МПА), антиэстрогены (тамоксифен) и аГтРГ. В последнее десятилетие активно используются комбинации препаратов аГтРГ с ВМС, высвобождающим левоноргестрел [10, 12].
Опубликованные данные показывают, что минимальное время до получения гистологического ответа составляет 3,6 мес. [22]. Порядка 62–75% женщин с высокодифференцированной аденокарциномой хорошо отвечают на лечение в течение 3–9 мес. с сохранением стойкого длительного эффекта [23].
Метаанализ 34 исследований (408 пациенток с РЭ I стадии) консервативного лечения РЭ прогестинами продемонстрировал достаточно высокую эффективность. Полный регресс опухоли был достигнут у 76% пациенток, рецидивы зафиксированы у 41%. При рецидиве РЭ II стадия была диагностирована у 1,8% пациенток [24].
Продолжаются дискуссии относительно выбора дозы и длительности лечения. Для МПА эффективность доказана при дозах от 2,5 до 1500 мг/сут. Интересные результаты получены в многоцентровом проспективном исследовании II фазы, включившем 22 пациентки с РЭ с предполагаемой инвазией в миометрий <50%. Все женщины получали МПА по 600 мг 1 р/сут в течение 26 нед. Полный терапевтический ответ, определяемый как отсутствие гиперплазии и раковых клеток, был получен у 56% пациенток, у 32% выявлен частичный ответ. Рецидивы наблюдались у 47% в течение периода от 7 до 36 мес. [19].
Существует мало данных, которыми можно руководствоваться при выборе дозы МА в терапии РЭ. Выбор лечебной дозы основан на необходимости сбалансировать эффективность с токсичностью, поскольку перорально вводимые прогестины имеют потенциальные побочные эффекты: образование тромбов, изменение настроения, головные боли, увеличение массы тела, болезненность и нагрубание молочных желез [19].
В проспективном рандомизированном исследовании пациенток с прогрессирующим или рецидивирующим РЭ, получавших МПА, низкая доза (200 мг/сут) показала большую эффективность, чем высокая (1000 мг/сут) [25].
Эффективность терапии гестагенами обусловлена наличием рецепторов к прогестерону, которые сохраняются только в высокодифференцированных типах РЭ. Лучший ответ на терапию можно ожидать у более молодых пациенток при наличии предшествующей беременности и отсутствии бесплодия [26]. Косвенным маркером эффективности и достижения желаемых результатов на фоне лечения является толщина эндометрия по данным УЗИ. Более тонкий эндометрий (до 6,5 мм) через 8 нед. лечения ассоциирован с лучшими показателями, нежели более толстый эндометрий (14,7 мм) (73% против 25%) [19].
Продолжительность терапии определяется индивидуально. Среднее время до получения полного ответа составляет от 8 нед. до 9 мес. [19]. Вычисление среднего временного интервала от начала терапии до гистологического ответа затруднено из-за различий в дизайне и методологии представленных исследований. Чаще всего проводится повторный забор эндометрия через 3 мес.
Продолжительность эффекта от гормональной терапии неизвестна. Даже у пациенток с хорошим первоначальным ответом сохраняется значительный риск рецидива РЭ, достигающий 24–41% [26], со средним временем до рецидива от 15 до 35 мес. [27].
Эффективность монотерапии РЭ с применением ВМС, высвобождающего левоноргестрел, менее изучена, чем при лечении пероральными препаратами [28]. Преимущество ВМС, высвобождающего левоноргестрел, заключается в том, что оно не требует ежедневного введения, служит эффективным противозачаточным средством и создает стойкие концентрации левоноргестрела в эндометрии, в 100 раз превышающие таковые при применении пероральных гестагенов.
Анализ 2230 публикаций, посвященных применению пероральных и внутриматочных гестагенов с 1980 по 2009 г., показал, что ВМС, высвобождающее левоноргестрел, более эффективно в лечении атипической гиперплазии эндометрия (90% против 69%) [19].
В проспективном наблюдательном исследовании пациенток, получавших лечение с применением как ВМС, высвобождающего левоноргестрел, так и МПА перорально, среднее время до полной ремиссии составило 10 мес. (от 3 до 35 мес.), причем у 25% полный ответ был достигнут уже через 3 мес., а у 50% — через 6 мес. [29].
Опубликованы результаты нескольких исследований, в которых пациенткам репродуктивного возраста с РЭ проводилось лечение при помощи ВМС, высвобождающего левоноргестрел. Наибольшее из них включило 190 пациенток с РЭ I–II стадии с минимальной инвазией в эндометрий. Контрольный кюретаж проводился через 0, 3 и 6 мес. Частота достижения полного ответа составила 96%, в то время как на фоне применения аГнРГ — 71–89% [30].
Репродуктивные исходы после консервативного лечения РЭ
В таблице 2 приведены данные о частоте наступления беременности и родов у пациенток после консервативного лечения РЭ по данным исследований, посвященных консервативному лечению РЭ.
![Таблица 2. Частота наступления беременности и родов в исследованиях, посвященных консервативному лечению РЭ [31–67] Table 2. Frequency of pregnancy and childbirth in studies on conservative treatment of EC [31–67] Таблица 2. Частота наступления беременности и родов в исследованиях, посвященных консервативному лечению РЭ [31–67] Table 2. Frequency of pregnancy and childbirth in studies on conservative treatment of EC [31–67]](https://medblog.su/wp-content/uploads/2023/12/1703612621_174_Vozmozhnosti-sohraneniya-reproduktivnoj-funktsii-u-patsientok-s-atipicheskoj-giperplaziej-i.png)
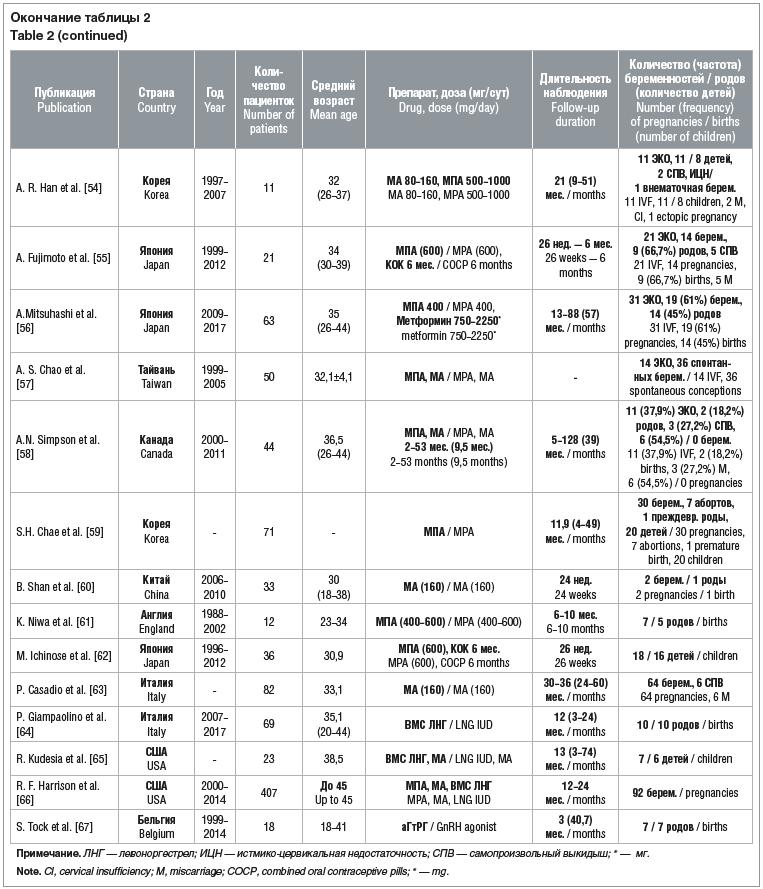
Систематические обзоры опубликованных исследований показали, что средняя частота наступления беременности после терапии РЭ составляет 35% [21], а родов — от 28 [24] до 47% [68].
Наибольшее число наблюдений опубликовано J.Y. Park et al. [27] в 2012 и 2013 гг. В серии исследований сообщается о 141 пациентке с РЭ, получивших консервативное лечение, после которого беременность наступила у 73%, а роды произошли у 66% женщин.
В то же время, по данным M. Yu et al. [69], частота наступления беременности не превышает 28%, а родами заканчиваются только 12% беременностей.
По данным обобщенного обзора, включившего результаты 27 исследований консервативного лечения РЭ у 81 пациентки, полный ответ получен у 62, беременность наступила у 20 (у 12 путем экстракорпорального оплодотворения (ЭКО)), роды в срок произошли у 17, а преждевременные роды отмечены у 3 пациенток [70].
Невысокий процент наступивших беременностей большинство авторов связывают с исходным состоянием здоровья женщин (бесплодие, синдром поликистозных яичников, ожирение), а также с последствиями неоднократных раздельных диагностических выскабливаний, проводимых для оценки состояния эндометрия и ответа на проводимую терапию. Это способствует формированию маточного фактора бесплодия (внутриматочные синехии, истмико-цервикальная недостаточность), что должно быть учтено при планировании беременности и принятии решения о применении вспомогательных репродуктивных технологий (ВРТ) [19].
По данным A.R. Han et al. [54], применение ВРТ позволяет минимизировать интервал между прекращением терапии РЭ и зачатием. Авторы представили результаты лечения 11 пациенток с начальным РЭ, получавших терапию МПА или МА в течение 6 мес. Беременность наступила у всех женщин, роды — у восьми. В связи с формированием истмико-цервикальной недостаточности 2 беременности спонтанно прервались. После родов пациентки продолжали получать гормональное лечение в течение 46,8 (от 13 до 75) мес., рецидива РЭ не было зафиксировано ни в одном случае.
A. Fujimoto et al. [55] сообщают о 21 пациентке с начальным РЭ 1 типа, которым было проведено консервативное лечение с использованием МПА в дозе 600 мг/сут в течение 26 нед. с последующим 6-месячным курсом терапии комбинированными пероральными контрацептивами (КОК). После отмены терапии проводились циклы стимуляции суперовуляции, выбор протокола зависел от исходного фолликулярного резерва и причин бесплодия. Средний возраст пациенток составил 34 года (от 30 до 39 лет). Было доказано, что ВРТ не повышают риск рецидива РЭ, но улучшают результативность в достижении беременности. Из 21 пациентки беременность наступила у 14, отношение частоты наступления беременности к родам составило 66,7%. У 5 женщин произошел выкидыш.
В 2012 г. был опубликован систематический обзор, включивший 329 сообщений (391 пациентка), посвященных консервативной тактике ведения пациенток с атипической гиперплазией и начальным РЭ за период с 2004 по 2011 г. 49% пациенток получали терапию МПА, 25,2% — МА, 19% — ВМС, высвобождающим левоноргестрел, остальные — КОК, норэтистерон, дидрогестерон, натуральный прогестерон и 17-гидроксипрогестерон. У 53,2% был достигнут полный ответ, у 24,6% диагностирован рецидив, у 22,2% не было получено ответа на терапию. Средняя безрецидивная выживаемость составила 24 мес. Только в 38 исследованиях сообщалось о репродуктивных исходах. Из 315 пациенток, заинтересованных в беременности, она наступила у 36,2%, и было рождено 117 детей [21].
Репродуктивные исходы после консервативного лечения РЭ являются многообещающими, хотя результаты варьируют в зависимости от исходных характеристик пациенток и того, применялись ли ВРТ. Многоцентровое исследование 141 корейской женщины в возрасте до 40 лет, у которых был диагностирован РЭ I стадии G1, пролеченный пероральными прогестинами, показало, что из 73% женщин, пытавшихся забеременеть, у 66% произошли роды. Частота бесплодия в этой группе, безусловно, выше, чем в общей популяции, и зачастую беременность наступала благодаря ВРТ, что не оказывало влияния на показатели безрецидивной 5-летней выживаемости [27].
Более поздний анализ 118 женщин с РЭ I–II стадии, получавших МПА и ВМС , высвобождающее левоноргестрел, показал, что уровень живорождения составил 67%. В этой когорте медиана безрецидивной выживаемости достигала 26 мес. в группе тех, кто забеременел, и 12 мес. в группе незабеременевших, что свидетельствует о благоприятном влиянии беременности на онкологический прогноз [57].
A.N. Simpson et al. [58] отмечает, что в связи с невысокими показателями наступления беременности у женщин после гормонального лечения РЭ целесообразно прибегать к ВРТ как можно раньше.
Обсуждение рисков применения ВРТ с точки зрения отдаленных последствий и влияния на прогноз является крайне важным. По данным исследования A.S. Chao et. al. [57], рецидив РЭ после родов развивается в среднем через 40 мес. В одном случае пациентка умерла от прогрессирования РЭ через 8 мес. после срочных родов. Для минимизации неблагоприятных исходов после реализации репродуктивной функции рекомендовано проведение гистерэктомии [57, 59].
Эффективность протоколов ВРТ после терапии РЭ также невысока. По результатам проспективного исследования Z. Eftekhar et al. [44], положительный исход наблюдался только в 11% случаев. По данным R. Kudesia et al. [65], эффективность ВРТ после гормонального лечения РЭ не превышает 30%.
Ретроспективное исследование, включившее 45 женщин с РЭ G1, проведенное P. Dursun et al. [46], показало, что беременность наступает у 42% пациенток, из них у 85% — при помощи ВРТ. Однако в большинстве случаев беременность прерывается, роды в исследуемой когорте произошли только в одном случае.
Применение ВРТ способствует скорейшей реализации репродуктивных планов и безопасно для пациенток после консервативного лечения РЭ [57].
Большинство доступных исследований свидетельствуют о том, что витрификация яйцеклеток перед началом терапии РЭ или проведение ВРТ после достижения полного ответа на гормонотерапию безопасны и не ухудшают прогноз [71].
Метаанализ, в который было включено 408 женщин с РЭ и 151 — с атипической гиперплазией эндометрия, показал, что полный ответ на консервативное лечение достигнут у 76% при РЭ и у 86% при атипической гиперплазии. Спонтанное зачатие произошло в 28% случаев после терапии РЭ и в 26% случаев после терапии атипической гиперплазии. Женщины, у которых применялись ВРТ, имели значительно лучшие результаты независимо от первоначального диагноза. Однако частота рецидивов достигла 41% для РЭ и 26% для атипической гиперплазии. Прогрессирование заболевания отмечено в 10 случаях, и 2 женщины умерли [24].
Индукция овуляции не связана с повышенным риском рецидива РЭ, а последующие беременности не ухудшают онкологический прогноз [16, 55]. Однако влияние высокого уровня эстрадиола в сыворотке крови на прогрессирование или рецидив РЭ остается неопределенным, хотя некоторые данные свидетельствуют о неблагоприятном влиянии циклов стимуляции яичников. В настоящее время не разработана оптимальная продолжительность протоколов и не определено безопасное количество циклов стимуляции яичников для женщин с ранней стадией РЭ [16].
Была предложена стратегия поддержания низкого уровня эстрогенов во время контролируемой гиперстимуляции яичников за счет использования ингибиторов ароматазы в сочетании с аГтРГ [39]. Применение аГтРГ в качестве триггера овуляции ассоциировано с большим числом получения зрелых ооцитов и большим количеством криоконсервированных эмбрионов или ооцитов по сравнению с циклами с использованием хорионического гонадотропина человека [72].
Результаты клинических испытаний и наблюдательных исследований показывают, что криоконсервация неоплодотворенных ооцитов представляет собой приемлемую альтернативу, особенно для одиноких женщин, и что она должна рассматриваться как рутинный метод для пациенток перед проведением химио- и/или лучевой терапии.
Очень важно подчеркнуть необходимость обсуждения с пациенткой рисков консервативного лечения РЭ. Даже при I стадии заболевания в 2,8% случаев имеется вовлечение тазовых, в 1,7% — парааортальных лимфоузлов. Кроме того, до 10% опухолей I стадии имеют невыявленную глубокую мышечную инвазию, у 6% пациенток с I–II стадией опухоль распространяется на придатки и у 19% выявляются самостоятельные опухоли яичников [73].
В целом смертность, связанная с консервативным лечением РЭ, невелика, и женщины в возрасте до 45 лет с отсутствием или минимальной инвазией опухоли в миометрий, получающие лечение прогестинами, имеют хорошие прогнозы, сопоставимые с таковыми при гистерэктомии [74].
На рисунке 2 представлен алгоритм действий при принятии решения о тактике ведения пациенток репродуктивного возраста с онкологическими заболеваниями половых органов [19].
![Рис. 2. Терапия и методы сохранения фертильности у пациенток репродуктивного возраста [19] Fig. 2. Therapy and methods of fertility preservation in female patients of reproductive age [19] Рис. 2. Терапия и методы сохранения фертильности у пациенток репродуктивного возраста [19] Fig. 2. Therapy and methods of fertility preservation in female patients of reproductive age [19]](https://medblog.su/wp-content/uploads/2023/12/1703612621_838_Vozmozhnosti-sohraneniya-reproduktivnoj-funktsii-u-patsientok-s-atipicheskoj-giperplaziej-i.png)
Количество публикаций, посвященных репродуктивным исходам при консервативном лечении РЭ, увеличивается с каждым годом. Это связано с приобретением опыта и расширением наших возможностей при ведении молодых пациенток с онкологическими заболеваниями. Однако в большинстве представленных работ сообщается только о частоте наступления беременности и отсутствует информация о специфике течения беременности и родов.
Опубликовано только одно крупное исследование A.S. Chao et al. [57], обобщившее данные доступных литературных источников за период с 1990 по 2005 г., в которых сообщалось об особенностях течения беременности у пациенток после консервативного лечения РЭ в зависимости от способа зачатия (ВРТ или спонтанная/внутриматочная инсеминация). Средний возраст женщин был 32,1 года. В группе пациенток, беременность у которых наступила в результате ВРТ, статистически значимо чаще по сравнению с группой со спонтанным зачатием развивались преждевременные роды (46,7% против 6%), многоплодие (40% против 6%), кесарево сечение (93,3% против 22%) и акушерские осложнения, такие как преэклампсия и гестационный сахарный диабет (22% против 2%). Этот метаанализ продемонстрировал значительно большую частоту выявления гипертензивных расстройств, преждевременных родов, многоплодной беременности и выполнения операции кесарева сечения у женщин после ВРТ.
Заключение
На фоне снижения показателей рождаемости сохранение каждой беременности является крайне важным аспектом современного здравоохранения. Изменение репродуктивной парадигмы привело к смещению возраста деторождения за рамки 35 лет, что явилось значимым фактором роста частоты развития у женщин сочетанных и онкологических заболеваний, ухудшающих прогноз течения беременности и родов. Международные научные усилия направлены на разработку и внедрение новых, современных технологий, позволяющих предотвратить развитие онкологического заболевания или диагностировать его на ранней стадии. Классические подходы к терапии РЭ предполагают проведение радикального хирургического лечения, что не позволяет женщине в будущем планировать беременность. Диагностика заболевания на ранней стадии у пациенток с нереализованным репродуктивным потенциалом может позволить провести консервативное лечение и сохранить возможность деторождения. Накопленный опыт свидетельствует о том, что медикаментозное лечение атипической гиперплазии и начального РЭ эффективно, а при условии последующего наступления беременности не усугубляет онкологический прогноз. Однако остается еще много вопросов, посвященных специфике прегравидарной подготовки, профилактике истмико-цервикальной недостаточности, невынашиванию беременности и преэклампсии у женщин с РЭ в анамнезе. Очевидно, что они составляют группу высокого риска и требуют особенно тщательного подхода к определению тактики ведения беременности и родов.
Сведения об авторах:
Серова Ольга Федоровна — д.м.н., профессор, главный внештатный специалист Минздрава Московской области по акушерству и гинекологии, заведующая кафедрой акушерства, гинекологии и перинатологии ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России; 123182, Россия, г. Москва, ул. Живописная, д. 46.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии РНИМУ им. Н.И. Пирогова Минздрава России; 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Боровкова Екатерина Игоревна — д.м.н., доцент, профессор кафедры акушерства и гинекологии РНИМУ им. Н.И. Пирогова Минздрава России; 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-7140-262X.
Чархифалакян Аревик Вачагановна — акушер-гинеколог, онколог АО «ЕМЦ»; 129110, Россия, г. Москва, ул. Щепкина 35; ORCID iD 0009-0001-2002-8735.
Контактная информация: Чархифалакян Аревик Вачагановна, e-mail: dr.charkh@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.09.2023.
Поступила после рецензирования 18.10.2023.
Принята в печать 09.11.2023.
About the authors:
Olga F. Serova — Dr. Sc. (Med.), Professor, Chief Consultant Specialist of the Ministry of Health of the Moscow Region in Obstetrics and Gynecology, Head of the Department of Obstetrics, Gynecology and Perinatology, Burnasyan Federal Medical Biophysical Center of Federal Medical Biological Agency; 46, Zhivopisnaya str., Moscow, 123182, Russian Federation.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation, ORCID iD 0000-0002-7830-2290.
Ekaterina I. Borovkova — Dr. Sc. (Med.), Associate Professor, Professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation, ORCID iD 0000-0001-7140-262X.
Arevik V. Charkhifalakyan — obstetrician-gynecologist, oncologist of European Medical Center JCS; 35, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0009-0001-2002-8735.
Contact information: Arevik V. Charkhifalakyan, e-mail: dr.charkh@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.09.2023.
Revised 18.10.2023.
Accepted 09.11.2023.
Информация с rmj.ru
