Введение
Описторхоз вызывается трематодами, принадлежащими к семейству Opisthorchiidae, — Opisthorchis viverrini, O. felineus и Clonorchis sinensis, и является серьезной проблемой общественного здравоохранения во многих частях Дальнего Востока, Юго-Восточной Азии и Восточной Европы. Возбудитель описторхоза был открыт и описан S. Rivolta в 1884 г. у кошек и назван Opisthorchis (Distomum) felineus. По оценкам исследователей, 1,6 млн людей в мире заражены O. felineus. Заболевание встречается и в Российской Федерации. Миграция и глобальный туризм приводят к появлению заболевания в районах, где оно не является эндемичным [1, 2]. Самый крупный и напряженный очаг описторхоза в мире — Обь-Иртышский, охватывающий 10 краев и областей России и Казахстана. Распространенность инвазии среди населения в Западной Сибири достигает 51,82–95% в отдельных районах. Описаны инвазии также у жителей Белоруссии, Германии, Греции, Италии, Литвы, Польши, Румынии, Испании и Украины [3].
Когда фекалии зараженного человека или животных (собак, лис, кошек) попадают в пресную воду, промежуточный хозяин — пресноводный моллюск Bithyniidae рода Codiella поглощает яйца и выделяет мирацидии, которые развиваются в спороцисты, редии и церкарии. Церкарии попадают в воду, где они свободно плавают, а далее проникают под чешую рыбы, которая служит вторым промежуточным хозяином; они инцистируются в метацеркарии, преимущественно в мышцах тела рыб. Рыбы, принадлежащие к семейству Ciprinidae (карповых), являются основным промежуточным хозяином Opisthorchis spp. [4]. Человек как окончательный хозяин заражается при употреблении в пищу сырой рыбы, содержащей метацеркарии. После эксцистирования в двенадцатиперстной кишке метацеркарии мигрируют через фатеров сосок в желчные протоки, где в течение 4 нед. созревают до взрослых червей-гермафродитов и откладывают яйца. Паразиты могут жить в организме человека до 45 лет, производя 1000–2500 яиц в день [5, 6].
Инвазия описторхов связана с рядом заболеваний гепатобилиарной системы. Различают острый, подострый и хронический описторхоз. Патологические и клинические последствия описторхоза связаны с интенсивностью и продолжительностью кумулятивной инвазии. Описторхи вызывают механическое повреждение желчных протоков, а продукты их метаболизма повреждают эпителиальные клетки желчных протоков, что приводит к гиперплазии клеток, дисплазии и в конечном итоге к фиброзу и/или холангиокарциноме [7]. Хроническое заражение может привести к обструкции желчевыводящих путей, расширению внутрипеченочных протоков и последующим кистозным образованиям. Желчный пузырь увеличивается, становится нефункциональным, содержит сладж. Желчь приобретает литогенные свойства, приводя к быстрому формированию полипов и камней в желчном пузыре. Поскольку взрослые трематоды живут продолжительное время, они могут производить яйца и вызывать симптомы заболевания еще долго после того, как человек-хозяин эмигрирует из эндемичного района. Острые симптомы инфекции O. felineus включают высокую температуру, недомогание, анорексию, диарею или запор, тупую боль и дискомфорт в правом верхнем квадранте живота, артралгии, лимфаденопатию и уртикарную кожную сыпь. Подострые и хронические осложнения включают гнойный холангит, абсцесс печени и холангиокарциному. При хронической форме часто наблюдается вегетативная дисфункция. Диагностика основывается на микроскопическом исследовании образцов кала на наличие яиц. Для лабораторной диагностики используются серологические и молекулярные исследования. Лечение включает курсовой прием празиквантела или альбендазола [3, 8].
Инвазирование населения в Западной Сибири достигает 51–82%, в отдельных районах — свыше 95%. Отмечено, что через год после переезда в очаг ОХ заражается от 11,5 до 17,9% людей, через 1,5 года — 42%, через 5 лет — 46,7%, в дальнейшем уровень инвазии растет и достигает 73,3% [9]. Алтайский край является одним из наиболее значимых природных очагов описторхоза не только в Западной Сибири, но и на территории Российской Федерации в целом. Уровень заболеваемости данным гельминтозом на территории края составляет от 44 до 34 на 100 тыс. населения, что превышает общероссийский показатель — от 12 до 15 на 100 тыс. населения — в 2 и более раз, при этом пораженность рыбы семейства карповых в Обь-Иртышском бассейне составляет от 70 до 90% [10].
Дыхание, иммунная система, пищеварение, гормональный баланс, кровяное давление и частота сердечных сокращений у человека поддерживаются автоматически, человек не имеет прямого влияния на эти процессы. Центром управления, ответственным за эти жизненно важные функции организма, является вегетативная нервная система (ВНС), которая регулирует их. Если эта система показывает признаки нарушения и это остается незамеченным, нарушаются системы физиологической адаптации, что приводит к серьезному расстройству здоровья пациента. Именно поэтому важно изучать состояние ВНС у пациентов, в том числе с хроническим описторхозом (ХО), для того чтобы при необходимости направить терапевтические мероприятия на коррекцию выявленных нарушений [11]. Наиболее широко используемые методы клинической оценки активности симпатического нерва — реакции органов-мишеней на физиологические стимулы ВНС — это ортостатический тест, проба Вальсальвы, определение уровней катехоламинов плазмы крови, оценка чувствительности барорефлексов, терморегуляторный потовый тест и анализ вариабельности частоты сердечных сокращений (ЧСС) — кардиоинтервалография [12, 13]. Среди этих тестов анализ вариабельности сердечного ритма является широко распространенным методом неинвазивной и удобной оценки симпатовагусного соотношения. Анализ вариабельности ЧСС может дать представление о функции ВНС и предоставить информацию о симпатико-парасимпатическом вегетативном балансе [14–16].
Вариабельность сердечного ритма является достоверным отражением многих физиологических факторов, модулирующих нормальный ритм сердца. Фактически они представляют мощное средство наблюдения за взаимодействием между симпатической и парасимпатической нервной системой. Структуре, генерирующей сигнал, присущи не только линейные, но и нелинейные формы действия. ЧСС — нестационарный сигнал, его вариации могут содержать индикаторы текущего заболевания или предупреждения о надвигающихся заболеваниях. Эти колебания являются результатом нескольких сложных физиологических процессов. Изучение и выявление отклонений в объемных данных требуют усилий и времени. Анализ вариаций ЧСС (мгновенная ЧСС в зависимости от оси времени) стал популярным неинвазивным инструментом оценки деятельности ВНС. Компьютерные аналитические инструменты для углубленного изучения данных за суточные интервалы могут быть очень полезны в диагностике. Таким образом, параметры сигнала вариабельности сердечного ритма (ВСР), полученные и проанализированные с помощью специальных компьютерных программ, очень полезны в диагностике. ВСР — это колебания временных интервалов между соседними сердечными сокращениями. На рисунке показан способ расчета ВСР на основе интервалов R-R комплекса QRS, извлеченных из сигнала электрокардиограммы (ЭКГ) [17]. Кратковременная ВСР (~5 мин) генерируется двумя источниками. Первый включает сложное взаимодействие двух ветвей ВНС, т. е. симпатической и парасимпатической. Симпатическая активность увеличивает ЧСС, а парасимпатическая — снижает. Симпатическая и парасимпатическая системы могут быть активными одновременно. При этом повышение активности в одной системе необязательно приводит к снижению активности в другой. Внезапные изменения ЧСС в первую очередь опосредованы парасимпатической системой, и, следовательно, кратковременная ВСР в основном определяется парасимпатическими влияниями. Вторым источником влияния являются регуляторные механизмы, контролирующие ЧСС: дыхательная синусовая аритмия (RSA), барорецепторный рефлекс и ритмические изменения сосудистого тонуса. RSA описывает явление, при котором ЧСС увеличивается во время вдоха и уменьшается во время выдоха. Выраженная RSA с медленным, глубоким дыханием характеризует здоровый организм. Барорецепторы измеряют кровяное давление в ветви аорты и артериях и вызывают изменения ЧСС и тонуса сосудов посредством механизмов обратной связи. ВСР, наконец, отражает все эти динамические и нелинейные физиологические процессы и поэтому может рассматриваться как мера нейрокардиальной функции, отражающая взаимодействие сердца и мозга и динамику ВНС [18, 19]. Вариабельность сердечного ритма является эмерджентным свойством взаимозависимых регуляторных систем, которые работают в разных временных масштабах, чтобы помочь организму адаптироваться к экологическим и психологическим проблемам. ВСР отражает регуляцию вегетативного баланса, артериального давления, газообмена, работы органов пищеварения, сердца и т. п. [20]. Оптимальный уровень ВСР связан со здоровьем и способностью к саморегуляции, а также с адаптивностью организма или его устойчивостью к патогенным стимулам. Более высокие уровни вагусно-опосредованной ВСР в покое связаны с выполнением различных функций и их эмоциональной обработкой префронтальной корой. Реактивность внутренней сердечной нервной системы на афферентную информацию может модулировать деятельность лобной коры и воздействовать на функции более высокого уровня центральной нервной системы [21].
Здоровое сердце не метроном. Колебания здорового сердца лучше всего описываются математическим хаосом, они сложны и нелинейны [22]. Нормальная ВСР для подростков и 20-летних составляет в среднем от 55 до 105 мс, но у большинства людей в возрасте 60 лет и старше ВСР ниже, в среднем от 25 до 45 мс [23]. Изменчивость нелинейных систем обеспечивает гибкость, позволяющую быстро справляться с неопределенностью и меняющейся средой. В то время как здоровые биологические системы демонстрируют пространственную и временную вариабельность сердечного ритма, болезнь может нарушать эту вариабельность вплоть до ее утраты [24].
Вариабельность сердечного ритма можно определить количественно путем простого расчета стандартного отклонения интервалов RR. Кроме того, в частотной области спектральный анализ ВСР выявляет три различных частотных диапазона модуляции ЧСС у людей. Типичная спектральная картина в нормальных условиях показывает наличие трех частотных диапазонов: диапазона очень низких частот (very low frequency, VLF), диапазона низких частот (low frequency, LF) и диапазона высоких частот (high frequency, HF). Мощность LF-компонента, по-видимому, связана с вагусной и симпатической активностью (LF-компонент увеличивается при каждой форме симпатической стимуляции), тогда как площадь HF-компонента обеспечивает количественный показатель влияния дыхания на ЭКГ-сигнал и может быть связана с активностью блуждающего нерва. Таким образом, соотношение LF/HF является важным маркером симпатической модуляции или симпатовагального баланса в контроле ВСР [25, 26].![Рисунок. Вариабельность сердечного ритма [19] Figure. Heart rhythm variability [19] Рисунок. Вариабельность сердечного ритма [19] Figure. Heart rhythm variability [19]](https://medblog.su/wp-content/uploads/2023/12/Sostoyanie-vegetativnoj-adaptatsii-u-patsientov-s-hronicheskim-opistorhozom-Plotnikova.png)
Благодаря более доступным технологиям (аппаратное и программное обеспечение) и после установления Целевой группой Европейского общества кардиологов и Североамериканского общества кардиостимуляции и электрофизиологии два десятилетия назад стандартов [27], подтвержденных рекомендациями Общества психофизиологических исследований [28], ВСР стала весьма серьезным методом психофизиологических исследований. Данный метод стандартизирован и сегодня широко используется во всем мире. Показатели вариабельности ЧСС во временной и частотной области анализируются методами, рекомендованными Рабочей группой Европейского общества кардиологов [27]. За последние три десятилетия в мире были опубликованы более 40 тыс. исследований вариабельности ЧСС при многих патологических состояниях, во время физической нагрузки или при различных физиологических состояниях [18].
Вегетативные аспекты у пациентов с ХО изучались авторами статьи и ранее. Настоящее исследование включает в себя анализ ВСР для своевременной коррекции адаптационных возможностей организма, особенно перед назначением терапии празиквантелем, который является нейротоксином и значительно утяжеляет вегетативные нарушения у пациента.
Цель исследования: комплексное изучение состояния вегетативной регуляции путем анализа ВСР у пациентов с ХО.
Содержание статьи
Материал и методы
От каждого пациента было получено информированное согласие на участие в исследовании. В процессе выполнения исследования наблюдалась группа из 31 пациента (18 мужчин и 13 женщин) с ХО в возрасте от 18 до 55 лет. Сравнение проводилось с клиническими показателями системы желчевыделения и вегетативного обеспечения у 30 здоровых лиц (группы были сопоставимы по половозрастному составу). Больные прошли тщательное клиническое обследование, диагноз подтверждался лабораторным способом только при выделении яиц описторхов в кале или желчи.
При исследовании характера вегетативных изменений у изучаемых групп нами использовались методы частотного и спектрального анализа сердечного ритма. Все показатели оценивались в покое (в положении лежа) и активном ортостазе.
При изучении функции ВНС использовался метод математического анализа сердечного ритма по Баевскому, который наиболее полно отражает состояние адаптационно-компенсаторных механизмов всего организма [12].
Вычислялись показатели, характеризующие активность различных звеньев ВНС:
- МО — математическое ожидание динамического ряда кардиоинтервалов, отражает конечный результат всех регуляторных влияний на сердце и систему кровообращения в целом, обладает наименьшей изменчивостью среди всех математико-статистических показателей, поскольку это один из хорошо гомеостатируемых параметров организма и его отклонения от индивидуальной нормы обычно сигнализируют об увеличении нагрузки на аппарат кровообращения или о наличии патологических отклонений;
- СКО — среднее квадратичное отклонение значений динамического ряда кардиоинтервалов, один из основных показателей ВСР, характеризует состояние механизмов регуляции;
- Мо — мода (гуморальный канал центральной регуляции сердечного ритма);
- АМо — амплитуда моды (центральное нервное звено симпатической регуляции);
- CV — коэффициент вариации, представляет собой нормализованное значение СКО;
- ВР — вариационный размах (автономное, парасимпатическое звено) [12].
- Оценивали показатели спектрального состава ритма сердца:
- HF — высокочастотные дыхательные волны (средняя мощность спектральной функции с периодом 0,15–0,35 Гц/с2) — характеризует активность автономного контура регуляции, преимущественно парасимпатических влияний;
- LF — низкочастотные (low frequency) медленные волны первого порядка (средняя мощность спектральных функций при 0,05–0,15 Гц/с2) — характеризует активность центрального контура регуляции, преимущественно симпатических влияний;
- VLF — сверхнизкочастотные (very low frequency) медленные волны второго порядка (средняя мощность спектральных функций при 0,004–0,05 Гц/с2) — характеризует нарушение гуморального уровня регуляции.
- Вычислялись интегральные показатели (индексы), характеризующие соотношения первичных показателей:
- ИН — индекс напряжения (отражает степень централизации управления ритмом сердца);
- ИВР — индекс вегетативного равновесия (соотношение активности симпатического и парасимпатического звеньев);
- ПАПР — показатель адекватности процессов регуляции;
- ВПР — вегетативный показатель ритма;
- КО — индекс ортостатической пробы (направленность и степень изменения функционирования ВНС, преимущественно симпатического ее отдела) [12, 13].
Полученные результаты обрабатывались при помощи оригинальной программы CORVEG — программа для ЭВМ CORVEG (свидетельство об официальной регистрации № 200061883 от 8 сентября 2000 г. Российского агентства по патентам и товарным знакам). Стандартное отклонение всех нормальных интервалов RR (SDNN) и разница между максимальной почасовой вариабельностью ЧСС (циркадным ритмом) рассчитывались как стандартные меры вариабельности ЧСС во временной области. Спектральную мощность количественно определяли как с помощью быстрого преобразования Фурье, так и с помощью авторегрессионного анализа в четырех частотных диапазонах. Спектральные составляющие VLF рассчитывались по всему интервалу записи быстрым методом Фурье: от 0,003 до 0,04 Гц/с2 (VLF), от 0,04 до 0,15 Гц/с2 (LF) и от 0,15 до 0,40 Гц/с2 (НF). Компоненты LF и HF рассчитываются из сегментов 100 RR-интервалов методом авторегрессии.
Обработка данных проводилась с помощью пакета прикладных программ Statistica 8.0 (StatSoft Inc.). Количественные показатели представлены медианой, верхним и нижним квартилем (Me [LQ; HQ]), качественные — в виде частот (процентов). Сравнение двух групп количественных показателей проводилось с помощью критерия Манна — Уитни, анализ различий частот в сравниваемых группах — с помощью критерия χ2 Пирсона. При количестве наблюдений менее 5 в какой-либо ячейке таблицы сопряженности использовалась рандомизационная процедура Монте-Карло. Для выявления ячеек, давших неслучайный вклад в статистику критерия, проводился расчет остатков с определением статистической значимости остатков. Критический уровень значимости нулевой статистической гипотезы принимался равным 0,05.
Результаты и обсуждение
Результаты исследования характера вегетативных изменений у пациентов с ХО и группы контроля представлены в таблицах 1 и 2.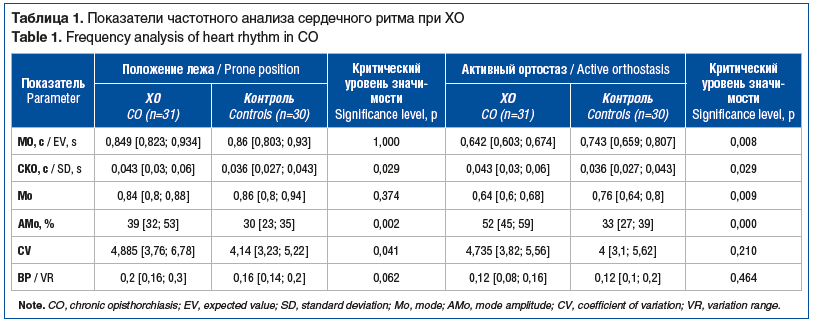
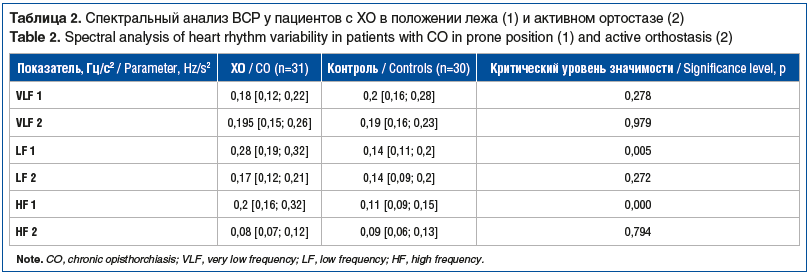
При частотном анализе у пациентов с ХО выявлены существенные отклонения СКО, АМо, V в положении лежа и МО, СКО, Мо, АМо в активном ортостазе, что указывает на повышение влияния симпатического отдела ВНС и ослабление влияния парасимпатического отдела ВНС — уменьшение ВСР в группе ХО.
Показатели волн HF и MF статистически значимо отличались в группе ХО (p
По приведенным выше показателям нами были вычислены индексы регуляторных систем ВНС. ИН был статистически значимо (р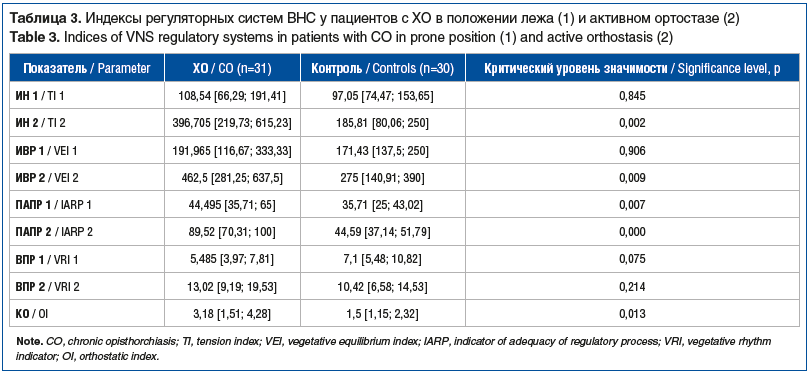
Изменения показателей регуляции сердечного ритма статистически значимо (р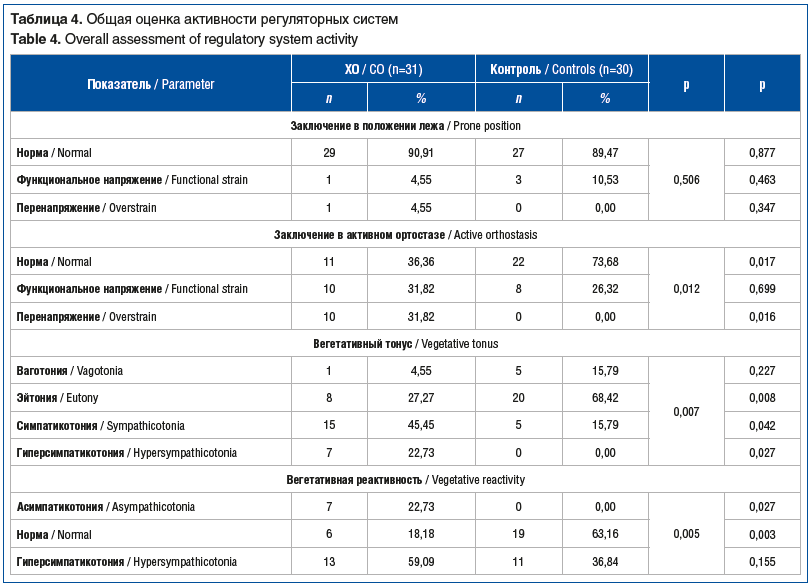
Оптимальный уровень ВСР указывает на нормальное функционирование и хорошие адаптационные способности организма человека в различных патогенных ситуациях [29, 30]. Чрезмерное напряжение приводит к снижению ВСР, нанося ущерб эффективному физиологическому функционированию и использованию энергии [31, 32], указывая на возрастное системное истощение, хронический стресс, патологию или неадекватное функционирование различных уровней систем саморегуляции и адаптации [27, 33, 34]. Такую картину мы увидели по результатам изучения частотного и спектрального анализа ВСР у пациентов с ХО, когда наблюдались отклонения по всем уровням вегетативной регуляции, что проявлялось в усилении активности симпатического отдела и снижении парасимпатической регуляции, вазорефлекторных и барорефлекторных механизмов, а также снижение гуморальной регуляции. Эти нарушения могут быть объяснены не только местным поражением билиарного тракта по типу воспаления желчевыводящих протоков, рефлекторным влиянием желчного пузыря на ЧСС, но и системным токсическим влиянием описторхозной инвазии на организм пациентов.
Заключение
Таким образом, в целом полученные данные свидетельствуют о том, что у пациентов с ХО наблюдается нарушение функционального состояния ВНС, снижение ВСР в сравнении с группой контроля. Необходимо разрабатывать схемы лечения ХО с включением в них методик, влияющих на вегетативный статус и вегетативную реактивность, нормализующих нейрогуморальный гомеостаз пациентов в процессе дегельминтизации и последующей реконвалесценции пациентов. Медикаментозная коррекция состояния ВНС должна рассматриваться как необходимое условие успешной реконвалесценции пациентов, страдающих ХО. Препаратами выбора могут служить вегетотропные препараты, например, с этой целью можно назначать пациентам β-адреноблокаторы, препараты калия и магния.
Сведения об авторах:
Плотникова Екатерина Юрьевна — д.м.н., профессор кафедры подготовки врачей первичного звена здравоохранения, руководитель курса клинической гастроэнтерологии ФГБОУ ВО КемГМУ Минздрава России; 650029, Россия, г. Кемерово, ул. Ворошилова, д. 22а; ORCID iD 0000-0002-6150-1808.
Карбышева Нина Валентиновна — д.м.н., профессор, заведующая кафедрой инфекционных болезней с курсом ДПО ФГБОУ ВО АГМУ Минздрава России, 6560368, Россия, г. Барнаул, пр-т Ленина, д. 40; ORCID iD 0000-0001-8320-3468.
Никонорова Марина Анатольевна — д.м.н., доцент, профессор кафедры инфекционных болезней с курсом ДПО ФГБОУ ВО АГМУ Минздрава России, 6560368, Россия, г. Барнаул, пр-т Ленина, д. 40; ORCID iD 0000-0001-6621-9310.
Бесхлебова Ольга Васильевна — к.м.н., доцент, доцент кафедры инфекционных болезней с курсом ДПО ФГБОУ ВО АГМУ Минздрава России, 6560368, Россия, г. Барнаул, пр-т Ленина, д. 40; ORCID iD 0000-0003-4561-1019.
Иванова Мария Эдуардовна — заведующая вторым инфекционным отделением КГБУЗ АККЦОМД; 656019, Россия, г. Барнаул, ул. Гущина, д. 179; ORCID iD 0009-0007-9413-3216.
Синьков Максим Алексеевич — к.м.н., сердечно-сосудистый хирург НИИ КПССЗ; 650002, Россия, г. Кемерово, б-р Сосновый, д. 6; ORCID iD 0000-0002-2494-8694.
Каннер Екатерина Валерьевна — д.м.н., старший научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0003-3204-1846.
Каннер Илья Дмитриевич — студент 6-го курса МГУ имени М.В. Ломоносова; 119991, Россия, г. Москва, Ленинские горы, д. 1; ORCID iD 0000-0003-4632-0547. Контактная информация: Плотникова Екатерина Юрьевна, e-mail: eka-pl@rambler.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.08.2023.
Поступила после рецензирования 30.09.2023.
Принята в печать 20.10.2023.
About the authors:
Ekaterina Yu. Plotnikova — Dr. Sc. (Med.), professor of the Department of Training of Primary Care Doctors, Head of the Course of Clinical Gastroenterology, Kemerovo State Medical University; 22A, Voroshilov str., Kemerovo, 650029, Russian Federation; ORCID iD 0000-0002-6150-1808.
Nina V. Karbysheva — Dr. Sc. (Med.), Professor, Head of the Department of Infectious Diseases with the Course of Additional Professional Education, Altai State Medical University; 40, Lenin str., Barnaul, 656038, Russian Federation; ORCID iD 0000-0001-8320-3468.
Marina A. Nikonorova — Dr. Sc. (Med.), Associate Professor, professor of the Department of Infectious Diseases with the Course of Additional Professional Education, Altai State Medical University; 40, Lenin str., Barnaul, 656038, Russian Federation; ORCID iD 0000-0001-6621-9310.
Olga V. Beskhlebova — C. Sc. (Med.), Associate Professor, associate professor of the Department of Infectious Diseases with the Course of Additional Professional Education, Altai State Medical University; 40, Lenin str., Barnaul, 656038, Russian Federation; ORCID iD 0000-0003-4561-1019.
Mariya E. Ivanova — Head of the Second Infectious Department, Altay Kray Clinical Center for Maternity and Childhood; 179, Gushchin str., Barnaul, 656019, Russian Federation; ORCID iD 0009-0007-9413-3216.
Maksim A. Sinkov — C. Sc. (Med.), cardiovascular surgeon, Scientific Institute for Complex Issues of Cardiovascular Diseases; 6, Sosnovyy blvd., Kemerovo, 650002, Russian Federation; ORCID iD 0000-0002-2494-8694.
Ekaterina V. Kanner — Dr. Sc. (Med.), Senior Researcher of the Clinical Department of Infectious Pathology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-3204-1846.
Ilya D. Kanner — 6th year student of Lomonosov Moscow State University; 1, Leninskie Gory, Moscow, 119991, Russian Federation; ORCID iD 0000-0003-4632-0547.
Contact information: Ekaterina Yu. Plotnikova, e-mail: eka-pl@rambler.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.08.2023.
Revised 30.09.2023.
Accepted 20.10.2023.
Информация с rmj.ru
