Введение
Ожирение — хроническое заболевание, проявляющееся чрезмерной аккумуляцией жировой ткани в организме человека1, — признано одним из главных факторов риска развития ряда хронических заболеваний, в том числе социально значимых. Особую актуальность оно имеет для людей репродуктивного возраста. У людей, страдающих ожирением, повышен риск развития сахарного диабета 2 типа (СД2), сердечно-сосудистых заболеваний, обструктивного апноэ сна, неалкогольной жировой болезни печени, некоторых видов рака, особенно пищевода, толстой, прямой кишки, печени, а также хронической болезни почек, остеоартроза коленного и/или тазобедренного сустава, варикозной болезни вен нижних конечностей, заболеваний репродуктивной системы, в том числе влияющих на фертильность [1–6].
Решение проблемы бесплодия зачастую выходит за рамки компетенций одного специалиста. Особенно это касается пациентов с ожирением, причем как мужчин, так и женщин. И первым шагом в успешной реализации попыток забеременеть, как естественным путем, так и в рамках программ вспомогательных репродуктивных технологий (ВРТ), как правило, становится определение тактики ведения, направленной на снижение массы тела. В этой связи чрезвычайно важным представляется единое понимание и четкое взаимодействие специалистов, осуществляющих ведение указанной группы пациентов: эндокринолога, акушера-гинеколога, уролога-андролога.
Содержание статьи
Взгляд эндокринолога
Распространенность ожирения среди женщин репродуктивного возраста, по различным данным, составляет от 10 до 42% [7]. Течение беременности и родов у таких пациенток может осложняться развитием гестационного СД, преэклампсии, родоразрешением путем экстренного кесарева сечения, мертворождением и пр. [8, 9].
![Рисунок. Основные механизмы действия аГПП-1 (адапт. из [14]) Figure. Main mechanisms of aGPP-1 action (adapted from [14]) Рисунок. Основные механизмы действия аГПП-1 (адапт. из [14]) Figure. Main mechanisms of aGPP-1 action (adapted from [14])](https://medblog.su/wp-content/uploads/2025/01/Mnogogrannost-reproduktivnyh-narushenij-u-patsientov-s-ozhireniem-vzglyad-endokrinologa-akushera-ginekologa.png)
В ряде исследований установлено, что снижение массы тела способствует повышению шансов наступления и успешного вынашивания беременности [5] и должно быть рекомендовано на этапе прегравидарной подготовки [10]. В случае ановуляторных циклов, обусловленных избытком массы тела / ожирением, снижение веса может способствовать восстановлению овуляции, тем самым повышая шансы успешного зачатия [6]. При этом коррекция массы тела в период беременности не рекомендуется ввиду высокого риска развития задержки роста плода [10].
На данный момент в Российской Федерации зарегистрировано 3 группы препаратов для лечения ожирения: ингибитор желудочно-кишечных липаз (орлистат); ингибитор обратного захвата норэпинефрина и серотонина (сибутрамин), в том числе в сочетании с метформином; агонисты глюкагоноподобного пептида-1 (аГПП-1) (лираглутид) [11]. Применение другого представителя группы аГПП-1, семаглутида, в РФ одобрено только у лиц с избыточной массой тела / ожирением, страдающих СД2. Отметим, что в 2021 г. Управление по контролю за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило использование семаглутида в максимальной дозе 2,4 мг п/к для лечения ожирения [6].
Основной механизм действия аГПП-1 заключается в глюкозозависимом усилении секреции инсулина и подавлении секреции глюкагона [12]. Помимо этого, аГПП-1 оказывают прямое влияние на центральную нервную систему, способствуя снижению аппетита, замедляют скорость опорожнения желудка, уменьшая тем самым постпрандиальные пики гликемии [13] (см. рисунок). Использование аГПП-1 не рекомендовано у пациентов с отягощенным семейным анамнезом по медуллярному раку щитовидной железы или синдрому множественных эндокринных неоплазий 2-го типа. Отметим, что риск развития С-клеточных опухолей на фоне использования аГПП-1 был исходно выявлен в исследованиях на животных и не изучался на людях [6].
Эффективность и безопасность применения аГПП-1, в частности семаглутида, у лиц с избыточной массой тела и ожирением были неоднократно продемонстрированы в ходе крупных рандомизированных клинических исследований под общим названием Semaglutide Treatment Effect in People with Obesity (STEP), в рамках которых испытуемым проводились еженедельные инъекции препарата в максимальной дозе 2,4 мг [15]. В исследованиях STEP 1, 3, 4 и 8 было показано, что семаглутид способствовал снижению массы тела в среднем на 14,9–17,4% за исследуемый период (68 нед.) у лиц без СД2 [16–19], а в STEP 2 было выявлено снижение массы тела на 9,6% у лиц с сопутствующим СД2 [20]. При более длительном использовании препарата (в течение 104 нед.) отмечено снижение массы тела в среднем на 15,2% [21].
Количество исследований, посвященных влиянию семаглутида на репродуктивное здоровье, ограничено. Так, в метаанализе L. Zhou et al. [22] было установлено, что использование аГПП-1 у женщин с синдромом поликистозных яичников способствовало восстановлению менструального цикла и успешному наступлению беременности. Важно, что использование семаглутида у беременных и кормящих женщин противопоказано в связи с возможным тератогенным эффектом, а сам препарат должен быть отменен как минимум за 2 мес. до предполагаемого зачатия [6]. Так, в исследованиях на животных было показано, что введение аГПП-1 животным в период беременности способствовало появлению потомства с задержкой роста и различными пороками развития [23].
Несмотря на определенные ограничения в использовании препарата, потенциальная польза от него, в том числе у женщин с сочетанной патологией (ожирение, нарушения менструального цикла или бесплодие, СД2), очевидна. Представляем клиническое наблюдение успешного использования семаглутида у пациентки с СД2 в сочетании с ожирением и отсутствием беременности на фоне регулярной половой жизни.
Клиническое наблюдение
Пациентка Л., 33 года, обратилась к эндокринологу по рекомендации гинеколога с жалобами на избыточную массу тела, сухость во рту, отсутствие беременности в течение 1–1,5 года регулярной половой жизни.
Анамнез заболевания: длительно избыточная масса тела, у эндокринолога ранее не наблюдалась, не обследовалась. Изначально обратилась к гинекологу с жалобами на отсутствие беременности в течение 1–1,5 года, по поводу чего проведено стандартное лабораторное обследование.
Результаты лабораторного обследования.
Общий анализ крови: без клинически значимой патологии.
Биохимический анализ крови: глюкоза 7,1 ммоль/л (N 4,1–6,0); креатинин 72 мкмоль/л (N 58–96); АЛТ 23 ед/л (N 5–35); АСТ 26 ед/л (N 5–35); холестерин общий 4,5 ммоль/л (N 3,1–5,2).
Гормональное обследование (на 4-й день менструального цикла): ТТГ 2,8 мЕд/л (N 0,4–4,0); пролактин 7,2 нг/мл (N 6,0–29,9); ЛГ 9,2 мМЕ/мл (N 2,4–12,6); ФСГ 6,4 мМЕ/мл (N 3,5–12,5); тестостерон 0,8 нг/мл (N <0,9), глобулин, связывающий половые гормоны (ГСПГ), 42,5 нмоль/л (N 19,8–155); ИСА 6,5% (N <11%); 17-ОН прогестерон 1,2 нг/мл (N <2); ДГЭА-С: 369 мкг/дл (N 140–400).
Анамнез жизни: низкий уровень физической активности; характер питания — нерациональное с большим количеством жиров и быстроусвояемых углеводов. Наследственность не отягощена. Аллергические реакции отрицает. Перенесенные операции, травмы отрицает.
Осмотр: рост 162 см, масса тела 88 кг, индекс массы тела (ИМТ) 33,53 кг/м2, что соответствует ожирению 1-й степени по определению ВОЗ. Окружность талии (ОТ) 89 см, окружность бедер (ОБ) 101 см, ОТ/ОБ 0,88. Кожные покровы физиологической окраски, нормальной влажности, отеков нет. Подкожно-жировая клетчатка развита избыточно, распределена равномерно. Частота сердечных сокращений 67 в 1 мин. Артериальное давление (АД) во время приема (левая рука) 120/70 мм рт. ст.
С учетом полученных данных с целью верификации диа-гноза эндокринологом было рекомендовано дообследование: анализ крови на гликированный гемоглобин (HbA1c), который показал содержание HbA1c 6,6% (N <6,5), что соответствует СД2.
Согласно актуальным клиническим рекомендациям препаратами выбора для лечения пациента с избыточной массой тела и ожирением являются аГПП-1, ингибиторы натрий-глюкозного котранспортера 2-го типа или метформин [20]. С целью снижения массы тела и достижения целевых показателей гликемического контроля лечащим врачом были даны следующие рекомендации:
модификация образа жизни, включающая в себя: рационализацию питания, увеличение уровня физической активности с обязательным включением в программу тренировок аэробной физической нагрузки общей длительностью не менее 150 мин в неделю;
семаглутид в начальной дозе 0,25 мг 1 раз в неделю подкожно в область живота, бедра или плеча (4 нед.), далее — постепенная титрация дозы до 1 мг 1 раз в неделю;
обязательное использование барьерной контрацепции в период приема препарата;
самоконтроль гликемии в течение первого месяца не менее 4 р/сут (перед основными приемами пищи и перед сном), далее — не менее 1 р/сут в разное время, дополнительно — полный гликемический профиль 1 раз в неделю;
контроль массы тела 1 раз в неделю утром натощак после опорожнения мочевого пузыря.
На фоне модификации образа жизни и использования семаглутида в дозе 1 мг 1 раз в неделю отмечена положительная динамика в виде снижения массы тела на 14 кг (14% от исходного) за 8 мес. и достижения целевых показателей гликемии. Побочных эффектов от использования препарата (тошнота, боли в животе и пр.) зафиксировано не было. При осмотре: рост 162 см, масса тела 74 кг, ИМТ 28,2 кг/м2, что соответствует избыточной массе тела. ОТ 82 см, ОБ 98 см, ОТ/ОБ 0,80, HbA1c 6,1%. С учетом планирования беременности пациентке был отменен семаглутид, рекомендовано продолжить соблюдение принципов рационального питания и физической активности под контролем уровня гликемии.
Представленное клиническое наблюдение подтверждает эффективность использования аГПП-1, в частности семаглутида, в снижении массы тела, достижении целевых показателей гликемического контроля и повышении шансов наступления самостоятельной беременности.
Взгляд акушера-гинеколога
Перечень сопряженных с ожирением соматических заболеваний довольно широк, но нельзя не обратить внимания на гинекологическую патологию у женщин с избыточной массой тела.
Об этом свидетельствуют отечественные и зарубежные публикации последних двух десятков лет, сообщающие не только о повышении распространенности ожирения среди женщин во всем мире, но и о его негативном влиянии на репродуктивное здоровье [24–26]. Так, по данным Центра по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, CDC), распространенность ожирения среди женского населения начиная с 2001 г., независимо от расовой принадлежности, выросла в среднем на 33,4% [24]. При этом прослеживается явная тенденция к увеличению частоты этого заболевания среди молодых женщин репродуктивного возраста. Например, в США у женщин в возрасте от 18 до 24 лет отмечали ожирение или избыточную массу тела в 54,5% случаев, от 25 до 44 лет — в 62,2%, тогда как в возрасте 45–64 лет — в 40,5% и в возрасте ≥65 лет — в 38,6% случаев [26]. В РФ, согласно данным Федеральной службы государственной статистики, также отмечается отрицательная динамика роста болезней эндокринной системы, расстройств питания, нарушений обмена веществ2. Если в 2001 г. было зарегистрировано 5861,5 тыс. пациентов с подобными нарушениями, то в 2022 г. эта цифра составила уже 13 051,4 тыс.2,3. Учитывая такую тенденцию роста эндокринной патологии, с 2010 г. в ежегодном статистическом сборнике «Здравоохранение России» отдельно проводится учет больных с ожирением. Данные по этой нозологии очень неутешительны и демонстрируют многократное увеличение числа пациентов с впервые установленным таким диагнозом: если в 2010 г. эта цифра составляла 228,5 тыс., то в 2022 г. — уже 419,4 тыс.2,4.
Активно обсуждаемый в литературе вопрос взаимосвязи патологии репродуктивной системы у женщин с ожирением на сегодняшний день уже закрыт. Наблюдения и исследования показывают, что около 60% женщин с ожирением имеют нарушения менструальной функции с превалированием вторичной аменореи, в основе которой лежит ановуляция, у них в 2 раза чаще констатируют первичное бесплодие и в 2,5 раза повышен риск осложнений беременности [27–29].
D.C. Gesink Law et al. [30] описывают снижение фертильности у женщин с избыточной массой тела и ожирением по сравнению с женщинами с оптимальным индексом массы тела. Согласно этим данным, вероятность зачатия была снижена на 8% у женщин с избыточной массой тела и на 18% у женщин с ожирением. При этом авторы обращают внимание и на значительное снижение эффективности терапии, направленной на восстановление фертильности.
Подобную статистику отмечают и J.A. Grieger et al. [31], обращая особое внимание на роль инсулинорезистентности в развитии репродуктивных расстройств. Текущее понимание патогенетических аспектов ожирения позволяет воспринимать подобные нарушения без связи с первичным поражением яичников. Показано, что, помимо гипоталамо-гипофизарной дисфункции, инсулинорезистентность может негативно влиять на имплантацию и последующую беременность. Изобилие транспортера глюкозы GLUT4 в адипоцитах человека сильно коррелирует с чувствительностью к инсулину. У женщин с ожирением с нормальной толерантностью к глюкозе экспрессия GLUT4 в мембранах адипоцитов снижена на 40% по сравнению с контрольной группой, что свидетельствует о резистентности тканей к инсулину. А инсулинорезистентность эндометрия потенциально может быть одним из механизмов, негативно влияющих на фертильность у пациенток с ожирением [31, 32]. Нельзя забывать и о влиянии повышенного уровня инсулина на подавление синтеза ГСПГ в печени и развитие гиперандрогенемии, которая, помимо дополнительных метаболических проблем, приводит к апоптозу клеток гранулезы яичников, снижая в принципе репродуктивный потенциал женщин, страдающих ожирением [33]. А усиление ароматизации андрогенов в периферической жировой ткани, приводящее к гипер-эстрогенемии, по принципу отрицательной обратной связи подавляющей секрецию гонадотропинов и, соответственно, препятствующей необходимым колебаниям ФСГ и ЛГ на протяжении менструального цикла, вносит свой вклад в развитие ановуляции у пациенток с ожирением.
Кроме этого, результаты активного и детального изучения биологии адипоцита однозначно позволяют считать жировую ткань эндокринным органом, синтезирующим большое количество адипоцитокинов, которые играют роль возможных медиаторов метаболических нарушений и эндотелиальной дисфункции, оказывая в том числе и прямое эмбриотоксическое действие, способствуя ранним потерям беременности [34, 35].
Нужно учитывать и высокую вероятность появления тревожно-депрессивных расстройств у женщин с ожирением вследствие как недовольства своими внешними данными, так и наличием репродуктивных расстройств, что способствует появлению стрессорной гиперпролактинемии, являющейся дополнительным ингибитором нормального роста и созревания преовуляторного фолликула и овуляции [36].
Таким образом, учитывая современные представления об ожирении как о многофакторном заболевании, реализующем генетические мутации в условиях несоответствия потребления высококалорийных продуктов питания и расхода энергетических субстратов, следует признать, что в лечении этого заболевания необходим только комплексный подход. При этом требуется осуществлять тщательный контроль за массой тела на протяжении всей жизни, не допуская как дополнительного набора, так и восстановления уже утраченной массы тела. Кроме того, необходимы регулярный мониторинг рисков реализации коморбидных ожирению заболеваний и их своевременная коррекция. Поэтому в терапии этого заболевания колоссальное значение имеет терапевтическая модификация образа жизни. Многочисленными исследованиями продемонстрировано положительное влияние снижения массы тела на улучшение состояния здоровья в целом и повышение вероятности наступления беременности при уменьшении массы тела даже на 5–10% от исходных значений на этапе планирования беременности за 3–6 мес. терапии и удержании результата в течение года [35, 37].
Представляем клиническое наблюдение пациентки, у которой наступление долгожданной беременности совершенно очевидно связано со снижением массы тела.
Клиническое наблюдение
Пациентка Г., 29 лет, поступила в гинекологическое отделение ГБУ РО «ОКБ» 26.08.2024 с жалобами на незначительные боли внизу живота, задержку менструации, небольшие периодические мажущие кровянистые выделения из половых путей.
Из анамнеза: менархе в 13 лет, менструации установились сразу, через 26–28 дней по 5–6 дней, безболезненные, в течение последних 6 лет менструальный цикл нарушен, отмечает задержки менструации до 50–60 дней, менструальные кровотечения умеренные, безболезненные; дата начала последней менструации 07.07.2024 (в срок); половая жизнь с 20 лет. В браке 4 года; беременностей в анамнезе 2, в 2019 и 2020 гг., обе закончились самопроизвольным выкидышем в сроке 6–7 нед. без диагностического выскабливания; в настоящее время контрацепцию не использует. Гинекологические заболевания: нарушение менструального цикла, первичное бесплодие неуточненного генеза. Экстрагенитальные заболевания, травмы, аллергические реакции, гемотрансфузии и вредные привычки отрицает.
Из анамнеза заболевания: обратилась к врачу акушеру-гинекологу впервые в 2022 г. с жалобами на отсутствие беременности в течение 2 лет после отказа от контрацепции. Амбулаторно проводилось прегравидарное консультирование, выполнена базовая диагностика согласно клиническому протоколу МАРС «Прегравидарная подготовка» 2020. Версия 2.15. Назначено обследование в связи с бесплодием в соответствии с действующими клиническими рекомендациями «Женское бесплодие»6.
При осмотре на момент обращения: пациентка повышенного питания с преимущественным отложением жировой ткани в области живота, на плечах, грудной клетке. При проведении антропометрических измерений у женщины на момент обращения выявлено абдоминальное ожирение 2-й степени (масса тела 99 кг при росте 164 см (ИМТ 36,8 кг/м2), ОТ 108 см). На приеме отмечено повышение АД на обеих руках до 140/90–145/90 мм рт. ст. В лабораторных показателях отмечено снижение концентрации витамина D до уровня недостаточности. При проведении перорального глюкозотолерантного теста определена глюкоза венозной плазмы натощак 4,9 ммоль/л, а через 2 ч после нагрузки 75 г безводной глюкозой, растворенной в 250 мл воды, — 9,1 ммоль/л, что, согласно «Диагностическим критериям сахарного диабета и других нарушений гликемии ВОЗ, 1999–2013», трактуется как нарушение толерантности к глюкозе. При динамической фолликулометрии в течение 3 мес. зафиксировано отсутствие доминантного фолликула в середине и желтого тела во второй фазе менструального цикла.
На этапе прегравидарной подготовки назначен прием фолиевой кислоты 400 мкг/сут, колекальциферола 50 000 МЕ еженедельно в течение 4 нед. внутрь с переходом на поддерживающую нормальный уровень витамина D дозировку 2000 МЕ, метформина по 500 мг 2 р/сут внутрь во время или после еды, консультация эндокринолога, консультация психиатра-психотерапевта. От предложенной консультации смежных специалистов пациентка категорически отказалась, мотивируя отказ отсутствием изменений при исследовании уровня ТТГ, гликемии натощак и исключением гиперкортицизма и гиперпролактинемии, заверив в самостоятельной возможности снижения массы тела. Женщине были даны рекомендации по соблюдению гипокалорийной диеты, сбалансированной по пищевым ингредиентам, и увеличению физической активности. Контрольный визит через 3 мес. выявил снижение массы тела всего на 2 кг, что составило 2% от исходного веса. После настойчивой рекомендации женщина посетила несколько сеансов терапии у психотерапевта, специализирующегося на лечении расстройств пищевого поведения. На очередном приеме у лечащего врача отмечено снижение массы тела всего на 1,5 кг за 6 мес., а случайное определение уровня гликемии в венозной плазме выявило концентрацию глюкозы 11,1 ммоль/л.
Учитывая неэффективность терапевтической модификации образа жизни, уровень глюкозы в плазме венозной крови, соответствующий диагнозу «сахарный диабет», было принято решение о назначении медикаментозной терапии. В данном случае препаратом выбора стал семаглутид — аГПП-1, устойчивый к воздействию фермента дипептидилпептидазы 4, разрушающему естественный ГПП-1. В данном случае назначен Семавик® — первый препарат семаглутида в РФ, выпускаемый российской компанией «ГЕРОФАРМ», биоэквивалентность и безопасность которого подтверждены открытым рандомизированным проведенным в параллельных группах исследованием на базе ГБУЗ «Клиническая больница № 3» в Ярославле в 2023 г. [38]. Лекарственный препарат применялся строго по рекомендованной схеме в виде подкожных инъекций 0,25 мг 1 раз в неделю на протяжении первых 4 нед. с оценкой переносимости и последующим переходом на терапевтическую дозу 0,5 мг 1 раз в неделю. При этом, несмотря на настойчивое желание женщины забеременеть, ей даны рекомендации по применению барьерной контрацепции на период лечения ожирения семаглутидом в связи с продемонстрированной им в исследованиях на животных репродуктивной токсичностью.
Являясь инкретиномиметиком, семаглутид селективно связывается и активирует рецепторы ГПП-1, расположенные преимущественно в поджелудочной железе и головном мозге. Это стимулирует секрецию инсулина и подавляет секрецию глюкагона в островках Лангерганса поджелудочной железы, а также интенсифицирует сигнал насыщения и снижает чувство голода. Таким образом реализуется его гипогликемический и снижающий массу тела эффект. При этом снижение уровня гликемии способствует небольшой отсрочке опорожнения желудка в ранней пост-прандиальной фазе и ослаблению секреции инсулина, не уменьшая выработку глюкагона.
Уже в первые 3 мес. приема терапевтической дозы семаглутида отмечено снижение массы тела на 6 кг, что составило 6,2% от исходного значения, самостоятельный контроль и измерение АД продемонстрировали его нормализацию, а уровень глюкозы венозной плазмы крови натощак составил 4,9 ммоль/л. Женщина отмечает восстановление регулярности менструальных циклов через 26–28 дней длительностью 5–6 дней и хорошую переносимость назначенной терапии. Вновь даны рекомендации по поддержанию физической активности и продолжению приема назначенных на этапе прегравидарного консультирования лекарственных средств и повышение дозы семаглутида до 1 мг 1 раз в неделю. Кроме этого, респондентка получила рекомендации по продолжению применения барьерной контрацепции на период применения семаглутида и по возможности его отмены после консультации с врачом после нормализации ИМТ.
Спустя 4 мес. женщина самостоятельно обратилась к врачу с настойчивым желанием отменить контрацепцию. Объективно отмечено снижение массы тела на 16 (17,6%) кг за 7 мес. приема семаглутида, отсутствие эпизодов повышения АД при его самостоятельном измерении и на приеме у врача; неоднократное постпрандиальное измерение концентрации глюкозы венозной плазмы показало значения в пределах нормы. Принимая во внимание намерение пациентки, снижение ИМТ до 29,6 кг/м2, нормализацию АД и уровня гликемии, принято решение о прекращении приема семаглутида и использовании контрацепции еще в течение 2 мес. после отмены препарата.
Спустя два самостоятельных регулярных, нормальных по частоте и длительности менструальных цикла, 12.08.2024 пациентка самостоятельно выполнила мочевой тест на хорионический гонадотропин человека (ХГЧ) в связи с задержкой менструации. Ввиду вышеперечисленных жалоб и отягощенного анамнеза направлена на стационарное лечение в ГБУ РО «ОКБ» с диагнозом: угрожающий аборт при беременности малого срока.
При поступлении в стационар: общее состояние удовлетворительное. Масса тела 75,1 кг, рост 164 см, ИМТ 27,9 кг/м2. Кожные покровы и видимые слизистые обычной окраски. Пульс 76 в 1 мин. АД 110/70 и 115/70 мм рт. ст. Живот мягкий, при пальпации безболезненный во всех отделах.
Гинекологический осмотр: шейка чистая, зев закрыт, матка увеличена до 6 нед., движения за шейку матки безболезненны, придатки не определяются, область их безболезненна, выделения сукровичные, незначительные. β-ХГЧ от 27.08.2024 — 18 645 мЕд/мл.
Заключение УЗИ от 29.08.2024: маточная беременность 7–8 нед.
Назначено лечение, направленное на пролонгирование беременности согласно действующим клиническим рекомендациям «Привычный выкидыш». На момент публикации статьи беременность прогрессирует.
Представленное клиническое наблюдение еще раз подтверждает неблагоприятное влияние избытка жировой ткани на репродуктивную функцию женского организма в виде нарушения менструальной функции, привычного невынашивания беременности и бесплодия, которые развивались во времени, совпадая с набором массы тела. Продемонстрированные изменения в углеводном обмене ограничивают возможность делать выводы о его состоянии по однократному определению уровня глюкозы натощак у женщин с ожирением. Кроме того, описанное клиническое наблюдение еще раз наглядно подтверждает трудности соблюдения пищевых ограничений при наличии сформировавшихся годами гастрономических привычек и выполнения рекомендаций по увеличению двигательной активности. Безусловно, для пациенток, страдающих ожирением и СД2, патогенетически обоснованным препаратом выбора для лечения коморбидных патологий будет семаглутид. Как показывает практика, именно семаглутид действует на 6 из 8 звеньев патогенеза развития СД2, нормализуя концентрацию глюкозы крови и снижая массу тела за счет уменьшения жировой ткани. А период полувыведения препарата (около 7 дней) позволяет применять его подкожно 1 раз в неделю, повышая комплаентность лечения. Таким образом, благодаря назначению современного эффективного, безопасного и удобного в применении препарата с хорошим профилем переносимости у женщины 29 лет было решено сразу несколько терапевтических задач: снижение массы тела, коррекция углеводного обмена, нормализация репродуктивной функции, что привело к наступлению и прогрессированию беременности.
Взгляд уролога
Ожирение — широко распространенное и сложное заболевание, уже превратившееся в мировую эпидемию, от которой страдают более 650 млн человек [39, 40]. Более того, ожирение коррелирует со значительным клиническим, психосоциальным и экономическим бременем в результате увеличения заболеваемости и смертности [40–42]. У мужчин репродуктивного возраста ожирение также является важным фактором риска мужского бесплодия и, как было обнаружено, связано с ухудшением результатов ВРТ [43–45].
Механизмы, посредством которых ожирение ухудшает репродуктивные возможности мужчин, многофакторны и взаимосвязаны. Избыточный жир в организме может влиять на выработку и качество спермы, гормоны, участвующие в функционировании мужской репродуктивной системы, и эректильную функцию [43, 46–50]. Несколько крупных метаанализов продемонстрировали связь между ИМТ, мужским фактором бесплодия и нарушенной фертильностью в паре, определяемой как время до беременности или отсутствие зачатия после ≥12 мес. регулярной половой жизни без предохранения [43]. Также показано, что более высокий ИМТ у мужчин коррелирует со снижением частоты положительных результатов протоколов ВРТ [45, 51]. В систематическом обзоре N. Sermondade et al. [51], проанализировав 21 исследование, пришли к выводу, что мужчины с ожирением чаще страдают олигоспермией и азооспермией. J. Ма et al. [48] в ходе обсервационного исследования также показали, что у мужчин с ожирением наблюдается снижение качества спермы, включая объем спермы, количество сперматозоидов и общее количество подвижных сперматозоидов. В то же время следует отметить, что данные метаанализов довольно противоречивы, а дизайн исследований подчас не отвечает требованиям, что обусловлено, в частности, трудностями исследований в области репродукции [43, 49, 50].
Ожирение у мужчин может нарушать регуляцию гормонов в оси гипоталамус — гипофиз — гонады (ГГГ), вызывая вторичный гипогонадизм, характеризующийся недостаточной выработкой тестостерона [49, 52–54]. Избыток жировой ткани сопровождается усилением периферической ароматизации тестостерона и, соответственно, повышением уровня эстрадиола [49, 55]. Эстрадиол, будучи более биологически активным, чем тестостерон, особенно при его высоких уровнях у мужчин с ожирением, ингибирует ось ГГГ посредством отрицательной обратной связи, нарушая синтез тестостерона и сперматогенез [56]. Кроме того, исследования показали, что гиперинсулинемия, связанная с более высоким ИМТ, приводит к снижению выработки ГСПГ, который ингибирует биологическую активность половых гормонов, усиливая эффекты эстрогена [49, 52, 56, 57]. Мужское ожирение также связано с более низким уровнем ингибина B, фактора роста, который стимулирует секрецию тестостерона в клетках Сертоли. Наконец, избыточная жировая ткань запускает секрецию провоспалительных цитокинов и адипокинов, которые еще больше подавляют выработку тестостерона [56].
Хотя лишь немногие исследования оценивали прямое влияние снижения массы тела у мужчин с ожирением на фертильность, некоторые продемонстрировали, что потеря массы тела в этой группе связана с повышением уровня тестостерона и улучшением параметров спермы [53, 58].
Современные методы снижения веса включают изменение образа жизни и хирургические вмешательства. Агонисты ГПП-1, класс препаратов, используемых при СД2 и ожирении, открывают новые возможности для лечения бесплодия у мужчин с ожирением [59].
Агонисты ГПП-1 являются многообещающим средством в лечении ожирения с потенциальным применением мужской инфертильности. Данная группа препаратов оказывает свое терапевтическое действие посредством активации рецепторов ГПП-1, присутствующих в различных тканях, включая кишечник, сердце, почки, мозг, иммунные клетки и островки поджелудочной железы. Каждая из этих тканей реагирует на аГПП-1 различными фармакологическими реакциями, охватывая широкий спектр метаболических и физиологических процессов [60].
Помимо хорошо изученного влияния на кишечник и поджелудочную железу, аГПП-1 могут также оказывать дополнительные эффекты на уровне яичек [61, 62]. В ряде исследований было установлено наличие рецепторов ГПП-1 в клетках Сертоли и Лейдига [63–66]. Результаты исследования R. Caltabiano et al. [66] предполагают, что рецепторы ГПП-1 играют роль в онкосупрессии, функции клеток Лейдига, а также секреции и функции гормонов. ГПП-1 также признан регулятором гомеостаза глюкозы и энергетического обмена, которые являются жизненно важными процессами сперматогенеза [65]. Экспериментальное исследование [67] было посвящено изучению взаимодействия между аГПП-1, динамикой потери массы тела и параметрами спермы. Введение эксенатида ежедневно в течение 8 нед. мышам с ожирением приводило к улучшению подвижности сперматозоидов, целостности ДНК и снижению экспрессии провоспалительных цитокинов.
Современный подход к лечению вторичного гипогонадизма у мужчин с ожирением и олигоспермией обычно включает использование кломифена цитрата и анастрозола. Кломифена цитрат, селективный модулятор эстрогеновых рецепторов, эффективно повышает уровень тестостерона и концентрацию сперматозоидов у этой группы пациентов [68–70]. Анастрозол, селективный ингибитор ароматазы, препятствует периферическому превращению андрогенов в эстрадиол, его традиционно рекомендуют мужчинам с соотношением тестостерона и эстрогена ниже 10 [71]. Хотя оба препарата эффективно улучшают гормональный баланс и параметры спермы, прием кломифена цитрата у мужчин нередко может ассоциироваться с развитием таких побочных эффектов, как тромбоэмболия, желудочно-кишечные расстройства и незначительные колебания массы тела (в сторону увеличения) [72]. Более того, как показал метаанализ [73], кломифена цитрат обеспечивает значительное увеличение концентрации сперматозоидов примерно лишь у 60% мужчин. Особо следует отметить, что повышение уровня тестостерона за счет заместительной гормональной терапии не приводит к улучшению качества эякулята. Наоборот, при ее использовании существует небольшой риск негативного влияния на концентрацию сперматозоидов [74, 75].
С учетом имеющихся пробелов в лечении этой группы пациентов становится очевидным, что мужчины с ожирением, характеризующиеся гипогонадизмом и желающие сохранить фертильность, могут представлять собой идеальную группу для потенциального вмешательства с помощью аГПП-1. В тех случаях, когда у мужчин с ожирением наблюдается олигоспермия при нормальной концентрации тестостерона и эстрадиола, традиционные фармацевтические подходы (применение антиэстрогенов нестероидной структуры) не всегда может оказать должный эффект. Исследования показывают, что около 45% мужчин с ожирением могут иметь пониженный уровень тестостерона, однако значительная часть попадает в широкий спектр его нормальных уровней [76]. В этой когорте также существует возможность фармакологического вмешательства с помощью аГПП-1. Изучение результатов протоколов ВРТ у мужчин с ожирением выявило заметное негативное влияние по сравнению с мужчинами с нормальным ИМТ, что потенциально связано с ухудшением качества спермы [77]. Были отмечены более низкие показатели оплодо-творения и наличие в целом эмбрионов худшего качества у лиц с ИМТ≥28 кг/м2. Кроме того, исследование выявило примечательное различие в длине теломер сперматозоидов: у мужчин с ожирением теломеры короче по сравнению с группой с нормальным ИМТ [77]. Эта разница в длине теломер, вероятно, обусловливает снижение оплодотворяющей способности сперматозоидов и репродуктивные потери у данной группы мужчин. Это подчеркивает важность удовлетворения конкретных потребностей таких пациентов. Даже при достаточной концентрации сперматозоидов крайне важно уделять внимание всем параметрам эякулята для обеспечения благоприятных результатов протоколов ВРТ у мужчин с высоким ИМТ.
Хотя предыдущие исследования не обнаружили значимой связи между ИМТ и параметрами эякулята, более современные данные опровергают эти наблюдения [78–80]. Это говорит о том, что взаимосвязи между массой тела и мужским репродуктивным здоровьем являются сложными и многофакторными. D. Guo et al. [81 провели всесторонний обзор, в котором обсуждалось снижение количества, качества и концентрации сперматозоидов, связанное с высоким ИМТ. Как правило, основным параметром, определяющим качество спермы, в исследованиях является именно концентрация сперматозоидов. В когортном исследовании L.B. Håkonsen et al. [58] за 43 мужчинами наблюдали в течение 14 нед., пока они участвовали в программе по снижению веса по месту жительства. В начале исследования была отмечена обратная корреляция между ИМТ (от 33 до 61 кг/м2), общим количеством сперматозоидов, концентрацией сперматозоидов и подвижностью сперматозоидов. Примерно у 34% мужчин в этом исследовании наблюдался ОАТ-синдром (олигоастенотератозооспермия) (<15 млн/мл). Через 14 нед. среднее снижение массы тела составило 22 кг (медиана 15%) и наблюдалась положительная корреляция между потерей массы тела и увеличением общего количества сперматозоидов [58]. Данная концепция была развита в исследовании C. Faure et al. [82], которые оценили фрагментацию ДНК сперматозоидов при снижении массы тела в небольшом исследовании с участием 6 пациентов, модифицировавших образ жизни. Авторы констатировали снижение фрагментации ДНК сперматозоидов наряду со значительным увеличением соотношения тестостерона и эстрадиола, но не выявили значительных изменений в других параметрах спермы, что, по-видимому, связано с небольшим размером выборки. J. Mir et al. [83] обнаружили, что потеря веса связана со статистически значимым улучшением индекса фрагментации ДНК сперматозоидов и их морфологии.
Интересным и показательным представляется рандомизированное контролируемое исследование S-LiTE E. Andersen et al. [78]. Мужчины (n=56) получали либо аГПП-1, либо плацебо с дополнительной программой упражнений или без нее. До рандомизации в группы все участники прошли 8-недельную программу низкокалорийной диеты, после чего оценивали динамику массы тела и параметры спермы. ИМТ в среднем снизился на 5 кг/м2 при исходном значении 37 кг/м2 . Исходно ОАТ-синдром имел место у 17% участников, после 8-недельной диеты — у 13%, что еще раз подтверждает связь между снижением массы тела и улучшением параметров спермы. В частности, через 8 нед. наблюдалось увеличение концентрации сперматозоидов в 1,71 раза и увеличение их количества в 1,41 раза. Это улучшение сохранялось через год, но только у тех, кто сохранил потерю веса как минимум на 12 кг, независимо от группы лечения. Подвижность и объем сперматозоидов остались неизменными, наблюдалось статистически значимое увеличение подвижных сперматозоидов [78]. В целом одним из основных выводов исследования стало определение важности снижения и поддержания массы тела, в том числе с использованием аГПП-1, в обеспечении более высокого качества спермы.
Клиническое наблюдение
Пациент Ж., 47 лет, обратился к андрологу для выявления возможных причин бесплодия в браке (11 лет) без использования контрацепции. Женский фактор бесплодия исключает. Ранее в браке не состоял. Детей нет. Ранее с данной проблемой в медицинские учреждения не обращался.
Из анамнеза: отмечает прибавку массы тела (до 20 кг) в течение последних 15 лет, что связывает с малоподвижным образом жизни и большими погрешностями в пищевом поведении, обусловленными суточным графиком рабочей недели и ненормированным рабочим днем. На этом фоне около 7 лет назад стал отмечать снижение полового влечения, нарушения эрекции и ноктурию. Около 3 лет назад появились затруднения при мочеиспускании и ощущение неполного опорожнения мочевого пузыря (обструктивная симптоматика). Находился под наблюдением уролога с диагнозом хронического простатита; лечился консервативно (противовоспалительная, антибактериальная терапия, α1-адреноблокаторы).
При осмотре: пациент гиперстенического типа телосложения. Рост 172 см. Индекс массы тела 46,64 кг/м2. Рост волос на теле по мужскому типу. Размеры, консистенция яичек соответствуют норме. Данных за варикозное расширение вен семенного канатика нет. Кариотип 46 XY. Данные спермограммы (ВОЗ, 2012) после 3-дневного воздержания: объем эякулята 1,2 мл (N 1,5 (1,4–1,7)), цвет серо-желтый (N молочно-серый), консистенция умеренно вязкая, разжижение — 40 мин (N 10–60). Данные сперматогенеза: ОАТ-синдром. По данным УЗИ: размер яичек в пределах границ нижней нормы, структура обоих яичек не изменена, вены обоих семенных канатиков не расширены.
По результатам обследования был установлен клинический диагноз: мужское бесплодие 1 (первичное). Возрастной гипогонадизм. Олигоастенотератозооспермия. Доброкачественная гиперплазия предстательной железы. Морбидное ожирение 3-й степени. Инсулиннезависимый сахарный диабет. Метаболический синдром.
Назначена терапия: коррекция образа жизни, питание 1400 ккал с ограничением легкоусвояемых углеводов, жиров до 40 г/сут, ежедневная аэробная нагрузка 10 000 шагов в день, умеренная силовая нагрузка 2–3 раза в неделю. Метформин по 500 мг — первые 2 нед. вечером, далее по 1000 мг; урорек 8 мг 1 р/сут, аГПП-1 по стандартной схеме.
Через 6 мес. на фоне проведенного лечения отмечено клиническое улучшение: снижение массы тела на 14 кг, восстановление либидо, и, как следствие, восстановление эректильной функции, улучшение симптомов мочеиспускания и морфологии сперматозоидов (табл. 1, 2). Спермограмма: объем эякулята 2,5 мл, разжижение — 30 мин. Достигнутая положительная динамика позволила провести стимуляцию сперматогенеза в рамках прегравидарной подготовки в протоколе ВРТ, результатом которого стало наступление беременности у супруги.
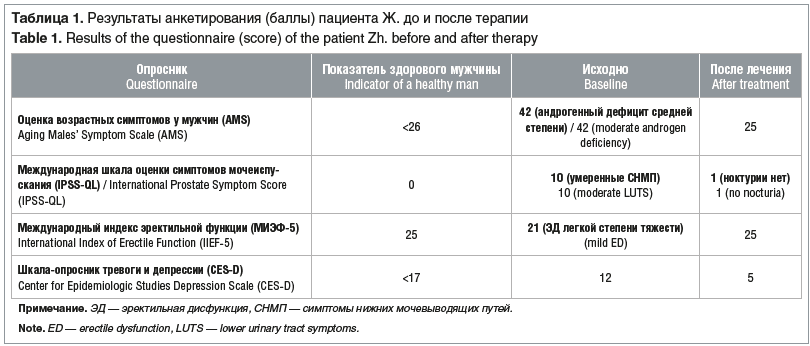
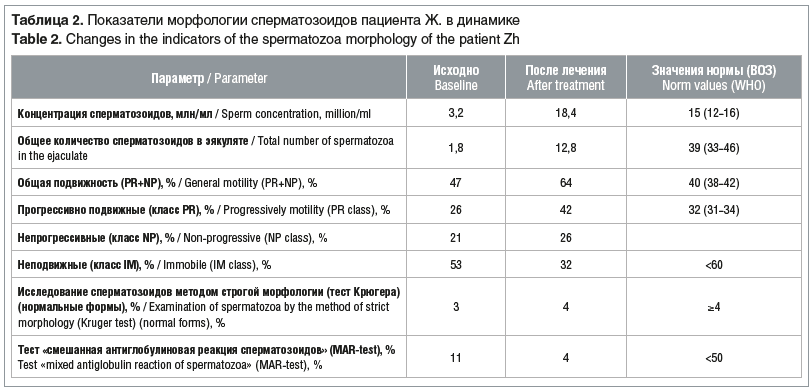
Представленное наблюдение наглядно демонстрирует важность всесторонней оценки и обследования пациентов с мужским фактором бесплодия и избыточной массой тела / ожирением перед планируемым протоколом ВРТ. Понимание сложных связей между метаболизмом и воспроизводством закладывает основу для будущих исследований по изучению применения аГПП-1 во вспомогательной репродукции и управлении репродуктивным здоровьем мужчин с ожирением [84].
Заключение
Высокая распространенность ожирения среди населения создает дополнительные риски развития не только сердечно-сосудистых заболеваний, но и заболеваний репродуктивной системы. В связи с этим крайне важным представляется активное информирование практикующих врачей о современных возможностях медикаментозного лечения лиц, страдающих избыточной массой тела и ожирением. Важно понимать, что проблема бесплодия многогранна и реализуется в различных взаимосвязях органов и тканей, а значит, и воздействие для ее решения может осуществляться на различных уровнях. Разработка адекватных подходов к коррекции массы тела в данной когорте больных будет способствовать не только снижению сердечно-сосудистых рисков, но и повышению фертильности. Несмотря на необходимость дальнейших исследований, современные данные свидетельствуют о том, что использование аГПП-1 перед зачатием может стать многообещающим терапевтическим средством в контроле массы тела у пациентов с ожирением и бесплодием.
Сведения об авторах:
Барсуков Илья Алексеевич — к.м.н., доцент, старший научный сотрудник отделения терапевтической эндокринологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-1889-8555.
Тазина Татьяна Викторовна — к.м.н., доцент, доцент кафедры хирургии, акушерства и гинекологии ФДПО ФГБОУ ВО РязГМУ им. И.П. Павлова; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0003-1029-0390.
Фаниев Михаил Владимирович — к.м.н., доцент кафедры эндоскопической урологии ФПКМР МИ Российского университета дружбы народов; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 6; ORCID iD 0000-0002-7323-3126.
Контактная информация: Барсуков Илья Алексеевич, e-mail: palantirr@inbox.ru; Тазина Татьяна Викторовна, e-mail: tazina@inbox.ru; Фаниев Михаил Владимирович, e-mail: faniev.mv@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.07.2024.
Поступила после рецензирования 06.08.2024.
Принята в печать 29.08.2024.
About the authors:
Ilya A. Barsukov — C. Sc. (Med.), Senior Researcher at the Department of Therapeutic Endocrinology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-1889-8555.
Tatyana V. Tazina — C. Sc. (Med.), Associate Professor, Department of Surgery, Obstetrics, & Gynecology of the Faculty of Postgraduate Education, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; ORCID iD 0000-0003-1029-0390. Mikhail V. Faniev — C. Sc. (Med.), Associate Professor of the Department of Endoscopic Urology, Medical Institute of the RUDN University; 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation; ORCID iD 0000-0002-7323-3126.
Contact information: Ilya A. Barsukov, e-mail: palantirr@inbox.ru; Tatyana V. Tazina, e-mail: tazina@inbox.ru; Mikhail V. Faniev, e-mail: faniev.mv@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 15.07.2024.
Revised 06.08.2024.
Accepted 29.08.2024.
1World Health Organization. Obesity: preventing and managing the global epidemic. 1997, Geneva: WHO.
2Федеральная служба государственной статистики. Российский статистический ежегодник. 2023. М.; 2023.
3Федеральная служба государственной статистики. Российский статистический ежегодник. 2005. М.; 2005.
4Федеральная служба государственной статистики. Российский статистический ежегодник. 2019. М.; 2019.
5Прегравидарная подготовка. Клинический протокол Междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС). Версия 2.0. М.: Редакция журнала StatusPraesens; 2020.
6Клинические рекомендации. Женское бесплодие. М.; 2021.
Информация с rmj.ru
