Содержание статьи
Введение
Процесс естественного старения приводит к целому ряду молекулярных и клеточных изменений. В основе процесса старения лежат изменения метилирования ДНК и, как следствие, ее повреждения [1, 2]. Угнетение эндогенных механизмов репарации ДНК способствует накоплению соматических мутаций, являющихся движущими силами механизмов канцерогенеза совместно с эпигенетическими изменениями в естественном процессе старения [2]. Нарушения работы и структуры генов различной функциональной направленности возникают вследствие изменений ДНК. Изучено большое количество генов, изменение экспрессии которых приводит к изменению содержания кодируемых ими веществ, что способствует развитию онкологических заболеваний.
Инсулиноподобный фактор роста 1 (IGF1) представляет собой пептидный фактор роста, который способствует пролиферации клеток и ингибирует апоптоз. На клеточном уровне IGF1 рассматривается как ключевой фактор прогрессии, необходимый для прохождения клеточного цикла. Как нормальные, так и раковые клетки колоректального эпителия экспрессируют рецепторы IGF1 (IGF1R) [3]. При повышенном уровне IGF1 усиливается рост раковых клеток.
Интерферон γ (IFN-γ) — наиболее важный цитокин, участвующий в противоопухолевом иммунитете. Обладая цитостатическим, проапоптотическим и иммуностимулирующим действием, IFN-γ играет центральную роль в распознавании и элиминации трансформированных клеток. В ходе эпигенетических изменений данная функция IFN-γ может нарушаться, приводя к нарушению детекции измененных единиц [4].
Члены семейства димерных полипептидов — TGF-β контролируют многочисленные клеточные функции, включая пролиферацию, апоптоз, дифференцировку, эпителиально-мезенхимальный переход и миграцию. Дисрегуляция TGF-β вовлечена в канцерогенез. На ранних стадиях рака TGF-β ингибирует прогрессирование клеточного цикла и стимулирует апоптоз. Однако на поздних стадиях TGF-β может оказывать стимулирующее действие на опухоль, увеличивая ее инвазивность и способность к метастазированию [5].
Белок CD69 представляет собой трансмембранный гликопротеин с лектиновым доменом С-типа (CTLD). После перекрестного связывания внеклеточных доменов CTLD цитоплазматический хвост CD69 генерирует внутриклеточный путь передачи сигнала. Цитоплазматический домен этой молекулы связан с киназой семейства Janus(Jak)3, которая активирует транскрипционный фактор STAT. Jak/STAT сигнальный путь эволюционно консервативен и регулирует центральные клеточные процессы, такие как развитие и рост. Его нарушение может привести к развитию рака и/или иммунодефицитным состояниям [6].
К семейству транскрипционных факторов принадлежит GATA-связывающий белок 3 (GATA3), который играет важную роль в дифференцировке и пролиферативной активности Т-клеток, являясь опухолевым супрессором [7].
К группе толл-подобных рецепторов относится мембранный белок TLR4, который экспрессируется на клетках карциномы толстой кишки человека. TLR4 может содействовать иммунному «ускользанию» клеток опухоли, индуцируя иммуносупрессивные факторы и обеспечивая устойчивость к апоптозу [8].
Белковый продукт считывания локуса CDKN2A — p14ARF, который образует стабильные комплексы с NPM или Mdm, действует как супрессор опухоли, ингибируя биогенез рибосом или инициируя p53-зависимую остановку клеточного цикла и апоптоз соответственно. Вследствие эпигенетических перестроек функции супрессии опухолей могут нарушаться, что может провоцировать развитие колоректального рака (КРР) [9].
Помимо вышеперечисленных продуктов генов-участников известны и другие гены, экспрессия которых влечет за собой повышение риска развития КРР.
С течением времени физиологические и молекулярные изменения, происходящие в слизистой оболочке толстой кишки, влияют на пролиферацию эпителия, его регенерацию и интенсивность происходящих в нем воспалительных процессов, приводя к хроническому повреждению и развитию различных неоплазий [10, 11]. Изучение влияния эпигенетических факторов на экспрессию генов в слизистой оболочке толстой кишки, а также понимание механизмов ее тканевого старения могут иметь большое клиническое значение в отношении первичной и вторичной профилактики КРР.
Цель исследования: оценить возрастные особенности экспрессии мРНК в образцах неизмененной слизистой оболочки различных эмбрионально-анатомических отделов толстой кишки.
Материал и методы
Для достижения цели исследования проанализирован профиль экспрессии мРНК 63 генов-кандидатов, потенциально связанных с развитием неоплазий слизистой оболочки кишечника.
В исследование включено 95 пациентов от 21 года до 79 лет (средний возраст 55,25±17,37 года, 43 мужчины).
Критерии включения в исследование: возраст 21–79 лет, отсутствие патологии толстой кишки и онкологических заболеваний любой локализации на момент исследования и в анамнезе. Все пациенты подписали письменное согласие на участие в исследовании.
Критерии невключения в исследование: возраст младше 21 года и старше 79 лет, патология толстой кишки и онкологические заболевания любой локализации на момент исследования и в анамнезе, отсутствие подписанного согласия на участие в исследовании, общие противопоказания к проведению видеоколоноскопии и/или биопсии.
Все образцы слизистой оболочки кишечника получены путем щипцовой биопсии в ходе профилактической и/или диагностической видеоколоноскопии. Образцы отбирались из всех эмбрионально-анатомических отделов толстой кишки: правой ободочной (n=91), левой ободочной (n=95) и прямой (n=87). Всего было исследовано 273 образца. Экспрессию мРНК оценивали методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Образцы клеточного материала помещали в раствор Ever Fresh RNA («Клоноген», Россия) стабилизирующий РНК. Суммарную РНК выделяли с помощью набора RNeasy Mini Kit (QIAGEN, Германия) согласно протоколу производителя. РНК элюировали в 100 мкл DEPC-обработанной воды. Концентрация РНК в конечном растворе составляла 35–40 мкг/мл. Из протокола был исключен этап обработки ДНКазой I, поскольку в качестве затравок для последующей обратной транскрипции (ОТ) использовали праймеры, специфические для сплайсированной мРНК исследуемых генов, разработанные компанией «НПФ ДНК-Технология» (Россия). Реакцию ОТ проводили, используя ген-специфичные праймеры, наборы реагентов, протоколы и оборудование «НПФ ДНК-Технология». Реакция протекала при температуре 40 °C в течение 30 мин, с последующей инактивацией обратной транскриптазы при 95 °C в течение 5 мин. Для определения экспрессии генов методом ПЦР в реальном времени использовали набор из 63 ген-специфичных зондов и пар праймеров, разработанный компанией «НПФ ДНК-Технология». Реакционную смесь готовили с использованием автоматического дозирующего устройства DТstream9 («НПФ ДНК-Технология»). Реакцию проводили согласно инструкции производителя в 384-луночном формате в двух повторах на амплификаторе DT-Prime 5 («НПФ ДНК-Технология»). Экспрессию мРНК измеряли в относительных единицах, определяемых методом сравнения индикаторных циклов (Cp). Уровень экспрессии гена без учета количества материала, [Ci], определяли как [Ci] = 2Cpi — Cpi min, где Сpi — значение индикаторного цикла в исследуемом образце, а Сpi min — значение индикаторного цикла в образце с максимальным уровнем экспрессии данного гена, используя панель нормировочных генов. В результате анализа в каждом образце клеточного материала был определен относительный уровень экспрессии мРНК 63 генов, относящихся к разным функциональным кластерам. Более подробно методика ОТ-РНК было описана нами ранее [12].
Статистическая обработка собранной базы данных выполнена с помощью открытого программного статистического пакета Jamovi (США). Создаваемые линейные и логистические регрессионные модели оценивались показателями R2 и тестом на автокорреляцию Дурбина — Уотсона (DW). Качество модели считали приемлемым при значениях R2>0,3 и DW>1,5. Визуальная оценка полученных данных представлена в диаграммах рассеяния. Статистически значимыми считали различия показателей при значениях p<0,001.
Результаты исследования
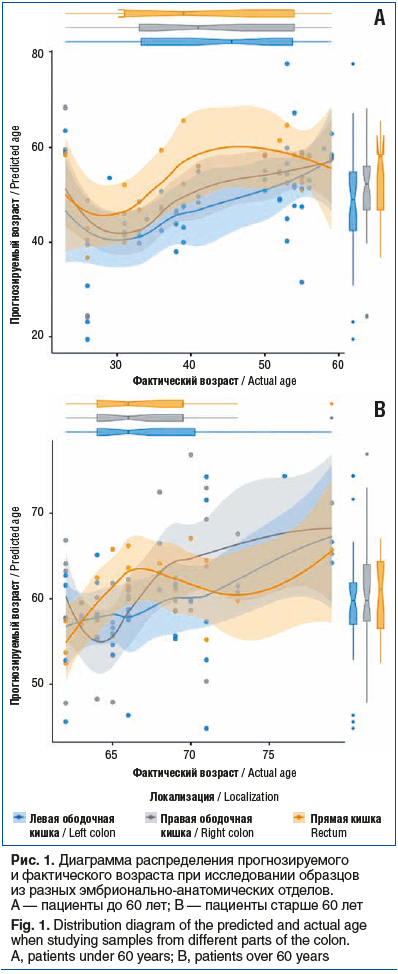
На первом этапе была сформирована линейная регрессионная модель зависимости фактического возраста (полных лет) в качестве зависимой переменной от показателей экспрессии мРНК ряда генов в образцах слизистой оболочки толстой кишки из различных эмбрионально-анатомических отделов, которые использованы как объясняющие переменные. R2 полученной модели 0,43, тест DW на автокорреляцию 1,54, что позволило считать модель умеренно надежной. Модель сформировали 10 генов-участников: TERT, IGF1, IFNg, TGFb, CD69, GATA3, IL7, LGALS1, TLR4, P14ARF (P19ARF) (табл. 1).
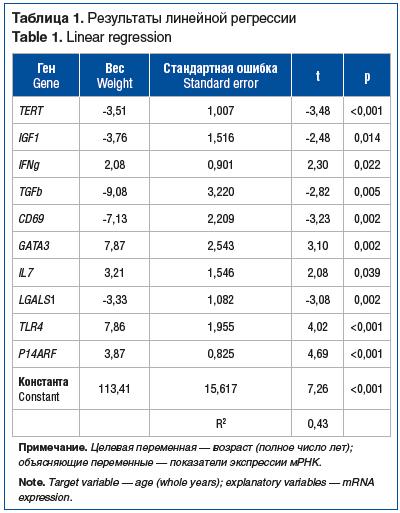
На втором этапе работы мы изучили ошибки классификации линейной модели зависимости фактического возраста от показателей экспрессии мРНК ряда генов в слизистой оболочке и их связь с эмбрионально-анатомическими отделами толстой кишки.
Выявлено, что минимальное число ошибок возникает при исследовании образцов из прямой кишки, максимальное — из правой ободочной (рис. 1).
Ориентируясь на эпидемиологические данные о значительном повышении риска развития КРР после 60 лет, на третьем этапе работы мы решили выяснить, как различаются уровни экспрессии изученных генов до и после достижения этого возраста и какие из них могут сформировать «молекулярную» возрастную шкалу.
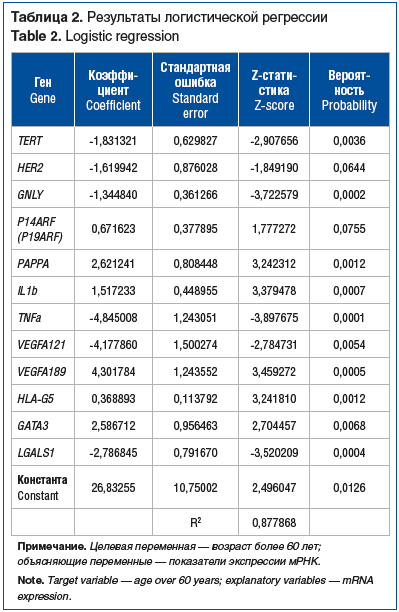
С этой целью была сформирована регрессионная модель бинарного выбора, где целевой переменной служил критический возраст пациента, определенный нами в 60 полных лет. Результаты полученной логистической регрессии представлены в таблице 2. Модель сформировали показатели экспрессии 12 генов-участников: TERT, HER2, GNLY, P14ARF (P19ARF), PAPPA, IL1b, TNFa, VEGFA121, VEGFA189, HLA-G5, GATA3, LGALS1. R2 данной модели 0,87, тест DW на автокорреляцию 1,84. Показатели модели мы сочли удовлетворительными.
Для решения задачи распределения пациентов на возрастные подгруппы моложе и старше 60 лет и определения критических значений показателей экспрессии статистически значимых генов мы построили дерево бинарной классификации (рис. 2).
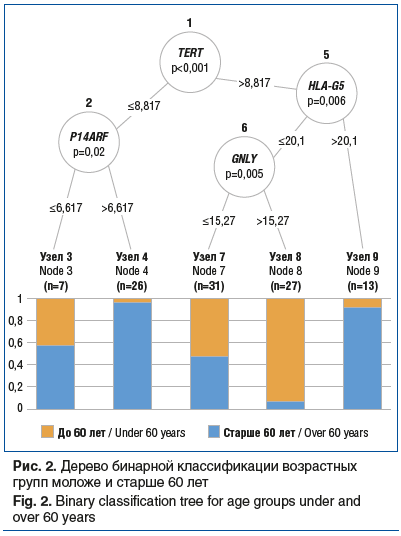
Выявлено, что первичный узел классификации пациентов по возрасту старше или моложе 60 лет образует уровень экспрессии гена TERT. Теломеразная активность в сочетании с гиперэкспрессией гена HLA-G5 характерна для старшей возрастной группы. Гипоэкспрессия же человеческого лейкоцитарного антигена G (HLA-G5) с одновременной гиперэкспрессией гранулизина (GNLY) характерна для возрастной группы моложе 60 лет. Молекулярный каскад, представленный снижением теломеразной активности вследствие гипоэкспрессии TERT с одновременной гиперэкспрессией регулятора клеточного цикла и гена-онкосупрессора P14ARF, также характерен для изменений слизистой оболочки толстой кишки у людей старше 60 лет.
Обсуждение
В мировой и отечественной литературе тема возрастных особенностей экспрессии генов в различных тканях и влияние этого фактора на канцерогенез мало обсуждаются. Необходимо более детальное изучение эпигенетических изменений, влекущих за собой риски развития онкологических заболеваний. В ходе анализа экспрессии 63 генов-участников нами были определены группы генов, экспрессия которых, вероятно, наиболее значима для развития КРР.
Мы обратили внимание на то, что изменения экспрессии генов — участников наших прогностических моделей имеют важное значение при КРР. Так, в литературе имеются сведения, что высокие уровни коэкспрессии IGF2 и TGFβ предсказывают прогрессирование КРР с большей точностью, чем повышенная экспрессия отдельных генов. Ген IGF2 также предлагается в качестве потенциальной мишени лечения [13]. A.J. Cagnoni et al. [14] показали, что повышенная экспрессия галептина (LGALS1) указывает на неблагоприятный прогноз при КРР.
Помимо гетерогенности молекулярных и биологических вариантов КРР обнаружено, что опухолевые клетки могут также обходить репликативное старение и приобретать способность поддерживать неограниченную пролиферацию. Теломеразная обратная транскриптаза (TERT) — каталитическая субъединица теломеразы. Взаимодействие теломер/теломераза служит важным механизмом, участвующим как в стабильности генома, так и в клеточном репликативном потенциале, и его дисфункция играет ключевую роль в онкогенезе. Сокращение теломер из-за клеточной пролиферации может быть ускорено специфическими изменениями в генах, вовлеченных в канцерогенез КРР, таких как APC и MSH2. Активация TERT позволяет опухолевым клеткам неограниченно расти за счет сохранения длины теломер, что способствует образованию/прогрессированию опухоли [15, 16]. В нашем исследовании было показано, что увеличение экспрессии TERT характерно для лиц старше 60 лет.
Ген TNFa кодирует провоспалительный цитокин семейства факторов некроза опухолей (TNF). Цитокин участвует в клеточных процессах, включая пролиферацию, дифференцировку, апоптоз, а также метаболизм липидов и коагуляцию. Молекулы гистосовместимости HLA-G класса I подавляют функции естественных клеток-киллеров. Рядом авторов установлено, что гиперэкспрессия HLA-G в злокачественных клетках позволяет избегать иммунологическую детекцию [17, 18]. В представленном исследовании обнаружено, что экспрессия HLA-G увеличивается в старшей возрастной группе.
Обращает на себя внимание гиперэкспрессия GNLY в группе здоровых людей моложе 60 лет. Кодируемый им гранулизин, член семейства сапозиноподобных белков, находится в цитотоксических гранулах Т-клеток, которые высвобождаются при стимуляции антигеном. Данный белок присутствует в цитотоксических гранулах Т-лимфоцитов и натуральных клеток-киллеров, обладая противомикробной активностью, что может объяснить более частые нарушения микробиоты в старшей возрастной группе. Участие в этом молекулярном каскаде гена-онкосупрессора P14ARF позволяет предположить повышенную митогенную стимуляцию в этой группе и инициацию апоптоза p53-зависимого клеточного цикла [19].
Значимость генов, определенная с помощью линейной регрессионной модели прогнозирования паспортного возраста, которая включает в себя показатели их экспрессии, имеет умеренные показатели надежности: R2 модели 0,45, тест DW 1,54. Ошибки оценки возраста в модели возникают пропорционально с его увеличением, что связано с кумуляцией эпигенетических изменений.
Заключение
Нами установлено, что с увеличением возраста в слизистой оболочке толстой кишки у здоровых людей происходят изменения уровней экспрессии ряда генов. Несмотря на то, что это естественные возрастные (эпигенетические) изменения, они в то же время увеличивают риск развития КРР. Точность ассоциации фактического возраста и экспрессии генов — участников канцерогенеза зависит от эмбрионально-анатомического отдела, из которого получен образец.
Показатели экспрессии мРНК 12 генов (TERT, HER2, GNLY, P14ARF, PAPPA, IL1b, TNFa, VEGFA121, VEGFA189, HLA-G5, GATA3, LGALS) в образцах неизмененной слизистой оболочки прямой кишки имеют специфический профиль, характерный для возрастной группы старше 60 лет. Таким образом, исследование этого профиля можно рассматривать как инструмент оценки риска развития КРР. Полученные результаты косвенно подтверждают причинно-следственную связь между нарушениями экспрессии генов — участников логистической модели, обнаруженной нами в старшей возрастной группе, и увеличением риска развития ККР, связанным с возрастом.
Сведения об авторах:
Гончаров Сергей Владимирович — к.м.н., заведующий отделением хирургических методов лечения и противоопухолевой лекарственной терапии абдоминальной онкологии с койками абдоминальной хирургии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0001-7914-1882.
Боженко Владимир Константинович — д.м.н., профессор, заведующий отделом молекулярной биологии и экспериментальной терапии опухолей ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0001-8351-8152.
Захаренко Маргарита Владимировна — к.б.н., младший научный сотрудник лаборатории иммунологии и онкоцитологии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0003-2480-4145.
Чаптыков Андрей Александрович — врач-хирург отделения хирургических методов лечения и противоопухолевой лекарственной терапии абдоминальной онкологии с койками абдоминальной хирургии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-2120-6783.
Кулинич Татьяна Михайловна — к.м.н., заведующая лабораторией иммунологии и онкоцитологии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0003-2331-5753.
Солодкий Владимир Алексеевич — д.м.н., профессор, академик РАН, директор ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-1641-6452.
Контактная информация: Гончаров Сергей Владимирович, e-mail: 9015@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.07.2023.
Поступила после рецензирования 28.07.2023.
Принята в печать 22.08.2023.
About the authors:
Sergey V. Goncharov — C. Sc. (Med.), Head of the Department of Surgical Treatment and Anticancer Drug Therapy for Abdominal Oncology with Abdominal Surgery Beds, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-7914-1882.
Vladimir K. Bozhenko — Dr. Sc. (Med.), Professor, Head of the Division of Tumor Molecular Biology and Experimental Therapy, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-8351-8152.
Margarita V. Zakharenko — C. Sc. (Biol.), junior researcher of the Laboratory of Immunology and Oncocytology, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2480-4145.
Andrey A. Chaptykov — surgeon of the Department of Surgical Treatment and Anticancer Drug Therapy for Abdominal Oncology with Abdominal Surgery Beds, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2120-6783.
Tat’yana M. Kulinich — C. Sc. (Med.), Head of the Laboratory of Immunology and Oncocytology, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2331-5753.
Vladimir A. Solodkiy — Academician of the RAS, Professor, Director of the Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1641-6452. Contact information: Sergey V. Goncharov, e-mail: 9015@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.07.2023.
Revised 28.07.2023.
Accepted 22.08.2023.
Информация с rmj.ru
