Введение
Согласно определению ВОЗ мужское бесплодие — это нарушение мужской репродуктивной функции, которое выражается в количественном или качественном изменении сперматозоидов. Мужское бесплодие может быть клиническим проявлением множества различных патологических состояний, затрагивающих как половую, так и другие системы организма. Значительную долю во всем многообразии форм мужского бесплодия составляют нарушения качественных характеристик эякулята. В частности, известно, что физико-химические сдвиги в ткани предстательной железы, возникающие при ее воспалении, приводят к изменению качества спермы [1–3].
Вопросы этиологии и патогенеза фертильной дисфункции при хроническом простатите остаются предметом серьезных дискуссий и разногласий. Несмотря на множество опубликованных работ, данное состояние остается недостаточно изученным и плохо поддающимся лечению [4, 5]. Хотя абактериальный простатит признается самостоятельным заболеванием, остается неясным вопрос, не является ли он этапом в развитии бактериального простатита. Высказываются предположения, что первичного инфекционного простатита не существует, а есть только вторичный инфекционный, возникающий вследствие морфологических изменений или нарушения функции предстательной железы [6, 7].
Окислительный стресс, возникающий в условиях воспалительного процесса, отрицательно влияет на микросреду яичка и нарушает сперматогенез, повреждает ДНК, снижает подвижность и изменяет морфологию сперматозоидов. Многие аспекты окислительного стресса обусловлены повреждением митохондрий, энергетический потенциал которых регулируется, в частности, инозитолами [8–10].
Одна из причин ухудшения фертильности у больных хроническим простатитом заключается в снижении концентрации тестостерона в сыворотке крови. Так, была установлена прямая корреляция между уровнем половых гормонов и выраженностью сексуальной дисфункции у мужчин. Эти данные свидетельствуют о важной роли нетестикулярных андрогенов в регуляции половой функции мужчин [11–13].
Предстательная железа и яичко находятся в положительной коррелятивной зависимости, и при нарушении функции одного из органов страдает другой. Вместе с тем предстательная железа — это орган, отвечающий за метаболизм половых гормонов, и ее заболевание ведет к нарушению этого метаболизма [14, 15].
К сожалению, этиология и патогенез, своевременная диагностика хронического простатита, характерная для него инфертильность и терапевтические подходы к его лечению — все эти вопросы на сегодняшний день далеки от решения. Несмотря на широкое распространение мужского бесплодия у больных хроническим простатитом, роль этого заболевания в генезе инфертильности остается спорной.
Цель исследования: оценить нарушения качества спермы и секрета предстательной железы у больных с инфертильностью и хроническим простатитом, а также сравнить эффективность различных схем терапии данной патологии.
Материал и методы
Проведен ретроспективный анализ результатов лечения пациентов с инфертильностью и хроническим простатитом. Поводом для обращения за медицинской помощью к урологу служил бесплодный брак. В результате комплексного обследования пациентов у части больных был верифицирован хронический простатит, который ранее клинически не проявлялся, у некоторых пациентов наличие хронического простатита было подтверждено анамнестически. В исследование были включены только пациенты, впервые обратившиеся с проблемами зачатия к врачу и ранее не получавшие специфического лечения. Данные лабораторного обследования и лечения пациентов были получены из медицинских карт амбулаторного больного (форма № 025/У-87)
методом выкопировки.
В проведенный нами анализ были включены 50 мужчин репродуктивного возраста от 18 до 36 лет (средний возраст составил 26,6±2,2 года) с хроническим простатитом, имеющих различные проявления патоспермии. В 1-й группе (n=25) пациенты наряду со стандартной терапией хронического простатита получали комплексную биологически активную добавку (БАД) Актиферт-Андро по стандартной схеме (по 1 таблетке 1 р/сут в течение 3 мес. непрерывным курсом), во 2-й группе (n=25) — только стандартную медикаментозную терапию хронического простатита: противовоспалительную, антибактериальную, простатотропную, противоотечную, улучшающую микроциркуляцию.
Применялись общеклинические, лабораторные и ультразвуковые методы исследования согласно общепринятым стандартам. У всех пациентов проводился физикальный осмотр предстательной железы per rectum. Лабораторные методы включали спермограмму, бактериологическое исследование образцов эякулята, микроскопию секрета предстательной железы. При проведении бактериологического анализа диагностически значимым считали титр бактерий не менее 104 КОЕ/мл.
Секрет предстательной железы получали после проведения пальцевого массажа простаты через прямую кишку. За норму было принято не более 10 лейкоцитов в поле зрения в секрете простаты, большое количество лецитиновых зерен и отсутствие эритроцитов. Анализ эякулята проводили согласно рекомендациям ВОЗ 2010 г. Для выявления антиспермальных антител (IgA, IgG) на поверхности сперматозоидов (MAR-тест) использовали метод MarScreen. Лабораторные исследования выполняли до начала лечения и через 3 мес. после начала лечения.
Диагностику хронического простатита проводили по общепринятым критериям и стандартам, используя Индекс шкалы симптомов хронического простатита и синдрома тазовых болей у мужчин по версии Национального института здоровья США (NIH-CPSI).
При трансректальном УЗИ предстательной железы определяли размеры и объем простаты, ее структуру, симметричность, наличие дополнительных образований, очагов повышенной и пониженной эхогенности, кальцинатов и фиброза.
Статистическая обработка полученных результатов проведена с использованием пакета прикладных программ Microsoft Exсel, Statistica, v. 12.6 for Windows (2015) с оценкой характера распределения. Достоверность различий оценивали по критерию Стьюдента.
Результаты и обсуждение
Возрастная структура обследованных нами пациентов выглядела следующим образом: 8 (16%) пациентов младше 20 лет, 15 (30%) — в возрасте от 20 до 30 лет, 27 (54%) — старше 30 лет. То есть с возрастом заболеваемость хроническим бактериальным простатитом растет.
Нормальные размеры простаты (менее 20 см3) определялись у 26% пациентов, умеренно увеличенные (20–30 см3) — у 56%, значительно увеличенные (более 30 см3) — у 18%.
Исходно группы были сопоставимы по изучаемым лабораторным показателям.
По результатам бактериологического анализа эякулята у 39 пациентов титр бактерий в посеве превышал 104 КОЕ/мл, у 11 пациентов рост микрофлоры не определялся или выявлялся в клинически незначимом титре (менее 104 КОЕ/мл).
При сравнении лабораторных показателей секрета простаты и эякулята в различных возрастных группах пациентов отмечалась следующая тенденция: наиболее ярко выраженные воспалительные изменения в эякуляте выявлены у пациентов 20–30 лет, у пациентов моложе 20 лет воспалительные изменения были чуть менее выраженными и встречались реже, а в группе старше 30 лет нарушения воспалительного генеза встречались наиболее часто, однако их выраженность соответствовала среднему уровню (табл. 1).
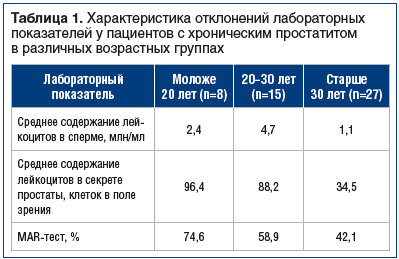
Изменения воспалительного характера в секрете простаты были наиболее выраженными у пациентов молодого возраста (моложе 20 лет), в более старшем возрасте (20–30 лет) активность воспалительных изменений несколько снижалась, достигая своего минимума у пациентов старше 30 лет.
Аналогичная тенденция сохранялась и при оценке MAR-теста: его показатель снижался с 74,6% (в группе моложе 20 лет) до 42,1% (в группе старше 30 лет).
С увеличением возраста частота и распространенность выявляемых отклонений лабораторных параметров возрастали, однако их активность и выраженность имели тенденцию к снижению.
Выявленные изменения позволяют заключить, что количество лейкоцитов в секрете простаты и эякуляте не отражает в полной мере состояние предстательной железы и не дает полной информации для понимания сущности текущего воспалительного процесса. Дело в том, что при заборе биологического материала для данных анализов опорожняется лишь часть ацинусов простаты, что не может дать полной картины воспалительного процесса в железе, а характеризует состояние ограниченного участка органа.
Несмотря на отсутствие четких закономерностей в сочетании микробиологических, иммунологических и сперматологических изменений в секрете простаты и эякуляте, данные методы являются «золотым стандартом» диагностики патологических состояний половой системы ввиду низкой стоимости, доступности и быстроты выполнения.
Оценка взаимосвязи воспалительных нарушений (по данным лабораторных исследований) и структурных изменений в предстательной железе выявила следующие закономерности. С увеличением размеров простаты у пациентов с хроническим простатитом отмечается снижение выраженности воспалительных изменений в секрете простаты и эякуляте, что может быть обусловлено замещением ткани железы на соединительную при хронически текущем воспалительном процессе в ткани самого органа. Известно, что умеренное увеличение простаты говорит ο ее отеке, который является признаком воспалительного процесса и активность которого характеризуется воспалительными отклонениями в лабораторных анализах. Значительное же увеличение размеров предстательной железы обусловлено не отеком органа, а рубцовыми структурными изменениями в самой ткани железы, что является признаком хронического вялотекущего процесса без обострений. Это и отражается в снижении выраженности воспалительных изменений в секрете простаты и эякуляте при увеличении размеров железы.
Исходно олигоастенозооспермия в 1-й группе была выявлена у 18 (72%) пациентов, во 2-й группе — у 20 (80%). Группы пациентов сравнивались в основном по степени выраженности воспалительных изменений в секрете простаты и эякуляте.
После трехмесячного курса лечения в эякуляте 52% пациентов обеих групп лейкоспермия не отмечалась, эритроциты отсутствовали. У остальных мужчин уровень воспалительных отклонений был минимальным (выявлялась слабая лейко- и эритроспермия). В 1-й группе общие показатели (вязкость, время разжижения, цвет, примеси) практически у всех были в норме, так же как и морфология и жизнеспособность сперматозоидов (табл. 2). В 6 случаях выявлялась невыраженная агглютинация сперматозоидов, присутствовала легкая астенозооспермия, агрегация отсутствовала, MAR-тест был отрицательным. Выраженность воспалительных изменений в секрете простаты была минимальной. Выявлены лишь единичные случаи выраженных (более 50 лейкоцитов в поле зрения) — у 1 (4%) человека и умеренных (10–50 лейкоцитов в поле зрения) — у 3 (12%) человек воспалительных изменений в секрете простаты. В остальных случаях показатель соответствовал норме.
Среди пациентов 2-й группы чаще отмечали наличие слизи в эякуляте и сдвиг рН эякулята, повышение вязкости спермы и увеличение времени ее разжижения (см. табл. 2). Также более выраженной была астенозооспермия, в ряде случаев выявлялась олигоастено- и тератозооспермия, чаще регистрировали агглютинацию и агрегацию сперматозоидов, слабоположительный (50-60%) MAR-тест. Различия носили статистически значимый характер (р<0,05). В спермограмме у 7 пациентов выявлены воспалительные явления (0,5–6 млн лейкоцитов в 1 мл эякулята), сопровождавшиеся патоспермией и астенозооспермией, примесью слизи и сдвигом рН эякулята, MAR-тест был на уровне 50%. Воспалительные изменения и микробиологические отклонения в лабораторных анализах секрета простаты во 2-й группе встречались достоверно чаще, чем в 1-й группе (р<0,05). Выраженные воспалительные изменения в секрете простаты выявлены у 5 (20%) пациентов, умеренные — у 7 (28%). В остальных случаях отклонений данного показателя не выявлено.
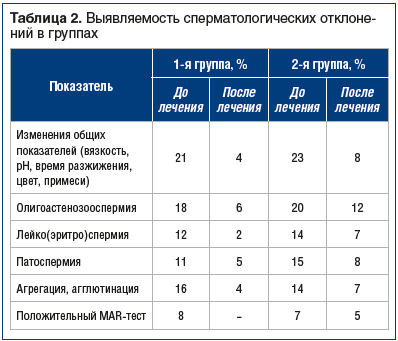
Как видно из представленных данных, комплексная БАД Актиферт-Андро способствовала улучшению качественных и количественных показателей эякулята, а также повышению качества спермы. Компоненты, входящие в состав Актиферта-Андро (мио-инозитол, карнитин, аргинин, цистеин, селен, цинк, витамин Е и фолиевая кислота), способствуют снижению вязкости эякулята, повышению активности и подвижности сперматозоидов. Мио-инозитол участвует в синтезе белков, необходимых для созревания сперматозоидов. Кроме того, он регулирует осмолярность и объем семенной жидкости, увеличивая подвижность сперматозоидов. Комплексное воздействие на репродуктивную функцию мужчины, способность устранять имеющиеся фертильные нарушения дают основание использовать этот препарат в плановом порядке с целью прегравидарной подготовки, в т. ч. у мужчин с хроническим простатитом.
Инозитолы традиционно используются как средство лечения женского бесплодия, связанного с инсулинорезистентностью. Однако в последнее время встречаются свидетельства их использования для лечения мужского варианта бесплодия. В частности, предлагаются клинические алгоритмы, предназначенные для пациентов с астенозооспермией [16]. В проведенных европейских исследованиях отмечалось улучшение подвижности сперматозоидов у 85,3% пациентов на фоне трехмесячного курса лечения препаратами на основе мио-инозитола с минералами и витаминами [17]. Данный компонент представляет собой сахароподобную молекулу и является одним из предшественников синтеза полифосфатов фосфатидилинозитола, ключевых биомолекул, принадлежащих к системе передачи сигналов нескольких клеточных функций. Мио-инозитол нормализует метаболический профиль пациентов, повышая чувствительность к инсулину, улучшает характеристики спермы, такие как концентрация, подвижность и морфология сперматозоидов, т. е. может быть использован в терапии сперматологических и метаболических нарушений, ответственных за мужское бесплодие [18].
Заключение
Хронический простатит, осложненный инфертильностью, наиболее распространен в возрастной группе старше 30 лет, тогда как активность воспалительного процесса более выражена в молодом возрасте до 20 лет. В ходе исследования выявлено, что с увеличением размеров предстательной железы снижается выраженность воспалительных изменений в секрете простаты и спермограмме, что может быть обусловлено изменением структуры органа и замещением железистой ткани на соединительную. Выявляемые микробиологические и сперматологические изменения в секрете простаты и эякуляте в различных возрастных группах у пациентов с хроническим простатитом и бесплодием имеют однотипный характер. Включение в комплексную терапию мужского бесплодия, развившегося на фоне хронического простатита, комплекса Актиферт-Андро позволяет воздействовать на различные звенья нарушений сперматогенеза, что особенно важно с учетом полиэтиологичности этой патологии.
Благодарность
Редакция благодарит ООО «ЮФЛ» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru
