Содержание статьи
Закономерности изменений коагуляционного потенциала крови при
недоношенной беременности, осложненной преждевременным разрывом плодных оболочек
Л. И. Дятлова*, кандидат медицинских наук
Н. П. Чеснокова**, доктор медицинских наук, профессор
Е. В. Понукалина**, доктор медицинских наук, профессор
И. Е. Рогожина**, доктор медицинских наук, профессор
Т. Н. Глухова**, доктор медицинских наук, профессор
*ГУЗ Перинатальный центр CО, Саратов
**ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
Одной из актуальных проблем акушерства и гинекологии является преждевременное
излитие околоплодных вод, обуславливающее в свою очередь досрочное прерывание
беременности у 50–60% пациенток [1]. До настоящего момента существуют различные
концепции относительно этиологии и факторов риска развития преждевременного
разрыва плодных оболочек, согласно которым наиболее часто инициирующими
механизмами развития указанной патологии являются внутриутробное инфицирование
плода, нейроэндокринная патология, аутоиммунные процессы в системе
мать–плацента–плод, различные формы экстрагенитальной патологии матери и др.
Однако, как известно, одной из закономерностей развития патологических состояний
и болезней различного генеза является динамическая смена причинно-следственных
отношений, когда вслед за пусковыми механизмами развития патологии включаются
типовые патологические процессы и реакции, обеспечивающие реализацию эфферентных
звеньев развития патологии [2].
Как показали результаты проведенных нами ранее исследований, преждевременное
излитие околоплодных вод в сроки гестации 22–34 недели закономерно
сопровождается системной активацией процессов липопероксидации и чрезмерным
накоплением в крови матери и околоплодных водах промежуточных продуктов
липопероксидации — диеновых конъюгатов и малонового диальдегида, возрастанием
показателя Oxystat, отражающего суммарное возрастание перекисей [3]. Последнее
определяет возможность развития эндотелиальной дисфункции и связанных с ней
изменений регуляции сосудистого тонуса, коагуляционного потенциала крови,
нарушений микрогемодинамики в различных органах и тканях, в частности, в системе
мать–плацента–плод. В связи с указанными данными очевидно, что несостоятельность
околоплодных оболочек при преждевременном излитии околоплодных вод формируется
на фоне оксидативного стресса, характеризующего универсальную дестабилизацию
биомембран клеток различной морфофункциональной организации, межуточного
вещества, а также сосудистой стенки.
До настоящего времени не установлена патогенетическая взаимосвязь между
вышеуказанными метаболическими сдвигами, в частности, системной активацией
процессов липопероксидации, недостаточностью антиоксидантной системы крови и
возможностью развития эндотелиальной дисфункции, нарушений коагуляционного и
тромбоцитарно-сосудистого звеньев системы гемостаза.
Целью настоящего исследования явилось изучение характера и механизмов
нарушений коагуляционного потенциала крови, установление их взаимосвязи с
изменениями функциональной активности сосудистой стенки при преждевременном
разрыве плодных оболочек (ПРПО), патогенетическое обоснование новых объективных
критериев возможности пролонгирования беременности при указанной патологии на
фоне адекватной комплексной терапии.
Материалы и методы исследования
Проведено комплексное клинико-лабораторное обследование 72 пациенток,
находившихся на лечении в ГУЗ «Перинатальный центр Саратовской области» в
2012–2014 гг. Критериями включения пациенток в исследование явилось осложнение
беременности преждевременным разрывом плодных оболочек при сроках гестации 22–34
недели, отсутствие клинических и лабораторных признаков реализации восходящей
инфекции, в частности лихорадки, тахикардии, лейкоцитоза с нейтрофильным сдвигом
влево в периферической крови.
Критерии исключения: многоплодная беременность, тяжелые формы преэклампсии и
экстрагенитальной патологии (артериальная гипертензия, сахарный диабет,
гломерулонефрит и др.), наличие у пациентки синдрома задержки роста плода II и
III степени.
Контрольную группу составили 40 женщин с физиологически протекающей
беременностью в аналогичные сроки гестации.
Комплексное клинико-лабораторное обследование включало оценку общего
состояния беременных, 3-часовую термометрию, контроль гемодинамических
параметров, количества и характера подтекающих вод, ежедневный клинический
анализ крови. Одновременно проводилось исследование вагинального мазка на
микрофлору каждые 2–3 дня, бактериологический посев отделяемого из цервикального
канала на β-гемолитический стрептококк, флору и чувствительность к антибиотикам,
а также определение С-реактивного белка в крови 1 раз в 3 дня.
Для антенатальной диагностики состояния плода использовали ультразвуковую
фетометрию и плацентометрию, ежедневную оценку индекса амниотической жидкости, а
также допплерографическое исследование кровотока в артерии пуповины, аорте
плода, маточных артериях и средней мозговой артерии раз в 2–3 дня.
Ультразвуковое сканирование в реальном масштабе времени и допплерометрию
плодового и плацентарного кровотока проводили на ультразвуковом аппарате Voluson
e8 Еxpert, кардиотокографию проводили ежедневно аппаратом Sonicaid Team Cape.
Сравнительная оценка ряда клинико-лабораторных показателей проведена при
поступлении беременной с преждевременным разрывом плодных оболочек в стационар
(до проведения терапии) и после пролонгации беременности, в момент начала
родовой деятельности.
Функциональная активность сосудистой стенки оценивалась по ряду традиционных
показателей — уровню эндотелина-1, тромбомодулина, тромбоспондина, молекул
межклеточной адгезии и метаболитов оксида азота в крови.
Содержание эндотелина-1 в крови определяли с использованием тест-систем
производства Biomedica (Австрия), для определения тромбомодулина использованы
реактивы фирмы Siemens Healthare Diagnostics (Германия), тромбоспондина —
реактивы фирмы RnD Systems (Англия), молекул межклеточной адгезии sICAM-реактивы
фирмы Bender MedSystems (Австрия).
Все вышеуказанные исследования проведены методом твердофазного
иммуноферментного анализа на иммуноферментном анализаторе «MD-6000»
(производитель Meredith Diagnostics, Англия).
Изучение состояния системы гемостаза проводилось путем определения ряда
общепринятых интегративных показателей: протромбинового времени, активированного
частичного тромбопластинового времени (АЧТВ), тромбинового времени,
международного нормализованного отношения (МНО), а также содержания в крови
фибриногена.
Статистический анализ данных проводили с использованием пакета прикладных
программы Microsoft Office Excel (версия 2007, Microsoft Corporation, США, 2007)
и программного пакета для статистического анализа Statistica (версия 5.5А,
StatSoft Inc., США, 1999). Статистически значимыми различия считали при уровне р
≤ 0,05.
Результаты
Как показали результаты проведенных исследований, у беременных с
преждевременным разрывом плодных оболочек при поступлении в стационар имело
место снижение содержания метаболитов оксида азота в крови (табл. 1).
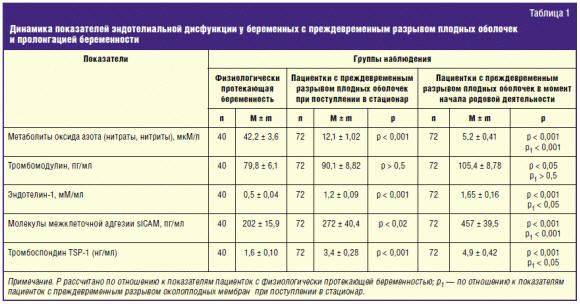
Как известно, основными свойствами оксида азота является вазодилатация и
обеспечение дезагрегирующего эффекта в отношении тромбоцитов, а также
антиоксидантные и мембранопротекторные эффекты. В связи с этим выявленное нами
снижение уровня метаболитов оксида азота в крови беременных с ПРПО является
одним из факторов риска развития вазоконстрикции и тромбофилии.
В последующих исследованиях проведено определение уровня в крови беременных с
ПРПО эндотелина-1. Согласно данным литературы, эндотелин-1 является, с одной
стороны, одним из регуляторов продукции оксида азота сосудистой стенкой,
обеспечивающим при участии эндотелиновых рецепторов усиление продукции оксида
азота эндотелиальными клетками, а с другой стороны, антагонизирует
вазодилатирующие эффекты оксида азота [2, 4].
Определение уровня эндотелина-1 в крови пациенток с указанной патологией
гестации свидетельствовало о резком возрастании содержания в крови этого
соединения (табл. 1).
Резюмируя вышеизложенное, следует заключить, что при преждевременном излитии
околоплодных вод развивается выраженная дисрегуляция сосудистого тонуса, когда
увеличение содержания в крови эндотелина-1 не обеспечивает адекватной стимуляции
освобождения оксида азота, что приводит к развитию вазоконстрикторного эффекта.
Целью последующих наблюдений было определение содержания в крови беременных с
ПРПО таких тромбогенных субстанций, как тромбоспондин и молекулы межклеточной
адгезии. Проведенные нами исследования свидетельствовали о выраженном нарастании
уровня в крови пациенток с ПРПО указанных тромбогенных субстанций (табл. 1).
Касаясь биологической значимости возрастания уровня указанных соединений в
крови, следует отметить, что тромбоспондин является белком внеклеточного
матрикса, продуцируемым преимущественно тромбоцитами и макрофагами, способным
регулировать процессы адгезии, миграции, пролиферации клеток различных типов. К
числу биологических эффектов тромбоспондина относится его способность
ингибировать процессы пролиферации эндотелия и в то же время инициировать
апоптоз эндотелиальных клеток. Экспрессия тромбоспондина коррелирует с
повреждением эндотелия микроциркуляторного русла, обеспечивая развитие
антагонизирующих эффектов по отношению к оксиду азота на сохранность структуры
сосудистой стенки [4–6].
Таким образом, тромбоспондин является одним из антагонистов оксида азота во
влиянии его на структуру сосудистой стенки и ее тромбогенную активность.
Проведенные далее исследования позволили выявить заметное возрастание
содержания в крови растворимых молекул межклеточной адгезии sICAM-1 (табл. 1).
Как известно, в физиологических условиях эндотелиальные клетки не
экспрессируют молекулы sICAM-1. Концентрация растворимых молекул межклеточной
адгезии на поверхности эндотелиальных клеток увеличивается при действии
различных факторов, активирующих эндотелий, включая провоспалительные цитокины
[7, 8].
В связи с этим очевидно, что повышение содержания растворимых молекул
межклеточной адгезии в крови беременных с преждевременным излитием околоплодных
вод, с одной стороны, является признаком деструктивных процессов в
эндотелиальных клетках, а с другой стороны, имеет патогенетическую взаимосвязь с
обнаруженным нами ранее возрастанием уровня провоспалительных цитокинов (ИЛ-6,
ИЛ-8, ФНО-α) в крови пациенток с указанной патологией гестации [9, 10].
Таким образом, проведенные нами исследования убедительно свидетельствуют о
развитии эндотелиальной дисфункции при преждевременном излитии околоплодных вод,
характеризующейся нарушениями адгезивно-агрегационных свойств сосудистой стенки,
инициирующими сдвиги коагуляционного потенциала крови.
Последнее определило целесообразность последующих исследований состояния
коагуляционного гемостаза в той же группе пациенток с преждевременным излитием
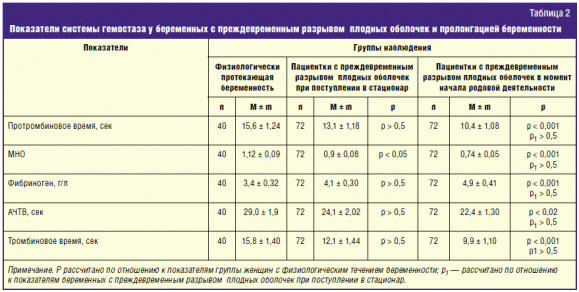
околоплодных вод при сроках гестации 22–34 недели. При этом не было выявлено
изменений традиционных показателей оценки коагуляционного гемостаза:
протромбиновое время, АЧТВ, тромбиновое время, содержание фибриногена в крови
оставались в пределах нормы (табл. 2). Лишь показатель МНО статистически
достоверно снижался, что свидетельствовало о начале развития гиперкоагуляционых
сдвигов.
Как указывалось выше, для обеспечения возможности пролонгирования
беременности пациенток с ПРПО госпитализировали в специализированные палаты,
оборудованные бактерицидными лампами. В целях своевременного выявления развития
инфекционного процесса в системе мать–плацента–плод проводилось исследование
вагинального мазка на микрофлору каждые 2–3 дня, контроль количества и характера
подтекающих вод, 3-часовая термометрия, оценка клеточного состава периферической
крови и ее белкового спектра. Для профилактики развития инфекционных осложнений
пациенткам осуществлялась антибактериальная терапия. На фоне указанной терапии
беременность у пациенток основной группы удалось пролонгировать без развития
осложнений у матери и плода в среднем на 10–12 дней (10,8 ± 2,4 дня), после чего
у наблюдаемых нами пациенток спонтанно развилась родовая деятельность,
завершившаяся родами через естественные родовые пути без осложнений для матери и
плода.
Клинико-лабораторное обследование беременных с ПРПО в момент начала родовой
деятельности позволило выявить определенную динамику вышеуказанных показателей
эндотелиальной дисфункции и коагуляционного потенциала крови.
Как оказалось, в указанный период наблюдения возникало дальнейшее усиление
тромбогенной активности эндотелия, о чем свидетельствовало прогрессирующее
нарастание уровня в крови эндотелина-1, тромбоспондина и молекул межклеточной
адгезии. Одновременно имело место резкое падение уровня в крови метаболитов
оксида азота и возрастание содержания тромбомодулина (табл. 1).
Усиление тромбогенной активности сосудистой стенки в момент начала родовой
деятельности после пролонгации беременности у пациенток с ПРПО обнаружило
патогенетическую взаимосвязь и параллелизм с развитием гиперкоагуляционных
сдвигов. Последние характеризовались укорочением протромбинового и тромбинового
времени, АЧТВ, снижением МНО, повышением уровня фибриногена в крови (табл. 2).
Резюмируя вышеизложенное, следует заключить, что проведенное нами комплексное
клинико-лабораторное обследование пациенток с ПРПО со сроками гестации 22–34
недели позволило впервые обнаружить патогенетическую взаимосвязь первичного
развития эндотелиальной дисфункции с последующими нарушениями коагуляционного
потенциала крови.
Заключение
- Преждевременное излитие околоплодных вод в сроки гестации 22–34 недели
формируется на фоне эндотелиальной дисфункции, характеризующейся уменьшением
продукции оксида азота и возрастанием содержания в крови вазоконстрикторных
тромбогенных субстанций (эндотелина-1, тромбоспондина) и молекул межклеточной
адгезии при отсутствии изменений показателей коагуляционного гемостаза. - Установлена принципиальная возможность пролонгации беременности при
преждевременном разрыве плодных оболочек в сроки гестации 22–34 недели на
10–12 дней в асептических условиях и проведении адекватной комплексной
терапии. - Патогенетически обосновано время завершения пролонгации беременности и
индукции родовой деятельности при преждевременном разрыве плодных оболочек в
сроки гестации 22–34 недели на основе мониторинга показателей эндотелиальной
дисфункции и коагуляционного гемостаза, когда имела место прогрессирующая
активация продукции тромбогенных субстанций (эндотелина-1, тромбоспондина и
молекул межклеточной адгезии), обнаруживающая параллелизм с выраженной
активацией процессов коагуляционного гемостаза.
Литература
-
Сидельникова В. М. Привычная потеря беременности. М.: Триада-Х,
2005. 304 с. -
Зайчик А. Ш., Чурилов Л. П. Основы общей патологии. Ч. I. СПб:
ЭЛБИ, 1999. С. 556–580. -
Дятлова Л. И., Михайлов А. В., Чеснокова Н. П. и др. Системная
активация процессов липопероксидации как фактор риска преждевременного
отхождения околоплодных вод и угрозы прерывания беременности //
Фундаментальные исследования. 2013. № 9 (ч. 1). С. 28–31. -
Петрищев Н. Н., Власов Т. Д. Дисфункция эндотелия. Причины,
механизмы, фармакологическая коррекция. СПб: Изд-во СПбГМУ, 2003. 182 с. -
Кузнецова С. А., Крылов А. В., Киселева Е. П. Иммунорегуляторные
свойства тромбоспондина-1, компонента внеклеточного матрикса и ингибитора
ангиогенеза // Медицинская иммунология. 2008. Т. 10, № 6. С. 499–506. -
Adams J. C., Lawler J. The thrombospondins // Int. J. Biochem.
Cell Biol. 2004. Vol. 36. P. 961–968. -
Huo Y., Ley К. Adhesion molecules and atherogenesis // Acta
Physiology. 2001. № 173 (1). Р. 35–43. -
Galkina E., Ley К. Vascular adhesion molecules in atherosclerosis
// Arterioscler. Thromb. Vasc. Biol. 2007. № 27 (11). Р. 2292–2301. -
Дятлова Л. И., Чеснокова Н. П., Глухова Т. Н. Цитокиновый
дисбаланс в механизмах развития преждевременного излития околоплодных вод /
Научная дискуссия: вопросы медицины: Материалы Х Международной
научно-практической конференции. М., 2013. С. 14–20. -
Глухова Т. Н., Михайлов А. В., Дятлова Л. И., Чеснокова Н. П.
Особенности метаболического и цитокинового гомеостаза при беременности,
осложненной преждевременным разрывом околоплодных мембран / V съезд
акушеров-гинекологов России: Материалы форума. М., 2013. С. 43–44.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru




