Выживаемость биологической терапии у пациентов с псориатическим артритом
Содержание статьи
Введение
Псориатический артрит (ПсА) — это хроническое воспалительное заболевание суставов, позвоночника и энтезисов, ассоциированное с псориазом.
Ранняя эффективная терапия ПсА, целью которой является достижение минимальной активности заболевания путем реализации стратегии treat-to-target («лечение до достижения цели»), может замедлить прогрессирование повреждения суставов [1].
Таргетные иммуносупрессоры — генно-инженерные биологические препараты и таргетные синтетические препараты — при ПсА используются, если не удается достигнуть низкой или минимальной активности заболевания на фоне применения нестероидных противовоспалительных препаратов, локальных инъекций глюкокортикостероидов и традиционных базисных противовоспалительных препаратов (метотрексат, сульфасалазин, лефлуномид, циклоспорин А). Используемые таргетные препараты влияют на все проявления «псориатической болезни»: кожные проявления псориаза, артриты, энтезиты, дактилиты, спондилит, а также улучшают функциональный статус пациентов. Для лечения ПсА в настоящий момент зарегистрированы генно-инженерные биологические препараты (ГИБП): ингибиторы фактора некроза опухоли-α (иФНО), к которым относятся этанерцепт, адалимумаб, инфликсимаб, цертолизумаба пэгол, голимумаб, ингибитор интерлейкинов 12 и 23 — устекинумаб, ингибиторы интерлейкина 17 — секукинумаб и иксекизумаб. Кроме того, в последнее время зарегистрированы 2 синтетических таргетных препарата: ингибитор фосфодиэстеразы 4 — апремиласт и ингибитор JAK-киназ — тофацитиниб. В случаях недостижения целевой активности заболевания на фоне лечения таргетным препаратом производится его замена на другой [2].
Выживаемость терапии определяется как время от начала биологической терапии до ее прекращения по каким-либо причинам, в т. ч. в результате перехода на другой ГИБП, — это интегральная характеристика препарата, отражающая его эффективность, переносимость и общую приемлемость для пациента и врача[3]. Выживаемость терапии не может быть исследована в рандомизированных клинических исследованиях, т. к. в них она определяется дизайном исследования. Этот показатель удобен для оценки в условиях реальной клинической практики (в наблюдательных исследованиях).
Оценка выживаемости безусловно важна для определения места того или иного препарата в реальной клинической практике, а также для долгосрочного планирования потребности в препаратах различных популяций пациентов. Анализ причин отмены генно-инженерной биологической терапии (ГИБТ) может дать ключ к более эффективному применению ГИБП.
Цель данного исследования — анализ длительности удержания пациентов с ПсА на ГИБТ и поиск возможных предикторов выживаемости терапии.
Материал и методы
Московский единый регистр артритов (МЕРА) начал работать с 2011 г. Первоначально в регистр включались пациенты с ревматоидным артритом, с января 2015 г. включаются также пациенты с ПсА, а с 2018 г. — пациенты с анкилозирующим спондилоартритом. Критериями включения в МЕРА (ветвь ПсА) являются:
соответствие критериям СASPAR (ClASsification criteria for Psoriatic ARthritis, 2006) [4];
применение таргетного препарата для лечения ПсА или планируемое назначение таргетного препарата;
подписанное информированное согласие на участие в исследовании.
У пациентов, включенных в регистр, собираются демографические данные, анамнез жизни (в т. ч. уровень образования, социальный статус, статус курения, сопутствующие и перенесенные заболевания, используемые для их лечения препараты). Подробно фиксируется анамнез заболевания: время появления симптомов артрита, время появления кожных проявлений псориаза, время установления диагноза ПсА, характер дебюта заболевания (острый, постепенный), симптомы в дебюте заболевания и эволюция симптомов за время наблюдения (артриты, энтезиты, дактилиты, вовлечение позвоночника, поражение ногтей, наличие сакроилеита, поражение глаз), наличие антигена HLA B-27, терапия, назначавшаяся за весь период заболевания. Также на каждом визите отмечаются все изменения, произошедшие в проводимом медикаментозном лечении.
Статистический анализ. Некорригированный анализ удержания на ГИБТ проводился путем оценки среднего времени лечения до прекращения по любой причине методом Каплана — Майера. Поиск независимых предикторов риска прерывания терапии осуществлялся путем прямого пошагового отбора переменных в рамках многофакторной регрессионной модели пропорциональных рисков по Коксу. Корригированное сравнение риска отмены ГИБП произведено в многофакторной регрессионной модели по Коксу с включением выявленных вышеуказанных предикторов в качестве кофаундеров. С учетом того, что некоторые препараты (устекинумаб, цертолизумаба пэгол, голимумаб) стали использоваться для лечения ПсА в последние 2–3 года и применяются преимущественно при недостаточной эффективности других препаратов, дополнительно в модель введены поправки на год начала лечения и порядковый номер препарата в таргетной терапии (линия таргетного лечения). Статистический анализ проводился с помощью программы IBM SPSS Statistics ver. 22. (SPSS corp. 1989, 2013).
Результаты исследования
В анализ включено 236 эпизодов лечения ГИБТ по поводу ПсА у 141 пациента. Средний возраст пациентов составил 50,1±11,4 года, возраст заболевания артритом — 37,4±13,0 года. Общая характеристика включенных в исследование пациентов представлена в таблице 1.
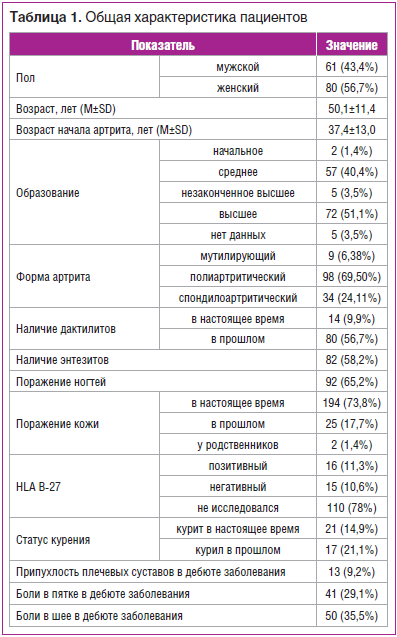
В лечении использовались следующие таргетные препараты: адалимумаб, голимумаб, инфликсимаб, этанерцепт, цертолизумаба пэгол, устекинумаб. Наибольшее количество пациентов, включенных в регистр, получали этанерцепт, инфликсимаб и адалимумаб, реже назначался устекинумаб. Наименьшее число пациентов получали голимумаб и цертолизумаба пэгол.
Частота использования различных препаратов и характеристика эпизодов лечения представлены в таблице 2.
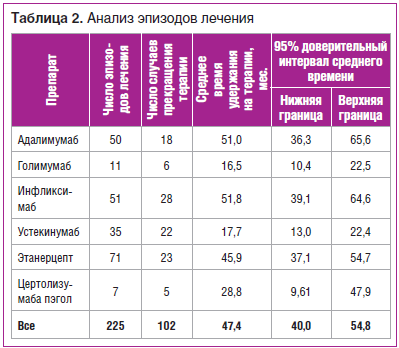
При первичном анализе выживаемости ГИБТ при ПсА (некорригированный анализ) получены следующие данные: лучшее удержание на терапии показали этанерцепт, адалимумаб и ифликсимаб, несколько хуже — устекинумаб, голимумаб и цертолизумаба пэгол. Данные о статистической значимости выявленных различий приведены в таблице 3 и на рисунке 1.
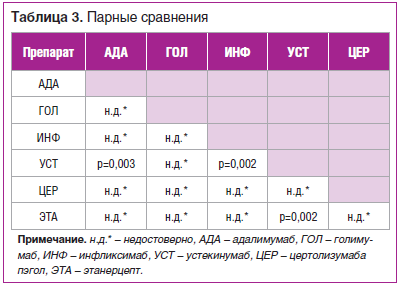
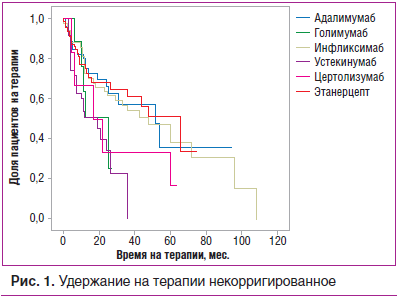
Проведенный поиск показателей, коррелирующих с длительностью удержания на ГИБТ и являющихся характеристиками пациента, выявил следующие взаимонезависимые значимые факторы:
уровень образования (лучше удерживались на терапии пациенты с высшим образованием);
боли в пяточной области в дебюте заболевания (пациенты с болями раньше прекращали лечение);
клиническая форма (пациенты со спондилоартритом лучше удерживались на терапии);
припухлость плечевого сустава в дебюте заболевания (пациенты, имевшие припухлость, раньше прерывали таргетную терапию);
боль в шее в дебюте заболевания (соответствовала лучшему удержанию на лечении).
Описание выявленных предикторов представлено в таблице 4.

Следует особо отметить, что не было выявлено значимой связи между длительностью удержания на ГИБТ и числом предшествующих таргетных препаратов.
При анализе с поправкой на указанные показатели, а также на время начала лечения и число предшествовавших таргетных препаратов существенных различий между различными ГИБП по риску их отмены не выявлено (р=0,74) (рис. 2).
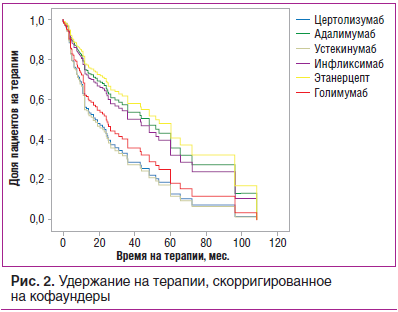
Год первого эпизода лечения, а также количество предшествующих эпизодов применения ГИБП не продемонстрировали значимого влияния на риск отмены препарата.
Обсуждение результатов
В результате анализа не было выявлено значимых различий в риске отмены между отдельными препаратами. Различия, выявленные в некорригированном анализе, вероятнее, были обусловлены исходными различиями между группами пациентов, получавших те или иные биологические препараты. Пациенты включались в исследование в разное время, выбор препарата был не случайным и часто основывался на клинических особенностях пациентов. Обращает на себя внимание отличие полученных результатов от данных больших псориатических регистров. Различия могут быть обусловлены тем, что в нашем регистре мы анализировали данные только по ПсА в отличие от большинства международных регистров, в которые включены пациенты с ПС и ПсА, и ГИБП назначались им преимущественно по дерматологическим показаниям. Есть основания полагать, что устекинумаб превосходит иФНО по влиянию на кожу [5], и этот факт мог оказать существенное влияние на удержание на терапии пациентов с выраженными кожными поражениями.
В нашем исследовании мы не выявили различий между длительностью удержания на лечении и числом предшествующих таргетных препаратов. Это отличает ПсА от ревматоидного артрита, при котором показана четкая связь между линией ГИБП и выживаемостью терапии. Литературные данные о связи между выживаемостью терапии ПсА и линией проводимой биологической терапии разноречивы. Так, в датском регистре DANBIO у пациентов с ПсА второй из назначенных иФНО демонстрировал меньшую выживаемость по сравнению с первым [3]. В сетевом регистре EuroSpa, объединившем данные 15 европейских регистров, при изучении времени удержания на терапии иФНО пациентов с ПсА и спондилоартритами была также показана отрицательная связь между выживаемостью ГИБТ и линией терапии [6].
Данные, касающиеся линии терапии и риска отмены биологических препаратов, полученные в нашем регистре, согласуются с опубликованными данными наблюдательного исследования G. Haberhauer et al. (2010) результатов замены ГИБП у пациентов с анкилозирующим спондилоартритом (АС), ПсА и ревматоидным артритом (РА). У пациентов с ПсА наблюдался лучший ответ на второй иФНО, чем у пациентов с АС и РА. Все пациенты с АС и все, кроме одного, пациенты с ПсА демонстрировали хороший ответ и на третий иФНО. Менее половины пациентов с РА продемонстрировали адекватный ответ на третий иФНО [7].
По данным МЕРА, одним из независимых предикторов отмены ГИБТ явилась клиническая форма заболевания. При этом наименьший риск отмены ассоциировался со спондилоартритической формой, а наибольший — с мутилирующей. Можно предположить, что пациенты с преобладанием аксиального вовлечения лучше отвечают на применяемые ГИБП. В пользу этого свидетельствует и позитивная связь с удержанием на лечении имеющейся у пациента боли в шейном отделе позвоночника в дебюте заболевания. Факторами неблагоприятного прогноза в отношении удержания на ГИБТ явились боли в пятке в дебюте заболевания, т. е. проявления энтезита.
МЕРА — это исследование реальной практики, имеющее высокую репрезентативность. В регистр включено более 90% пациентов с ПсА из Москвы, получающих биологическую терапию за счет средств федерального и регионального бюджетов, т. е. есть близкая к полной региональная выборка. Обращает на себя внимание разделение на ранее использовавшиеся и недавно включенные препараты, что может косвенно указывать на наличие невыявленного и, соответственно, нескорректированного кофаундера, возможно, связанного с изменениями в тактике лечения.
Выводы
В данном исследовании нами были выявлены факторы, которые ассоциированы с риском прекращения ГИБТ пациентов с ПсА в реальной клинической практике. К ним относятся: уровень образования, боли в пяточной области, припухлость плечевых суставов в дебюте заболевания, клиническая форма ПсА, боли в шее. Анализ выживаемости терапии ПсА и факторов, которые могут повлиять на удержание на терапии, может предоставить специалистам инструмент для индивидуализации ГИБТ. Дальнейшее изучение пациентов, включенных в МЕРА, исключительно важно для выявления возможностей улучшения оказания помощи пациентам с ПсА в условиях реальной клинической практики.
Информация с rmj.ru






