Введение
Вторичная глаукома, развивающаяся на почве афакии и артифакии, является одним из наиболее распространенных осложнений после выполненной в детском возрасте экстракции врожденной катаракты. Частота ее варьирует, по данным разных авторов, в широком диапазоне — от 6 до 58,7%, вероятно, из-за различий в дизайне исследований, вариабельности возраста ребенка на момент операции, объема выборки и продолжительности послеоперационного наблюдения [1–3].
В большинстве случаев глаукома после устранения катаракты является открытоугольной [1, 4]. Патогенез афакической глаукомы многофакторный и обусловлен сразу несколькими механизмами, которые объясняются следующими теориями [1, 4, 5]:
химическая теория — связана с повреждением дренажной системы медиаторами послеоперационного воспаления, токсичными метаболитами стекловидного тела и остаточных хрусталиковых масс. Возникает так называемый хронический трабекулит, при котором изменяется микроструктура трабекулярной сети, формируются периферические передние синехии;
механическая теория — ослабление тракций трабекулярной сети со стороны цинновых связок после удаления хрусталика, что приводит к снижению функции трабекулярной сети.
Кроме того, еще одной причиной повышения внутриглазного давления (ВГД) являются глюкокортикоиды, используемые в послеоперационный период после экстракции катаракты [4].
Глаукома после экстракции врожденной катаракты отличается особой коварностью и может возникнуть в любое время — и в ближайший послеоперационный период, и несколько лет спустя. Кроме того, это заболевание у таких детей может протекать бессимптомно, несмотря на высокое ВГД. Поскольку начало афакической глаукомы приходится на возраст старше 5–6 лет, многие признаки «детской» глаукомы, такие как слезотечение, блефароспазм, светобоязнь, увеличение диаметра роговицы, линии Гааба и отек роговицы, могут отсутствовать. Более «толстая» роговица на афакических глазах представляет потенциальный источник ошибки измерения ВГД в качестве критерия диагностики глаукомы. Таких детей сложно обследовать из-за сопротивления осмотру в силу возраста, плохой визуализации глазного дна вследствие нередкого помутнения капсул хрусталика или нистагма.
Рассматриваемой проблеме уже посвящено немало исследований, направленных на изучение распространенности, сроков возникновения, факторов риска развития и способов лечения вторичной афакической глаукомы у детей [1–3, 5–8]. Однако результаты таких исследований оказались достаточно противоречивыми из-за различий в критериях включения, продолжительности наблюдения, а также использованных авторами критериев диагностики глаукомы. Так, в некоторых исследованиях глаукому диагностировали уже при повышении ВГД [9, 10], в то время как другие авторы диагноз выставляли лишь в случаях, когда таким детям потребовалось лечение глаукомы [6, 11].
Цель исследования — анализ частоты возникновения глаукомы у детей, перенесших операцию экстракции врожденной катаракты, и определение факторов риска ее развития.
Материал и методы
Ретроспективное исследование было проведено среди детей в возрасте 10 лет и младше, которым в офтальмологическом отделении клиники ФГБОУ ВО СПбГПМУ Минздрава России была выполнена операция по поводу врожденной катаракты в период с 1 января 2006 г. по 31 декабря 2018 г. Пациенты были отобраны по операционным журналам, медицинским картам стационарных пациентов, а также доступным амбулаторным картам.
В исследование были включены дети с афакией или артифакией, перенесшие одностороннюю или двустороннюю экстракцию катаракты в возрасте младше 10 лет, с минимальным периодом наблюдения 4 года.
В исследование не были включены пациенты, перенесшие в анамнезе травму, увеит, длительное применение глюкокортикоидов, страдающие сахарным диабетом, а также с отсутствием сведений об их дальнейшем наблюдении.
Дети были разделены на 4 группы в зависимости от возраста на момент операции: 1-я включала тех, кто прооперирован в возрасте 90 дней и младше; 2-я — в возрасте от 91 до 365 дней; 3-я — от 1 года до 4 лет 11 мес. 29 дней; 4-я — от 5 до 10 лет.
У каждого пациента оценивали тип катаракты, ее латеральность, возраст на момент операции, наличие первичной или вторичной имплантации интраокулярной линзы (ИОЛ) и ее модель, особенности вмешательства и течения раннего послеоперационного периода. Оценке также подлежали клинико-анатомические особенности переднего отдела глаза (микрокорнеа, дистрофические изменения радужки, ригидность зрачка, микрокория, уплотнение и васкуляризация капсул хрусталика), особенности заднего отдела глазного яблока (первично-персистирующее стекловидное тело (ППСТ)), переднезадний размер глазного яблока до операции и в конце периода наблюдения, степень микрофтальма, сопутствующая экстраокулярная патология, максимальное ВГД в конце периода наблюдения. Кроме того, при возможности выполнения исследования оценивали центральную толщину роговицы, экскавацию диска зрительного нерва. У пациентов с диагностированной глаукомой фиксировали возраст на момент выявления глаукомы, ВГД, клиническую рефракцию, остроту зрения, способы компенсации ВГД.
Отмечены некоторые различия в хирургической технике экстракции катаракты в зависимости от возраста пациента, года операции, предпочтений хирурга. В подавляющем большинстве случаев выполняли факоаспирацию с первичной задней капсулотомией и частичной передней витрэктомией. При первичной имплантации ИОЛ фиксировали интракапсулярно, а задний капсулорексис выполняли через роговичный разрез или дополнительную склеротомию. Самым маленьким пациентам выполняли лимбальный парацентез, детям постарше — роговичный тоннельный разрез. Стандартное послеоперационное ведение включало субконъюнктивальные инъекции и инстилляции дексаметазона, инстилляции антибактериальных препаратов. При осложненном течении послеоперационного периода с фибриноидным синдромом применяли более интенсивный режим стероидов, а также субконъюнктивальное введение проурокиназы.
Так как данное исследование является ретроспективным, то режим последующих исследований и наблюдений был переменным.
До 2014 г. ВГД у детей раннего возраста измеряли преимущественно с помощью тонометра — индикатора ВГД (ИГД-03) или по Маклакову (зачастую — в наркозе). При этом отсутствие признаков глаукомного процесса (асимметричное усиление рефракции, отек и увеличение в размерах роговицы, увеличение переднезаднего размера глазного яблока) служило показанием к дальнейшему наблюдению таких детей до достижения ими возраста, позволяющего выполнить «традиционную» офтальмотонометрию по Маклакову. С 2014 г. ВГД измеряли уже с помощью тонометра Icare (Финляндия).
При верификации диагноза глаукомы мы руководствовались рекомендациями Всемирной ассоциации глаукомы [12] и диагностировали это заболевание при сочетании по крайней мере двух из следующих признаков:
-
ВГД (Ро) >21 мм рт. ст.;
-
прогрессирующее увеличение экскавации диска зрительного нерва или ее асимметрия ≥0,2;
-
изменения роговицы: увеличение диаметра >11 мм у новорожденных, >12 мм у детей до 1 года и >13 мм у детей старше 1 года; появление линий Гааба;
-
асимметричная прогрессирующая миопия в сочетании с увеличением переднезаднего отрезка глазного яблока;
-
изменения поля зрения, характерные для глаукомы.
Дата, когда эти признаки были впервые обнаружены при клиническом обследовании, была определена как дата манифестации глаукомы.
Статистический анализ полученных данных проведен с помощью программ Microsoft Excel и SPSS. Для описания количественных данных исследуемых групп было использовано среднее и стандартное отклонение, для качественных и порядковых данных — процентное выражение и общее количество наблюдений. Для анализа частоты исхода в зависимости от наличия фактора риска использовали критерий Пирсона. Различия считали статистически значимыми при уровне значимости р≤0,05.
Результаты и обсуждение
В исследование включены в общей сложности 206 детей (106 мальчиков и 100 девочек), перенесших операцию по поводу врожденной катаракты на 301 глазу, при этом в 43 (14,3%) случаях врожденная катаракта была наследственной. В 1-ю группу вошли 53 ребенка (77 глаз), средний возраст на момент операции составил 2,5±0,1 мес. Во 2-ю группу включен 51 ребенок (76 глаз), в 3-ю группу — 55 детей (80 глаз), средний возраст 33,9±1,7 меc., в 4-ю — 47 детей (68 глаз) старше 5 лет, средний возраст 7,0±0,2 года.
Характеристика пациентов и выполненных им вмешательств
Наиболее распространенным типом врожденного помутнения хрусталика явилась полная катаракта (табл. 1). У 95 (46,1%) детей катаракта была двусторонней.
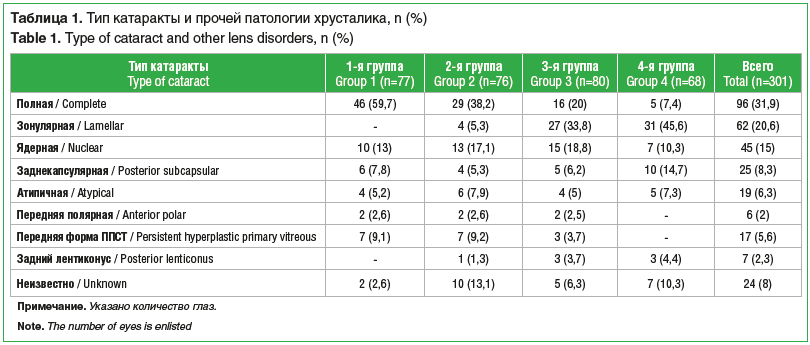
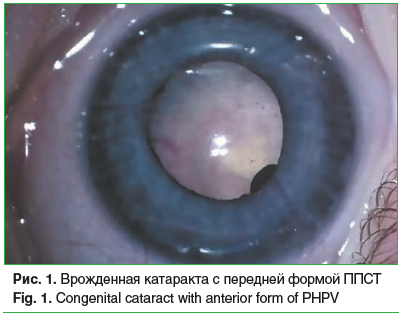
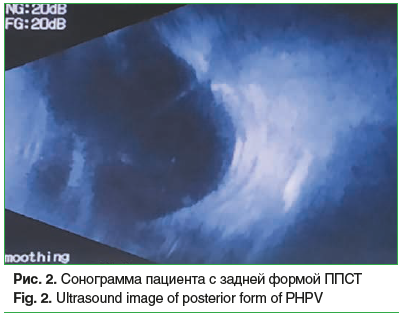
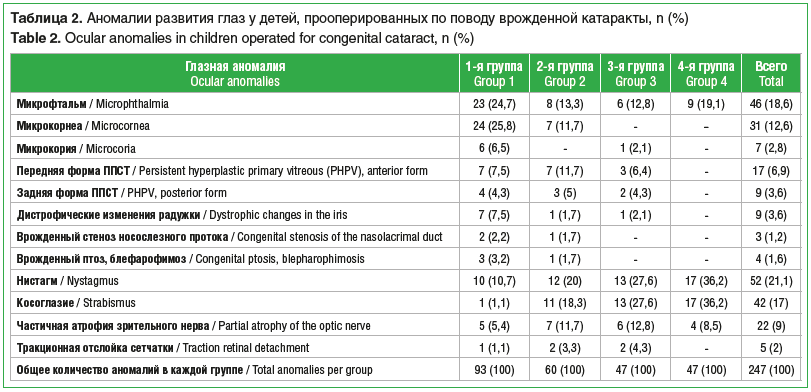
Сочетание врожденной катаракты с другой патологией органа зрения (микрофтальм, микрокорнеа, микрокория, первично-персистирующее стекловидное тело (рис. 1 и 2), врожденные пороки развития вспомогательного аппарата) отмечено на 163 (54,2%) глазах. Общее количество выявленных аномалий составило 247 (табл. 2).
Зарегистрирована следующая сопутствующая экстра-окулярная патология у 52 (25,2%) из 206 прооперированных детей: задержка психомоторного развития, задержка развития речи, синдром дефицита внимания с гиперактивностью (17 (32,7%)), органическое поражение центральной нервной системы, детский церебральный паралич (15 (28,9%)), синдром Дауна (5 (9,6%)), генетические синдромы (3 (5,8%)), галактоземия (2 (3,8%)), синдром Крузона, нейрофиброматоз, эпидермальная хондродисплазия (по 1 (1,9%) случаю).
В 1-й группе у 24 (45,3%) детей диагностирована двусторонняя катаракта. В этой группе всем детям выполнена факоаспирация с первичным задним капсулорексисом и передней витрэктомией без имплантации ИОЛ. В 61 (80%) случае выполнялся лимбальный разрез, в 16 (20%) — роговичный тоннельный разрез. За период 10-летнего наблюдения вторичная имплантация ИОЛ выполнена на 25 (32,5%) глазах. Кроме того, на 25 (32,5%) глазах потребовались другие дополнительные вмешательства, включая ИАГ-лазерную капсулотомию (табл. 3).
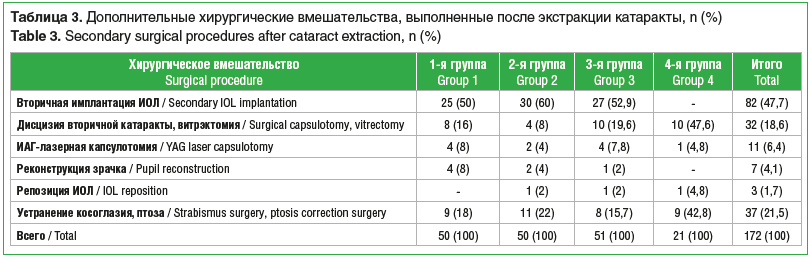
Как и в 1-й группе, во 2-й группе всем детям после факоаспирации выполнен первичный капсулорексис с передней витрэктомией, а проведение имплантации ИОЛ было отсрочено на 30 (39,5%) глазах. Дополнительные вмешательства, помимо вторичной имплантации, проведены еще на 20 глазах (табл. 3).
У детей из 3-й группы на 30 (37,5%) глазах выполнена факоаспирация с первичной имплантацией ИОЛ, на 27 (33,75%) глазах ИОЛ имплантирована отсроченно, а 23 (28,75%) глаза остались афакическими. Дополнительные хирургические вмешательства, включая вторичную имплантацию ИОЛ, выполнены на 51 глазу (табл. 3).
В 4-й группе всем детям выполнена факоаспирация с первичной имплантацией ИОЛ, первичный задний капсулорексис проведен на 47 (69,1%) глазах. При этом дополнительные вмешательства, включая лазерную капсулотомию, потребовались на 21 (30,9%) глазу (табл. 3).
Средний период наблюдения составил 8,8±0,2 года (диапазон от 4,2 до 15,6 года). Не было статистически значимых различий в продолжительности наблюдения и в количестве пациентов между группами (t=0,4–0,9; р>0,05).
Частота и факторы риска развития глаукомы
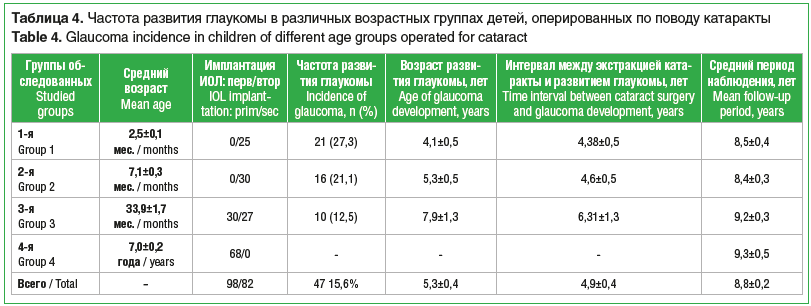
На момент последнего визита ни у одного пациента из 4-й группы не развилась глаукома. В то же время глаукома была диагностирована на 21 (27,3%) глазу у 14 пациентов в 1-й группе, на 16 (21,1%) глазах у 12 пациентов 2-й группы и на 10 (12,5%) глазах у 8 пациентов в 3-й группе. Интервал между экстракцией катаракты и манифестацией глаукомы составил в среднем 4,9±0,4 года (диапазон от 1,2 до 12 лет) (табл. 4).
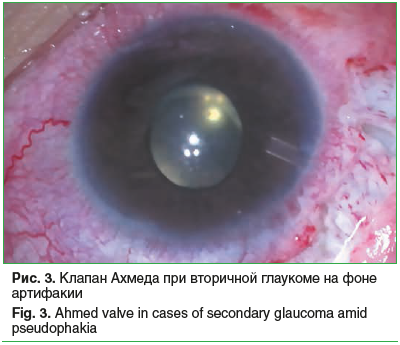
Во всех случаях лечение афакической глаукомы начинали с медикаментозной терапии. Однако из-за прогрессирующего буфтальма или глаукомной экскавации в сочетании с неконтролируемым ВГД впоследствии потребовалось хирургическое вмешательство. На 6 глазах проведена синусотрабекулотомия, при этом на 4 глазах удалось добиться компенсации глаукомы, в 2 случаях для купирования офтальмогипертензии впоследствии дополнительно имплантирован клапан Ахмеда. Еще на 13 глазах имплантация клапана Ахмеда послужила первой гипотензивной операцией [13, 14] (рис. 3). На 3 глазах трабекулэктомию по показаниям сочетали с дополнительной витрэктомией, формированием зрачка, дисцизией вторичной катаракты. В остальных случаях (27 (57,4%) глаз) глаукома компенсирована медикаментозно.
Безусловно, интерес представляет также сравнительный анализ значимости различных предполагаемых факторов риска развития вторичной глаукомы после оперативного лечения врожденной катаракты у детей.
Как видно из таблицы 5, статистически значимыми факторами риска развития глаукомы оказались экстракция катаракты, выполненная в возрасте до 1 года, микрокорнеа, дополнительные внутриглазные хирургические вмешательства (главным образом, дисцизия вторичной катаракты), а также отсутствие имплантации ИОЛ (афакия).

Заключение
С широким внедрением первичного заднего капсулорексиса и передней витрэктомии в практику хирургического лечения врожденной катаракты значимо снизилась частота развития закрытоугольной глаукомы вследствие зрачкового блока [1, 15]. И в настоящее время большинство случаев глаукомы после экстракции катаракты у детей являются поздней открытоугольной глаукомой, которая может не выявляться в течение многих лет после операции. Поэтому наблюдение в течение всей жизни детей, оперированных по поводу катаракты, особенно в раннем возрасте, имеет решающее значение.
Медикаментозная терапия может быть достаточной для стабилизации ВГД и компенсации глаукомы у некоторых пациентов. Тем не менее в подавляющем большинстве случаев таким детям все же требуется хирургическое вмешательство. Плохой визуальный результат лечения афакической глаукомы обусловлен многими факторами, включая амблиопию, нистагм, а также позднюю диагностику и несвоевременно выполненное хирургическое вмешательство.
В связи с этим в комплекс диагностических мероприятий при амбулаторном наблюдении пациентов после экстракции врожденной катаракты необходимо включать тонометрию и измерение переднезадней оси глазного яблока, чтобы обнаружить глаукому на самых ранних стадиях.
Сведения об авторах:
Садовникова Наталия Николаевна — к.м.н., заведущая офтальмологическим отделением клиники ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-8217-4594.
Бржеский Владимир Всеволодович — д.м.н., профессор, заведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000- 0001-7361-0270.
Зерцалова Марина Андреевна — ассистент кафедры офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2.
Баранов Андрей Юрьевич — ассистент кафедры офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-6024-4635.
Контактная информация: Садовникова Наталия Николаевна, e-mail: natasha.sadov@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.06.2022.
Поступила после рецензирования 29.06.2022.
Принята в печать 25.07.2022.
About the authors:
Natalia N. Sadovnikova — C. Sc. (Med.), Head of the Ophthalmological Department of the Clinic, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-8217-4594.
Vladimir V. Brzesky — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000- 0001-7361-0270.
Marina A. Zertsalova — assistant of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation.
Andrey Yu. Baranov — assistant of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-6024-4635.
Contact information: Natalia N. Sadovnikova, e-mail: natasha.sadov@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 03.06.2022.
Revised 29.06.2022.
Accepted 25.07.2022.
Информация с rmj.ru





