Ключевые слова: пневмония внебольничная, отек легких, бронхообструктивный синдром, суперинфекция, бронхоэктатическая болезнь, реабилитация, прогноз.
Для цитирования: Барденикова С.И., Зайцева О.В., Снитко С.Ю., Довгун О.Б. Внебольничная пневмония у подростка с впервые выявленными бронхоэктазами // РМЖ. 2018. №5(II). С. 104-112
Bardenikova S.I.1, Zaytseva O.V.1, Snitko S.Yu.1, Dovgun O.B.2
1 A. I. Yevdokimov Moscow State University of Medicine and Dentistry
2 Children’s City Clinical Hospital of St. Vladimir, Moscow
The article presents a clinical case of bronchiectasis diagnosed for the first time with pneumonia in a boy at the age of 13 years. The severe course of the disease with severe respiratory insufficiency, subcutaneous emphysema, infectious-toxic cardiomyopathy, pulmonary edema, was accompanied by an x-ray picture of multi-focal (multilobar, bilateral) pulmonary lesion and did not correspond to community-acquired infection and the safe premorbid background of the child. Multispiral computed tomography, performed when local symptomatology in the lungs after resolving acute inflammation returned, revealed structural changes in the bronchial tree — cylindrical bronchiectasis. With the resolution of pneumonia, the boy showed a clinical picture of bronchial obstructive syndrome, as a result, probably, of intrahospital superinfection with atypical pathogens (mycoplasmas, pneumocysts) against the background of a decrease in immune resistance. The article notes that the frequent cause of bronchial obstructive syndrome in patients without atopic heredity is atypical infections occurring in the form of obstructive bronchitis. The article discusses the following issues: congenital genesis of multiple bronchiectasis, possible causes of their late verification, the role of the severe course of the present disease with the successive change of infectious agents, algorithms for treating the patient with the importance of active drainage and anti-relapse antibacterial therapy. Issues for discussion are the potential risks of exacerbation of the disease, rational ways of rehabilitation, including active immunization with bacterial pneumococcal vaccines and hemophilic rod, palliative surgical intervention — capable of improving the prognosis of the disease and the quality of life of a teenager with bronchiectatic disease.
Key words: community-acquired pneumonia, pulmonary edema, broncho-obstructive syndrome, superinfection, bronchiectatic disease, rehabilitation, prognosis.
For citation: Bardenikova S.I., Zaytseva O.V., Snitko S.Yu., Dovgun O.B. Community-acquired pneumonia in a teenager with the first revealed bronchiectasis // RMJ. 2018. № 5(II). P.104 –112.
В статье представлен клинический случай бронхоэктатической болезни у мальчика, выявленной впервые в 13 лет при пневмонии.
 В декабре 2016 г., в эпидемиологический сезон подъема заболеваемости вирусными инфекциями в ДГКБ св. Владимира поступил мальчик 13 лет c диагнозом «Пневмония внебольничная».
В декабре 2016 г., в эпидемиологический сезон подъема заболеваемости вирусными инфекциями в ДГКБ св. Владимира поступил мальчик 13 лет c диагнозом «Пневмония внебольничная».
Состояние ребенка при поступлении тяжелое, положение в постели вынужденное, выражены симптомы интоксикации (лихорадит — 38,6 °С, вялый, бледный), грубый влажный кашель, дистанционные хрипы, одышка смешанного характера (ЧД — 36/мин) с участием в акте дыхания вспомогательной мускулатуры. При осмотре в нижних отделах легких справа и слева выявлено притупление перкуторного звука, здесь же дыхание ослаблено, выслушиваются обильные влажные мелкопузырчатые хрипы. Границы относительной сердечной тупости соответствовали возрастной норме, выражена тахикардия (120 уд./мин). Заболевание наступило остро (19.12.2016): поднялась температура (40 °С), появился сухой кашель. На 3-и сут болезни ребенок осмотрен участковым врачом, начат курс антибактериальной терапии (амоксициллин 375 мг 3 р./сут), проводилось противовирусное (имидазолилэтанамид пентандиовой кислоты 1 капс. — 60 мг 1 р./сут), симптоматическое лечение. Несмотря на выполнение рекомендаций врача, на 6-е сут у ребенка сохранялась высокая лихорадка, кашель стал мучительным, навязчивым, появились одышка и боли в грудной клетке при дыхании. Бригадой скорой медицинской помощи мальчик доставлен в ДГКБ св. Владимира.
Ранний анамнез ребенка и наследственность не отягощены, на диспансерном учете у специалистов мальчик не состоит. В раннем детстве перенес скарлатину, ОРВИ болел 1 раз в году. С весны 2016 г. наблюдается кардиологом по поводу вегетососудистой дистонии (ваготонический тип). Мальчик растет в семье, ведущей здоровый образ жизни, активно занимается спортом.
При обследовании в отделении в клиническом анализе крови выявлен высокий нейтрофильный (69%) лейкоцитоз (14,9×109) с выраженным палочкоядерным сдвигом (20%), ускоренная СОЭ (43 мм/ч). В анализе мочи патологии не обнаружено. На рентгенограмме органов грудной клетки резко усилен легочный рисунок, корни широкие, не структурные, выявлены множественные очаговые тени в обоих легких, преимущественно в средних медиальных отделах. С учетом имеющихся данных выставлен клинический диагноз: Пневмония внебольничная, очаговая, двусторонняя, ДН 2–3 ст.; ОРВИ, течение (7-й день болезни). Назначена комбинированная антибактериальная терапия (внутривенно — цефотаксим 1 г 3 р./сут и амикацин 200 мг 2 р./сут), противовирусное и симптоматическое лечение продолжено. С целью дезинтоксикации, улучшения бронхиальной проходимости и реологии крови подключена инфузионная терапия в объеме 600 мл (аминофиллин, гепарин натрия, преднизолон) на фоне постоянной подачи увлажненного кислорода.
Клинико-рентгенологические особенности данной «домашней» пневмонии вызывали вопрос о ее вероятной этиологии. Известно, что внебольничные пневмонии у социализированных детей вызываются преимущественно пневмококком (Streptococcus pneumoniae) и имеют очаговый характер [1–6]. Пневмония у данного больного была многоочаговой (многодолевой, билатеральной), и тяжесть течения изначально не соответствовала рентгенологическим данным и преморбидному фону. Тяжесть пневмонии обычно зависит от вида возбудителя и массивности инфекции, а также от состояния иммунитета заболевшего и своевременности начала лечения. Тяжесть «домашней» пневмонии у нашего больного могла быть связана с инфицированием особо агрессивными возбудителями (штаммы пневмококка 1, 3, 7, 8) или с их низкой чувствительностью к стартовому антибиотику (амоксициллину) [2–8]. Этиологическая принадлежность пневмонии в нашем случае может лишь обсуждаться в ходе теоретической дискуссии, т. к. микроб-возбудитель не был выделен. Клинико-рентгенологические проявления внебольничной пневмонии неспецифичны и не могут однозначно указывать на этиологию заболевания. У детей с нормальной иммунной резистентностью, без преморбидной патологии очаговые пневмонии (пневмококковые преимущественно) протекают благоприятно, не дают осложнений и хорошо поддаются лечению при своевременно начатой и правильно подобранной антибактериальной терапии. Наш пациент на момент заболевания не имел в анамнезе факторов риска (хронических и рецидивирующих заболеваний легких и ЛОР-органов, недавних курсов антибиотиков), антибактериальная терапия была начата своевременно (с 3 сут от начала ОРВИ) и подобрана адекватно (в соответствии с требованиями современных стандартов лечения в РФ и международных рекомендаций) [9–11]. Несоответствие тяжести и распространенности очагов воспаления в легких, эпидемиологии и предполагаемой (пневмококковой) этиологии пневмонии вызвало настороженность лечащих врачей [1, 3, 12]. В этой связи эмпирически расширен объем стартовой антибактериальной терапии: назначена комбинация антибиотиков, действующих на грамположительную и грамотрицательную флору.
Однако проводимая в отделении комплексная терапия не дала ожидаемого эффекта: на 8-е сут болезни у ребенок сохранялась высокая температура тела (40 °С), беспокоил навязчивый кашель, появилось головокружение, наросла тахикардия, отмечалась бледность кожных покровов (как результат централизации кровообращения), сохранялась боль в груди (связанная с нехваткой кислорода для питания сердечной и межреберных мышц). Ребенок спал и бодрствовал только сидя (что облегчало участие вспомогательной мускулатуры в акте дыхания), цианоз губ и одышка (ЧД 35–37/мин) наблюдались в покое (особенно в положении лежа), после незначительных усилий дыхание восстанавливалось с трудом. Увеличились гипоксемия (рО2 – 89%), кислородозависимость, появилась пенистая розовая мокрота. С клиникой отека легких ребенок переведен в ОРИТ.
Известно, что тяжесть дыхательной недостаточности при пневмонии зависит от объема паренхимы легкого, вовлеченного в воспаление и выключенного из процесса газообмена. При отеке легких нарушения газообмена усугубляются пропотеванием жидкой части крови из легочных капилляров в интерстициальное пространство и далее в воздухсодержащие дыхательные пути. Патогенетические механизмы отека легких при тяжелой пневмонии многообразны, действуют комплексно и одновременно. Так, в результате инфекционно-токсического и гипоксического поражения в патологический процесс вовлекается миокард, что приводит к повышению гидростатического давления в микрососудах малого круга кровообращения (кардиогенный отек легких); при этом у больного часто регистрируется повышение артериального давления (АД). Существенную роль в патогенезе отека легких играет нарушение белкового состава крови (гипопротеинемия), что сопровождается снижением онкотического давления в капиллярном русле и выходом жидкости из сосуда во внеклеточное (интерстициальное) пространство. Наконец, при тяжелой пневмонии эндотоксины патогенных бактерий непосредственно действуют на альвеолярно-капиллярную мембрану, повышая ее проницаемость и способствуя выходу жидкости во внесосудистое пространство (некардиогенный отек легких). В дифференциальной диагностике ведущих причин отека легких лабораторные данные малоинформативны, показательны резкие сдвиги в газовом составе артериальной крови (ГАК) и кислотно-щелочном состоянии (КОС) (метаболический ацидоз и гипоксемия). Кардиогенная природа отека легких подтверждается данными ЭКГ (тахикардия, аритмии, изменение конечной части комплекса QT в виде снижения сегмента ST и повышения амплитуды зубца Р с его деформацией) как проявление ишемии миокарда и острой перегрузки предсердий, ЭХО-КГ (снижение фракции выброса сердца, утолщение стенок сердечных камер, патология клапанов, отек папиллярных мышц и др.), рентгенографией грудной клетки (увеличение размеров сердца и его полостей, визуальные симптомы интерстициального отека легких с симметричным усилением легочного рисунка за счет отечной инфильтрации периваскулярной и перибронхиальной межуточной ткани, особенно выраженного в прикорневых и базальных отделах, линии Керли, уплотнения пo ходу междолевой щели) [13, 14].
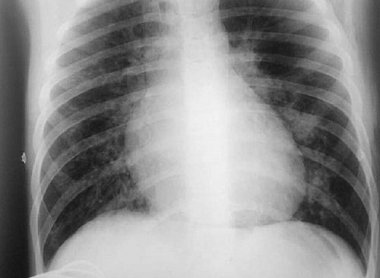
Обследование в ОРИТ выявило респираторный ацидоз вследствие альвеолярной гиповентиляции (рН — 7,34, SB — 23 ммоль/л, ВЕ — 2,9 ммоль/л, рО2 – 59 мм рт. ст., рСО2 – 50 мм рт. ст.). В клиническом анализе крови воспалительные изменения сохранялись: увеличились лейкоцитоз (19,3×10 9) и содержание сегментоядерных нейтрофилов (81%), снизилась СОЭ (22 мм/ч). Как свидетельство метаболических нарушений обнаружены отклонения в биохимическом анализе крови: низкий уровень альбуминов — 24,4% (возрастная норма — 38–54%) при нормальном содержании общего белка 64,9 г/л (норма — 56–77 г/л), активность ферментов не изменилась: щелочная фосфатаза — 131,3 МЕ/л (норма — 155–500 МЕ/л) и лактатдегидрогеназа — 273 Ед/л (норма — 115–300 Ед/л), констатированы повышение показателя индикатора неспецифического воспаления — С-реактивного белка (СРБ) — 68,5 мг/л (норма — менее 5 мг/л), небольшое снижение содержания регулятора жидкости между вне- и внутриклеточным пространством — натрия — 133,8 ммоль/л (норма — 136–145 ммоль/л) (возможно, ввиду повышенной продукции антидиуретического гормона в остром периоде пневмонии). В анализе мочи патологических изменений не выявлено. На рентгенограмме легких (рис. 1) очаги инфильтрации уменьшились, но обнаружены признаки подкожной эмфиземы (воздух в мягких тканях верхних отделов грудной клетки с обеих сторон); выявлено увеличение тени средостения в обе стороны за счет расширения сердца. На ЭКГ зарегистрированы синусовая брадикардия (50–68 уд./мин), синдром ранней реполяризации желудочков. На ЭХО-КГ обнаружены признаки дилатации левого желудочка, отек папиллярных мышц, нарушение гемодинамики по гиперкинетическому типу. Общая кардиологическая картина у ребенка с отеком легких на фоне течения пневмонии расценена кардиологом как инфекционно-токсическая кардиомиопатия, НК 0 степени. Следует отметить, что в период пребывания в ОРИТ у мальчика зафиксированы подъемы АД (максимально до 185/95 мм рт. ст.), в этой связи ребенку проведено суточное мониторирование АД, и верифицирована артериальная гипертензия 1 степени. В соответствии с диагнозом в лечении увеличена парентеральная доза глюкокортикостероидов (преднизолон 180 мг/сут), добавлена гипотензивная терапия (эналаприл 0,1 мг утром) [1, 2, 5, 9, 13].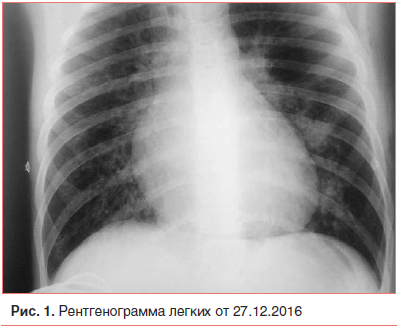
В ОРИТ был проведен посев мокроты, обнаружен рост колоний Staphylococcus aureus в титре 10 3 КОЕ/мл (норма — 10 4–10 5 КОЕ/мл).
Обнаружение в посеве мокроты S. aureus (хотя и в низком титре обсемененности биологического материала) вызывало настороженность и одновременно сомнение в его этиологической значимости для данной пневмонии. Необходимо отметить, что бактериологическое исследование проводилось в ОРИТ на фоне массивной антибактериальной терапии и было значительно отсрочено от начала заболевания (9-е сут болезни). Рентгенологическая картина также не соответствовала характеру стафилококковых поражений легких, для которых типичны крупные «сливные» очаги инфильтрации, склонные к деструкции. Таким образом, несмотря на то, что S. aureus относится к возбудителям высокого уровня приоритетности в отношении госпитальных пневмоний (вместе с другими пневмотропными патогенами: Кlebsiella pneumoniae, Streptococcus pneumoniae, Haemophilus influenzae) и внебольничных пневмоний в сезон подъема заболеваемости гриппом, высев его в таком титре из мокроты пациента в ОРИТ в данный момент течения (внебольничного) заболевания был не актуален, а скорее имел значение контаминантной флоры и в итоге не повлиял на концепцию антибактериальной терапии [1–4, 12].
В ОРИТ мальчик находился 4 сут. На фоне терапии состояние ребенка улучшилось, купировались явления дыхательной и сердечно-сосудистой недостаточности. На рентгенограмме легких от 31.12.2016 (рис. 2): инфильтрация легочной ткани уменьшилась; подкожная эмфизема в области мягких тканей шеи прослеживалась только слева; сохранялось умеренное расширение тени сердца, преимущественно вправо.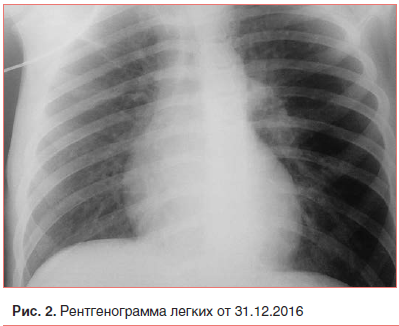
Дальнейшее лечение мальчика продолжено в пульмонологическом отделении. Комплексная терапия дала положительный эффект: нормализовалась температура, постепенно исчезли симптомы интоксикации и влажные хрипы в нижних отделах легких, отмечался редкий продуктивный кашель. По данным контрольной рентгенографии органов грудной клетки от 09.01.2017 (рис. 3) воспалительные изменения в легких с обеих сторон разрешились. На ЭХО-КГ, выполненной в динамике, патологических отклонений не выявлено. Мальчик проконсультирован офтальмологом: сосуды глазного дна не изменены. В анализах крови (клиническом и биохимическом) и мочи патологических изменений не обнаружено. Таким образом, к 20-му дню болезни воспаление в легких и сердечные изменения полностью купировались, ребенок готовился к выписке. Клинический диагноз, сформулированный к выписке: Пневмония внебольничная, очаговая, двусторонняя, тяжелая, ДН 2–3 ст., острое течение. Отек легких. Подкожная эмфизема. Инфекционно-токсическая кардиомиопатия, НК 0 ст. Артериальная гипертензия 1 ст.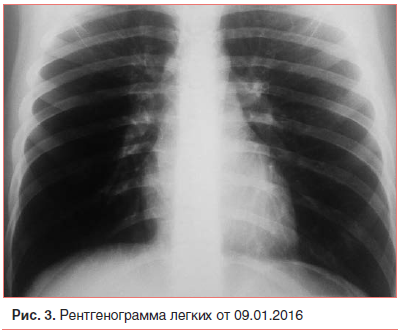
Однако на 21-й день болезни без видимых катаральных явлений и лихорадки у ребенка впервые появилась клиническая картина бронхообструктивного синдрома: рассеянные сухие свистящие и немногочисленные влажные (среднепузырчатые) хрипы в нижних отделах легких с обеих сторон. Самочувствие мальчика не страдало, но беспокоили навязчивый малопродуктивный кашель и периодическая смешанная одышка при физической нагрузке, рО2 – 89%. Исследование функции внешнего дыхания (ФВД) от 10.01.2017 (рис. 4) выявило генерализованную обструкцию бронхов 1 степени.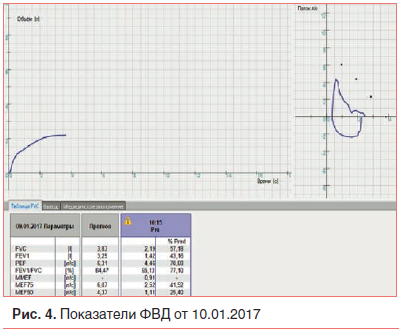
Известно, что в процессе разрешения пневмонии (бронхопневмонии) у ряда детей выявляются нарушения вентиляции по обструктивному типу, которые благополучно исчезают через 1–2 мес. на противоастматической терапии [1–3, 12]. Следует отметить, что частой причиной появления бронхообструктивного синдрома у пациентов без атопической наследственности являются атипичные инфекции, протекающие в форме обструктивного бронхита [2, 3, 15]. К атипичным патогенам относят облигатные внутриклеточные грамотрицательные микроорганизмы: Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila. Имеет значение и Pneumocystis carinii — классический оппортунистический внеклеточный патоген со строгим тропизмом к легочной ткани, вызывающий заболевания у людей, имеющих иммунодефицитный статус (так называемый «маркер» сниженного иммунитета) [1–3, 12, 15, 16]. Этот возбудитель, недавно переименованный в Pneumocystis jirovecii, относится к почкующимся дрожжеподобным грибам-бластомицетам (однако современный молекулярно-биологический и молекулярно-генетический анализ не может окончательно определить их видовую принадлежность). С учетом длительности пребывания нашего больного в госпитальных условиях (ввиду тяжести основного заболевания) с последовательной сменой отделений (терапевтическое, реанимационное, пульмонологическое) велика эпидемиологическая вероятность как реинфицирования, так и суперинфицирования пациента вне- или внутрибольничными микроорганизмами, которые ранее у него не определялись [17]. Контаминации госпитальными инфектами способствуют внешняя среда, инвазивные процедуры, носительство бактерий персоналом, а также воздействие на иммунную систему активной медикаментозной терапии (healthcare-associated инфекции).
Для уточнения этиологии бронхообструктивного синдрома проведено серологическое тестирование: взят анализ крови на антитела к атипичным патогенам. Обнаружены: диагностические титры антител к Mycoplasma pneumoniae — IgM 1:800, IgG 1:200, Pneumocystis jirovecii (carinii) — IgM 1:345, IgG 1:325, антител к Chlamydophila pneumoniae не выявлено.
Следует заметить, что антитела класса IgM при респираторных микоплазмозах появляются уже в конце 1-й нед. болезни (циркулируют до 6–7 нед. и более), IgG-антитела обнаруживаются в крови на 3-й нед. заболевания и способны сохраняться длительно на низком уровне, отражая следовую реакцию после перенесенной инфекции. По литературным данным, заболеваемость респираторным микоплазмозом регистрируется (особенно в осенне-зимний период) у 9,8% детей 1-го года жизни и растет до 61,6% у детей школьного возраста, кроме того, во время эпидемиологических подъемов в популяции высока распространенность инаппарантных инфекций, встречается носительство M. pneumoniae [15, 16, 18]. Продукция антител у больных пневмоцистозом аналогично наблюдается в те же сроки, причем как системная (IgM, IgG, IgА), так и местная. Однако формирующийся иммунитет нестойкий, типоспецифичный, поэтому возможны рецидивы инфекции при повторном заражении возбудителем с другим генотипом. Таким образом, антителогенез при первичном инфицировании при пневмоцистозе не обладает протективным действием [18, 19]. Роль Pneumocystis jirovecii (условно-патогенного микроорганизма с воздушно-капельным механизмом заражения) в патологическом легочном процессе у нашего пациента неочевидна и может быть предметом дискуссии. Инфицирование могло быть острым (внутрибольничным), т. к. у пациента обнаружены IgM-антитела, или, возможно, произошла активация латентной пневмоцистной инфекции в условиях снижения иммунной резистентности (клеточного и гуморального иммунитета) на фоне тяжелой пневмонии (вторичная иммунологическая недостаточность). Нельзя исключать возможность иммуносупрессивного эффекта системных кортикостероидов, которые в значительных дозах вводились пациенту парентерально в начале заболевания ввиду тяжести его состояния, что могло вызвать подавление фагоцитарной и цитолитической активности альвеолярных макрофагов, призванных «убивать» пневмоцисты. В специальной литературе имеются данные о том, что 10–75% здорового населения являются носителями пневмоцист [1, 2, 19], 70% детей к 4 годам уже инфицированы Pneumocystis jirovecii, а 56% пациентов с хроническими неспецифическими заболеваниями легких имеют высокую инфицированность пневмоцистозом [19]. Высказывается мнение, что после заражения Pneumocystis jirovecii взаимоотношения возбудителя (обладающего крайне низкой вирулентностью) и иммунной системы могут длительно оставаться на субклиническом уровне. Однако компрометация иммунной системы стимулирует быстрый рост численности пневмоцист, в результате чего происходит клиническая манифестация заболевания, тяжесть которой в значительной степени определяется наличием альвеолокапиллярного блока. Практический интерес представляет обнаруженный в процессе клинических исследований факт, доказывающий тесную (структурную) связь и ко-патогенность Pneumocystis jirovecii с бактериями и коронавирусами [19]. Кроме того, исследованиями показано, что у больных с острыми и хроническими неспецифическими заболеваниями легких, инфицированных P. jirovecii (carinii), наблюдается микробная колонизация дыхательных путей ассоциациями кокковой флоры с нозокомиальными штаммами микроорганизмов, устойчивыми к антибиотикам широкого спектра действия. Таким образом, учитывая клинико-анамнестические данные (отсутствие у ребенка преморбидного фона, выздоровление через 3 нед. после острого заболевания дыхательной системы, подтвержденное лабораторно-инструментальными исследованиями), мы расценили выявленную микст-инфекцию (микоплазменно-пневмоцистную), имеющую клинику обструктивного бронхита, как «свежее», внутрибольничное инфицирование.
В продолжение дифференциальной диагностики бронхообструктивного синдрома на фоне тяжелого течения пневмонии у ребенка с длительным кашлем исключена гастроэзофагеальная рефлюксная болезнь (ГЭРБ). Рентгеноскопия пищевода и желудка с барием выявила нормальную проходимость пищевода и своевременную эвакуацию из желудка. Таким образом, клинический диагноз расширен: Пневмония внебольничная, очаговая, двусторонняя, тяжелая, ДН 2–3 ст., острое течение. Отек легких. Подкожная эмфизема. Инфекционно-токсическая кардиомиопатия, НК 0 ст. Артериальная гипертензия 1 ст. Cуперинфекция внутрибольничная (микоплазменная, пневмоцистная): обструктивный бронхит, ДН 0–1 ст. В соответствии с атипичной этиологией микст-инфекции ребенку начата этиотропная терапия: в лечение введены макролиды (кларитромицин суспензия 250 мг / 5 мл 2 р./сут) и сульфаниламиды (ко-тримоксазол 480 мг 2 р./сут), по поводу бронхообструкции добавлены (через небулайзер): бронхолитик (сальбутамол 2,0 мл 3 р./сут) и глюкокортикоид (будесонид 500 мкг 2 р./сут) [2, 5, 19–23].
К 4-му дню течения бронхообструкции (25-й день болезни), несмотря на активную антибактериальную терапию и средства, восстанавливающие проходимость бронхов, у мальчика упорно сохранялись малопродуктивный кашель и одышка смешанного характера при физической нагрузке. Аускультация легких вновь обнаружила локальное ослабление дыхания, мелко- и среднепузырчатые звучные влажные хрипы справа в нижних отделах, «трескучие», с «металлическим» оттенком (описываемые в литературе, как «скрип несмазанной телеги»). Однако очередное рентгенологическое исследование органов грудной клетки (рис. 5) очаговых и инфильтративных теней в легких не выявило. Клинический анализ крови оставался «спокойным»: лейкоциты — 6,4×10 9, нейтрофилы сегментоядерные — 46%, палочкоядерные — 0%, эозинофилы — 5%, СОЭ — 10 мм/ч. Анализ газового состава крови выявил гипоксемию (рН — 7,35, SB — 24 ммоль/л, ВЕ — 2,0 ммоль/л, рО2 – 72 мм рт. ст., рСО2 – 49 мм рт. ст.). Ввиду усиления дыхательной недостаточности при физической нагрузке дренажная
терапия была ограничена ребенку массажем грудной клетки и дозированной лечебной дыхательной гимнастикой.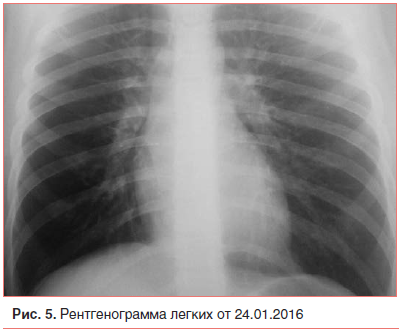
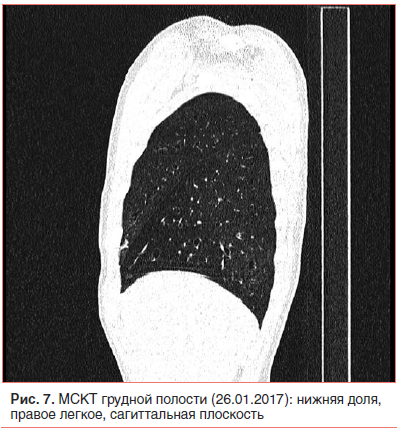
Неадекватная тяжесть течения внебольничной пневмонии на фоне рационально подобранной терапии и возвращение стойкой локальной симптоматики после разрешения легочного процесса явились показанием к проведению КТ органов грудной клетки [1, 2, 5, 24, 25]. Мультиспиральная компьютерная томография (МСКТ) грудной полости с внутривенным контрастным усилением (26.01.17) показала, что инфильтративных изменений в легких нет; бронхи прослеживаются до уровня субсегментарных, стенки бронхов неравномерно утолщены, просветы расширены с формированием множественных цилиндрических бронхоэктазов во всех отделах; структуры средостения дифференцированы правильно; выявляются множественные не увеличенные в размере лимфатические узлы средостения всех групп (рис. 6–8).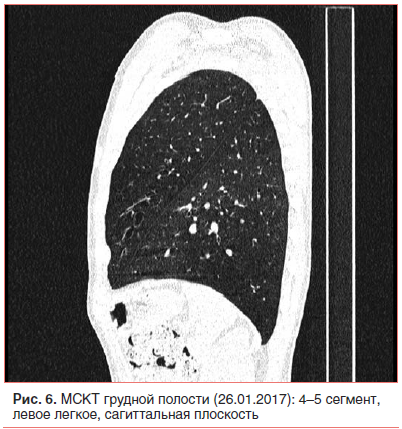
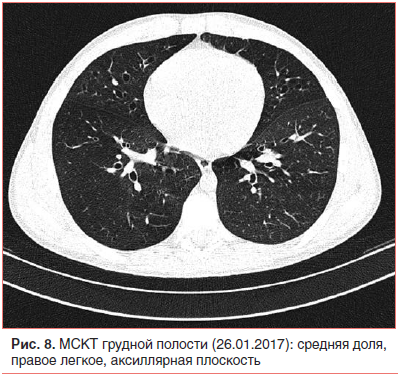
Бронхоэктатическая болезнь — врожденное (или приобретенное) заболевание, характеризующееся хроническим нагноительным процессом в измененных (расширенных, деформированных) и функционально неполноценных бронхах; следствием воспаления являются утолщение бронхиальной стенки, бактериальная колонизация слизистой и деструкция окружающих тканей [24–32]. Бронхоэктатические поражения наиболее часто локализуются в нижних долях (чаще слева), язычковых сегментах и средней доле правого легкого; причем двусторонние бронхоэктазы встречаются в 3 раза реже, чем односторонние. Классификация бронхоэктазов многообразна: по этиологии различают врожденные или приобретенные, первичные или вторичные; по распространенности — локализованные или диффузные; по форме — цилиндрические, веретенообразные, мешотчатые, кистоподобные, смешанные; клиническое течение может быть интермиттирующим или осложненным, различают фазы обострения или ремиссии. У одного больного могут встречаться различные типы бронхоэктазов, в этой связи существенное значение имеют распространенность и локализация изменений в конкретных бронхолегочных сегментах. Поскольку подавляющее большинство бронхоэктазов формируется в детском возрасте, считают, что повреждение бронхов возникает на фоне их врожденных структурных дефектов. Пусковым фактором для образования бронхоэктазов является воспаление дыхательных путей (с нарушением бронхиальной проходимости, длительным кашлем), которое на фоне уже имеющихся нарушений строения стенки бронха (дефект хрящевого остова) приводит к расширению (греч. еktasis — растягивание) и инфицированию бронхов («инфицированная бронхоэктазия») [29]. В последние годы в патогенезе бронхоэктазов уделяют внимание нарушению эластичности тканей легкого («эластическое перенапряжение») при глубоком поражении паренхимы и интерстиция, при ателектазах. Высказывается предположение о том, что при острых инфекциях (корь, коклюш, грипп) и инородных телах в бронхах бронхоэктазы у детей могут развиваться крайне быстро (в течение 1–2 сут) [27, 30, 32, 33].
В связи с сохраняющейся, несмотря на активную противовоспалительную и дренажную терапию, локализованной симптоматикой в нижней доле справа мальчику проведена лечебно-диагностическая трахеобронхоскопия (43-й день болезни), в ходе которой выявлен двухсторонний гнойный нижнедолевой деформирующий эндобронхит [34]. Ввиду скопления в дистальных отделах густой, вязкой мокроты выполнен лечебный лаваж бронхов. В посеве мокроты на флору с определением чувствительности к антибиотикам, взятом во время процедуры лаважа, выделен Streptococcus viridans в титре 10 2 КОЕ/мл (норма — 10 4–10 5 КОЕ/мл), чувствительный к ванкомицину, линезолиду, цефепиму, цефотаксиму, ципрофлоксацину, устойчивый к амикацину.
Заметим, что Streptococcus viridans — гетерогенная группа стрептококков, которая широко представлена (30–50%) в микрофлоре ротоглотки (так называемые «пищевые» виды). S. viridans относится к группе комменсантных малопатогенных бактерий. Поэтому клиническая интерпретация роли S. viridans, выделенного в бактериологическом посеве мокроты у нашего больного с бронхоэктазией при гнойном эндобронхите, неоднозначна. Известно, что S. viridans нередко обнаруживается в составе смешанной флоры при гнойных процессах, но практически не бывает колонизирующим видом бактерий при хронических заболеваниях нижних дыхательных путей. Заметим, что не исключается возможность контаминации (загрязнения) материала для биологического исследования представителем симбиотической микрофлоры (S. viridans), вегетирующей в ротоглотке. Однако обнаружение лишь нормальной микрофлоры отнюдь не означает отсутствия инфекции [35].
Антибактериальная терапия была продолжена ребенку цефтриаксоном (1 г 2 р./сут) внутримышечно и ко-тримоксазолом (в прежней дозе).
На 55-й день болезни в удовлетворительном состоянии мальчик был выписан домой на амбулаторное долечивание с окончательным клиническим диагнозом: Пневмония внебольничная, очаговая, двусторонняя, тяжелая, ДН 2–3 ст., острое течение (J.16). Отек легких. Подкожная эмфизема. Инфекционно-токсическая кардиомиопатия, НК 0 ст. Артериальная гипертензия 1 ст. Cуперинфекция внутрибольничная (микоплазменная, пневмоцистная): обструктивный бронхит, ДН 0–1 ст. Бронхоэктатическая болезнь (бронхоэктазы множественные, диффузные, цилиндрические), фаза обострения, ДН 0–1 ст. (J.47). При выписке пациенту рекомендованы: соблюдение режима дня; полноценное, богатое белками питание; общеукрепляющие процедуры, профилактика ОРВИ (домашнее обучение).
Главной задачей консервативного лечения бронхоэктатической болезни является санация бронхиального дерева, которая достигается предотвращением развития патогенной микрофлоры в бронхах (бронхоэктазах) путем назначения антибактериальных средств (с учетом антибиотикочувствительности колонизирующей микробной флоры) и активной эвакуации гнойной мокроты [29, 30, 32, 36, 37].
В этой связи, учитывая длительный непрерывный курс предшествующей антибиотикотерапии, ребенку рекомендовано продолжить антибактериальное лечение ко-тримоксазолом (по схеме: 1 р./нед. в двойной суточной дозе) вместе с иммуномодулятором меглюмина акридонацетатом (по схеме, N 10); назначены комбинированный ингаляционный глюкокортикостероидный препарат с пролонгированным бронхолитиком (салметерол + флутиказон 50/250 2 р./сут), муколитик (амброксол 2,0 мл 2 р./сут через небулайзер), а также дренажная терапия (позиционный дренаж, вибрационный массаж грудной клетки), дыхательная гимнастика. Ребенок выписан под диспансерное наблюдение районного пульмонолога, планировалось продолжить реабилитацию в местном (подмосковном) санатории в теплое время года; при стабилизации состояния через 5–6 мес. рекомендовано повторное КТ-обследование.
В течение 38 дней мальчик находился на домашнем режиме. У ребенка сохранялись ежедневный нечастый продуктивный кашель с отделением мокроты белого
цвета, одышка смешанного характера в покое, усиливающаяся при физической нагрузке. Пролонгированный курс лечения ко-тримоксазолом закончен 18.03.2017 (90-й день от начала заболевания). Однако уже через 3 дня после окончания поддерживающей антибактериальной терапии (22.03.2017) у мальчика вновь появились симптомы обострения инфекционного процесса в бронхах, и с подозрением на правостороннюю пневмонию в состоянии средней тяжести (температура 38 °С, головная боль, бледность, влажный кашель с мокротой зеленого цвета) ребенок повторно госпитализирован в пульмонологическое отделение ДГКБ св. Владимира. В легких над средней и нижней долей справа в зоне укорочения перкуторного тона вновь выслушивались мелко- и среднепузырчатые влажные хрипы, не исчезающие при откашливании. Исследование КОС выявило нарушение состояния дыхательной и метаболической функций (рН — 7,34, SB — 23 ммоль/л, ВЕ — 2,7 ммоль/л, рО2 — 65 мм рт. ст., рСО2 — 52 мм рт. ст.). В клиническом анализе крови обнаружен высокий лейкоцитоз (17,3×109) без изменений лейкоцитарной формулы, ускорение СОЭ — 20 мм/ч. Опре-
деление уровня иммуноглобулинов не выявило существенных отклонений: IgA — 73,0 мг/дл (норма — 35–350 мг/дл), IgМ — 121,0 мг/дл (норма — 50–300 мг/дл), содержание IgG — на нижней границе нормы — 634,0 мг/дл (норма — 650–1600 мг/дл). На рентгенограмме грудной клетки инфильтративных изменений не обнаружено, определялись широкие, неструктурные корни легких.
Очевидно, данный эпизод явился обострением воспалительного процесса в зоне инфицированных бронхоэктазов, который возобновился после прекращения лечения, несмотря на пролонгированный курс антибактериальной и активной дренажной терапии, при наличии клинической картины локализованного бронхита (без вовлечения в патологический процесс легочной паренхимы).
Мальчику назначена комплексная терапия цефтриаксоном (1 г 2 р./сут внутримышечно — 9 дней), муколитиком бромгексином (8 мг 3 р./сут), противовоспалительным средством фенспиридом (15 мл 3 р./сут).
При обследовании на ЭКГ выявлена синусовая аритмия (61–77 уд./мин) с сохранением ритма в вертикальном положении (108 уд./мин). На ЭХО-КГ признаков гипертрофии миокарда не выявлялось, глобальная сократимость миокарда желудочков не снижена; обнаружены пролапс митрального клапана 1 степени (4,2 мм) без регургитации, функциональная недостаточность трикуспидального клапана, дополнительная диагональная хорда левого желудочка. При УЗИ органов брюшной полости (29.03.2017) обнаружены эхопризнаки гастрита, реактивные изменения желчного пузыря, поджелудочной железы. В продолжение обследования больного с хроническим воспалительным процессом в легких выполнены проба Манту — папула 6 мм (в 2014 г. — проба отрицательная, в 2016 г. — папула 4 мм) и Диаскинтест — результат отрицательный. Заключение фтизиатра: с учетом показателей специального обследования, клиники и анамнеза данных за туберкулезный процесс в легких нет; однако в связи с нарастающим ответом пробы Манту рекомендовано провести превентивный курс лечения противотуберкулезными препаратами под наблюдением районного фтизиатра. Исследование ФВД от 24.03.2017 выявило обструктивно-рестриктивные изменения (снижение объема форсированного выдоха в первую секунду, жизненной емкости легких (ЖЕЛ)), проба с сальбутамолом не дала прироста скоростных показателей, что исключает роль бронхоспазма в обструкции бронхов.
Известно, что бронхиальная гиперреактивность при бронхоэктазии обнаруживается лишь у 40% больных, при этом положительная проба с бронхолитиком выявляется еще реже (у 20–46% пациентов), поскольку в формировании бронхиальной обструкции главную роль играют не медиаторы воспаления, а структурные изменения бронхиального дерева [29, 32, 37]. Исследование ФВД у больных бронхоэктатической болезнью констатирует нарушение вентиляции, причем тяжесть дыхательных расстройств прямо пропорциональна распространенности бронхоэктатического процесса в легких. Однако спирографические показатели не коррелируют с изменениями, фиксируемыми КТ [38]. Результаты исследования ФВД у нашего больного демонстрируют наличие и обструкции, и рестрикции, в этой связи снижены как скоростные (величина форсированного выдоха, индекс Тиффно), так и объемные показатели (уменьшение ЖЕЛ, увеличение остаточного объема). Предшествующие патологические состояния, которые перенес ребенок (пневмония, отек легких, бронхообструктивный синдром), сопровождались нарушением вентиляции и гипоксией легочной паренхимы. Известно, что рецидивирующее воспаление в зоне бронхоэктазов неизбежно приводит к глубокому распространению процесса: на перибронхиальную ткань и далее на паренхиму легких, что способствует развитию пневмосклероза. Поражение легочной ткани нарушает ее растяжимость (рестрикция), увеличивается «функциональное мертвое пространство», прогрессирует неравномерность вентиляции, прерывается обмен газов — это поддерживает развитие хронической дыхательной недостаточности. Рестриктивная дыхательная недостаточность является наиболее тяжелой, в перспективе у пациентов с бронхоэктатической болезнью она продолжает нарастать, поскольку прогрессируют структурные нарушения, сложно устраняемые консервативной терапией [1, 29–32].
На фоне проводимого в отделении лечения в состоянии мальчика наметилась положительная динамика: исчезла интоксикация (нормализовалась температура, появилась двигательная активность), кашель стал редким, уменьшилось количество отделяемой (светлой) мокроты, однако после физической нагрузки (быстрая ходьба, бег) появлялась небольшая одышка смешанного характера, которая купировалась самостоятельно после отдыха. В легких справа (в средних и нижних отделах) сохранялось ослабление дыхания, выслушивались немногочисленные звучные хрипы. На 11-е сут лечения мальчик выписан домой в удовлетворительном состоянии под наблюдение педиатра и пульмонолога по месту жительства. Семье даны рекомендации: продолжить прием фенспирида с целью снижения продукции воспалительного секрета (1 табл. 2 р./сут, длительно); использовать при затруднении дыхания ипратропия бромид + фенотерол (ДАИ, 1–2 вдоха, до 3–4 р./сут с интервалом 4–6 ч); для облегчения экспекторации мокроты регулярно проводить лечебную дыхательную гимнастику. Рекомендовано при присоединении острой респираторной инфекции у ребенка обязательное поддержание санации бронхиального дерева антибиотикотерапией; в данном случае предпочтительнее стартовая терапия клавуланатами, однако возможно альтернативное назначение цефалоспоринов 3-го поколения, а в случаях тяжелых затянувшихся обострений — применение респираторных фторхинолонов (несмотря на возрастные ограничения). Мальчику рекомендовано контрольное обследование на антитела к Mycoplasma pneumoniae и Pneumocystis carinii (через 3 мес.). При стабильном состоянии ребенка в дальнейшем рассматривается вакцинация против пневмококковой и гемофильной инфекций (по индивидуально выбранным схемам), а также показана ежегодная предсезонная вакцинация против гриппа. Для определения дальнейшей тактики ведения пациента планируется повторное КТ-исследование органов грудной клетки с последующей консультацией торакального хирурга.
При бронхоэктатической болезни с ограниченными поражениями в легких (доля, сегмент) — так называемых «малых формах», в случаях, когда не удается добиться клинического благополучия под влиянием консервативного лечения, возможно проведение хирургического вмешательства. Допустима паллиативная резекция легкого на стороне большего поражения (что, возможно, рациональнее в нашем случае, учитывая билатеральность и «многоочаговость» поражения). Оптимальным возрастом для оперативного вмешательства считают 7–14 лет. Состояние пациентов после операции обычно значительно улучшается, прогрессирования процесса на неоперированной стороне не наблюдается, однако продолжение противорецидивного лечения обязательно [1, 2, 37, 39].
Заключение
Бронхоэктазы, впервые описанные Renе Laenneс 200 лет назад, сегодня диагностируются у 12–35% пациентов с хроническими заболеваниями легких [1, 2, 24–27, 29–32, 40, 41]. Следует отметить, что распространенность бронхоэктатической болезни в мире в последние десятилетия снизилась, вероятно, в связи с уменьшением числа детских инфекций, туберкулеза, возможностями ранней диагностики осложнений респираторных заболеваний и эффективностью антибактериальной терапии [27]. Однако многие аспекты бронхоэктатической болезни до настоящего времени остаются неясными и активно изучаются. Диагностика бронхоэктазии базируется в основном на рентгенологическом обследовании. Полипроекционная рентгенография грудной клетки, выполненная в самом начале клинических проявлений болезни, к сожалению, не выявляет типичных признаков заболевания, однако у пациентов «со стажем» обострений она может обнаружить грубый пневмосклероз и уменьшение объема пораженной доли легкого. «Золотым стандартом» диагностики (анатомической характеристики бронхоэктазов, уточнения распространенности и объема поражения) продолжает оставаться бронхография, причем применяется усовершенствованный селективный метод, выполняющийся с использованием волоконной оптики. Высокоинформативна современная КТ, позволяющая измерять абсолютные размеры бронхов и выявлять мелкие бронхоэктазы, не диагностируемые бронхографией; достоверным признаком бронхоэктазии считается резкое увеличение (в 2 раза и более) внутреннего диаметра периферического бронха по сравнению с диаметром предшествующей магистрали.
Обследуя нашего пациента, мы выявили бронхоэктатическую болезнь с бронхоэктазами цилиндрической формы, представленными в обоих легких: нижней и средней долях справа, язычковых сегментах и нижней доле слева. Подобная локализация бронхоэктазии является статистически весьма распространенной. Множественные бронхоэктазы в разных легочных сегментах сформировали у нашего пациента клинико-рентгенологическую картину многоочаговой пневмонии. Следует заметить, что при адекватном иммунном ответе на инфекцию в легочной ткани формируется, как правило, ограниченный воспалительный процесс, и пневмония в абсолютном большинстве случаев имеет одностороннюю локализацию. Кроме того, у иммунокомпетентных пациентов пневмония развивается лишь в тех случаях, когда вирулентность возбудителя превосходит противоинфекционную защиту хозяина, или когда иммунный ответ ослаблен ятрогенным воздействием или недавно перенесенным тяжелым заболеванием, или, наконец, при развитии болезни на фоне анатомических дефектов (в т. ч. бронхоэктазий, как у нашего больного) [3]. Известно, что закладка и дифференцировка бронхиального дерева начинаются на 5-й нед. внутриутробного развития и активно продолжаются после рождения в первые годы жизни ребенка; различные патологические воздействия могут нарушить процесс его формирования [2]. Следует обращать внимание на высокую частоту ассоциации врожденной бронхоэктазии с другими сопутствующими заболеваниями [24, 27, 29–32]. Нередки случаи развития цилиндрических бронхоэктазов в постнатальном периоде как следствие постинфекционного облитерирующего бронхиолита, развивающегося после перенесенной в первые годы жизни респираторно-вирусной инфекции (респираторно-синцитиальной, парагриппозной и особенно — аденовирусной). По данным научной литературы, первые клинические симптомы бронхоэктатической болезни обычно проявляются в первые 3 года жизни ребенка, однако диагноз, как правило, верифицируется значительно позднее. В наши дни пульмонологи констатируют преобладание более легких форм болезни, протекающей со стертой клинической картиной: рецидивирующие бронхиты 3–4 раза в год с влажным кашлем с мокротой по утрам [27, 30, 32]. Несмотря на возраст нашего пациента (13 лет), мы рассматриваем выявленные бронхоэктазы как врожденную патологию, связанную с дефектным формированием стенки терминальных отделов бронхов в эмбриональном периоде. Позднее выявление заболевания у данного пациента, на наш взгляд, связано со здоровым образом жизни и редкими респираторными заболеваниями у мальчика, причем имеющими в анамнезе преимущественно форму поражения верхних отделов дыхательных путей, протекающими остро, а значит, коротко, с быстрым полным выздоровлением, без нарушения дренажной функции бронхов и провокации снижения иммунной резистентности; отметим, что данная инфекция стала его первым (за 13 лет жизни) тяжелым заболеванием респираторного тракта. В этой связи представляет интерес высказываемое в специальной литературе мнение о том, что цилиндрические бронхоэктазы развиваются вследствие склероза бронхиальной стенки, при котором происходит равномерное расширение просвета бронха на большом протяжении. Эта форма бронхоэктазии не формирует грубого нарушения дренажной функции со скоплением гноя в бронхиальном дереве, поэтому протекает более благоприятно: состояние больных нарушается незначительно, а своевременное устранение причин может привести к регрессу заболевания [1, 2, 29–32]. С учетом сказанного провоцирующим фактором формирования бронхоэктазии у нашего пациента мог быть последовательный инфекционный микст: респираторный вирус, пневмококк, микоплазма, пневмоциста.
Дальнейшая тактика ведения нашего пациента заключается главным образом в противорецидивном лечении: борьбе с воспалением в зоне бронхоэктазов и гнойной интоксикацией. Об эффективности терапии будут свидетельствовать частота обострений заболевания и сохранность легочных функций, что косвенно регистрируется показателями ФВД. Учитывая неизбежное прогрессирование бронхоэктатической болезни ввиду повторных респираторных заболеваний в процессе жизни, а следовательно, систематическое возникновение и повторение гипоксии и гнойной интоксикации, необходимо контролировать деятельность других жизненно важных органов: сердца, печени и почек [29–32, 38].
В настоящее время пульмонологами обсуждаются рекомендации по активной иммунизации пациентов (детей, взрослых) с хроническими нагноительными заболеваниями дыхательной системы (и бронхоэктатической болезнью, в частности) вакцинами против основных бактерий, колонизирующих слизистую респираторного тракта, — пневмококков и гемофильной палочки. Данная категория больных относится к лицам групп повышенного риска развития инфекционных обострений бронхолегочной патологии, участие в которых принимает колонизирующая микробная флора. Исследованиями показана эффективная элиминация данных патогенов из мокроты при формировании защитного вакцинального иммунитета, что позволяет снизить частоту и тяжесть обострений [37, 42]. Ограниченные поражения бронхиального дерева, ранняя диагностика и своевременная терапия способствуют благоприятному прогнозу и улучшению качества жизни пациентов с бронхоэктатической болезнью. Активная противовоспалительная и дренажная терапия позволяют достичь длительной ремиссии. Обострения бронхоэктатической болезни могут возникать после ОРВИ, в сырое, холодное время года, при переохлаждении. Распространенность процесса в легких, тяжелое осложненное течение бронхоэктатической болезни с прогрессирующей симптоматикой (кровохарканьем), неэффективная терапия или отказ от лечения, фоновые заболевания делают прогноз неблагоприятным. При распространенных процессах у пациентов уже в детском возрасте могут развиваться симптомы легочной гипертензии (легочное сердце), что ухудшает прогноз, формирует раннюю инвалидизацию ребенка. В ряде случаев оперативное удаление локализованных бронхоэктазов может привести к выздоровлению.
Литература
1. Чучалин А. Г. Национальное руководство. Пульмонология. Краткое издание. М.: ГЭОТАР-Медиа, 2013. С. 768 [Chuchalin А. G. Nacionalnoe rukovodstvo. Pulmonologia. Kratkoe izdanie. M.: GEOTАR-Media, 2013. S. 768 (in Russian)].
2. Таточенко В. К. Болезни органов дыхания у детей: Практическое руководство. 2-е изд., испр. М., 2015. С. 396 [Tatochenko V. K. Bolezni organov dykhaniya u detej: Prakticheskoe rukovodstvo. 2-e izd., ispr. M., 2015. S. 396 (in Russian)].
3. Синопальников А. И., Козлов Р. С. Внебольничные инфекции дыхательных путей: Руководство для врачей. М., 2007. С. 352 [Sinopal’nikov А.I., Kozlov R. S. Vnebol’nichnye infektsii dykhatel’nykh putej: Rukovodstvo dlya vrachej. M., 2007. S. 352 (in Russian)].
4. Внебольничная пневмония у детей: Клинические рекомендации. М., 2015. С. 64 [Vnebol’nichnaya pnevmoniya u detej: Klinicheskie rekomendatsii. M., 2015. S. 64 (in Russian)].
5. Намазова-Баранова Л.С., Куличенко Т. В., Малахова А. Е. и др. Пневмококковая пневмония у детей // Вопросы современной педиатрии. 2012. Т. 11 (4). С. 65–72 [Namazova-Baranova L.S., Kulichenko T. V., Malakhova А. E. i dr. Pnevmokokkovaya pnevmoniya u detej // Voprosy sovremennoj pediatrii. 2012. T. 11 (4). S. 65–72 (in Russian)].
6. Козлов Р. С. Пневмококки: уроки прошлого — взгляд в будущее. Смоленск: МАКМАХ, 2010. 128 с. [Kozlov R. S. Pnevmokokki: uroki proshlogo — vzglyad v budushhee. Smolensk: MАKMАKH, 2010. 128 s. (in Russian)].
7. Самсыгина Г. А. Пневмония у детей и подростков [Samsygina G. А. Pnevmoniya u detej i podrostkov (in Russian)]. (Электронный ресурс). URL: http://www.rlsnet.ru/articles_456.htm (Дата обращения: 13.05.2017).
8. Авдеев С. Н. Интенсивная терапия в пульмонологии. М.: Атмосфера, 2014. Т. 1. С. 304 [Аvdeev S. N. Intensivnaya terapiya v pul’monologii. M.: Аtmosfera, 2014. T. 1. S. 304 (in Russian)].
9. Протоколы лечения внебольничной пневмонии у детей. Протокол Минздрава России от 25 декабря 2012 г. [Protokoly lecheniya vnebol’nichnoj pnevmonii u detej. Protokol Minzdrava Rossii ot 25 dekabrya 2012 g. (in Russian)]. (Электронный ресурс). URL: http://docs.cntd.ru/document/902389333 (Дата обращения: 13.05.2017).
10. Федеральные клинические рекомендации по оказанию скорой медицинской помощи при внебольничной пневмонии у детей. 2015. 12 с. [Federal’nye klinicheskie rekomendatsii po okazaniyu skoroj meditsinskoj pomoshhi pri vnebol’nichnoj pnevmonii u detej. 2015. 12 s. (in Russian)].
11. Harrisn M., Clark J., Coote N. et al. British Thoracic Society Standards of Care Committee. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011 // Thorax. 2011. Vol. 66. Suppl 2. P. 1–23.
12. Самсыгина Г. А., Дудина Т. А., Талалаев А. Г. и др. Тяжелые внебольничные пневмонии у детей // Педиатрия. 2005. Т. 4. С. 87–94 [Samsygina G.А., Dudina T. А., Talalaev А. G. i dr. Tyazhelye vnebol’nichnye pnevmonii u detej // Pediatriya. 2005. T. 4. S. 87–94 (in Russian)].
13. Чучалин А. Г. Отек легких: клинические формы (часть II) // РМЖ. 2006. Т. 4. С. 170–177 [Chuchalin А. G. Otek legkikh: klinicheskie formy (chast’ II) // RMZH. 2006. T. 4. S. 170–177 (in Russian)].
14. Штабницкий В. А. Кардиогенный и некардиогенный отек легких // Consilium Medicum. Болезни органов дыхания (Приложение). 2016. № 1. С. 36–41 [Shtabnitskij V. А. Kardiogennyj i nekardiogennyj otek legkikh // Consilium Medicum. Bolezni organov dykhaniya (Prilozhenie). 2016. № 1. S. 36–41 (in Russian)].
15. Волков И. К. Дифференциальная диагностика бронхообструктивного синдрома у детей // Медицина неотложных состояний. 2013. № 1. С. 48 [Volkov I. K. Differentsial’naya diagnostika bronkhoobstruktivnogo sindroma u detej // Meditsina neotlozhnykh sostoyanij. 2013. № 1. S. 48 (in Russian)].
16. Спичак Т. В. Респираторная микоплазменная инфекция у детей: насколько мы продвинулись в решении проблем? // Педиатрия. 2015. № 94 (6). С. 128–133 [Spichak T. V. Respiratornaya mikoplazmennaya infektsiya u detej: naskol’ko my prodvinulis’ v reshenii problem? // Pediatriya. 2015. № 94 (6). S. 128–133 (in Russian)].
17. Фадеева Т. В., Верещагина С. А., Габриэль Э. А. и др. Актуальные проблемы госпитальной инфекции: реинфицирование, суперинфицирование и резистентность возбудителей к антимикробным препаратам // Бюллетень Восточно-Сибирского научного центра Сибирского отделения РАМН. 2006. Вып. 5. С. 298–230 [Fadeeva T.V., Vereshhagina S. А., Gabriehl’ Eh.А. i dr. Аktual’nye problemy gospital’noj infektsii: reinfitsirovanie, superinfitsirovanie i rezistentnost’ vozbuditelej k antimikrobnym preparatam // Byulleten’ Vostochno-Sibirskogo nauchnogo tsentra Sibirskogo otdeleniya RАMN. 2006. Vyp. 5. S. 298–230 (in Russian)].
18. Лабораторная диагностика внебольничных пневмоний: Клинические рекомендации. Ассоциации специалистов и организаций лабораторной службы «Федерация лабораторной медицины». М., 2014. С. 49 [Laboratornaya diagnostika vnebol’nichnykh pnevmonij: Klinicheskie rekomendatsii. Аssotsiatsii spetsialistov i organizatsij laboratornoj sluzhby «Federatsiya laboratornoj meditsiny». M., 2014. S. 49 (in Russian)].
19. Каражас Н. В. Пневмоцистоз. Современное состояние проблемы // Альманах клинической медицины. 2010. № 23. С. 49–55 [Karazhas N. V. Pnevmotsistoz. Sovremennoe sostoyanie problemy // Аl’manakh klinicheskoj meditsiny. 2010. № 23. S. 49–55 (in Russian)].
20. Страчунский Л. С., Козлов С. Н. Современная антимикробная химиотерапия: Руководство для врачей. М.: Боргес, 2002. 436 с. [Strachunskij L.S., Kozlov S. N. Sovremennaya antimikrobnaya khimioterapiya: Rukovodstvo dlya vrachej. M.: Borges, 2002. 436 s. (in Russian)].
21. Геппе Н. А., Розинова Н. Н., Волков И. К., Манеров Ф. К., Мизерницкий Ю. Л. Внебольничная пневмония у детей // Эффективная фармакотерапия. 2012. № 17. С. 28–33 [Geppe N.А., Rozinova N. N., Volkov I. K., Manerov F. K., Mizernitskij YU.L. Vnebol’nichnaya pnevmoniya u detej // Effektivnaya farmakoterapiya. 2012. № 17. S. 28–33 (in Russian)].
22. Чучалин А. Г. Рациональная фармакотерапия заболеваний органов дыхания: Руководство для практикующих врачей. 2-е изд., испр. и доп. М.: Литтерра, 2013. 872 с. [Chuchalin А. G. Ratsional’naya farmakoterapiya zabolevanij organov dykhaniya: Rukovodstvo dlya praktikuyushhikh vrachej. 2-e izd., ispr. i dop. M.: Litterra, 2013. 872 s. (in Russian)].
23. Яковлева С. В., Сидоренко С. В., Рафальский В. В. и др. Стратегия и тактика рационального применения антимикробных средств в амбулаторной практике: Евразийские клинические рекомендации. М., 2016. 144 с. [Yakovleva S.V., Sidorenko S. V., Rafal’skii V.V. i dr. Strategiya i taktika ratsional’nogo primeneniya antimikrobnykh sredstv v ambulatornoj praktike: Evrazijskie klinicheskie rekomendatsii. M., 2016. 144 s. (in Russian)].
24. Розинова Н. Н. Клинические формы хронических воспалительных заболеваний легких у детей: критерии диагностики и принципы терапии // Трудный пациент. 2007. № 5 (10). С. 19–26 [Rozinova N. N. Klinicheskie formy khronicheskikh vospalitel’nykh zabolevanij lyogkikh u detej: kriterii diagnostiki i printsipy terapii // Trudnyj patsient. 2007. № 5 (10). S. 19–26 (in Russian)].
25. Розинова Н. Н., Мизерницкий Ю. Л. Хронические заболевания легких у детей. М.: Практика, 2011. 224 с. [Rozinova N.N., Mizernitskij Yu.L. Khronicheskie zabolevaniya legkikh u detej. M.: Praktika, 2011. 224 s. (in Russian)].
26. Розинова Н. Н., Мизерницкий Ю. Л. Редкие болезни легких у детей. Клинические наблюдения. М.: ООО «Оверлей», 2009. 192 с. [Rozinova N.N., Mizernitskij Yu.L. Redkie bolezni legkikh u detej. Klinicheskie nablyudeniya. M.: OOO «Overlej», 2009. 192 s. (in Russian)].
27. Мизерницкий Ю. Л., Розинова Н. Н., Соколова Л. В. и др. Редкие заболевания легких у детей — актуальная проблема современной пульмонологии // Российский вестник перинатологии и педиатрии. 2012. № 4 (1). С. 44–49 [Mizernitskij Yu.L., Rozinova N. N., Sokolova L. V. i dr. Redkie zabolevaniya legkikh u detej — aktual’naya problema sovremennoj pul’monologii // Rossijskij vestnik perinatologii i pediatrii. 2012. № 4 (1). S. 44–49 (in Russian)].
28. Кобринский Б. А., Подольная М. А., Богорад А. Е. и др. Регистр редких хронических заболеваний легких у детей // Врач и информационные технологии. 2015. № 3. С. 64–70 [Kobrinskij B.А., Podol’naya M.А., Bogorad А. E. i dr. Registr redkikh khronicheskikh zabolevanij legkikh u detej // Vrach i informatsionnye tekhnologii. 2015. № 3. S. 64–70 (in Russian)].
29. Чучалин А. Г. Бронхоэктазы: клинические проявления и диагностические программы // Пульмонология. 2005. № 1. С. 5–10 [Chuchalin А. G. Bronkhoehktazy: klinicheskie proyavleniya i diagnosticheskie programmy // Pul’monologiya. 2005. № 1. S. 5–10 (in Russian)].
30. Розинова Н. Н., Захаров П. П., Лев Н. С. Бронхоэктатическая болезнь у детей // Пульмонология. 2007. № 4. С. 91–95 [Rozinova N.N., Zakharov P. P., Lev N. S. Bronkhoektaticheskaya bolezn’ u detey // Pul’monologiya. 2007. № 4. S. 91–95 (in Russian)].
31. Floto R. A., Haworth C. S. Bronchiectasis // European Respiratory Society Monograph. 2011. Vol. 52. Р. 261.
32. Бобровничий В. И. Бронхоэктатическая болезнь у детей: учебно-методическое пособие. Минск: БГМУ, 2013. 24 с. [Bobrovnichij V. I. Bronkhoehktaticheskaya bolezn’ u detej: uchebno-metodicheskoe posobie. Minsk: BGMU, 2013. 24 s. (in Russian)].
33. Цигельник А. Я. Бронхоэктатическая болезнь. М.: Медицина, 1966. 443 с.[TSigel’nik А. Ya. Bronkhoehktaticheskaya bolezn’. M.: Meditsina, 1966. 443 s. (in Russian)].
34. Харитонова А. Ю., Шавров А. А., Калашникова Н. А. и др. Диагностическая бронхоскопия у детей // Вопросы современной педиатрии. 2013. № 12 (4). С. 112–119 [Kharitonova А. Yu., Shavrov А. А., Kalashnikova N. А. i dr. Diagnosticheskaya bronkhoskopiya u detej // Voprosy sovremennoj pediatrii. 2013. № 12 (4). S. 112–119 (in Russian)].
35. Лабораторные и инструментальные исследования в диагностике: Справочник. Пер. с англ. В. Ю. Халатова. В. Н. Титов, ред. М.: ГЭОТАР-Мед, 2004. 960 с. [Laboratornye i instrumental’nye issledovaniya v diagnostike: Spravochnik. Per. s angl. V. Yu. Khalatova. V. N. Titov, red. M.: GEOTАR-Med, 2004. 960 s. (in Russian)].
36. Pasteur M. C., Bilton D., Hill A. T. et al. British Thoracic Society guideline for non-CF bronchiectasis // Thorax. 2010. Vol. 65. Suppl 1. P. 1–58.
37. Баранов А. А., Намазова-Баранова Л.С., Симонова О. И. и др. Бронхоэктазы у детей: обзор современных клинических рекомендаций // Педиатрическая фармакология. 2017. № 14 (1). С. 33–42 [Baranov А.А., Namazova-Baranova L.S., Simonova O. I. i dr. Bronkhoehktazy u detej: obzor sovremennykh klinicheskikh rekomendatsij // Pediatricheskaya farmakologiya. 2017. № 14 (1). S. 33–42 (in Russian)].
38. Chang A. B., Masel J. P., Boyce N. C. et al. Non-CF bronchiectasis: clinical and HRCT evaluation // Pediatr Pulmonol. 2003. Vol. 35. P. 477–483.
39. Яблонский П. К., ред. Национальные клинические рекомендации. Торакальная хирургия. М.: ГЭОТАР-Медиа, 2014. 160 с. [Yablonskij P.K., red. Natsional’nye klinicheskie rekomendatsii. Torakal’naya khirurgiya. M.: GEOTАR-Media, 2014. 160 s. (in Russian)].
40. Ringshausen F., de Roux A., Diel R. et al. Bronchiectasis in Germany: a population-based estimation of disease prevalence // European Respiratory Journal. 2015. Vol. 46. P. 1805–1807.
41. Quint J. K., Millett E. R.C., Joshi M. et al. Changes in the incidence, prevalence and mortality of bronchiectasis in the UK from 2004 to 2013: a population-based cohort study // European Respiratory Journal. 2016. Vol. 47. P. 186–193.
42. Chang C. C., Singleton R. J., Morris P. S. et al. Pneumococcal vaccines for children and adults with bronchiectasis // Cochrane Database Syst. Rev. 2007. Vol. 15 (2). CD006316.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru







