Введение
Задержка роста плода (ЗРП) — состояние, при котором размеры плода меньше, чем должны быть для данного гестационного возраста (срока беременности). Это означает, что плод не растет с ожидаемой скоростью. ЗРП занимает одно из лидирующих мест в структуре перинатальной заболеваемости и смертности [1–5]. У беременных с ЗРП значительно повышается риск как антенатальной гибели плода [1, 6], так и неонатальной гибели ребенка [7, 8].
По данным различных авторов, 5–10% всех беременностей протекают с этим патологическим состоянием. Прогнозирование и своевременная профилактика ЗРП являются важнейшими задачами, так как эффективных методов лечения данного патологического состояния не существует. Кроме того, прогнозирование и профилактика ЗРП могут существенно снизить медико-экономические затраты, связанные с лечением и реабилитацией детей [9].
В разных странах до сих пор используются различные критерии постановки диагноза «задержка роста плода» [9]. Согласно клиническим рекомендациям, утвержденным научным советом Минздрава России, в Российской Федерации следует опираться на ультразвуковые и допплерометрические диагностические критерии, предложенные международным консенсусом в рамках протокола Delphi и рекомендованные Международным обществом ультразвука в акушерстве и гинекологии (International Society of Ultrasound in Obstetrics and Gynecology, ISUOG) [10, 11]1.
В подавляющем большинстве случаев в основе патогенеза ЗРП лежит плацентарная недостаточность, формированию которой предшествует каскад патологических процессов на нескольких уровнях регуляции [12–14]. Часть случаев патологической плацентации можно объяснить нарушением структуры генов, кодирующих регулярные молекулы, или нарушением экспрессии этих генов. Изменения в уровне экспрессии могут быть результатом эпигенетической трансформации [15]. Одним из механизмов регуляции экспрессии генов являются микроРНК — короткие некодирующие последовательности нуклеотидов, которые влияют на работу генов путем РНК-интерференции. Возможно, дальнейшие работы по изучению механизмов эпигенетической трансформации генов факторов роста позволят продвинуться в понимании патогенеза ЗРП.
Известно, что ЗРП существенно увеличивает заболеваемость не только в неонатальном периоде, но и на протяжении всей жизни человека. Дети, которые родились с задержкой роста, во взрослом состоянии чаще страдают ишемической болезнью сердца, артериальной гипертензией и сахарным диабетом. Риск повторения ЗРП у женщин при последующей беременности составляет примерно 20% [16–19].
Выделяют раннюю (до 32 нед.) и позднюю (после 32 нед.) ЗРП. Необходимо отметить, что ЗРП часто сочетается с преэклампсией (ПЭ), что также убедительно показывает плацентарную связь между двумя этими состояниями [20]. На сегодняшний день в акушерской практике одним из основных направлений в профилактике ЗРП является расчет и прогнозирование риска ее возникновения при проведении раннего пренатального скрининга (РПС) в сроках 11–13,6 нед. [21]. РПС — это комбинированный масс-скрининг беременных, направленный на раннюю диагностику грубых врожденных пороков развития плода, с расчетом групп риска рождения ребенка с хромосомной патологией, развития ПЭ, ЗРП, преждевременных родов.
При выявлении высокого риска развития ПЭ и ЗРП с профилактической целью рекомендован прием 150 мг ацетилсалициловой кислоты (АСК) в сроки с 12 до 36 нед. [21, 22]. АСК подавляет выработку простагландинов и тромбоксанов за счет необратимой инактивации фермента циклооксигеназы. Тромбоксан является мощным вазоконстриктором и протромботическим антиагрегантом. Длительное применение низких доз АСК необратимо блокирует образование тромбоксана А2 в тромбоцитах, ингибируя агрегацию тромбоцитов. Были выявлены новые цитопротективные и антиоксидантные механизмы АСК, которые не зависят от ингибирования циклооксигеназы. АСК ацетилирует эндотелиальную синтазу оксида азота, что приводит к высвобождению оксида азота из эндотелия сосудов. Кроме того, АСК повышает активность гемоксигеназы 1 в эндотелиальных клетках для катаболизма гема, что приводит к уменьшению окислительного стресса, травм и воспаления. В большинстве исследований применения АСК основное внимание уделялось ПЭ как первичному показателю исхода, а ЗРП включалась только как вторичный исход.
Цель исследования: изучение морфологической картины плацент у беременных группы высокого риска развития ЗРП с учетом данных РПС, в зависимости от того, принимали они АСК с целью профилактики ПЭ или нет.
Содержание статьи
Материал и методы
Исследование выполнено в период 2019–2021 гг. на базе кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России, в отделении пренатальной диагностики филиала ГБУЗ «ГКБ им. В.В. Вересаева ДЗМ»; исследование одобрено этическим комитетом вуза.
В проспективном анализе проведено изучение морфологической картины плацент 125 беременных группы высокого риска развития ЗРП и 554 плацент беременных низкого риска, определенного по результатам РПС.
Пренатальная диагностика проводилась в соответствии с приказом Минздрава России от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)»2 с использованием программного обеспечения Astraia (Аstraia software gmbh, Germany) [23]. Скрининговое УЗИ выполнялось в отделении пренатальной диагностики филиала ГБУЗ «ГКБ им. В.В. Вересаева ДЗМ» на ультра-звуковых аппаратах APLIO 500 (Toshiba Medical Systems Corporation, Япония) и GE Healthcare Voluson E6 (GE, США).
Определение в сыворотке крови беременной биохимических маркеров свободной β-субъединицы хорионического гонадотропина человека и протеина А, ассоциированного с беременностью, выполнялось иммуноферментным анализом на анализаторе AutoDELFIA (PerkinElmer, США) в лаборатории пренатального биохимического скрининга ГБУЗ «Центр планирования семьи и репродукции ДЗМ». Расчет рисков ЗРП и ПЭ в Astraia Obstetrics проведен врачом-экспертом, имеющим действующий сертификат специалиста и лицензию Фонда медицины плода (Fetal Medicine Foundation) на проведение РПС.
По результатам первого скрининга пациентки были разделены на 2 группы: 1-я группа включала 125 пациенток с высоким риском развития ЗРП, 2-я группа (группа контроля) включала стратифицированных по возрасту 554 пациенток с низким риском развития ЗРП согласно скринингу. Пациентки 1-й группы были дополнительно разделены на подгруппы по виду проводимой профилактики — 1А и 1Б. Беременные с высоким риском развития ЗРП подгруппы 1А (n=51) с профилактической целью принимали АСК в дозе 150 мг в непрерывном режиме в вечернее время с 12 до 36 нед. На период проведения исследования клинические рекомендации «Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода)» еще не были утверждены научным советом Минздрава, а следовательно, назначение АСК не было обязательным при высоком риске ЗРП по данным первого скрининга. Мотивацией для приема препарата явились наличие рождения ребенка с задержкой роста в предыдущую беременность, а также назначение препарата смежными специалистами и осведомленность беременных о профилактическом действии низких доз АСК. Назначение препарата проводилось по решению врачебной комиссии после подписания пациенткой письменного информированного согласия на прием препарата вне зарегистрированных показаний (off-label). Беременные с высоким риском развития ЗРП подгруппы 1Б (n=74) АСК не принимали.
После родоразрешения была проанализирована морфологическая картина плацент беременных и проведено сравнение между подгруппами 1А и 1Б и группой контроля (2-я группа).
Исследование плацент проводили в 3 этапа по стандартной схеме, предложенной А.П. Миловановым и соавт. [24], включающей макроскопический анализ, вырезку материала и гистологический анализ.
При макроскопическом исследовании последа определялся плодово-плацентарный коэффициент, место прикрепления пуповины к плаценте. Патология пуповины определялась краевым или оболочечным прикреплением к плаценте.
Для микроскопирования использовали микроскоп MT 4000 Series Biological Microscope. После определения массы плаценты без оболочек определяли площадь материнской поверхности путем отпечатка плаценты на чистой бумаге и его последующего измерения с помощью прозрачной сантиметровой сетки. По полученным данным — массе плаценты и массе плода — вычисляли плодово-плацентарный коэффициент.
Гистологическим материалом исследования служили 6 кусочков плацентарной ткани (2 из краевой, 2 из парацентральной и 2 из центральной зоны), фиксированных в 10% растворе формалина или в растворе Карнуа в течение двух суток. Далее взятый материал по одному часу фиксировали в четырех порциях изопропилового спирта, затем в течение часа в смеси спирта и толуола и еще в течение часа в трех порциях парафина. После биоматериал помещали в термостат при температуре 64 °C, после снова заливали парафином и разрезали на макропрепараты, которые депарафинировались в толуоле. Для лучшей визуализации окраску проводили гематоксилином и эозином и изучали при увеличении. Проводили полуколичественную оценку степени выраженности структурных показателей плаценты: межворсинчатого фибриноида; псевдоинфарктов; дистрофических нарушений (афункциональные зоны или склеенные ворсины); истинных или ишемических инфарктов; тромбов или межворсинчатых кровоизлияний; нарушения созревания ворсинчатого хориона.
Статистическую обработку материала осуществляли на персональном компьютере с помощью прикладной программы для работы с электронными таблицами Microsoft Excel и пакета Statistica 10 for Windows® 6.0. На этапе первичной статистической обработки для контроля качества исходной информации и проведения необходимых преобразований применялась программа Microsoft Excel. Для проверки соответствия выборки нормальному распределению применяли одновыборочный критерий Колмогорова — Смирнова. Для поиска и отбора признаков использовали критерий Краскела — Уоллиса и критерий Манна — Уитни для несвязанных выборок. Статистическую значимость различий между значениями признаков (р) выявляли для уровней значимости менее 0,05.
Результаты и обсуждение
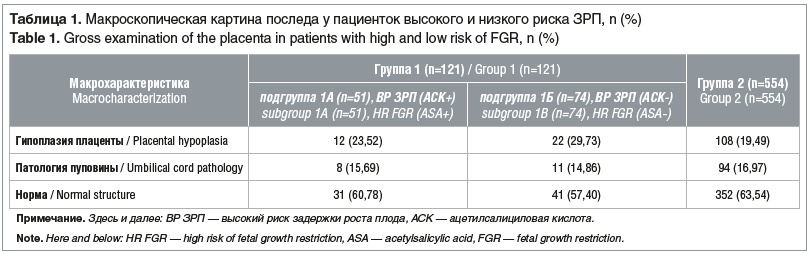
Средний возраст пациенток в исследуемых группах существенно не различался и составлял 31,4±4,7 года в 1-й группе и 30,6±3,9 года во 2-й группе. При макроскопическом исследовании плацент установлено, что гипоплазия плаценты и патология пуповины встречаются примерно с одинаковой частотой у пациенток высокого и низкого риска развития ЗРП, также не отмечено статистически значимых различий у пациенток, принимавших и не принимавших АСК (табл. 1).
В таблице 2 представлены результаты гистологического исследования плаценты. Наиболее редко встречались дистрофические нарушения последа и нарушения созревания ворсинчатого хориона в плацентах женщин 2-й группы, наиболее часто — в плацентах женщин в подгруппе 1Б. Показаны статистически значимые различия частоты дистрофических нарушений и нарушений созревания ворсинчатого хориона между подгруппой 1Б и остальными женщинами (р<0,001). Инфаркты плаценты встречались при исследовании плацент женщин контрольной группы и подгруппы 1А с одинаковой частотой, в плацентах же женщин из подгруппы 1Б их было существенно меньше. Частота образования синцитиальных узелков в подгруппе 1Б была существенно выше, чем в контрольной группе и в подгруппе 1А.
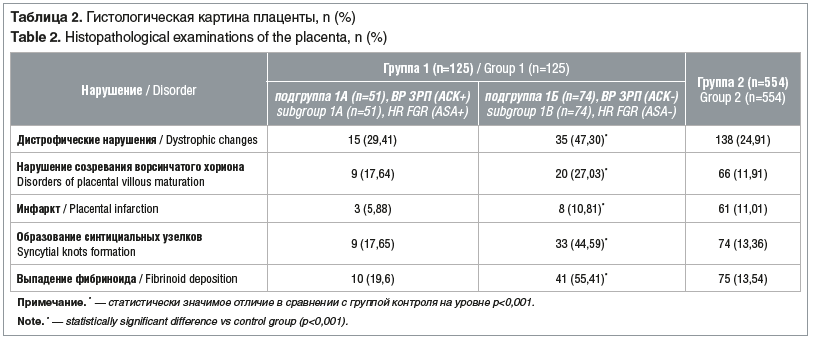
Оценка частоты выпадения фибриноида также выявила наличие существенных различий. Самый низкий показатель был зафиксирован в контрольной группе, а самый высокий — в подгруппе 1Б.
Таким образом, мы показали, что непрерывный профилактический прием АСК в дозе 150 мг с 12 до 36 нед. беременности в группе высокого риска ЗРП, определенного по результатам РПС, существенно снижал вероятность развития патологических изменений в плаценте (дистрофические нарушения, образование синтициальных узелков, выпадение фибриноида, нарушение созревания ворсинчатого хориона), приводящих к развитию и формированию плацентарной недостаточности с последующим отрицательным влиянием на плод. В качестве объяснения профилактического влияния АСК на развитие плацентоассоциированных осложнений (ПЭ, ЗРП и т. д.) предлагается несколько механизмов. Низкие дозы АСК снижают синтез тромбоксана в тромбоцитах, не влияя на выработку простациклина в сосудистой стенке. Также благотворное влияние АСК может быть опосредовано подавлением воспалительного ответа, который при плацентарной недостаточности, как правило, более выражен, чем при физиологической беременности.
Большинство специалистов склоняются к тому, что профилактический прием АСК следует начинать не позднее 16 нед. для того, чтобы добиться максимальной эффективности. Нами показано, что своевременно начатая профилактика позволяет предотвратить развитие многих патологических процессов в плаценте и избежать плацентоассоциированных осложнений в данной когорте беременных.
Заключение
У беременных высокого риска ЗРП, получавших АСК, по сравнению с беременными, не получавшими данное лекарственное средство, реже встречались дистрофические нарушения плаценты, нарушение созревания ворсинчатого хориона, инфаркты хориона, у них отмечалась более низкая частота образования синтициальных узелков. Таким образом, непрерывный профилактический прием АСК с 12 до 36 нед. беременности существенно снижает вероятность развития патологических изменений в плаценте.
1Клинические рекомендации. Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода). 2022. (Электронный ресурс.) URL: https://cr.minzdrav.gov. ru/recomend/722_1 (дата обращения: 01.07.2023).
2Приказ Минздрава России от 20.10.2020 No 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология». (Электронный ресурс.) URL: http://publication. pravo.gov.ru/Document/View/0001202011130037?ysclid=lr6a4x1xal696837272 (дата обращения: 01.07.2023).
Сведения об авторах:
Шамугия Валериан Валерианович — заведующий отделением антенатальной охраны плода филиала ГБУЗ «ГКБ им. В.В. Вересаева ДЗМ»; 127247, Россия, г. Москва, ул. 800-летия Москвы, д. 22; ORCID iD 0009-0008-6757-7660.
Кузнецов Павел Андреевич — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2492-3910.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Контактная информация: Кузнецов Павел Андреевич, e-mail: poohsmith@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.07.2023.
Поступила после рецензирования 28.07.2023.
Принята в печать 18.08.2023.
About the authors:
Valerian V. Shamugia — Head of the Department of Antenatal Fetal Protection of the branch of V.V. Veresaev City Clinical Hospital; 22, 800th Anniversary of Moscow str., Moscow, 127247, Russian Federation; ORCID iD 0009-0008-6757-7660.
Pavel A. Kuznetsov — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2492-3910.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-7830-2290.
Contact information: Pavel A. Kuznetsov, e-mail: poohsmith@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 07.07.2023.
Revised 28.07.2023.
Accepted 18.08.2023.
Информация с rmj.ru






