Влияние холецистэктомии на функцию сфинктера Одди
В.А. Ступин, А.М. Хоконов, Ж.В. Басарболиева, М.А. Хоконов
Проведено проспективное клинико-инструментальное исследование 119 пациентов с желчнокаменной болезнью (ЖКБ) и 71 пациента с постхолецистэктомическим синдромом (ПХЭС), перенесших холецистэктомию (ХЭ) 2-45 лет назад. Установлен полиморфизм клинической картины ПХЭС, представленной постоянным болевым синдромом (56,3%) и периодической болью (43,7%) в сочетании с диспепсическими явлениями и моторно-эвакуаторными нарушениями, при этом клинические симптомы в 1,2-3,7 раза чаще встречались в отдаленном периоде (>14 лет после ХЭ) вне зависимости от вида перенесенной операции. У 77,5% пациентов с ПХЭС выявлена различная органическая и функциональная патология ЖКТ, при этом через год после операции распространенность патологии ЖКТ составляет 15,1%, через 2-14 – 73,9%, через 15-45 лет – 84,0%. Согласно манометрическим данным, функциональные расстройства сфинктера Одди при ПХЭС, проявляющиеся повышением давления и амплитуды сокращений сфинктера Одди, а также холедоха и двенадцатиперстной кишки в наибольшей степени характерно для пациентов с ПХЭС с пролонгированным болевым синдромом. Установлено, что спустя 10 и более лет после исчезновения резервуарно-накопительной функции желчного нарастает дисфункция сфинктера Одди, коррелируя с развитием патологии ЖКТ в отдаленном периоде.
Ключевые слова: сфинктер Одди; постхолецистэктомический синдром; холецистэктомия; манометрия.
Введение
Желчнокаменная болезнь (ЖКБ) – одно из самых частых заболеваний желудочно-кишечного тракта (ЖКТ), распространенность которого варьирует от 10% до 35% и зависит от пола, возраста, генетических и средовых факторов [3, 9, 12, 14]. Одним из наиболее распространенных методов лечения ЖКБ является холецистэктомия (ХЭ), нередко приводящая к развитию постхолецистэктомического синдрома (ПХЭС).
ПХЭС – многогранное, сложное и противоречивое патологическое состояние, представляющее определенные трудности в диагностике, характеризуется сохранением симптоматики со стороны ЖКТ после проведения ХЭ и наблюдается по данным на фоне структурной или функциональной аномалии сфинктера разных авторов у 5-90% пациентов, наиболее частым является болевой синдром [5, 10, 13].
Потенциальные причины ПХЭС многочисленны. Одной из них является дисфункция сфинктера Одди (ДСО), который представляет собой гладкомышечную структуру, покрывающую и контролирующую терминальный отдел главного протока поджелудочной железы и общего желчного протока в месте впадения в двенадцатиперстную кишку [1, 6]. Частота развития ДСО после ХЭ достигает 45% [2, 7, 16], что вызывается новыми физиологическими условиями функционирования в результате исчезновения резервуарной функции желчного пузыря, а также операционной травмы. После ХЭ чаще встречается ДСО билиарного типа, предполагаемым механизмом которой является отсутствие резервуара для накопления объема желчи и обеспечения давления в фазу сокращения желчных путей [1, 8].
Другой возможной причиной является нарушение целостности нервов во время ХЭ, обеспечивающих функционирование сфинктера Одди [4]. При этом наличие ДСО у пациентов с интактным желчным пузырем, ставит под сомнение однозначность этой теории. В 10-20% случаев симптомы билиарной боли возникали в этой популяции и до проведения операции [15], что может быть связано с наличием других нарушений со стороны ЖКТ, таких как синдром раздражённой кишки и/или неязвенная диспепсия. Кроме того, у многих пациентов может быть микролитиаз, который коррелирует с ДСО [1].
Несмотря на внедрение новых хирургических, фармакологических и физиотерапевтических методов лечения ДСО, эффективность остается низкой, что может быть связано с низким применением золотого стандарта диагностики ДСО – манометрии, для контроля эффективности терапии, а также с недостаточно изученным патофизиологическим механизмом процесса пищеварения у пациентов, перенесших ХЭ.
Цель: улучшение результатов диагностики и лечения больных, перенесших холецистэктомию по поводу ЖКБ, на основании комплексного изучения влияния операции на функцию сфинктера Одди.
Материал и методы исследования
Проведено проспективное клинико-инструментальное исследование с включением 190 пациентов с ЖКБ и ПХЭС в возрасте от 20 до 86 лет (средний возраст составил 61,2±13,7 лет, медиана – 62 года), в том числе 32 мужчин (16,8%) и 158 женщин (83,2%). У 119 (62,6%) пациентов была диагностирована ЖКБ, в том числе у 76 (40,0%) – хронический калькулезный холецистит (ХКХ), 43 (22,6%) – острый калькулезный холецистит (ОКХ); 71 пациент (37,4%) перенес в анамнезе ХЭ по поводу ЖКБ и имели постоянный или периодический болевой синдром (группа ПХЭС). На момент включения в исследование самыми молодыми были пациенты с ОКХ, старшими – ПХЭС. Пациенты с ЖКБ чаще, чем пациенты с ПХЭС имели избыточную массу тела, что особенно было характерно для группы ХКХ (табл. 1).
Таблица 1. Распределение пациентов с ЖКБ и ПХЭС по полу и возрасту
| OKX (n=43) | ХКХ (n=76) | ПХЭС (n=71) | р | |
| Пол: — мужчины — женщины | 5 (11,6%) 38 (88,4%) | 23 (30,3%) 53 (69,7%) | 4 (5,6%) 67 (94,4%) | <0,05 |
| Возраст | 58,3±14,9, Ме=57 | 56,3±12,5, Ме=60 | 68,1±10,7, Ме=70 | <0,05 |
| Индекс массы тела | 26,9±2,4, Ме=27 | 28,1±2,5, Ме=28 | 25,6±2,3, Ме=25 | <0,05 |
100 пациентов с ЖКБ (65 человек с ХКХ и 35 с ОКХ) были прооперированы. 19 пациентов с ЖКБ, госпитализированных в плановом порядке, после дообследования от предложенного оперативного лечения отказались, им проводилась только консервативная терапия.
Пациентам с ПХЭС была выполнена открытая или лапароскопическая холецистэктомия 2-45 лет назад, в среднем (медиана) 14 лет назад. При этом у 4 (5,6%) пациентов ХЭ была выполнена 2-3 года назад, 12 (16,9%) – 4-9 лет, 30 (42,3%) – 10-14 лет и 25 (35,2%) – 15 и более лет назад. На момент проведения операции наиболее частым возрастным диапазоном включенных в исследование пациентов был 50-59 лет, при этом возраст пациентов с ПХЭС на момент проведения ХЭ был сопоставим с возрастом больных ЖКБ.
Пациентам чаще всего выполняли лапароскопическую холецистэктомию (ЛХЭ) – 61,6% (n=117), в том числе 68,4% при ХКХ, 53,5% при ОКХ, 59,2% в группе ПХЭС. Открытая ХЭ была выполнена 31 (16,3% пациенту, в том числе в 4-х случаях группы ЖКБ и 27 (38,0%) в группе ПХЭС. Эндоскопическая папиллосфинктеротомия (ЭПСТ) была выполнена 4 больным (9,3%) с ОКХ, 1 (1,3%) пациенту из группы ХКХ, а также ранее ЭПСТ была проведена 2 пациентам (2,8%) с ПХЭС. Пункцию желчного пузыря проводили 8 пациентам (18,6%) с ОКХ и 8 (10,5%) с ХКХ (табл. 2).
Таблица 2. Распределение пациентов с ЖКБ и ПХЭС по оперативному лечению
| Хирургическое лечение | ОКХ | ХКХ | ПХЭС | Всего |
| ЛХЭ | 23 (53,5%) | 52 (68,4%) | 42 (59,2%) | 117 (61,6%) |
| Открытая ХЭ | 0 | 4 (5,3%) | 27 (38,0%) | 31 (16,3%) |
| ЭПСТ | 4 (9,3%) | 1 (1,3%) | 2 (2,8%) | 7 (3,7%) |
| Пункция желчного пузыря | 8 (18,6%) | 8 (10,5%) | 0 | 16 (8,4%) |
| Не было операции | 8 (18,6%) | 11 (14,5%) | 0 | 19 (10,0%) |
При госпитализации всем пациентам с ОКХ проводили терапию, соответствующую стандартам лечения данной категории пациентов в условиях стационара. Пациенты с ХКХ были направлены поликлиникой и прооперированы нами в плановом порядке в первые сутки после поступления. Пациентам с ПХЭС проводили стандартную терапию болевого синдрома и причины возникновения ПХЭС.
Оценку состояния пациентов с ПХЭС проводили на госпитальном этапе, пациентов с ЖКБ – при госпитализации и выписке, а также через год, на основе комплексного клиническо-лабораторно-инструментрального обследования, включающего: анамнез и жалобы, анкетирование; клинический осмотр; общий клинический и биохимический анализ крови; ультразвуковое исследование (УЗИ) органов брюшной полости; дуоденоскопию; эндоскопическую манометрию; по показаниям РПХГ, ЭГДС, колоноскопию.
Манометрия выполнялась следующим образом. Пациента укладывали на левый бок, левую руку отводили за спину. Дуоденоскоп вводили до глубины двенадцатиперстной кишки, к области большого дуоденального соска, и после аспирации инсуфлированного ранее воздуха регистрировали давление в ДПК. После этого катетеризировали манометрическим катетером большой дуоденальный сосок и проникали в холедох, где также измеряли давление и амплитуду сокращения. В следующей стадии катетер медленно извлекали с шагом 2 мм в 2 минуты и устанавливали в сфинктере Одди и измеряли в нем давление, а также на каждом порте амплитуду фазовых сокращений сфинктера (в процессе извлечения катетера встречалась зона высокого давления; после того, как все порты катетера попадут в зону высокого давления, происходит регистрация давления в течение трёх-пяти минут). На заключительном этапе катетер извлекали. Когда порты достигали ДПК, давление падало и повторно регистрировали дуоденальное давление.
Результаты исследования и их обсуждения
Анализ жалоб установил полиморфизм клинической картины ПХЭС, которая была представлена постоянным болевым синдромом (56,3%) и периодической болью (43,7%) в сочетании с диспепсическими явлениями и моторно-эвакуаторными нарушениями: ощущением тяжести (40,9%), тошнотой (39,5%), рвотой (8,5%), изжогой (26,7%), сухостью/горечью во рту (25,3%), метеоризмом (22,5%), отрыжкой (19,7%), диареей (21,1%), запорами (9,9%). Жалобы на боль и диспепсические явления пациентов с ПХЭС не от вида перенесенной операции (табл. 3).
Таблица 3. Зависимость жалоб и диспепсических явлений у пациентов с ПХЭС от давности и вида операции, от патологии ЖКТ
| Периодическая боль | Постоянная боль | Всего | |
| N (%) | 31 (43,7%) | 40 (56,3%) | 71 (100%) |
| Давность операции (р=0,468) | |||
| 2-3 лет | 3 (9,7%) | 1 (2,5%) | 4 (5,6%) |
| 4-9 лет | 6 (19,4%) | 6 (15,0%) | 12 (16,9%) |
| 10-14 лет | 12 (38,7%) | 18 (45%) | 30 (42,3%) |
| 15-45 лет | 10 (32,2%) | 15 (37,5%) | 25 (35,2%) |
| В среднем | 14,4±5,0; Ме=14 | 15,1±8,9; Ме=14 | >0,05 |
| Вид операции (р=0,707) | |||
| открытая ХЭ | 14 (45,2%) | 13 (32,5%) | 27 (38,0%) |
| ЛХЭ | 15 (48,4%) | 27 (67,5%) | 42 (59,2%) |
| ЭПСТ | 2 (6,5%) | 0 | 2 (2,8%) |
Клинические симптомы в 1,22-3,67 раза чаще встречались в отдаленном периоде (>14 лет после ХЭ) вне зависимости от вида перенесенной операции (рис. 1).
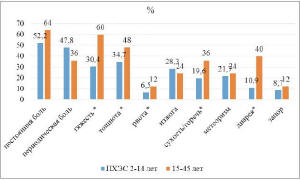
Рис. 1. Клиническая картина ПХЭС у пациентов, оперированных в разные сроки (* – межгрупповое различие при р<0,05; критерий х2)
Результаты интервью показали, что лишь 4 (5,6%) пациента с ПХЭС строго соблюдали диету, 44 (62,0%) старались соблюдать предписанный пищевой режим, 23 (32,4%) диету не соблюдали и их пищевой режим не изменился после ХЭ. К последним в большинстве случаев относились пациенты с ожирением I-III степени.
Анализ жалоб пациентов с ЖКБ в дооперационном периоде установил болевой синдром у 83,2% пациентов (у 100% больных с ОКХ и 73,7% больных с ХКХ). При ОКХ боль чаще носила постоянный характер (79,1%), при ХКХ – периодический (80,4%; p<0,05). Локализация и иррадиация боли были сопоставимы в группах ОКХ и ХКХ, чаще боли локализовались в правом подреберье (27,7%) и эпигастрии (28,6%).
Через год у пациентов с ЖКБ клинические проявления наблюдались у 18,5% пациентов, чаще у неоперированных больных (57,9%) и после пункции желчного пузыря (43,8%), реже после ЭПСТ (20,0%), ЛХЭ (4,0%), из 4-х больных, перенесших открытую ХЭ, никто жалоб через год не предъявлял (p<0,05). Таким образом, частота встречаемости ПХЭС через год после ХЭ составила 6,8%.
Следовательно, нарушение процесса пищеварения актуально не только для больных с конкрементами в желчном пузыре, но и для прооперированных по этому поводу пациентов, что в большей степени проявляется спустя 14 лет после операции, причем частота болевого синдрома и диспептических явлений сопоставима с показателями у неоперированных больных.
Одновременно с этим, частота органической патологии прогрессировала пропорционально времени, прошедшему после ХЭ. Так, данные инструментальных и лабораторных исследований позволили установить, что органическая и функциональная патология ЖКТ встречалась у 77,5% пациентов с ПХЭС: рецидивирующий панкреатит (29,6%), папиллит (19,7%), антральный рефлюкс-гастрит (14,1%), парафатеральный дивертикул (8,5%), холедохолитиаз (7,0%), желчный энтероколит (7,0%), стеноз БДС (4,2%), полип БДС (4,2%), цирроз печени (1,4%), рак желудка (1,4%), рак печени (1,4%), рак ободочной кишки (1,4%). Через год после операции распространенность патологии ЖКТ составила 15,1%, через 2-14 – 73,9%, через 15-45 лет – 84,0%. Значимо больше патологии ЖКТ было выявлено у пациентов, перенесших ХЭ более 14 лет назад, у которых панкреатит был выявлен в 2,03 раза чаще, желчный энтероколит в 2,79 раза чаще, антральный рефлюкс эзофагит в 2,76 раза чаще, парафатеральный дивертикул в 1,85 раза чаще, чем у пациентов, оперированных 2-14 лет назад (p<0,05). Цирроз печени и онкология выявлены у больных, оперированных 15-45 лет назад (рис. 2).
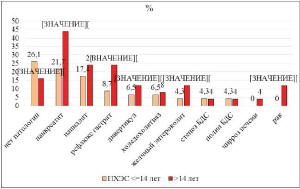
Рис. 2. Распространенность патологии ЖКТ у пациентов, перенесших ХЭ в разные сроки давности (* – межгруппое различие при р<0,05)
Анализ проводимого ранее специализированного лечения установил, что 45,1% (n=32) пациентов с ПХЭС в течение последнего года были госпитализированы, включая 24 (33,8%) человек, которые госпитализировались по поводу болей в животе. Из них 9 человек (12,7%) были госпитализированы с диагнозом ПХЭС, острый панкреатит, 7 человек (9,9%) – с диагнозом при выписке «острый гастродуоденит», 4 человека (5,6%) – «синдром раздраженного кишечника», 2 человека (2,8%) – «почечная колика», 2 (2,8%) – «язва желудка». Кроме этого, с болями в животе постоянно амбулаторно наблюдались в институте гастроэнтерологии 5 (7,0%) пациентов, из которых 2 человека наблюдались по поводу постхолецстэктомического рецидивирующего панкреатита, 1 – по поводу антрального рефлюкс гастрита, 1 – желчного энтероколита, 1 – стеноза БДС.
Важно отметить, что в течении года до момента настоящей госпитализации лечение проводилось у 35 (49,3%) пациентов с ПХЭС. Чаще всего пациенты принимали спазмолитики (n=20; 28,1%), ингибиторы протоновой помпы (напр., омез) (n=10; 14,1%) и ферментные препараты (напр., мезим) (n=14; 19,7%). При этом 17 (23,9%) пациентов с ПХЭС постоянно принимали фармакологические препараты, а 18 (25,4%) человек лечились периодически курсами (1-3 раза в год) и для купирования боли и диспептических явлений. Проводимое лечение не было эффективно в большинстве случаев, что связано в том числе с ошибками диагностики (рис. 3).
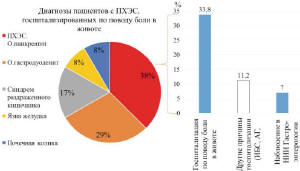
Рис. 3. Госпитализация пациентов с ПХЭС за последний год
Проведенное нами комплексное обследование, включающее данные УЗИ брюшной полости, дуоденоскопии, ЭГДС и т.д, не выявило большинство диагнозов, указанных в выписках.
У пациентов с ЖКБ наиболее часто был диагностирован полип БДС (у 8 (10,5%) пациентов с ХКХ и у 4 (9,3%) пациентов с ОКХ), другие виды патологии встречались у 11 (9,2%) больных: парафатеральный дивертикул (n=3; 2,5%; 1 при ОКХ и 2 при ХКХ), стеноз БДС (n=5; 4,2%; 4 при ОКХ и 1 при ХКХ), папиллит (n=3; 2,5%). Отсутствие органической патологии ЖКТ при госпитализации пациентов с ЖКБ было в 96 (80,7%) случаев. Через 12 месяцев у 18 (15,1%) пациентов была выявлена патология ЖКТ. Панкреатит был диагностирован у 2 (1,7%) пациентов, папиллит – у 3 (2,5%), парафатеральный дивертикул – у 3 (2,5%), полип БДС – у 10 (8,4%).
Распространенность органической и функциональной патологии ЖКТ через 2-14 лет после ХЭ в 3,83 раза больше, а через 15-45 лет – в 4,35 раза больше, чем при ЖКБ в дооперационном периоде (р<0,05). Распространенность патологии ЖКТ в 4,89 раза больше через 2-14 лет после ХЭ, в 5,56 раза больше через 15-45 лет по сравнению с распространенностью органической и функциональной патологии ЖКТ через год после ХЭ (рис. 4).
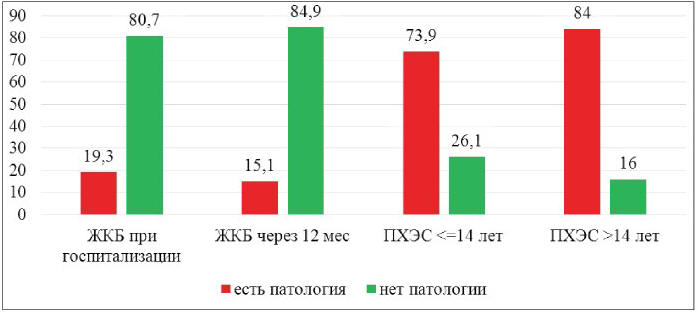
Рис. 4. Патология ЖКТ в динамике (%)
Влияние ХЭ на функцию сфинктера Одди изучали с помощью эндоскопической манометрии, выполненной в динамике.
Анализ манометрических показателей установил, что при ПХЭС выше нормы среднее давление в холедохе в 1,24 раза, среднее давление в сфинктере Одди в 1,71 раза при стабильных амплитудах сокращений сфинктера, холедоха, ДПК и давлении в ДПК. У пациентов с ЖКБ значимо повышены среднее давление в холедохе в 2,13 раза, давление в сфинктере Одди в 1,63 раза, амплитуда сокращений сфинктера в 1,21 раза и давление в ДПК в 2,90 раза относительно нормы; максимальные изменения моторно-эвакуаторных функций зарегистрировано при ОКХ (табл. 4).
Таблица 4. Манометрические показатели функционального состояния сфинктера Одди у пациентов с ЖКБ, ПХЭС по сравнению с нормой
| Отдел ЖКТ | Показатель | Норма (n=20) |
ЖКБ (n=107) |
пхэс (n=37) |
р (жкб/ пхэс) |
| ДПК | Среднее давление, мм вод. ст. | 7,9 5,5/8,7 [1,1-10,0] |
22,9 * 8,1/42,9 [3,3-101,8] |
9,0- 6,8/20,1 [0,5-45,0] |
0,005 |
| Холедох | Среднее давление, мм вод. ст. | 16,4 12,7/20,0 [5-23] |
35,0 * 19,9/70,1 [4,7-134] |
20,3 * 17,2/34,0 [8,2-56] |
0,012 |
| Сфинктер Одди | Среднее давление, мм вод. ст. | 28,4 25,5/32,5 [14,3-37,8] |
46,4 * 28,7/71,2 [14,6-169,9] |
48,5 * 31,1/59,9 [7,3-88,0] |
>0,05 0,392 |
| Средняя амплитуда сокращений, мм вод. ст |
62,5 43,1/87,5 [30,2-109,8] |
75,6 * 46,3/125,6 [33,3-272,3] |
72,1 56,1/81,8 [9,3-95,1] |
>0,05 0,145 |
|
| Результаты представлены в виде медианы (первая строка), 25%/75% квартилей (вторая строка) 95% – доверительного интервала (третья строка). * – достоверное отличие от нормы при p<0,05 (критерий Манна-Уитни). |
|||||
Таким образом, наибольший дисбаланс манометрических показателей был у пациентов с ЖКБ на 1-е сутки исследования. Однако полученные данные говорят о том, что выполненная в среднем 14 лет назад холецистэктомия не нормализовала физиологические показатели давления в сфинктере Одди и в холедохе, патологический процесс билиарного дерева у пациентов с ПХЭС продолжает развиваться длительное время, хотя и в меньшей степени, чем при обострении холецистита.
Наличие конкрементов в желчном пузыре и связанный с этим отек и воспалительные явления рефлекторно повышали давление в сфинктере Одди, общем желчном протоке и даже в ДПК. Последнее может быть связано со свойственным пациентам с ЖКБ лишним весом, что увеличивает не только внутрибрюшное давление, но и давление в кишечнике. Гипертония СО, холедоха и ДПК является неотъемлемой частью нарушения желчеоттока и сопровождается болевым синдромом и диспептическими явлениями.
Анализ манометрических показателей у пациентов с острым и хроническим калькулезным холециститом установил, что наибольшее изменения были при ОКХ, при котором было зарегистрированы максимальные цифры давления и амплитуды сокращений холедоха, сфинктера Одди и наибольшая амплитуда сокращений ДПК на фоне повышенного давления в ДПК. Это связано с наибольшей выраженностью отека и воспалительных явлений при ОКХ. На втором месте по степени изменения манометрических показателей были пациенты с ХКХ. Однако такие показатели как среднее давление в сфинктере Одди, амплитуда сокращений сфинктера, а также среднее давление и амплитуда сокращений ДПК, были сопоставимы с данными пациентов с ОКХ; статистически значимое отличие состояло в более высоких показателях среднего давления и амплитуды сокращений в холедохе (на 59% и 42% соответственно), а также показателя диапазона амплитуды сокращений сфинктера Одди (на 39%) у пациентов с ОКХ по сравнению с пациентами с ХКХ. Полученные существенные различия желчеоттока у пациентов с острым и хроническим холециститом могут служить основанием для тактики дальнейшего лечения.
Несмотря на то, что степень изменения показателей манометрии у пациентов с ПХЭС была наименьшей, такие показатели как среднее и базальное давление в сфинктере Одди, минимальная амплитуда сокращения сфинктера у пациентов с хроническим холециститом и ПХЭС не отличались (рис. 5).
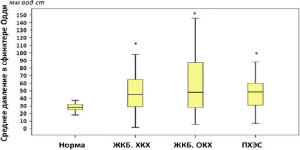
Рис. 5. Среднее давление в сфинктере Одди у пациентов разных групп (* – достоверное отличие от нормы при p<0,05; критерий Манна-Уитни)
Анализ показателей манометрии у пациентов с ПХЭС, предъявляющих жалобы на постоянный и периодически болевой синдром и диспепсические явления, показал, что постоянный болевой синдром и диспепсия у пациентов с ПХЭС сопровождается повышением давления в сфинктере Одди, холедохе и ДПК, а также повышением амплитуды сокращения сфинктера Одди, что говорит о постоянных функциональных расстройствах сфинктера, приводящих к стабильному и пролонгированному нарушенному пищеварению. Периодически возникающая клиническая картина ПХЭС в большинстве случаев не сопровождалась изменением давления в путях тока желчи (рис. 6-7).
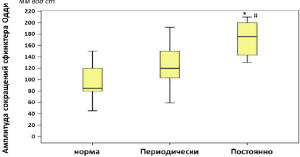
Рис. 6. Амплитуда сокращений в сфинктере Одди у пациентов с ПХЭС, предъявляющих жалобы на постоянные и периодические боли (* – достоверное отличие от нормы при p<0,05; # – межгрупповое различие при p<0,05 групп пациентов с ПХЭС; критерий Манна-Уитни)
Анализ манометрических показателей, определяемых при госпитализации и при выписке пациентов с ЖКБ, осуществляемой на 9-16 сутки (12,2±2,3 сут) показал, что включившиеся механизмы адаптации нормализовали давление в сфинктере Одди, улучшился уровень давления в холедохе в большинстве случаев, хотя и полностью не нормализовался. Впрочем, это трудно было бы ожидать, принимая во внимание исчезновение накопительной функции желчного пузыря у оперированных пациентов. У не оперированных больных при купировании острого приступа также наступало улучшение показателей, однако это улучшение было хуже, чем после ХЭ.
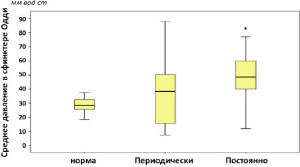
Рис. 7. Среднее давление в сфинктере Одди у пациентов с ПХЭС, предъявляющих жалобы на постоянные и периодические боли (* – достоверное отличие от нормы при p<0,05; критерий Манна-Уитни)
Это свидетельствует об приспособительно-компенсаторных изменениях ЖКТ к ЖКБ, и связанных с этим изменениями пищеварения, которые не всегда могут быть ликвидированы в короткие сроки после операции или после нивелирования приступа обострения болезни.
Оценка динамики показателей эндоскопической манометрии показала, что давление и амплитуда сокращений сфинктера Одди, холедоха и ДПК нормализовались через год после ХЭ и сохранялись на относительно стабильном уровне в течении 10 лет.
Спустя 10 и более лет после исчезновения резервуарно-накопительной функции желчного пузыря декомпенсировалась адаптативная функция сфинктера Одди, нарастала его дисфункция и гипертензия сфинктера Одди, холедоха и ДПК (табл. 5), коррелируя с развитием патологии ЖКТ в отдаленном периоде.
Таблица 5. Динамика манометрических показателей
| Отдел ЖКТ | Показатель | ЖКБ 1 сут |
ЖКБ при выписке |
ЖКБ через год |
ПХЭС 2-10 лет |
ПХЭС 11-45 лет |
| ДПК | Среднее давление, мм вод. ст. | 29,3 * 12,3/55,7 |
15,5 * 7,0/60,5 # |
8,2 5,8/9,3 # |
7,5 6,9/9,1 # |
16,4 * 5,1/34,2 # |
| Амплитуда сокращений, мм вод. ст. | 28,4 * 11,0/47,3 |
36,9 * 15,7/80,9 |
14,4 10,9/17,3 # |
13,2 11,2/14,5 # |
20,4 4,7/25,1 |
|
| Холедох | Среднее давление, мм вод. ст. | 35,0 * 19,9/70,1 |
33,3 * 20,5/59,2 |
17,1 15,1/20,5 # |
16,5 15,9/19,1 # |
30,2 * 22,9/40,1 |
| Амплитуда сокращений, мм вод. ст. | 59,9 * 24,3/85,7 |
44,4 * 24,9/75,8 |
25,8 20,4/29,1 # |
22,3 21,1/27,4 # |
35,3 * 28,9/46,3 # |
|
| Сфинктер Одди |
Среднее давление, мм вод. ст. | 46,4 * 28,7/71,2 |
40,1 34,5/90,2 |
38,9 25,9/51,4 |
42,2 38,2/50,3 |
49,1 * 24,1/77,3 |
| Амплитуда сокращений, мм вод. ст. | 75,6 * 46,3/125,6 |
86,2 * 40,1/137,5 |
65,1 43,9/89,4 |
60,4 56,2/81,8 |
79,1 60,5/87,1 |
|
| * – отличие показателя от нормы при р<0,05; # – отличие от показателя при ЖКБ на 1 сутки при р<0,05. | ||||||
Таким образом, несмотря на наличие позитивной тенденции в динамике манометрических показателей, выписываются пациенты с ЖКБ с выраженной дисфункцией сфинктера Одди и со значимой гипертонией исследуемых нами отделов ЖКТ. Нормализация амплитуды сокращений и давления в ДПК, холедоха и сфинктере Одди наступила через год после холецистэк-томии и сохранялась до 10 лет (у пациентов с ПХЭС). Дисфункция, гипертензия сфинктера Одди, в большинстве случаев характеризующая стеноз и спазм сфинктера, формировалась у трети больных, перенесших ХЭ, при этом ее формирование происходит в отдаленном периоде, что говорит о смене адаптативных механизмов на декампенсаторные в отдаленном периоде.
Несмотря на проведенные профилактические меры, развились осложнения манометрии, проводимой при первой госпитализации. Панкреатит развился у 3,0%, гиперамилаземия – у 7,6% человек. Осложнения были успешно устранены консервативным путем в течении 2-7 дней.
Анализ жалоб, лабораторных и инструментальных исследований позволил разделить пациентов по типу дисфункции сфинктера Одди на билиарный и панкреатический типы. К билиарному типу мы отнесли пациентов, имеющих типичные билиарные боли, локализованные в правом подреберье с/без иррадиацией в эпигастрий, у которых повышены АлАт, АсАт, а также пациентов с расширенным желчным протоком. К панкреатическому типу были отнесены больные с рецидивирующим панкреатитом, жалующиеся на боль опоясывающего или диффузного характера, в т.ч. с иррадиацией в спину, а также имеющие повышенный уровень амилазы крови. Отсутствие жалоб, органической патологии, повышения ферментов печени и амилазы при отсутствии изменений манометрических и других инструментальных данных свидетельствовало об отсутствии дисфункции сфинктера Одди после ХЭ. Установлено, что в 78,4% диагностирована ДСО. Биллиарный тип дисфункции зарегистрирован у 34,7% пациентов, панкреатический – у 43,7%.
Заключение
Проведенное исследование продемонстрировало актуальную эпидемиологическую ситуацию ПХЭС и дисфункции сфинктера Одди, приводящую к патологии ЖКТ, нарастающей в отдаленном послеоперационном периоде. Поэтому целесообразно проводить пристальное диспансерное наблюдение за пациентами с ЖКБ в течении первого года после операции и после консервативного купирования обострения калькулезного холецистита, а также за пациентами с ПХЭС. Вследствие высокого процента функциональной и органической патологии ЖКБ в отдаленном периоде после ХЭ, следует внимательно относиться к показаниям к оперативному лечению пациентов без клинической картины ЖКБ, у которых камни в желчном пузыре найдены случайно.
Учитывая максимальную диагностическую ценность эндоскопической манометрии относительно функционирования путей желчеооттока и дисфункции сфинктера Одди, манометрию необходимо проводить совместно с дуоденоскопией в динамике всем пациентам с ПХЭС (при отсутствии противопоказаний), в том числе, для оценки динамики течения, эффективности лечения и прогноза.
При выявлении функциональных расстройств сфинктера Одди, сопровождающихся клинической картиной ПХЭС, особенно постоянным болевым синдромом и симптомами нарушенного пищеварения, целесообразна плановая госпитализация с целью комплексного обследования и своевременного лечения пациентов, перенесших ХЭ. При этом необходимо выполнять не только стандартные методы диагностики (УЗИ органов брюшной полости, общий и биохимический анализ крови), но и дуоденоскопию в сочетании с манометрией, а также другие методы диагностики, соответствующие клинической картине (например, колоноскопию пациентам с нарушением стула для своевременного выявления и лечения рака ободочной кишки, развивающегося вследствие ДСО и бесконтрольного тока желчи, являющейся агрессивной средой для толстого кишечника при отсутствии поступающих с пищей жирных кислот; ЭГДС с целью своевременного выявления и лечения рака желудка, развивающегося на фоне ДСО и связанного с этим рефлюкс гастритом).
Список литературы
- Басарболиева Ж.В., Ступин В.А., Кобесов Н.В. Оптимизация лечебно-диагностического алгоритма у больных с постхолецистэктомическим синдромом. Справочник врача общей практики. 2015. № 2. С. 22-30.
- Винник Ю.С., Серова Е.В. Значение холецистокинина октапептида в развитии дисфункции сфинктера Одди неорганической этиологии после холецистэктомии у пациентов, оперированных по поводу калькулёзного холецистита. Пермский медицинский журнал, 2013. Т. 30. №5. С. 78-85.
- Дорофеенков М.Е. Факторы риска, особенности клинического течения и распространенность желчнокаменной болезни у лиц пожилого и старческого возраста в Москве. Клиническая геронтология. 2013. Т. 19, № 3-4. С. 30-35.
- Звягинцева Т.А., Гриднева С.В. Механизмы развития и подходы к лечению дисфункции сфинктера Одди после холецистэктомии. Гастроэнтерология. 2014. Т. 52. № 2. С. 77-81.
- Кучерявый Ю.А. Состояние после холецистэктомии: взгляд гастроэнтеролога. Медицинский совет. 2013. № 6. С. 39-44.
- Левин М.Д., Мендельсон Г., Коршун З. Сфинктер Одди и его роль в патогенезе заболеваний желчно-панкреатической зоны. Новости хирургии. 2011. Т. 19. № 6. С. 139-145.
- Леонтьев А.С., Короткевич А.Г., Репникова Р.В. и др. Оценка влияния оперативного доступа на структуру и частоту отдаленных осложнений холецистэктомии. Медицина в Кузбассе. 2014. № 1. С. 32-36.
- Панцырев Ю.М., Шаповальянц С.Г., Чернякевич С.А. Функциональные расстройства сфинктера Одди после холецистэктомии. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2011. Т. 21. № 3. С. 28-34.
- Тонких Ю.Л., Бронникова Е.П., Цуканов В.В. Распространенность и факторы риска заболеваний желчевыводящих путей у коренных жителей Тывы. Здравоохранение Российской Федерации. 2014. Т. 58. № 5. С. 42-45.
- Чарышкин А.Л., Бадеян В.А., Бикбаева К.И. Результаты холецистэктомии в отдаленном послеоперационном периоде. Сибирский медицинский журнал. – Иркутск. 2011. Т. 107. № 8. С. 32-34.
- Elmi F., Silverman W.B. Biliary sphincter of Oddi dysfunction type I versus occult biliary microlithiasis in postcholecystectomy patients: are they both part of the same clinical entity? Dig Dis Sci. 2010. №55(3). Рр. 842-846.
- Everhart JE, Khare M, Hill M, et al. Prevalence and ethnic differences in gallbladder disease in the United States. Gastroenterology, 1999; 117(3): 632-9.
- Glasgow R.E., Mulvihill S.J. Treatment of gallstone disease. In: Feldman M, Friedman LS, Brandt LJ, eds. Sleisenger & Fordtran’s gastrointestinal and liver diseases, 8th edn. Philadelphia, PA: Saunders. 2006. Рр. 1419-1437.
- Jessri M., Rashidkhani B. Dietary Patterns and Risk of Gallbladder Disease: A Hospital-based Case-Control Study in Adult Women. J Health Popul Nutr. 2015. №33(1). Рр. 39-49.
- Luman W., Adams W.H., Nixon S.N. et al. Incidence of persistent symptoms after laparoscopic cholecystectomy: a prospective study. Gut. 1996. №39(6). Рр. 863-866.
- Madacsy L., Fejes R., Kurucsai G., et al. Characterization of functional biliary pain and dyspeptic symptoms in patients with sphincter of Oddi dysfunction: effect of papillotomy. World J Gastroenterol. 2006. №12. Рр. 6850-6856.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru