Урогенитальный трихомониаз у женщин: современное состояние проблемы и вопросы терапии
Содержание статьи
Актуальность
В мае 2015 г. на 68-й сессии ВОЗ были подведены итоги реализации Глобальной стратегии по профилактике инфекций, передаваемых половым путем (ИППП), и борьбе с ними на 2006–2015 гг. Эксперты отметили, что наряду с прогрессом в достижении целевых показателей была отмечена необходимость дальнейшей работы в этой области. В проекте Глобальной стратегии сектора здравоохранения по ИППП на 2016–2021 гг. авторы обращают внимание на неблагополучную эпидемиологическую ситуацию по заболеваемости ИППП в мире [1]. Проблема распространенности ИППП — сигнал тревоги для врачей всего мира [2]. По обновленным в 2015 г. данным ВОЗ, ежедневно 1 млн человек приобретают ИППП; ежегодно 357 млн оказываются заражены одним из четырех возбудителей: Chlamydia trachomatis (131 млн), Trichomonas vaginalis (143 млн), Neisseria gonorrhoeae (78 млн), Treponema pallidum (5,6 млн) [1]. Одинаковый путь передачи, факторы риска, сходные жалобы, клинические симптомы, возможные осложнения создают сложности в дифференциальной диагностике заболеваний, вызываемых этими возбудителями в рутинной практике. Кроме того, у 30–60% пациентов с хламидийной, микоплазменной инфекцией и у 20–40% больных урогенитальным трихомониазом отмечается субъективно асимптомное течение [3].
Одним из принципиальных моментов современного течения урогенитальных инфекций является наличие микробных ассоциаций на фоне снижения локальной противоинфекционной защиты. Микст-инфекцию вызывают одновременно несколько видов микроорганизмов. Возрастает суммарное воздействие инфектов, с увеличением их вирулентности и формированием резистентности к противомикробным препаратам, что сопровождается изменением клинической картины, затруднением ранней диагностики и большей опасностью для организма [4–9].
Трихомониаз часто протекает на фоне диверсифицированной вагинальной микробиоты (community state type IV, CST-IV), которая включает виды, связанные с бактериальным вагинозом (Gardnerella vaginalis, Atopobium vaginae и Prevotella bivia). Оба заболевания связаны с передачей вируса иммунодефицита человека и преждевременными родами, осложнения которых могут возникнуть в результате нарушения эпителиального барьера влагалища. A.S. Hinderfeld et al. показали, что ассоциация T. vaginalis и вышеупомянутых видов бактерий CST-IV увеличивает проницаемость эпителия влагалища и шейки матки в 2 раза, что сопровождается повышением активности фосфатазы. Кроме того, эти микроорганизмы индуцируют изменения в экспрессии белков плотного соединения, в частности окклюдина, и провоспалительных цитокинов IL-6 и TNF-a [10].
В другом исследовании подчеркивается роль T. vaginalis в индукции повреждения клеток хозяина (цитотоксичность) через протеолитическую активность множественных цистеиновых протеиназ (CPs), некоторые из них модулируются такими факторами, как железо, цинк, полиамины и др. [11].
Являясь внеклеточными паразитами, трихомонады могут участвовать в инициации и реализации клеточного иммунного ответа с включением каскада цитокин-опосредованных реакций. Характер воспаления и исход взаимодействия между патогеном и механизмами противомикробной защиты хозяина в значительной мере зависят от спектра и уровня продуцируемых цитокинов. Данные цитокины оказывают плейотропные биологические эффекты на различные типы клеток, участвуя в формировании и регуляции защитных реакций (распознают маркеры активированного эндотелия) и иммунопатологических реакций, в т. ч. через активацию условно-патогенной микрофлоры [12].
В последнее десятилетие в широкую практику внедрены современные методы диагностики, разработаны Клинические рекомендации по ведению пациентов с ИППП и урогенитальными инфекциями согласно принципам доказательной медицины, но статистика неумолимо показывает достаточно высокий уровень заболеваемости ИППП. Урогенитальный трихомониаз относится к наиболее распространенным инфекциям, обнаруживаемым у лиц, обратившихся за специализированной дерматовенерологической, акушерско-гинекологической и урологической помощью по поводу инфекционно-воспалительных заболеваний урогенитального тракта [3, 13, 14].
Согласно Порядку оказания медицинской помощи по профилю «дерматовенерология», Клиническим рекомендациям Российского общества дерматовенерологов и косметологов (РОДВК) 2015 и 2017 гг., рекомендациям CDC единственным классом препаратов, применяемым для лечения урогенитального трихомониаза, являются 5-нитроимидазолы, к которым чувствительны большинство штаммов T. vaginalis [3, 14, 15]. Механизм действия препарата заключается в биохимическом восстановлении 5-нитрогруппы орнидазола внутриклеточными транспортными белками анаэробных бактерий и простейших. Восстановленная 5-нитрогруппа орнидазола взаимодействует с ДНК клеток микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели бактерий. Широкий спектр действия распространяется на T. vaginalis, анаэробные бактерии Bacteroides spp. (в т. ч. B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Fusobacterium spp., Clostridium spp. [16]. В 2016 г. H. Cakan et al. in vitro показали, что нитроимидазолы изменяют структуру клеточной мембраны T. vaginalis, проникают в его цитоплазму и ядро, блокируют клеточный метаболизм. Авторы наблюдали морфологические изменения, происходившие у T. vaginalis при воздействии in vitro 1,3 мкг/мл орнидазола с различными временными интервалами от 10 мин до 10 ч. На 10-й мин воздействия произошла вакуолизация. Частицы гликогена начали уменьшаться на 20-й мин. Лизис клеток начался на 30-й мин и ускорился к 60-й мин, а целостность цитоплазматического матрикса была нарушена на 60-й мин [17].
Современный фармацевтический рынок предлагает множество лекарственных препаратов с орнидазолом. Одним из них является препарат Дазолик, показанный при урогенитальном трихомониазе.
Цель работы — сравнительная оценка клинико-микробиологической эффективности метронидазола и орнидазола в терапии урогенитального трихомониаза у женщин.
Материал и методы Под наблюдением нахо
дились 47 женщин с диагнозом «урогенитальный трихомониаз» в возрасте от 19 до 42 лет, средний возраст составил 28,2±2,6 года. Диагноз был выставлен в соответствии с МКБ-10 и клиническими рекомендациями РОДВК по ведению больных с ИППП и урогенитальными инфекциями. Все пациентки были разделены на 2 группы: группа 1 (23 пациентки) получала терапию метронидазолом 500 мг 2 р./сут в течение 7 дней, группа 2 (24 пациентки) — орнидазолом (Дазолик®) по 500 мг 2 р./сут в течение 5 дней. Группу контроля составили 25 женщин без трихомонадной и гинекологической патологии. Исследование было открытым краткосрочным проспективным рандомизированным. План исследования соответствовал положениям Хельсинкской декларации Всемирной медицинской ассоциации последнего пересмотра, все пациентки дали письменное согласие на участие в исследовании.
Всем пациенткам был проведен комплекс исследований, включавший осмотр врача-дерматовенеролога, микроскопию нативного мазка, изучение микробиоценоза влагалища с помощью тест-системы «Флороценоз-16» для видовой идентификации и количественного анализа микрофлоры. В вагинальном секрете было исследовано содержание IL-6, IL-8, IFN-γ. Для определения цитокинов были использованы соответствующие тест-системы ООО «Цитокин» (Санкт-Петербург). Цифровой материал обрабатывали методом вариационной статистики с помощью пакета прикладных программ Statistica for Windows 8.
Все используемые в работе методы были стандартизированы в рамках GСP и выполнялись строго в соответствии с протоколом исследования.
Результаты и обсуждение
До начала терапии все пациентки предъявляли жалобы на выделения с неприятным запахом, жжение, зуд гениталий. При клиническом осмотре были выявлены гиперемия и отечность слизистой оболочки вульвы, влагалища, серо-желтые, жидкие пенистые вагинальные выделения с неприятным запахом. Исследование микробиоценоза показало резкое угнетение резидентной лактофлоры, присутствие в составе микробной ассоциации G. vaginalis, A. vaginae и P. bivia. Количество нейтрофильных гранулоцитов — 42±4 в цервикальном канале и 46±4 во влагалище. Содержание IL-6, IL-8, TNF-α в вагинальном секрете больных с мочеполовым трихомониазом было достоверно повышено.
Через месяц после окончания терапии всем пациенткам был выполнен клинико-лабораторный контроль. Этиологическая эффективность терапии в группе 1 составила 95,6% (у одной пациентки выявлен T. vaginalis), в группе 2 этот возбудитель не был выявлен.
Содержание IL-6, IL-8, TNF-α в вагинальном секрете у больных мочеполовым трихомониазом было достоверно повышено до лечения. По нашему мнению, повышенное по сравнению с контрольными значениями содержание вышеуказанных цитокинов может быть связано с характером воспалительного процесса. Являясь продуктами активированных моноцитов, макрофагов, нейтрофилов, Т-хелперов первого порядка, фибробластов и эндотелиальных клеток, провоспалительные цитокины обеспечивают развитие воспалительного ответа, и от их количества, возможно, зависит характер клинических симптомов у больных [1, 6, 7]. Нормальный пролиферативный ответ определяет прежде всего продукция TNF-α — важнейшего цитокина первой фазы иммунного ответа, служащего индуктором Т- и В-клеточного иммунитета. Иммунологическое исследование пациенток с мочеполовым трихомониазом выявило значительное увеличение спонтанного выброса TNF-α. У инфицированных женщин содержание исследуемого полипептида колебалось в пределах 2,47±0,23 нг/мл. В группе контроля показатели TNF-α составили в среднем 2,02±0,04 нг/мл. Учитывая, что TNF-α продуцируется моноцитами, макрофагами и Тh1-лимфоцитами, повышение его уровня у инфицированных женщин, очевидно, надо толковать как свидетельство повышения активизации клеточноопосредованных иммунных реакций, дисфункция которых часто встречается у больных с урогенитальным трихомониазом [6, 7]. Однако после проведенной терапии у пациенток, получавших метронидазол (группа 1), при общей тенденции к снижению уровень провоспалительных цитокинов оказался достоверно выше, чем у пациенток, получавших орнидазол (табл. 1).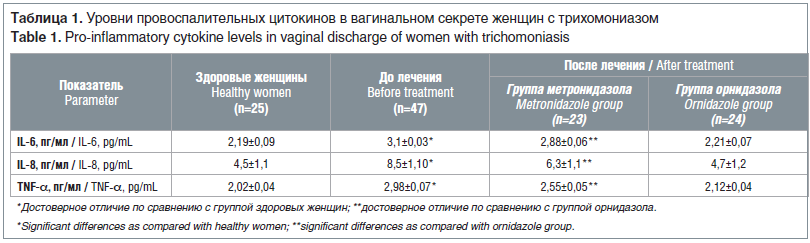
Возможно, это связано с тем, что у пациенток группы 1 были выявлены значительные дисбиотические нарушения на уровне вагинального биотопа.
Объективный осмотр показал, что у пациенток группы 1 выделения имели творожистый вид, слизистая оболочка влагалища и шейки матки была умеренно отечна, гиперемирована, при микроскопии выявлены грибы рода Candida у 6 (26%) пациенток. При рН-метрии вагинального отделяемого среднее значение рН в группе 1 составило 5,1±0,2, в группе 2 — 4,5±0,21. В группе 1 у 4 (17,4%) пациенток сохранялись клинико-лабораторные признаки воспалительного процесса, среднее число лейкоцитов в вагинальном отделяемом составило 26,4±1,2, в группе 2 лишь у одной пациентки присутствовала умеренная гиперемия слизистой оболочки влагалища, но количество нейтрофильных гранулоцитов было в пределах референсных значений.
Количественный анализ лактофлоры показал, что в группе 1 наблюдались лактобактерии: 103 геном-эквивалентов/мл (ГЭ/мл) у 56,5%; 104 ГЭ/мл у 34,7%; 105 ГЭ/мл у 8,8% пациенток. В группе 2 эти показатели распределились следующим образом: 104 ГЭ/мл у 58,3%; 105 ГЭ/мл у 25,0%; 106 ГЭ/мл у 16,8% (табл. 2).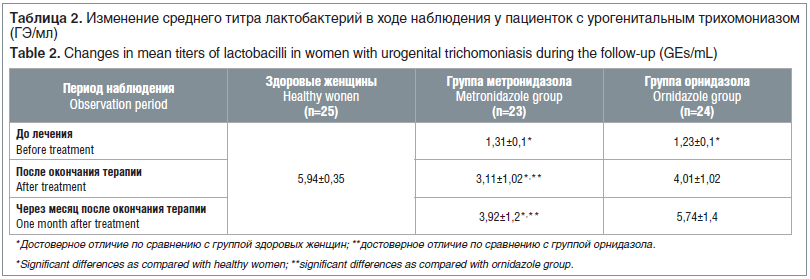
Также следует отметить, что в группе пациенток, получавших орнидазол (группа 2), качественный состав микрофлоры был представлен в основном морфотипами лактобактерий и умеренным количеством кокковой флоры. У пациенток группы 1 в состав микробной ассоциации входили энтеробактерии, β-гемолитический стрептококк, грибы рода Candida.
Следует отметить, что орнидазол имеет ряд преимуществ перед метронидазолом при лечении трихомонадной инфекции. Орнидазол субъективно легче переносится, не оставляет неприятного металлического привкуса во рту, не дает дисульфирамоподобной реакции, курс лечения этим препаратом на 2 дня короче, чем метронидазолом.
Выводы
Препарат орнидазол (Дазолик®) в дозе 500 мг 2 р./сут в течение 5 дней показал высокую эффективность и безопасность в терапии урогенитального трихомониаза у женщин репродуктивного возраста.
Лечение препаратом Дазолик® более выраженно снижает уровни провоспалительных цитокинов в вагинальном секрете, не угнетает резидентную флору влагалища.
Сведения об авторах:
Летяева Ольга Ивановна — д.м.н., доцент, профессор кафедры дерматовенерологии, ORCID iD 0000-0002-9085-6229;
Зиганшин Олег Раисович — д.м.н., профессор, заведующий кафедрой дерматовенерологии, ORCID iD 0000-0002-5857-0319.
ФГБОУ ВО ЮУГМУ Минздрава России. 454092, Россия, г. Челябинск, ул. Воровского, д. 64.
Контактная информация: Летяева Ольга Ивановна, e-mail: olga-letyaeva@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.03.2019.
About the authors:
Olga I. Letyaeva — MD, PhD, Professor of the Department of Dermatovenerology, ORCID iD 0000-0002-9085-6229;
Oleg R. Ziganshin — MD, PhD, Professor, Head of the Department of Dermatovenerology, ORCID iD 0000-0002-5857-0319.
South Ural State Medical University. 64, Vorovskogo str., Chelyabinsk, 454092, Russia.
Contact information: Olga I. Letyaeva, E-mail: olga-letyaeva@yandex.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.03.2019.
Информация с rmj.ru






