Введение
Токсокароз — зоонозный геогельминтоз, источником которого являются животные семейств псовых и кошачьих, широко распространен во всем мире. Возбудители инвазии — круглые черви рода Toxocara [1]: Toxocara canis, реже Toxocara cati, Toxocara leonina. Человек заражается при употреблении в пищу продуктов, загрязненных почвой, контаминированной инвазионными яйцами данных аскаридат [2].
Первые данные о заболевании токсокарозом человека были представлены в 1950-х гг. [3]. Исследователи описывали случаи обнаружения личинок Toxocara spp. в энуклеированных глазах детей, оперированных в связи с подозрением на ретинобластому [4]. При гистологическом исследовании сетчатки глаз были обнаружены гранулематозные поражения, содержащие личинки Toxocara spp. [3, 4]. В 1952 г. P. Beaver et al. сообщили о серии случаев заболевания детей с одинаковыми клиническими симптомами (лихорадка, эозинофильная реакция, полиорганность поражений) [4]. На основании результатов дальнейших исследований [5–8] авторами были классифицированы следующие клинические формы инвазии: висцеральная, глазная, неврологическая, латентная и распространенный токсокароз, а также нейротоксокароз.
В настоящее время токсокароз остается одной из наиболее сложных медицинских проблем. Многообразие клинических форм, отсутствие достоверных неинвазивных способов диагностики этого гельминтоза являются основными причинами гипо- или гипердиагностики
токсокароза [7–9]. Несмотря на относительно доброкачественное течение инвазии (за период ее официальной регистрации не отмечено ни одного летального исхода), токсокароз нередко приводит к осложнениям в форме различных хронических заболеваний, связанных с воздействием возбудителя на иммунную систему человека [10]. Более того, клинически манифестный токсокароз, протекающий с выраженными изменениями показателей периферической крови, требует проведения дифференциальной диагностики с заболеваниями крови, ошибки в выявлении которых могут привести к фатальному исходу.
Одним из наиболее широко применяемых методов диагностики токсокароза на сегодняшний день является твердофазный иммуноферментный анализ (ИФА) с целью определения иммуноглобулинов класса G (IgG) к Toxocara canis. Однако данный метод имеет ряд естественных ограничений, и на территориях, где регистрируется высокая степень контаминации объектов окружающей среды яйцами аскаридат и, соответственно, значительная доля серопозитивных лиц среди условно здорового населения, неверная интерпретация результатов ИФА может привести к диагностическим ошибкам, а значит, к неверному выбору тактики ведения больного [11].
Анализ данных литературы последних 5 лет свидетельствует о том, что в настоящее время недостаточно внимания уделяется вопросам диагностики, лечения и профилактики токсокароза.
Цель исследования: оптимизация диагностики токсокароза на основе анализа эпидемиологических, клинических и лабораторных показателей.
Материал и методы
Материалом для настоящей работы явились данные официальной статистической отчетности за период 2014–2018 гг., материалы государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году» [12]. Проведен ретроспективный анализ 57 медицинских карт больных (40 детей и 17 взрослых), получавших лечебно-диагностическую помощь в клинике инфекционных и паразитарных болезней ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора в 2015–2018 гг. Критерием включения в исследование был направительный диагноз «токсокароз».
Всем больным проводилось стандартное обследование в соответствии с общепринятой клинической практикой: общий анализ крови, общий анализ мочи, биохимические тесты функции печени, поджелудочной железы. Кроме того, с целью исключения других паразитарных инвазий выполнялись исследования биологического материала специальными методами обогащения в соответствии с методическими указаниями [13]. Для серологической диагностики токсокароза использовали ИФА с целью выявления специфических IgG к Toxocara canis с помощью диагностической тест-системы «Токсокар-IgG-ИФА-БЕСТ» производства ЗАО «Вектор-Бест» в соответствии с методическими указаниями [14].
Статистическую обработку полученных данных проводили с использованием программ Microsoft Excel 2010 и Statistica 6.0. Использовали метод корреляции Пирсона (r), непараметрический критерий Крускала — Уоллиса. Статистически значимым считали результат при t>2, при котором р=0,05.
Результаты
По данным официальной статистической отчетности [15–18], в последние годы отмечается снижение заболеваемости токсокарозом населения Российской Федерации (рис. 1).
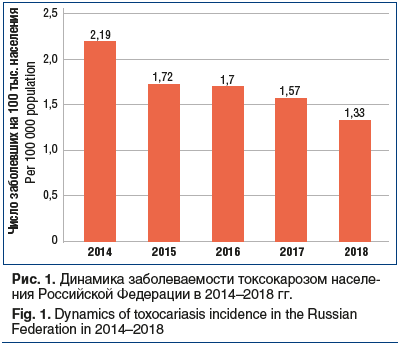
В 2018 г. данный показатель составил 1,33 на 100 тыс. населения, что в 1,6 раза ниже, чем в 2014 г. По данным государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году», в структуре больных токсокарозом доля детского населения в возрасте от 0 до 17 лет составила 35%, доля сельских жителей — 43,7%, из них детей — 35,3% [12].
При обследовании по месту жительства у всех 57 проанализированных нами больных были положительные результаты ИФА с токсокарозным антигеном, однако диагноз «токсокароз» был верифицирован в 26 случаях (у одного взрослого и 25 детей). Окончательный диагноз устанавливали на основании клинических и лабораторных данных: геофагии, эозинофилии, лейкоцитоза и анемии периферической крови, положительного результата ИФА с токсокарозным антигеном с учетом эпидемиологического анамнеза. У остальных пациентов были диагностированы другие заболевания, в т. ч. паразитарные инвазии.
Динамика числа случаев верифицированного токсокароза в клинике ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора показывает снижение числа впервые выявленной инвазии по годам: 12 случаев токсокароза в 2016 г., 9 случаев в 2017 г. и 4 случая в 2018 г., что коррелирует с данными официальной статистики (r=0,9; р=0,05).
Среди пациентов с верифицированным диагнозом «токсокароз» доля детей в возрасте от 1 года 1 мес. до 10 лет составила 96% (рис. 2). Принимая во внимание, что токсокароз был диагностирован только у 1 взрослого пациента, его исключили из исследования.
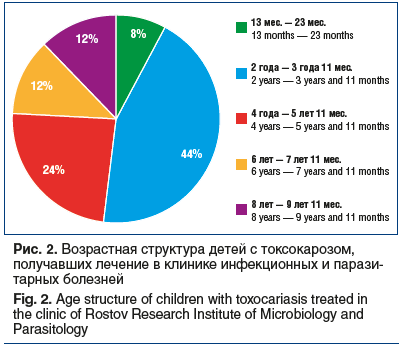
Анализ возрастной структуры больных токсокарозом свидетельствует о том, что наиболее часто подвержены инвазии дети младшего дошкольного возраста. Доля больных токсокарозом в возрасте от 2 лет до 5 лет 11 мес. составила 68%.
Анализ данных эпидемиологического анамнеза показал, что 13 (52%) детей были жителями сельской местности, проживали в домах с приусадебными участками и домашними животными (собаками, кошками). В городе проживали 12 (48%) человек, однако из них 3 ребенка в летнее время постоянно находились у родственников в деревне, а еще трое проживали в условиях частных домовладений в Ростове-на-Дону, Таганроге и Новочеркасске. Таким образом, тесный контакт с почвой наблюдался у 19 (76%) человек.
Из медицинских карт больных установлено, что выраженные клинические проявления регистрировались у 16 (64%) пациентов, 9 (36%) детей были выявлены по месту жительства при плановой диспансеризации в связи с обнаружением эозинофилии в периферической крови. Таким образом, в соответствии с клиническими формами инвазии были определены две группы больных: со скрытым и манифестным висцеральным токсокарозом.
Анализ результатов лабораторного обследования показал, что лейкоцитоз, анемия и лейкемоидная реакция эозинофильного типа регистрировались у всех больных. Коэффициент позитивности (КП) в ИФА с токсокарозным антигеном был выше 7 (табл. 1). Статистический анализ результатов лабораторного обследования детей показал отсутствие значимых различий в группах со скрытым и клинически манифестным токсокарозом (непараметрический критерий Крускала — Уоллиса: 0,696).

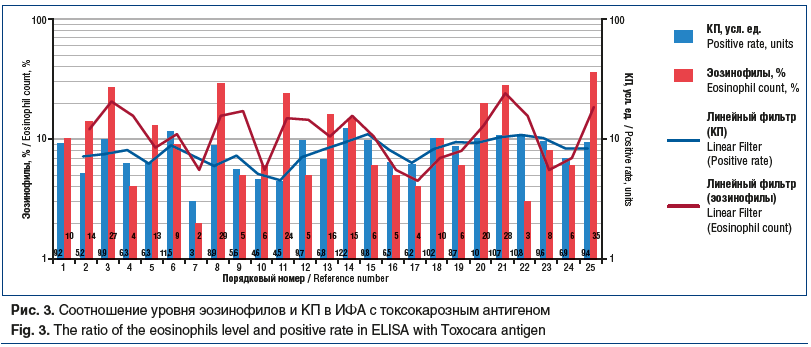
Следует отметить, что корреляции между уровнем эозинофилов и КП в ИФА с токсокарозным антигеном также не установлено (r=0,1; р=0,05; рис. 3).
Данные медицинских карт показали, что выраженная геофагия отмечалась у 14 детей с висцеральной формой заболевания, также в данной группе у 7 (28%) детей регистрировалась лихорадка, у 3 (12%) — уртикарная сыпь, у 3 (12%) — лимфаденопатия, у 4 (16%) — диспепсические явления (боли в животе, тошнота, снижение аппетита).
Обсуждение
В отличие от большинства зарубежных стран [19] в Российской Федерации токсокароз подлежит обязательной регистрации, а о каждом случае заболевания информация поступает в органы Роспотребнадзора, что позволяет иметь относительно полное представление о заболеваемости данной инвазией в субъектах Российской Федерации.
Результаты нашего исследования свидетельствуют в пользу улучшения эпидемиологической ситуации по токсокарозу и соответствуют как данным официальной статистической отчетности, государственного доклада Роспотребнадзора «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году», так и данным литературы [20]. Однако в отличие от федеральной статистической отчетности и результатов исследования ряда ученых, позиционирующих токсокароз как урбанистическую патологию преимущественно взрослого населения [17, 19, 21], по нашим данным, на юге России инвазии подвержены в первую очередь дети раннего возраста до 4 лет (52%), проживающие в условиях частных домовладений (76%). Такое несоответствие может быть связано с отсутствием надежных методов лабораторной диагностики инвазии, что приводит к гипердиагностике токсокароза у взрослого населения и гиподиагностике у детей, среди которых инвазия нередко протекает бессимптомно (по нашим данным, в 36% случаев). В регионах, где почва контаминирована яйцами токсокар, регистрируется значительная доля серопозитивных в отношении IgG к Toxocara canis среди условно здорового населения, что является одной из причин гипердиагностики токсокароза [9]. Положительный результат ИФА с токсокарозным антигеном регистрируется также у больных, страдающих аллергиями и другими паразитарными болезнями [22, 23]. Это соответствует полученным нами данным: из 57 больных с положительным результатом ИФА у 54,4% были верифицированы иные паразитарные или системные
болезни.
Одним из наиболее постоянных неспецифических признаков глистной инвазии является эозинофилия [24]. По нашим данным, этот показатель при токсокарозе у детей варьировал от 15,6±9,31% при скрытом токсокарозе до 25,5±15,0% при висцеральном. В некоторых случаях эозинофилия превышала 60%, что в сочетании с лейкоцитозом, анемией и ускоренной СОЭ требовало дифференциальной диагностики с заболеваниями крови. В таких клинических ситуациях серологические исследования с целью выявления специфических иммуноглобулинов к Toxocara canis играли важную роль в обосновании клинического диагноза.
Заключение
Несмотря на положительную динамику эпидемиологической ситуации, токсокароз на сегодняшний день остается социально значимой проблемой здравоохранения. Это обусловлено многообразием клинических проявлений и форм, отсутствием патогномоничных признаков инвазии и достоверных методов специфической диагностики, вследствие чего имеют место ошибки и поздняя диагностика заболевания. Для своевременной диагностики инвазии у детей на территориях, где регистрируются заболеваемость токсокарозом и высокая контаминация окружающей среды инвазионными яйцами геогельминтов, целесообразно исследование периферической крови, в первую очередь у детского населения, не реже 1 раза в год в осенний период. При выявлении эозинофилии периферической крови показано дальнейшее обследование с применением чувствительных и специфичных методов, в т. ч. ИФА с токсокарозным
антигеном.
Сведения об авторах:
Андреева Анна Олеговна — врач-инфекционист клиники инфекционных и паразитарных болезней, ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора, 344000, Россия, г. Ростов-на-Дону, пер. Газетный, д. 119; ORCID iD 0000-0001-5299-0737.
Головченко Наталья Владимировна — врач клинической лабораторной диагностики клиники инфекционных и паразитарных болезней, ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора, 344000, Россия,
г. Ростов-на-Дону, пер. Газетный, д. 119; ORCID iD 0000-0002-3683-1776.
Журавлев Андрей Сергеевич — студент Центра инновационных образовательных программ «Медицина будущего», ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), 119991, Россия,
г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-9130-707X.
Контактная информация: Андреева Анна Олеговна, e-mail: andreev5691.93@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 12.08.2019, поступила после рецензирования 06.09.2019, принята в печать 30.09.2019.
About THE authors:
Anna O. Andreeva — infectious disease physician in the clinic of infectious and parasitology diseases, Rostov Research Institute of Microbiology and Parasitology of the Federal Service for Surveillance on Consumer Rights Protection and Human Wellbeing, 119, per. Gazetnyi,
Rostov-on-Don, 344000, Russian Federation; ORCID iD 0000-0001-5299-0737.
Natalia V. Golovchenko — clinical pathologist in the clinic of infectious and parasitology diseases, Rostov Research Institute of Microbiology and Parasitology of the Federal Service for Surveillance on Consumer Rights Protection and Human Wellbeing, 119, per. Gazetnyi, Rostov-on-Don, 344000, Russian Federation; ORCID iD 0000-0002-3683-1776.
Andrei S. Zhuravlev — student of the Center for Innovative Educational Programs “Medicine of the Future”, Sechenov University, 8 bld. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-9130-707X.
Contact information: Anna O. Andreeva, e-mail: andreev5691.93@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 12.08.2019, revised 06.09.2019, accepted 30.09.2019.
.
Информация с rmj.ru





