Терапия коморбидного больного сахарным диабетом: фокус на гипогликемию
А. Л. Вёрткин, доктор медицинских наук, профессор
А. С. Скотников, кандидат медицинских наук
А. Ю. Магомедова
О. В. Ястребова
С. С. Казарцева
М. П. Алиев
П. Д. Алиева
ГБОУ ВПО МГМСУ им А. И. Евдокимова МЗ РФ, Москва
Сахарный диабет (СД) — группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, которая является результатом недостаточности секреции и действия инсулина либо обоих факторов (Всемирная Организация Здравоохранения, 1999 г.). В связи с высокой инвалидизацией и смертностью пациентов (СД занимает третье место после сердечно-сосудистой патологии и злокачественных новообразований) лечение и профилактика СД признаны одним из приоритетных направлений для национальных систем здравоохранения. В России примерное число больных СД 2-го типа составляет 3 млн человек, 75% из которых находятся в состоянии декомпенсации углеводного обмена и получают сахароснижающую терапию.
«Золотым стандартом» контроля гликемии признано определение уровня гликированного гемоглобина (HbA1с) — стабильного соединения гемоглобина с глюкозой, образующегося в результате неферментативной химической реакции гемоглобина А, содержащегося в эритроцитах, с глюкозой крови. Многочисленные проспективные и эпидемиологические исследования, в частности DCCT (Diabetes Controland Complications Trial) [1] и UKPDS (United Kingdom Prospective Diabetes Study), убедительно показали тесную взаимосвязь между уровнем HbA1с и риском развития осложнений СД [2].
Также показано, что содержание HbA1с отражает средний уровень гликемии за предшествующие 3 месяца. Согласно данным UKPDS, снижение уровня HbA1с на 1% приводит к снижению смертности на 21%, риска возникновения инфаркта миокарда — на 14%, инсульта — на 12%, микрососудистых осложнений — на 37%, ампутаций нижних конечностей — на 43%.
Еще одним важным обстоятельством в ведении больных СД 2-го типа является избежание гипогликемий. Частота развития гипогликемических состояний остается крайне высокой несмотря на доступные методы самоконтроля гликемии и большое разнообразие сахароснижающих препаратов. Понятие «гипогликемия» включает в себя все эпизоды снижения уровня глюкозы, которые могут принести потенциальный вред организму не только путем прямого воздействия, но и вследствие нарушения контррегуляции и чувствительности к гипогликемиям. Выделяют пять основных групп гипогликемий (табл. 1).
В данной классификации отражаются не только показатели гликемии, но и выраженность основных ее проявлений. Хорошо известно, что некоторые пациенты с постоянным неудовлетворительным гликемическим контролем испытывают симптомы гипогликемии при уровне глюкозы плазмы > 3,9 ммоль/л. Эти симптомы вызывают состояние дистресса и ограничивают достижение оптимального гликемического контроля.
В связи с этим в отечественных рекомендациями по ведению пациентов, страдающих СД, гипогликемия характеризуется как снижение глюкозы плазмы менее 2,8 ммоль/л, сопровождающееся определенной клинической симптоматикой или ниже 2,2 ммоль/л вне зависимости от наличия симптомов.
В клинической картине гипогликемий выделяют вегетативные и нейрогликопенические проявления. Вегетативные симптомы выходят на первый план при остром понижении уровня глюкозы и наиболее часто проявляются в виде гипергидроза, беспокойства, тремора конечностей, тахикардии и ощущения перебоев в работе сердца, а также стенокардии. К нейрогликопеническим симптомам (преобладают при постепенном понижении уровня глюкозы) относят головокружение, спутанность сознания, нарушения зрения, парестезии, судороги, кому.
«Запуск» контринсулярной секреции реализуется в следующем порядке: происходит выброс глюкагона, затем адреналина, соматотропного гормона и кортизола. В основе патогенеза начальных симптомов гипогликемии лежит гипоксия корковых отделов головного мозга. В дальнейшем происходит мощная стимуляция автономной нервной системы, высвобождение большого количества катехоламинов, что, в совокупности, оказывает значительный гемодинамический эффект, потенцирование гемостаза и коагуляции. Эти процессы могут приводить к изменениям регионарного кровотока и провоцировать миокардиальную или церебральную ишемию, вызывая инфаркт миокарда (ИМ), сердечную недостаточность или инсульт. Однако опасность заключается не только в острых сосудистых катастрофах. Лишая мозг глюкозы, гипогликемия в ведет к долгосрочным нарушениями восприимчивости и памяти. Тяжелые гипогликемии приводят к выраженным когнитивным нарушениям, по этой причине они особенно опасны в пожилом возрасте, а также при наличии сопутствующих заболеваний.
Высвобождение катехоламинов в ответ на гипогликемию ведет к снижению уровня калия плазмы, что отражается на изменениях электрокардиограммы (ЭКГ), включая удлинение интервала QT, и процессах реполяризации миокарда, что у ряда пациентов может приводить к возникновению сердечных аритмий. Из результатов исследования VADT (Veterans Affairs Diabetes Trial) известно, что тяжелые гипогликемии являются предикторами развития ИМ и острого нарушения мозгового кровообращения (ОНМК) [3]. В другом масштабном проекте — рандомизированном двухфакториальном исследовании ACCORD (Action to Control Cardiovascular Risk in Diabetes) показана более высокая смертность у пациентов с зарегистрированными гипогликемическими эпизодами независимо от применяемой к ним терапевтической стратегии [4]. Так, у пациентов с СД 2-го типа без гипогликемических эпизодов общий показатель смертности за год составил 1,2%, а при наличии гипогликемий — 3,3%.
Более того, как в группе интенсивного контроля (обязательное достижение уровня гликированного гемоглобина не более 6,9%) смертность была выше в подгруппах с зарегистрированными гипогликемическими эпизодами (2,8% против 1,3% в год), так и в группе стандартного контроля (4,9% против 1,1% в год). По данным других авторов, относительный риск развития ИМ, связанный с перенесенными год назад эпизодами тяжелой гипогликемии, составляет 12%, полгода назад — 20%, 2 недели назад — 65%.
У пациентов с СД 2-го типа, получающих пероральные формы сахароснижающих препаратов, определение HbA1с следует производить 3–4 раза в год, уровень гликемии — ежедневно, а гликемический профиль необходимо наблюдать один раз в неделю. Помимо гликемического контроля, в рамках профилактики и лечения СД, ключевую роль играет мониторинг состояния органов-«мишеней». Осмотр пациента окулистом, неврологом, кардиологом должен осуществляться не реже одного раза в год, контроль биохимического анализа крови, клинического анализа мочи — также один раз в год, а микроальбуминурии — два раза в год [5]. Ведущая роль в реализации диабетологической помощи населению в России отведена эндокринологам-диабетологам городских и областных амбулаторно-поликлинических учреждений, однако официальной статистики частоты гипогликемий у больных СД в поликлинике нет.
Авторы проанализировали карты амбулаторного пациента 2104 больных СД 2-го типа, находящихся на учете в поликлиниках Северного административного округа (САО) Москвы, в том числе медицинскую документацию 867 пациентов (41,2%), получающих пероральную сахароснижающую терапию. Данным пациентам были предложены для заполнения анкеты, в которых больным следовало указать свои паспортные данные, возраст, стаж СД, составляющие сахароснижающей терапии, динамику показателей уровня гликемии (минимальные и максимальные), кратность контроля уровня глюкозы, режим питания, наличие или отсутствие коррекции терапии, сопутствующие заболевания, а также осложнения СД. Средний возраст пациентов составил 61,2 ± 11,3 года. Стаж сахарного диабета в среднем составил 6,0 ± 2,1 года. Из общего числа больных СД, получающих сахароснижающую терапию (n = 867), были сформированы две группы.
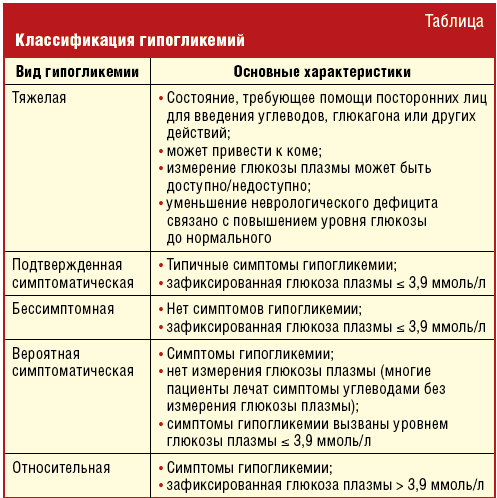
В первую группу вошли 512 пациентов (59%), не знакомых с гипогликемией, и 355 пациентов (41%), перенесших гипогликемические состояния (субъективные и/или объективные). Среди них были 291 женщина (83%) и 64 мужчины (17%), при этом данные больные различались по кратности возникновения гипогликемических состояний. Так, из 355 пациентов 78 (22%) отмечали гипогликемии несколько раз в месяц, 224 (63%) — несколько раз в год, а у 53 (15%) гипогликемии возникали однократно (рис. 1).
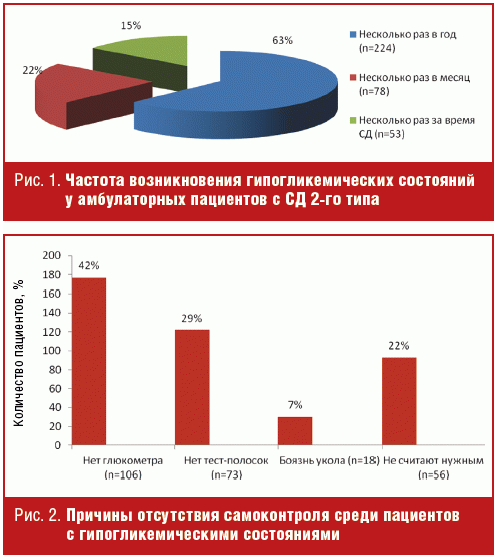
Из 355 больных 253 (72%) в своих ответах ориентировались сугубо на клинические эквиваленты гипогликемий, в том числе 42% (n = 106) не имели дома глюкометров, 73 (29%) — обладали глюкометрами, но не имели тест-полосок к ним, 18 (7%) больных — боялись уколов и 56 (22%) пациентов — в принципе не видели необходимости в измерении уровня гликемии. Только у 99 (28%) больных гипогликемия (ниже 3,9 ммоль/л) имела под собой лабораторное подтверждение (рис. 2).
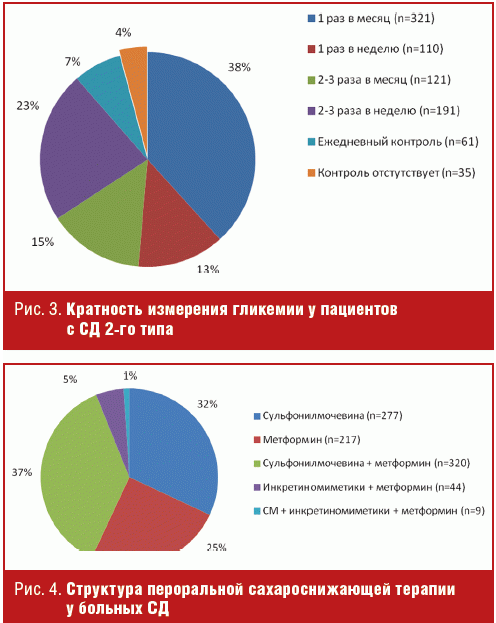
При анализе кратности самоконтроля гликемии из всех опрошенных пациентов лишь 319 больных (37%) измеряют ее 1 раз в месяц в поликлинике по месту жительства, 110 (16%) — 1 раз в неделю, 121 (14%) — 2–3 раза в месяц, 191 (22%) — 2–3 раза в неделю, 35 (4%) — не контролируют гликемию вообще и лишь 61 человек (7%) осуществляет ежедневный самоконтроль (рис. 3).
Учитывая полученные данные (низкий процент пациентов, осуществляющих самоконтроль), можно предположить большой удельный вес больных, которые испытывают «скрытые» (бессимптомные) и ночные гипогликемии.
Кроме того, у пациентов, получающих пероральные формы препаратов (n = 867), отдельно была проанализирована структура этой сахароснижающей терапии. Так, препараты сульфонилмочевины амбулаторно получают 32% больных (n = 277), бигуаниды (метформин) — 25% пациентов (n = 217), комбинацию этих классов препаратов — 37% больных (n = 320), в то время как комбинацию инкретиномиметиков и метформина получают лишь 5% пациентов (n = 44), а комбинацию инкретиномиметиков с сульфаниламидами и метформином только 1% больных СД (n = 9) (рис. 4).
Структура сахароснижающей терапии в группе пациентов, отмечающих в анамнезе гипогликемические состояния (n = 355), была следующей: 134 пациента (38%) получали препараты сульфонилмочевины (глибенкламид, гликлазид, глимепирид) в различных дозах и с разной кратностью приема, 82 человека (23%) — в комбинации с препаратами метформина, 99 больных (28%) — комбинированный препарат сульфонилмочевины + метформин в различных дозах, 36 пациентов (10%) — метформин в дозе 2,5 грамма в сутки, 4 человека (1%) — инкретиномиметики в комбинации с препаратами сульфонилмочевины (рис. 5).
Анализируя полученные данные, видно, что частота встречаемости гипогликемических состояний у пациентов, получающих препараты сульфонилмочевины в различных комбинациях с другими лекарственными группами, составляет 53%, тогда как при применении инкретиномиметиков гипогликемические состояния отмечаются лишь у 8% пациентов (n = 4). Коррекция сахароснижающей терапии у 149 (42%) пациентов не осуществлялась, у 75 (21%) коррекция производилась в рамках одной группы препаратов в рамках изменения дозы. Примерно треть пациентов — 99 (28%) выходили из гипогликемического состояния амбулаторно, 5 пациентам (1,4%) потребовалась экстренная госпитализация.
Низкая частота гипогликемических состояний на фоне приема инкретиномиметиков в целом и вилдаглиптина (Галвус) в частности может быть объяснена физиологичностью их механизма действия, в основе которого лежит блокирование фермента дипептилпетидазы-4 (ДПП-4), ответственного за инактивацию инкретинов (ГПП-1, ГИП), вырабатывающихся в кишечнике. В результате этого увеличивается как базальная, так и стимулированная приемом пищи секреция глюкагоноподобного пептида 1-го типа (ГПП-1) и глюкозозависимого инсулинотропного полипептида из кишечника в системный кровоток в течение всего дня. Инсулинотропный эффект в данном случае носит глюкозозависимый характер, что обеспечивает снижение риска гипогликемических состояний.
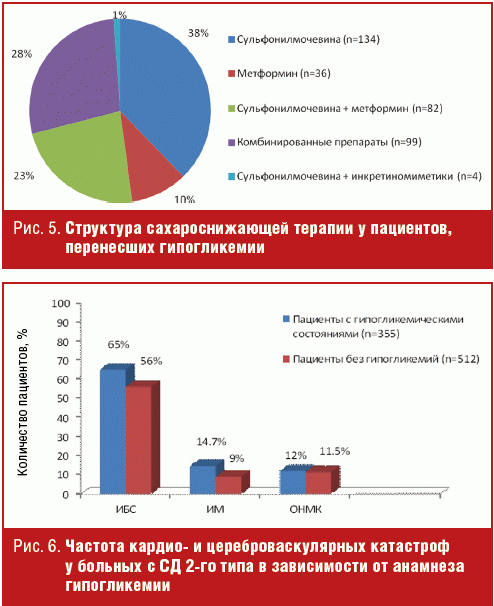
Среди сопутствующих заболеваний в группе пациентов с гипогликемиями в анамнезе (n = 355) у 231 больного (65%) имела место ишемическая болезнь сердца (ИБС), 52 человека (14,7%) перенесли инфаркт миокарда и 43 пациента (12%) — инсульт. Кроме того, у 43 больных (12,2%) отмечались различные нарушения сердечного ритма. В группе больных без анамнеза гипогликемий (n = 512) ИБС имела место у 287 человек (56%), ИМ перенесли ранее 67 пациентов (13%), а инсульт — 46 человек (9%). Нарушениями сердечного ритма страдали 59 пациентов (11,5%) этой группы (рис. 6).
Очевидно, что высокие показатели смертности от ИБС и мозгового инсульта обусловлены значительной распространенностью артериальной гипертензии (АГ) среди населения, тяжелым коморбидным фоном большинства пациентов и недостаточной эффективностью рекомендуемой терапии.
Учитывая широкую распространенность у пациентов с СД различной сосудистой патологии в целом и АГ в частности, выбирая лекарственное средство для коррекции артериального давления у больных с нарушениями углеводного обмена, каждый врач должен учитывать метаболический профиль препаратов. Считается, что наименьшим профилем безопасности в отношении усугубления СД обладают бета-адреноблокаторы и тиазидные диуретики (ВНОК, 2009), хотя ряд исследований показал метаболический нейтралитет высокоселективных представителей данных классов.
Наиболее метаболически нейтральными препаратами являются ингибиторы ангиотензинпревращающего фермента (АПФ), сартаны и антагонисты кальция (АК), которые играют немаловажную роль в лечении АГ, в том числе и у пациентов с СД. Существует несколько поколений АК, отличающихся различными механизмами действия, химической структурой и селективностью.
Клинические и гемодинамические эффекты АК складываются из их воздействия на миокард, проводящую систему сердца, гладкомышечные клетки коронарных, мозговых и периферических сосудов. Способность расширять коронарные артерии явилась поводом для их применения при лечении ишемической болезни сердца, а периферическая вазодилатация — для лечения АГ.
Все АК различаются по продолжительности действия: нифедипин, верапамил, дилтиазем являются короткодействующими лекарственными веществами, а поэтому для поддержания постоянного эффекта их необходимо назначать 3–4 раза в день, что крайне неудобно в ежедневной многолетней терапии пациентов с АГ. К АК пролонгированного действия относятся либо специальные лекарственные формы нифедипина, верапамила и дилтиазема, обеспечивающие равномерное высвобождение препарата в течение длительного времени (препараты II поколения), либо препараты иной химической структуры, обладающие способностью более длительно циркулировать в организме (препараты III поколения: амлодипин, лацидипин). Последние не только более удобны в назначении, но и более безопасны ввиду значительно меньших колебаний их концентраций в крови больного. Амлодипин (Амлотоп) отличается от других препаратов высокой биодоступностью (до 80%), незначительными различиями в минимальной и максимальной концентрациях в течение суток, а также сверхдлительным действием (до 36 часов).
Антигипертензивное действие АК обусловлено уменьшением силы и частоты сердечных сокращений (отрицательное ино-, дромо- и хронотропное действие), замедлением тока ионов кальция через альфа-1,2-адренергические пути и на кальциевые каналы периферических сосудов, уменьшением чувствительности артериальных сосудов к эндогенным влияниям норадреналина, вазопрессина, гистамина, серотонина, ацетилхолина, снижением общего периферического сосудистого сопротивления, периферической вазодилатацией и снижением постнагрузки на сердце.
Амлодипин наиболее эффективно снижал риск общей смертности, частоту возникновения ишемической болезни сердца и ее осложнений, мозгового инсульта и оказался сопоставимым по эффективности с ингибиторами АПФ [6].
По данным многонационального исследования VALUE, в группе амлодипина риск развития инфаркта миокарда был на 19% ниже, также выявлено достоверное снижение числа инсультов, контроль артериального давления при монотерапии достигался у 63% больных, находившихся под наблюдением [7].
Безопасность амлодипина оценивалась более чем у 2,5 тысяч больных АГ в различных плацебо-контролируемых исследованиях. Большинство побочных эффектов амлодипина (головная боль, отеки, приливы крови) были небольшими или умеренными по выраженности и зависели от дозы препарата. Амлодипин практически не воздействует на вегетативный статус и метаболически нейтрален, а поэтому доступен для длительной терапии пациентов с АГ, СД и высоким риском гипогликемических состояний.
Таким образом, на основании полученных данных можно констатировать, что среди амбулаторных больных имеет место высокая распространенность АГ и СД, а также недостаточный контроль уровня гликемии, мониторирования осложнений СД и обучения больных с нарушениями углеводного обмена. У большинства пациентов коррекция терапии осуществляется на основании разовых измерений гликемии и в рамках одной группы препаратов, что не позволяет добиться компенсации углеводного обмена. Таким образом, организационной и клинической работе терапевтов, кардиологов и эндокринологов поликлиник требуется совершенствование с аспектом на прогностическую значимость гипогликемических состояний коморбидных больных СД 2-го типа, получающих сахароснижающую терапию.
Литература
- The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus // N Engl J Med. 1993. 329 (14): 977–986.
- United Kingdom Prospective Diabetes Study Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes // Lancet. 1998. 352 (9131), 837–853.
- Veterans Affairs Diabetes Trial Study Group. Ethnicity, race, and clinically significant macular edema // Diabetes Res Clin Pract. 2009, Nov; 86 (2): 104–110.
- Action to Control Cardiovascular Risk in Diabetes Study Group. Rationale and design for the blood pressure intervention // Am J Cardiol. 2007; 99 (suppl): 44 i-55 i.
- Дедов И. И., Шестакова М. В. Алгоритмы специализированной медицинской помощи пациентам с сахарным диабетом. М., 2009.
- Antihypertensive and Lipid-lowering Treatment to Prevent Heart Attack Trial Research Group. Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic // JAMA. 2002; 288: 2981–2997.
- The Valsartan Antihypertensive Long-term Use Evaluation Study Group. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipin // Lancet. 2004; 363 (9426): 2022–2033.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru



