Введение
Термин «часто болеющие дети» (ЧБД) стал использоваться в отечественной медицинской литературе в начале 1980-х годов. В мировой литературе также дискутируются причины, методы диагностики, лечения и профилактики частых респираторных заболеваний у детей, при этом используется термин «recurrence infections» — «повторные, рецидивирующие инфекции». В данную группу включают детей с повышенной восприимчивостью к респираторным инфекциям, у которых не диагностировано врожденное или приобретенное заболевание, проявляющееся подобной симптоматикой. Наиболее часто критериями включения в группу ЧБД являются: 8 или более эпизодов респираторных инфекций в год у детей в возрасте до 3 лет и 6 или более — у детей старше 3 лет; более 3 отитов за 6 мес. (или более 4 — за 12 мес.); более 3 эпизодов тонзиллита в год; более 3 инфекций нижних дыхательных путей в год [1]. Согласно эпидемиологическим исследованиям от 10 до 15% детей в возрасте до 6 лет в мире страдают рекуррентными респираторными инфекциями. Причины повышенной заболеваемости детей крайне многообразны. К ним относятся: период социализации ребенка (переход из узкого круга семьи в широкий круг детского коллектива, часто сопровождаемый стрессом); повторные инфекционные заболевания и их затяжное или хроническое течение при поздней диагностике и неадекватной терапии; аллергия; анатомические дефекты; иммунодефицитные состояния в результате избыточных физических и эмоциональных нагрузок, недостаточность макро- и микронутриентов; врожденные нарушения иммунной системы — первичные иммунодефициты (ПИД) [1, 2].
С рецидивирующим течением респираторных заболеваний тесно связана активная персистенция вирусов из семейства Herpesviridae, инфицированность которыми населения нашей страны к взрослому возрасту превышает 90% [3]. Герпесвирусные инфекции (ГВИ) являются классическим примером пожизненной оппортунистической инфекции, тяжелая форма которой, как и рецидивирующее, затяжное или хроническое течение, свидетельствует об иммуносупрессии. Вместе с тем любая активно персистирующая инфекция усугубляет имеющийся иммунодефицит, запуская этим порочный круг новых суперинфекций, и часто становится триггером иммунопатологических реакций.
Согласно многочисленным данным литературы обнаружение маркеров активной ГВИ является одной из наиболее частых находок при проведении этиологической диагностики у ЧБД. По данным ФГБУ ДНКЦИБ ФМБА России, при обследовании 243 детей с рекуррентным течением респираторных заболеваний у 86,8% пациентов были выявлены ДНК герпесвирусов в крови или слюне: вируса герпеса человека (ВГЧ) 6-го типа — в 65,4% случаев, вируса Эпштейна — Барр (ВЭБ) — в 63,7%, цитомегаловируса (ЦМВ) — в 30,5%, а в 56,0% случаев диагностирована сочетанная ГВИ. Причем если у дошкольников ДНК герпес-вирусов в большинстве (75,0%) случаев выявляли в крови, то у ЧБД школьного возраста ДНК герпесвирусов выявляли в крови только в 33% случаев [4]. По данным Е.В. Мелехиной и соавт. [5], при обследовании 958 детей с ежемесячными респираторными заболеваниями ДНК и/или ранние антигены ГВИ выявляли в крови у 37% пациентов в возрасте от 1 года до 4 лет и у 26% — старше 4 лет, тогда как у здоровых детей — только в 5,6% случаев. Еще чаще активные формы ГВИ диагностировали у детей с респираторной инфекцией, требующей госпитализации, — у 39% пациентов в возрасте от 1 года до 4 лет и у 43% — старше 4 лет.
Активные ГВИ у ЧБД часто сочетаются с другими персистирующими инфекционными агентами бактериальной, вирусной и протозойной природы. Затяжной, рецидивирующий воспалительный процесс в верхних и нижних дыхательных путях часто приводит к формированию хронической соматической патологии, в первую очередь ЛОР-органов. При обследовании ЧБД в возрасте от 3 до 6 лет мы выявляли стрептококковую инфекцию в 16%, микоплазменную — в 10%, хламидийную — в 4% случаев. У 84% детей с рекуррентными респираторными инфекциями в возрасте от 3 до 6 лет диагностировали хронический аденоидит с обильным ростом условно-патогенных бактериальных возбудителей у половины пациентов. У ЧБД школьного возраста персистирующие инфекции определяются реже, но отмечается высокая частота соматической патологии: хронический тонзиллит у 43% и хронический синусит у 14% детей старше 12 лет, аллергический ринит у 23% детей от 7 до 17 лет [6].
Исследования иммунного статуса ЧБД с хроническим течением ГВИ демонстрируют признаки дефицита преимущественно Т-клеточного звена. Так, в исследовании, проведенном в ФГБУ ДНКЦИБ ФМБА России в 2012 г., при обследовании 54 детей с хронической ГВИ выявлен существенный дефицит клеток с кластерами дифференцировки CD3+, CD4+, CD8+, CD16+ и CD20+, повышение концентрации циркулирующих иммунных комплексов в крови и резко сниженную реакцию бласттрансформации лимфоцитов, стимулированных фитогемагглютинином [7]. Данные катамнестического наблюдения за детьми после перенесенного инфекционного мононуклеоза (ИМ), вызванного первичной ВЭБ-инфекцией, подтвердили прогнозируемые риски хронического течения ГВИ у детей с низким уровнем атипичных мононуклеаров, менее 7,4% от всех Т-цитотоксических лимфоцитов (процент CD8+AM от CD45RA), а также с иммунорегуляторным индексом более 1,2 [8]. В исследовании принимали участие дети с первым эпизодом ИМ, поступившие в инфекционные отделения в разгар болезни. У 16 (15%) пациентов более 6 мес. сохранялись клинические проявления в виде лимфаденопатии, тонзиллита, субфебрилитета, а также обнаруживались лабораторные маркеры активной ГВИ. Анализ показал, что наибольший риск формирования хронической ГВИ у детей имеется при ИМ ВЭБ-этиологии, особенно первичной в моноварианте: у 8 (27,6%) из 29 детей с моно-ВЭБ-инфекцией не отмечалось клинико-лабораторного выздоровления спустя 6 мес. после перенесенного заболевания [8].
В работе И.В. Нестеровой и соавт. [9] также продемонстрирована недостаточность противовирусного иммунитета при обследовании 198 взрослых пациентов, страдающих хроническими моно- и микст-ГВИ: нарушения индуцированной продукции интерферона α и γ, дефицит цитотоксических Т-лимфоцитов, дефицит естественных киллерных клеток и/или неадекватное отсутствие их активации, нейтропения [9].
Таким образом, терапия пациентов с рекуррентным течением респираторных инфекций представляет собой трудную задачу в связи с наличием иммунодефицитного состояния, персистирующей, как правило, сочетанной инфекции, сопутствующей соматической патологии. Эффективность лечения в большой степени зависит от качества клинической и лабораторной диагностики.
В настоящее время в терапии хронических заболеваний, ассоциированных с ГВИ, при сохранении доказанной вирусной активности применяют противовирусные препараты из группы ациклических аналогов нуклеозидов (ацикловир, ганцикловир, валацикловир, валганцикловир, фамцикловир); ациклических аналогов нуклеотидов (цидофовир, адефовир); аналогов пирофосфатов (фоскарнет). Данные препараты подавляют репликативную активность вируса на период лечения, однако не позволяют добиться эрадикации возбудителя. В педиатрии вышеперечисленные препараты, за исключением ацикловира, используются по узким показаниям при тяжелых формах и жизнеугрожающих состояниях из-за своей токсичности и побочных эффектов. Несмотря на рост частоты выявления резистентных штаммов, ацикловир, как правило, высокоэффективен в отношении вирусов простого герпеса (ВПГ) 1-го и 2-го типа, в меньшей степени — в отношении ВЭБ и ВГЧ 3-го типа, в терапии которых используют высокие дозы препарата.
Применение новых высокотехнологичных методов таргетной терапии ГВИ препаратами моноклональных антител, иммунной клеточной CD8+-терапии, трансплантации костного мозга ограничено в силу технических сложностей, отсутствия стандартизированных методик и показано главным образом лицам с выраженными нарушениями иммунитета, гемофагоцитозом, посттрансплантационными лимфопролиферативными заболеваниями [10]. Разработана и широко используется в практике неспецифическая и специфическая иммунотерапия хронических ГВИ с использованием рекомбинантных цитокинов (интерферона α, интерлейкинов — ронколейкина, беталейкина), индукторов интерферонов, внутривенных иммуноглобулинов, вакцины против ВПГ 1-го и 2-го типа.
Одним из наиболее часто используемых препаратов с неспецифическим противовирусным и иммуномодулирующим действием является инозин пранобекс (Нормомед®, АО «Валента Фарм»), способный стимулировать активность цитотоксических Т-лимфоцитов и естественных киллеров, повышать продукцию IgG, интерферона γ, интерлейкинов (ИЛ) 1 и 2, потенцировать хемотаксис нейтрофилов, моноцитов и макрофагов. Эффективность инозина пранобекса и препарата Нормомед® в частности продемонстрирована при терапии хронических и рецидивирующих ГВИ, в том числе у ЧБД [11–13].
В работе Э.Н. Симованьян и соавт. [14] показано, что применение инозина пранобекса в комбинации с интерфероном α2b в группе детей c острой ВЭБ-инфекцией способствовало достоверному сокращению длительности лихорадки, катарального синдрома, лимфаденопатии, гепатоспленомегалии по сравнению с группой пациентов, которым назначали только интерферон α2b. Иммуномодулирующая активность препарата проявлялась повышением количества иммунокомпетентных клеток, синтеза иммуноглобулинов А, М, G, интерферонов α и γ [14]. Аналогичные исследования сравнительной эффективности монотерапии инозином пранобексом, интерфероном α и их комбинацией проведены А.Е. Митрофановым и соавт. [15]. В группе больных, получающих комбинированную терапию, отмечен более высокий терапевтический эффект — выраженная положительная динамика клинических и лабораторных проявлений заболевания по сравнению с детьми, получавшими монотерапию.
Эффективность различных схем терапии с использованием инозина пранобекса, рекомбинантного интерферона α2b, меглумина акридонацетата, как в виде монотерапии, так и в сочетании у ЧБД с активной инфекцией, обусловленной ВГЧ-6, была показана Е.В. Мелехиной и соавт. [13].
В опубликованной нами ранее работе [4] представлены результаты дифференцированной в зависимости от этиологии персистирующей инфекции этиотропной и иммунотропной терапии ЧБД. Комбинированные схемы включали в себя поэтапное применение препаратов интерферона α2b и индукторов интерферона меглумина акридонацетата, тилорона либо инозина пранобекса. Дополнительно ацикловир получали пациенты с инфекцией, вызванной ВЭБ и ВПГ-1, -2. По показаниям часть детей получали антибактериальные препараты. Представленная комбинированная терапия ЧБД позволила в 78% случаев достигнуть стабильной (при наблюдении в течение года) нормализации состояния — купирования катарального, лимфопролиферативного и астенического синдромов, снижения частоты эпизодов острых респираторных инфекций.
У части детей, несмотря на проведенную комплексную, иногда повторными курсами, терапию, сохранялись симптомы хронического или рецидивирующего заболевания и лабораторные признаки активности ГВИ. Можно предположить, что низкая эффективность терапии у таких детей связана со значимыми врожденными дефектами иммунной системы. В рамках проекта по изучению причин рекуррентных респираторных инфекций у детей у некоторых из таких пациентов было проведено молекулярно-генетическое исследование образцов ДНК на предмет наличия мутаций в генах, ассоциированных с ПИД.
Цель исследования: установить спектр редких вариантов генов, ассоциированных с развитием ПИД, выявленных у ЧБД с упорной, активной персистенцией ГВИ, не ответивших на повторные курсы противовирусной и иммунотропной терапии.
Материал и методы
Проведено молекулярно-генетическое исследование образцов ДНК 33 пациентов, из них 17 (51,5%) мальчиков, в возрасте от 2 до 17 лет (средний возраст 6,8±1,2 года) с хронической ГВИ и рекуррентным течением респираторных инфекций, рефрактерных к проводимой этиотропной и иммунотропной терапии.
Среди обследованных детей 20 (61%) страдали от ежемесячных респираторных заболеваний. Хроническая болезнь миндалин и аденоидов с гипертрофией 2–3-й степени была диагностирована у 9 (27,3%) детей. У 4 (12,1%) пациентов проведена аденотомия, причем у 3 (9,1%) без эффекта: дети продолжали болеть с той же частотой, что и до операции, у 2 (6%) отмечали повторный рост аденоидов. Рецидивирующие гнойные отиты регистрировали у 5 (15,2%) детей, катаральные — у 3 (9,1%), повторные пневмонии — у 2 (6,1%), бронхиты — у 3 (9,1%), рецидивирующее течение хронического тонзиллита — у 6 (18,2%), гнойные синуситы — у 3 (9,1%). У 6 (18,2%) пациентов ежемесячные заболевания сопровождались артралгиями. Трое (9,1%) пациентов страдали от частых обострений лабиального герпеса, 1 (3%) ребенок перенес неврит лицевого нерва герпетической этиологии, 2 (6,1%) ребенка — герпетический менингоэнцефалит.
Хроническая ВЭБ-инфекция была диагностирована у 24 (73%) пациентов, из них у 9 (27,3%) — как моноинфекция, у 4 — в сочетании с ЦМВ, у 7 — в сочетании с ВГЧ-6, у 4 — в сочетании с ЦМВ и ВГЧ-6. Активная персистенция ВГЧ-6 в моноварианте выявлена у 3 (9,1%) детей, ЦМВ — у 2. Сочетание ЦМВ и ВГЧ-6 отмечалось у 1 ребенка. У всех пациентов исключены ВИЧ-инфекция и туберкулез.
Несмотря на повторные курсы противовирусной (в случае ВЭБ и ВПГ — ацикловиром) и иммунотропной терапии препаратами рекомбинантного интерферона α и индукторами интерферона меглумина акридон-ацетата, тилорона либо инозина пранобекса, у данных пациентов было отмечено лишь слабое или кратковременное урежение эпизодов заболеваний, сохранялась репликативная активность герпесвирусов. Почти все (94%) дети получали многочисленные курсы антибактериальной терапии, до 6–10 курсов в год.
В качестве метода исследования использовано таргетное мультигенное секвенирование на платформе Illumina, методика анализа была описана ранее [16]. Исследованы 338 генов, связанных с развитием первичных иммунодефицитов. Всеми родителями (или пациентами старше 15 лет совместно с родителями) подписано информированное добровольное согласие на участие в исследовании и обработку личных данных.
Результаты исследования
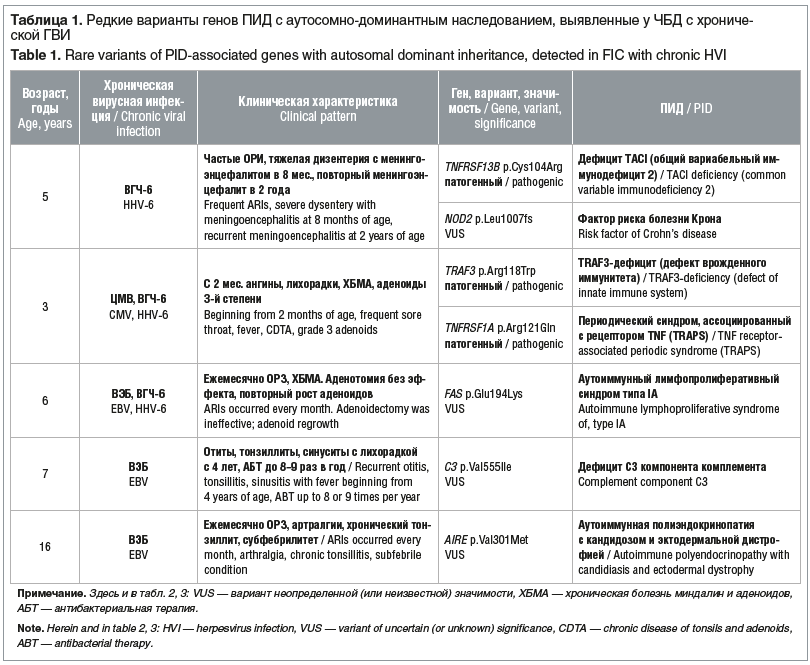
У 25 (76%) детей были выявлены редкие варианты генов, ассоциированных с ПИД. Патогенные / вероятно патогенные варианты генов ПИД с аутосомно-доминантным типом наследования, потенциально соответствующие диагнозу ПИД, выявлены у 2 (6,1%) пациентов (табл. 1). У девочки 5 лет с двумя эпизодами тяжелой формы инфекционного заболевания, осложненного менингоэнцефалитом, в анамнезе выявлен патогенный вариант гена TNFRSF13B, ассоциированного с общим вариабельным иммунодефицитом. У девочки 3 лет выявлен гетерозиготный вариант TNFRSF1A, многократно описанный как мутация (с неполной пенетрантностью), приводящая к развитию семейной периодической лихорадки (TRAPS-синдром), и редкий гетерозиготный вариант TRAF3, описанный как фактор риска герпетического энцефалита. Еще у 3 детей выявлены варианты неопределенной значимости генов FAS, C3 и AIRE.
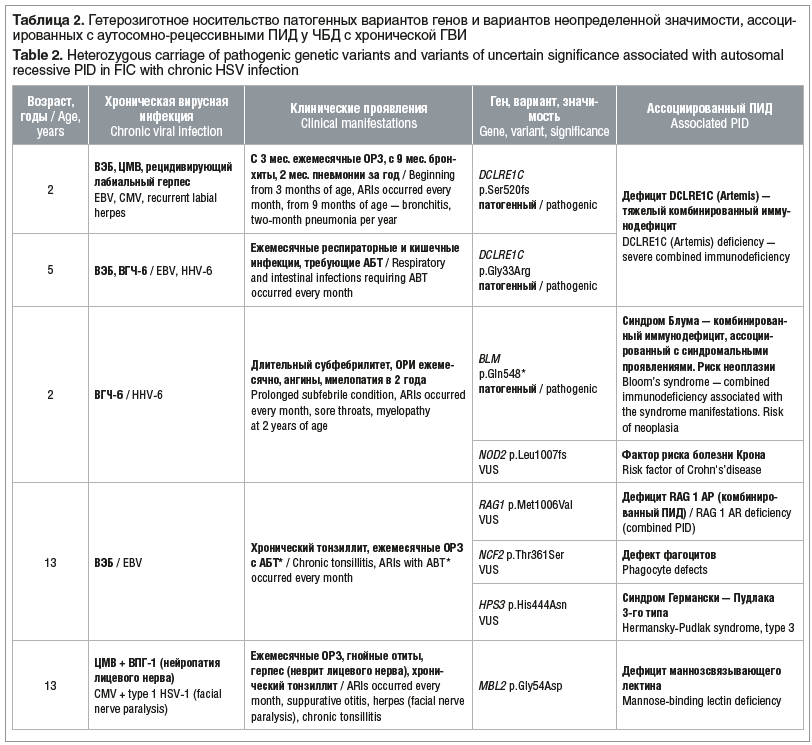
У 5 (15%) пациентов с рекуррентным течением респираторных инфекций выявлено гетерозиготное носительство редких вариантов генов, ассоциированных с аутосомно-рецессивными ПИД, у одного из них — в сочетании с носительством варианта NOD2 p.Leu1007fs (табл. 2).
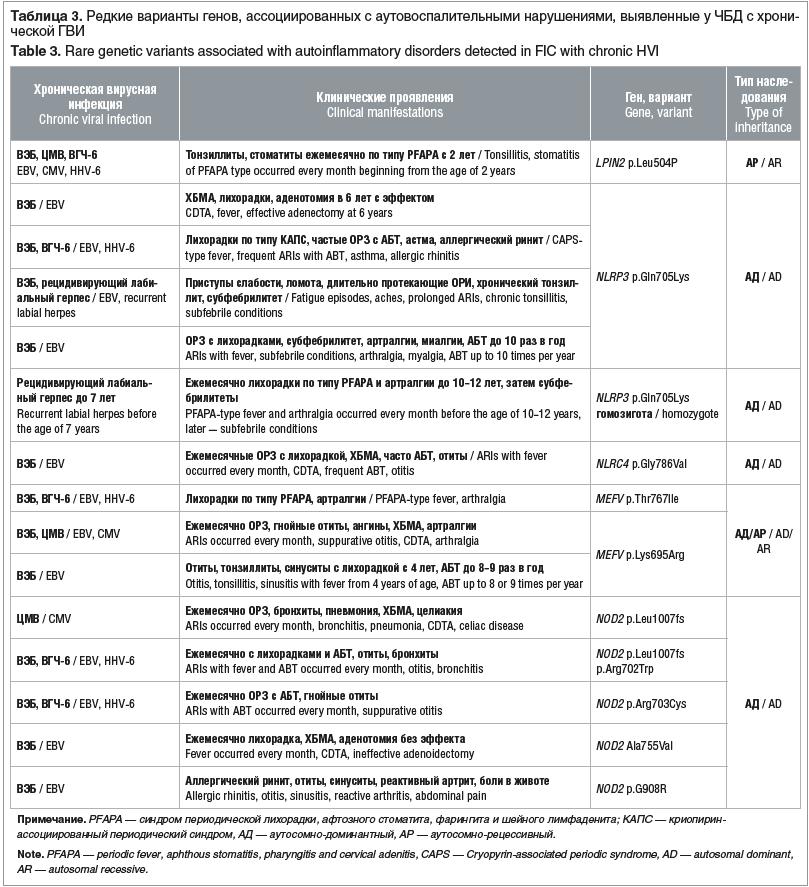
У 18 (54,5%) ЧБД с хронической ГВИ выявлено носительство вариантов генов, ассоциированных с аутовоспалительными нарушениями (табл. 3), иногда в сочетании с мутациями в других генах (см. табл. 1 и 2).
Обсуждение
Исследование генов, ассоциированных с ПИД, у ЧБД с хроническим течением ГВИ показывает, что наиболее часто такие пациенты являются носителями редких вариантов генов неопределенной (или неизвестной) значимости — VUS (variant of uncertain (or unknown) significance) — вариантов, которые по одним данным считаются клинически не значимыми (выявлены у здоровых людей), по другим — вызывают заболевание с пониженной пенетрантностью, т. е. являются фактором риска развития данного заболевания, которое реализуется при наличии других врожденных и приобретенных факторов. К таким факторам относятся инфекционные агенты.
Гетерозиготное носительство варианта гена, ассоциированного с ПИД с аутосомно-рецессивным наследованием, выявленное у 5 (15,2%) пациентов, не должно проявляться клинически, однако в некоторых случаях фенотипические эффекты рецессивных аллелей могут в какой-то мере влиять на функцию кодируемого белка.
Обращает на себя внимание высокая частота у ЧБД носительства редких вариантов генов, ассоциированных с аутовоспалительными нарушениями. У большинства таких пациентов отмечались регулярные лихорадки (часто ежемесячные), которые обычно расценивались как обострение хронической глоточной патологии или обострение хронической ГВИ; дети получали частые курсы антибактериальной терапии. Спустя несколько лет у 3 детей диагностирован синдром PFAPA (periodic fever, aphthous stomatitis, pharyngitis and cervical adenitis — синдром периодической лихорадки, афтозного стоматита, фарингита и шейного лимфаденита), известный как синдром Маршалла, у одного ребенка заподозрен криопирин-ассоциированный периодический синдром (КАПС).
Наиболее часто выявляли вариант гена NLRP3 p.Gln705Lys — у 5 (15,2%) детей. Данный вариант связан с синдромом PFAPA и КАПС. По результатам исследования K. Theodoropoulou et al. [17], данный вариант наблюдался у 21 (14%) из 150 пациентов с PFAPA, у 6 (25%) из 24 пациентов с КАПС и у 15 (42%) из 36 пациентов с неопределенным аутовоспалительным заболеванием.
Редкие варианты гена MEFV (ген средиземноморской лихорадки) выявлены у 3 (9,2%) детей. Оба гена — NLRP3 и MEFV, так же как и ген LPIN2, редкий вариант которого в гетерозиготном состоянии выявлен у 1 ребенка, — связаны с функционированием инфламмасомы — внутриклеточной белковой платформы, ведущей к синтезу ИЛ-1 — основного провоспалительного цитокина. Мутации в этих генах, приводящие к усилению функции, ответственны за гиперактивацию иммунного ответа.
У 7 (21,2%) детей определены редкие варианты гена NOD2, некоторые варианты которого являются факторами риска развития болезни Крона, а также редких аутовоспалительных заболеваний, проявляющихся эпизодами лихорадки и аномального воспаления с поражением кожи, суставов и желудочно-кишечного тракта. NOD2 является членом подсемейств Nod-подобных рецепторов, которые при взаимодействии с бактериальными продуктами активирует провоспалительный фактор транскрипции NF-κB. Вариант гена NOD2 p. Leu1007fs выявлен у 4 (12,2%) детей. М.А. Казумян и соавт. [18] выявили повышенную встречаемость этого варианта у детей с рекуррентными респираторными инфекциями.
Поскольку причиной частых лихорадочных заболеваний у детей в большом проценте случаев, вероятно, является гиперактивация воспаления в ответ на инфекционный или иной фактор, возможно, следует рассмотреть новые подходы к терапии детей — носителей VUS-вариантов генов, ассоциированных с аутовоспалительными заболеваниями, в том числе применение агонистов сигнальных рецепторов врожденного иммунитета и иных препаратов, модулирующих пути передачи сигнала.
Выводы
-
Причиной рекуррентных респираторных инфекций у часто и длительно болеющих детей нередко являются хронические активные ГВИ, в терапии которых максимальный эффект демонстрируют комбинированные схемы лечения иммунотропными препаратами, в том числе препаратом Нормомед®.
-
Неэффективность терапии детей с хронической ГВИ может быть обусловлена врожденными особенностями иммунной системы и является основанием для направления ребенка на консультацию иммунолога и проведение молекулярно-генетического исследования.
-
Генетические дефекты, совместимые с диагнозом ПИД, редки (6,1%) в этой группе.
-
Выявление более чем у половины пациентов редких вариантов генов, ассоциированных с аутовоспалительными заболеваниями, указывает на то, что под маской частых, ежемесячных заболеваний с лихорадкой может скрываться стертая, а иногда и типичная форма аутовоспалительного заболевания, несмотря на выявление у ребенка маркеров вирусных и бактериальных агентов.
Сведения об авторах:
Левина Анастасия Сергеевна — к.м.н., доцент кафед-ры инфекционных заболеваний у детей ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; врач-инфекционист консультативно-диагностической поликлиники ФГБУ ДНКЦИБ ФМБА России; 197022, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 9; ORCID iD 0000-0003-0470-0672.
Бабаченко Ирина Владимировна — д.м.н., профессор кафедры инфекционных заболеваний у детей ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; профессор, заведующая отделом капельных инфекций ФГБУ ДНКЦИБ ФМБА России; 197022, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 9; ORCID iD 0000-0002-1159-0515.
Скрипченко Наталья Викторовна — д.м.н., профессор, заслуженный деятель науки Российской Федерации, заведующая кафедрой инфекционных заболеваний у детей ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; заместитель директора по научной работе ФГБУ ДНКЦИБ ФМБА России, 197022, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 9; ORCID iD 0000-0001-8927-3176.
Чеботарева Татьяна Александровна — д.м.н., профессор, профессор кафедры детских инфекционных болезней ФГБО ДПО РМАНПО Минздрава России; 125993, Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-6607-3793.
Демина Ольга Игоревна — к.м.н., ассистент кафедры детских инфекционных болезней ФГБО ДПО РМАНПО Минздрава России; 125993, Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-9511-0995.
Контактная информация: Левина Анастасия Сергеевна, e-mail: rossii@mail.ru.
Источник финансирования: работа поддержана грантом РНФ 15-15-00079. Никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.10.2022.
Поступила после рецензирования 26.10.2022.
Принята в печать 21.11.2022.
About the authors:
Anastasia S. Levina — C. Sc. (Med.), associate professor of the Department of Infectious Diseases in Children, St. Petersburg State Pediatric Medical University, 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; infectious disease specialist of the consulting and diagnostic polyclinic, Children’s Scientific Clinical Center of Infectious Diseases of the Federal Medical Biological Agency of Russia; 9, Professor Popov str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-0470-0672.
Irina V. Babachenko — Dr. Sc. (Med.), Professor of the Department of Infectious Diseases in Children, St. Petersburg State Pediatric Medical University, 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; Head of the Department of Droplet Infections, Children’s Scientific Clinical Center of Infectious Diseases of the Federal Medical Biological Agency of Russia; 9, Professor Popov str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1159-0515.
Natalia V. Skripchenko — Dr. Sc. (Med.), Professor, Honored Scientist of the Russian Federation; Head of the Department of Infectious Diseases in Children, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; Deputy Director for Research, Children’s Scientific Clinical Center of Infectious Diseases of the Federal Medical Biological Agency of Russia; 9, Professor Popov str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-8927-3176.
Tatyana A. Chebotareva — Dr. Sc. (Med.), Professor, Professor of the Department of Pediatric Infectious Diseases, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-6607-3793.
Olga I. Demina — C. Sc. (Med.), assistant of the Department of Pediatric Infectious Diseases, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-9511-0995.
Contact information: Anastasia S. Levina, e-mail: rossii@mail.ru.
Financial Disclosure: the research is supported by RSF Grant 15-15-00079. No authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 03.10.2022.
Revised 26.10.2022.
Accepted 21.11.2022.
Информация с rmj.ru