В статье представлена тактика ведения беременных с инвазивным раком шейки матки.
Содержание статьи
Введение
Рак шейки матки (РШМ) является одним из наиболее распространенных злокачественных новообразований у беременных и встречается с частотой от 0,8 до 1,5 случая на 10 000 родов. Во время беременности и в течение первого года после родов верифицируется до 3% случаев болезни [1, 2].
Крупных рандомизированных исследований, на материалах которых можно основывать рекомендации по ведению беременных с РШМ, не проводилось. И при лечении этой категории больных применяются рекомендации, основанные на материалах исследований с участием небеременных пациенток. При этом дополнительно тактика ведения беременных с РШМ определяется сроком гестации, стадией опухолевого процесса и желанием пациентки сохранить беременность. Лечение должно быть индивидуальным, своевременным, с минимальным риском для женщины и плода [2].
Во время беременности РШМ в большинстве случаев диагностируется на ранних стадиях, а средний гестационный срок составляет 19,5 нед. [3, 4]. Клинические проявления РШМ во время беременности зачастую отсутствуют или могут быть приняты за акушерские осложнения (влагалищное кровотечение, тазовые боли, боли по ходу седалищного нерва, анемия).
Тактика лечения пациенток с РШМ
Тактика лечения пациенток с РШМ определяется стадией заболевания, сроком гестации, а также вовлеченностью в процесс регионарных лимфатических узлов. Основными методами лечения являются хирургический и медикаментозный (химиотерапия) [5–7] (табл. 1).![Таблица 1. Алгоритм лечения женщин в зависимости от стадии заболевания и срока гестации [2] Table 1. Treatment approach to cervical cancer depending on cancer stage and gestation period [2] Таблица 1. Алгоритм лечения женщин в зависимости от стадии заболевания и срока гестации [2] Table 1. Treatment approach to cervical cancer depending on cancer stage and gestation period [2]](https://medblog.su/wp-content/uploads/2019/06/taktika-vedeniya-beremennyh-s-invazivnym-rakom-shejki-matki-payanidi-yu-g-borovkova-e-i-dobrohotova-yu-e-arutyunyan-a-m.png)
Согласно приказу Минздрава России № 572н от 1 ноября 2012 г. все беременные подлежат обязательному цитологическому скринингу, что позволяет своевременно поставить диагноз. При выявлении признаков, подозрительных в отношении микроинвазивного процесса, проводится атипичная конизация шейки матки с высотой конуса не более 1,5 см. Во время беременности не производится выскабливание цервикального канала в связи с высоким риском прерывания беременности после данной манипуляции. Конизация шейки матки может быть выполнена в любом сроке гестации, но не менее, чем за 4 нед. до предполагаемых родов. При IA1 стадии (инвазия до 3 мм и протяженность по горизонтали до 7 мм без сосудистой инвазии) конизация является оптимальным и безопасным методом лечения. Риск метастазирования составляет 0,8% при плоскоклеточном раке и 1,5% при аденокарциноме. При подозрении на поражение тазовых лимфатических узлов показано проведение тазовой лимфаденэктомии (ТЛАЭ) или биопсии сторожевого лимфатического узла [8].
Ведение пациенток до 22 нед. гестации с IА2 и IB1 стадией и опухолью до 2 см.
На первом этапе проводится атипичная конизация шейки матки с лимфаденэктомией. Если подтверждается метастатическое поражение лимфатических узлов, должен быть рассмотрен вопрос прерывания беременности. При отсутствии поражения лимфатических узлов возможно пролонгирование беременности с проведением стандартной терапии после родов (при IА2 стадии) или неоадъювантной химиотерапии (НАХТ) (при IB1 стадии) с отсроченным стандартным лечением после родов [9] (рис. 1).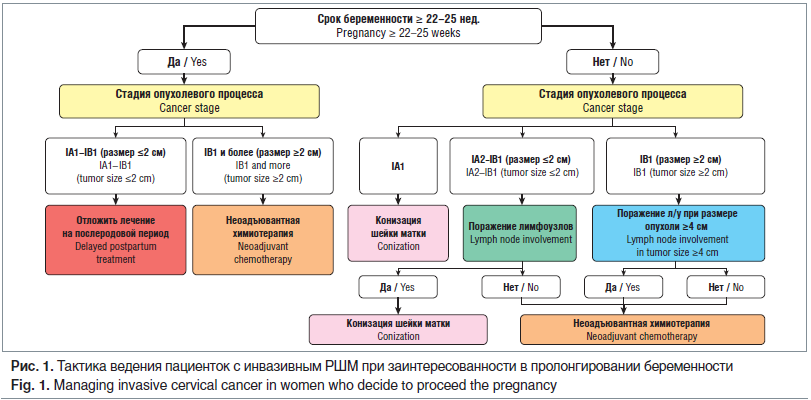
Ведение пациенток в сроке более 22 нед. с IА2 и IB1 стадией при опухоли до 2 см. В данном сроке гестации для стадирования процесса проводится атипичная конизация шейки матки. Тазовая лимфаденэктомия не выполняется в связи с техническими ограничениями, связанными с размером матки. При подтверждении IА2 стадии после родов проводится стандартное лечение, при IB1 стадии начинают неоадъювантную полихимиотерапию [9].
Ведение беременных до 22 нед. с IB1 стадией и опухолью до 2–4 см. Для уточнения распространенности процесса проводится ТЛАЭ. При подтверждении вовлечения лимфатических узлов рекомендовано прерывание беременности с последующим стандартным лечением. В случае интактности лимфатических узлов после 12 нед. начинают НАХТ [9].
Беременным в сроке гестации до 22 нед. с подтвержденным РШМ IB2 и IIA стадии рекомендовано прерывание беременности вне зависимости от вовлеченности лимфатических узлов [9]. После 22 нед. проводят несколько курсов НАХТ. Последний курс должен быть завершен не позднее 3 нед. до родов [9].
Хирургическое лечение
Диагностика РШМ основывается на гистологическом исследовании, однако прогноз заболевания определяется размером опухоли и вовлеченностью в патологический процесс лимфатических узлов. В первой половине беременности (до 22 нед.) проведение лапароскопической ТЛАЭ является безопасной и весьма информативной операцией [10]. При выявлении метастазов показано прерывание беременности и проведение химиолучевой терапии [11]. Пролонгирование беременности допустимо при интактности лимфатических узлов и начале НАХТ [11]. Проведение трахелэктомии во время беременности не рекомендовано в связи с малой эффективностью и высоким риском прерывания беременности (до 34%) [12].
Неоадъювантная химиотерапия
В случае пролонгирования беременности у пациенток с местнораспространенным РШМ проведение НАХТ позволяет стабилизировать опухолевый процесс [6]. Расчет лечебной дозы и выбор препарата идентичен таковым вне беременности. Однако необходимо учитывать, что физиологические изменения, связанные с беременностью (гемодилюция, гипопротеинемия, ускорение скорости клубочковой фильтрации, появление третьего пространства — амниотической полости), оказывают влияние на фармакокинетические свойства химиопрепаратов.
Согласно международным протоколам химиотерапия не проводится в I триместре беременности в связи с высоким риском эмбриотоксического и тератогенного действия. Во время беременности у пациенток с РШМ химиотерапию можно проводить начиная со II триместра: при IB1 стадии, отсутствии метастазов в лимфатических узлах и размерах опухоли
В подавляющем большинстве случаев проведение НАХТ позволяет стабилизировать опухолевый процесс и пролонгировать беременность до периода достижения плодом жизнеспособности и зрелости. Наиболее часто схема терапии включает цисплатин (50–100 мг/м2) в монорежиме или в комбинации с паклитакселом (175 мг/м2). Курсы проводятся с интервалом каждые 3 нед. [13]. Реже применяется комбинация цисплатина (75 мг/м2) с ифосфамидом 2 г/м2 циклами каждые 2 нед. [12, 14].
Тактика родоразрешения беременных с РШМ
Последний курс полихимиотерапии должен быть завершен за 3 нед. до предполагаемой даты родов. Это связано с риском рождения ребенка с подавленным костным мозгом и высокой вероятностью развития у него инфекционных осложнений [14, 15]. В настоящее время рекомендовано пролонгировать беременность как минимум до доношенного срока (37 нед.), при отсутствии такой возможности — хотя бы до 34 нед. [14–17].
После конизации шейки матки, выполненной при IA1–IA2 стадиях, теоретически возможны влагалищные роды [9]. В случае распространенного РШМ методом родоразрешения является операция корпорального кесарева сечения с последующей операцией Вертгейма. Выбор метода родоразрешения зависит от стадии заболевания с учетом желания пациентки сохранить фертильность [1, 2, 12, 18–20].
Заключение
«Золотой стандарт» лечения РШМ у беременных еще не разработан. Следует признать, что приведенные выше клинические рекомендации ESGO, к сожалению, не могут ответить на все вопросы. Так, например, с нашей точки зрения, важным прогностическим фактором являются биологические особенности новообразования, которые в рекомендациях не учитываются. Также не ясно, какова тактика лечения при запущенных стадиях процесса и не являются ли рискованными рекомендуемые роды через естественные родовые пути при IA2 стадии заболевания и т. д. Тем не менее целесообразно следовать предложенному варианту тактических подходов, учитывая рекомендации Международного консенсусного совещания по «гинекологическим ракам», основанные на базе мирового опыта. Необходимо подчеркнуть особую роль мультидисциплинарного подхода с участием онкогинеколога, акушера-гинеколога, неонатолога, химио- и лучевого терапевтов, психолога, юриста в решении ряда важных вопросов.
Сведения об авторах:
1Паяниди Юлия Геннадиевна — д.м.н., старший научный сотрудник гинекологического отделения, ORCID iD 0000-0001-5950-4543;
2Боровкова Екатерина Игоревна — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0001-7140-262Х;
2Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета, ORCID iD 0000-0001-6571-3448;
2Арутюнян Анна Меружановна — аспирант кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0002-6392-5444.
1ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. 115478, Россия, г. Москва, Каширское шоссе, д. 24.
2ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Боровкова Екатерина Игоревна, e-mail: katyanikitina@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 13.12.2018.
About the authors:
1Yulia G. Payanidi — MD, PhD, Senior Researcher of the Department of Gynecology, ORCID iD 0000-0001-5950-4543;
2Ekaterina I. Borovkova — MD, PhD, Professor of the Department of Obstetrics and Gynecology, Medical Faculty, ORCID iD 0000-0001-7140-262Х;
2Yulia E. Dobrokhotova — MD, PhD, Professor, Head of the Department of Obstetrics and Gynecology, Medical Faculty, ORCID iD 0000-0001-6571-3448;
2Anna M. Arutunyan — post-graduate student of the Department of Obstetrics and Gynecology, Medical Faculty, ORCID iD 0000-0002-6392-5444.
1Blokhin Cancer Research Center. 24, Kashirskoye shosse, Moscow,115478, Russian Federation.
2Pirogov Russian National Research Medical University,
1 Ostrovityanova str., Moscow, 117997, Russian Federation.
Contact information: Ekaterina I. Borovkova, e-mail: katyanikitina@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 13.12.2018.
Информация с rmj.ru






