Введение
Аденомы толстой кишки (ТК) сегодня считают предраковым состоянием для колоректального рака (КРР) [1, 2]. Удаление всех выявленных аденом приводит к снижению частоты КРР в сравнении с популяцией и группами населения, которым аденомы не удалялись [3, 4]. Однако удаление аденом не гарантирует полного предупреждения КРР, а выявление метахронных аденом после полипэктомии в неиндексных сегментах и интервальные КРР заставляют продолжать искать причины для их появления [5–7]. Слизистая оболочка (СО) ТК представляет собой кооперацию кишечных желез, формирующих крипты [2]. В основе каждой крипты находится небольшое количество стволовых клеток, которые являются предшественниками созревающих и дифференцирующихся клеток в данной крипте и обновляются в сроки до 5,5 года [2]. Это объясняет интервалы скрининговых эндоскопий. Считается, что в основе появления аденом ТК лежат нарушения на молекулярно-генетическом уровне именно в стволовых клетках [2]. При этом в неизмененной СО ТК процент драйверных мутаций существенно ниже таковых в прочих тканях — 1%, что объясняют анатомической уникальностью крипт [2]. Возможно, поэтому появилось мнение о наибольшем риске развития полипов на участках ТК в области ее физиологического сужения, где происходит длительная задержка кишечного содержимого и изменяется количественный и качественный состав кишечной микрофлоры [8]. Неворсинчатые аденомы — тубулярные и гиперпластические — являются наиболее распространенными морфологическими типами аденом с разной частотой встречаемости в разных сегментах ТК [8, 12, 13]. Поскольку риск малигнизации таких новообразований существенно ниже, чем у опухолей с преобладанием ворсинчатого компонента, в этой работе мы рассматриваем только неворсинчатые аденомы. Считается, что первым шагом в последовательности «аденома — карцинома» является спорадическая или зародышевая инактивация гена-супрессора опухоли (APC), позже происходят мутации драйверных генов, например гена KRAS, что приводит к образованию полипов. Процесс перехода из аденомы в карциному может длиться от 5 до 20 лет [14, 15]. Преобразование представляет собой сложный многофакторный процесс, который характеризуется хромосомной нестабильностью (chromosomal instability — CIN), MSI и метилированием ДНК в областях CpG-островков (CpG island hypermethylation — CIMP) [16]. Однако помимо накопления различных мутаций возникновение и развитие аденом сопровождается аберрантной экспрессией генов длинных некодирующих РНК, миРНК и белок-кодирующих генов [17–19]. Поскольку экспрессия миРНК/мРНК отличается в аденомах и нормальной/неизмененной СО, возникает вопрос о тождественности изменений экспрессии миРНК/мРНК в аденоме и СО именно индексного сегмента ТК (не просто между правой и левой половинами) от нормальной/неизмененной СО соответствующего сегмента ТК. Исследования показывают, что фактором повышенного риска развития КРР является количество аденом ≥10 и их строение [20, 21]. Таким образом, это может указывать на то, что СО ТК таких людей отличается от СО ТК людей с небольшим количеством аденом. Изучение свойств СО и сравнение их по сегментам ТК встречается в единичных работах, но могло бы расширить наши представления о возникновении аденом, найти пути профилактики и ранней диагностики, углубить понимание связи с КРР [22–24].
Цель исследования: выявить частоту одиночных неворсинчатых аденом в разных отделах ТК и сравнить профили экспрессии миРНК и мРНК между аденомами, СО индексного сегмента ТК пациентов с аденомами и СО индексного сегмента ТК пациентов без аденом.
Содержание статьи
Материал и методы
Проведено сплошное поперечное ретроспективное исследование результатов 3086 колоноскопий, выполненных в отделении эндоскопии ГАУЗ «НГКБ № 29 им. А.А. Луцика» в 2019–2020 гг., а также проспективное исследование (2022–2023 гг.) СО ТК у 111 пациентов с неворсинчатыми аденомами. Исследование одобрено локальным этическим комитетом ГАУЗ «НГКБ № 29 им. А.А. Луцика», от 19.04.2022. Материал был получен в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации (ВМА), принятой на 18-й Генеральной ассамблее ВМА (Хельсинки, Финляндия, июнь 1964 г.) с последующими редакциями и положениями действующего законодательства РФ, от каждого пациента было получено информированное добровольное согласие, все данные были деперсонализированы.
Использовали эндоскопы высокого разрешения с функцией виртуальной хромоскопии (PENTAX Medical, Япония; Olympus, Япония). Биоптат СО брали не ближе 10 см от аденомы из индексного сегмента. Биоптаты помещали на предметное стекло, делали мазок, высушивали. В мазках определяли относительные уровни экспрессии миРНК и мРНК, всего в рамках данной работы было исследовано 372 клеточных образца (аденомы — 92, СО индексного сегмента — 111, нормальная СО — 169). Для некоторых сравнений (при отсутствии различий между сегментами) образцы поперечной, нисходящей и сигмовидной ободочной кишки объединяли под аббревиатурой ПНС.
Выделение РНК. Цитологический препарат соскребали со стекла в пробирку и добавляли 600 мкл лизирующего буфера (4 М гуанидинизотиоцианат, 25 мМ цитрат натрия, 0,3% саркозил, 3% ДТТ). Далее выделение проводили, как описано в статье В.В. Анищенко [25].
Первичный отбор набора миРНК для анализа был осуществлен на основании анализа литературы. В итоге был сформирован список из 9 миРНК-маркеров, связанных с развитием КРР: миРНК-135b-5p, -141-3p, -143-3p, -200a-3p, -20a-5p, -21-5p, -31-5p, -34a-5p, -92a-3p, в качестве референса для них использовалась малая ядерная РНК U6, а также миРНК-16-5p и -191-5p. Помимо миРНК, в данной работе в качестве маркеров были использованы мРНК следующих генов: MUC2, CDX2, NOX1, LGR5, SMAD4, MS4A12, TIMP1, Ki-67, TERT с нормировкой на гены «домашнего хозяйства» PGK1 и PUM1.
Детекцию миРНК и мРНК выполняли с помощью обратной транскрипции и ПЦР в режиме реального времени (ОТ-ПЦР-РВ). Для выявления зрелых миРНК и малой РНК U6 использовали метод, предложенный С. Chen et al. [26]. Метод включает в себя ОТ зрелой миРНК с помощью длинного праймера со шпилькой с последующей детекцией полученной кДНК с помощью ПЦР-РВ [26]. Нормировку содержания миРНК проводили на среднее содержание малой ядерной РНК U6, а также миРНК-16 и -191 в образце с помощью метода 2-ΔΔCT [27]. Полуколичественную оценку содержания мРНК проводили методом ОТ-ПЦР-РВ со специфическими праймерами и флуоресцентно-мечеными зондами для выявления мРНК соответствующих генов и генов «домашнего хозяйства» PGK1 и PUM1, используемых для нормировки данных. Уровень относительной экспрессии рассчитывали с помощью метода 2-ΔΔCT.
Детекцию соматических мутаций проводили с помощью аллель-специфичной ПЦР с гидролизуемым зондом. Протокол ПЦР: предварительный прогрев при 95 °С — 2 мин, 50 циклов: денатурация при 94 °С — 10 с, отжиг и элонгация: 60 °С — 15 с. Чувствительность выявления мутантного аллеля определяли с помощью контрольных образцов, с известным отношением мутантного аллеля и аллеля дикого типа.
Статистический анализ проведен с использованием пакета IBM SPSS Statistics-22 и Statistica 10 (TIBCO Software, США). По результатам исследования создана база данных, выполнен ее первичный анализ. Сравнение двух независимых выборок по количественному признаку проводили при помощи критерия Манна — Уитни, так как нормальность распределения выявлена не для всех сравниваемых признаков. Сравнение качественных признаков проводили при помощи критерия χ2. Критический уровень значимости (p) был принят равным 0,000231 с учетом поправки Бонферрони.
Результаты исследования
Новообразования ТК выявлены у 980 человек (общая частота выявленных новообразований — 31,8%). Преобладали одиночные опухоли ТК (рис. 1).
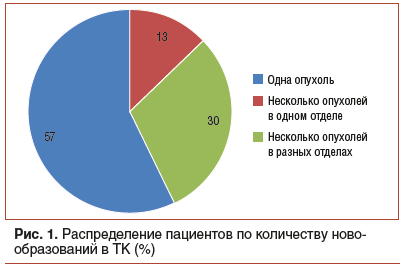
Структура всех выявленных одиночных опухолей имела существенные различия по отделам ТК (χ2=17,6, р<0,001) (рис. 2).
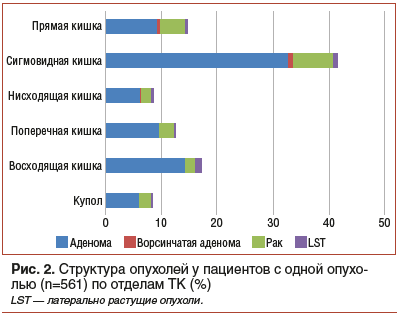
Наибольшее число одиночных новообразований локализовалось в восходящей и сигмовидной кишке. Во всех отделах преобладали неворсинчатые аденомы. Также частота новообразований указанной локализации превышала долю злокачественных новообразований в прочих отделах кишки. Тем не менее подтверждения связи между количеством аденом в отделе кишки и долей злокачественных новообразований не выявлено (р=0,49).
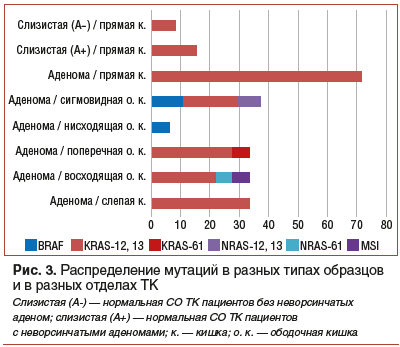
В исследуемой выборке образцов мы определили соматические мутации в 600 кодоне гена BRAF, 12/13 и 61 кодонах генов KRAS и NRAS, а также статус микросателлитной нестабильности (MSI/MSS). Среди аденом чаще всего выявлялась мутация в 12/13 кодонах гена KRAS — 22,8%, далее по частоте встречаемости следует мутация в 600 кодоне гена BRAF — 4,3%, все остальные мутации встретились в диапазоне 1,1–2,2%. Как ни странно, мутации KRAS-12/13 встретились также в 1,8% СО ТК пациентов с аденомами и в 1,2% нормальной СО ТК (пациенты без аденом). В неизмененной СО ТК и СО индексных отделов (кроме прямой кишки) мутаций не было. Распределение выявленных мутаций между разными типами образцов и разными отделами ТК (χ2=6,0, р=0,014) приведено на рисунке 3.
С помощью ОТ-ПЦР-РВ мы определили относительную экспрессию 9 миРНК и 9 белок-кодирующих генов, связанных с развитием КРР. В таблицах 1 и 2 приведены данные по статистической значимости различий между экспрессией миРНК/мРНК в образцах, относящихся к разным типам образцов и разным отделам ТК.
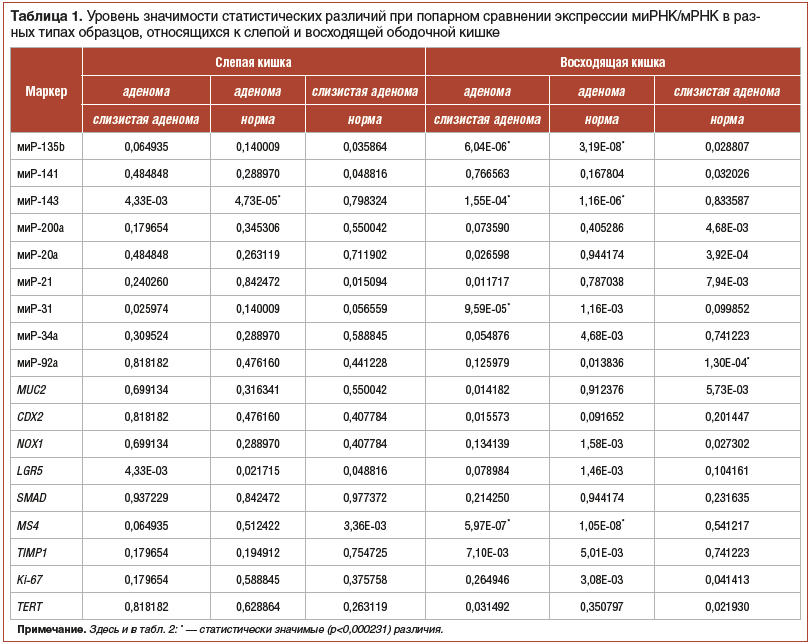
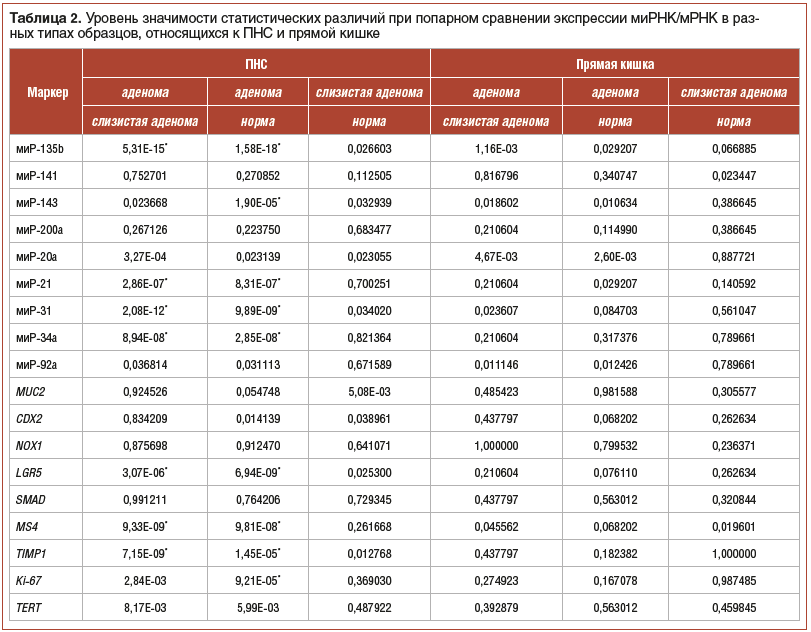
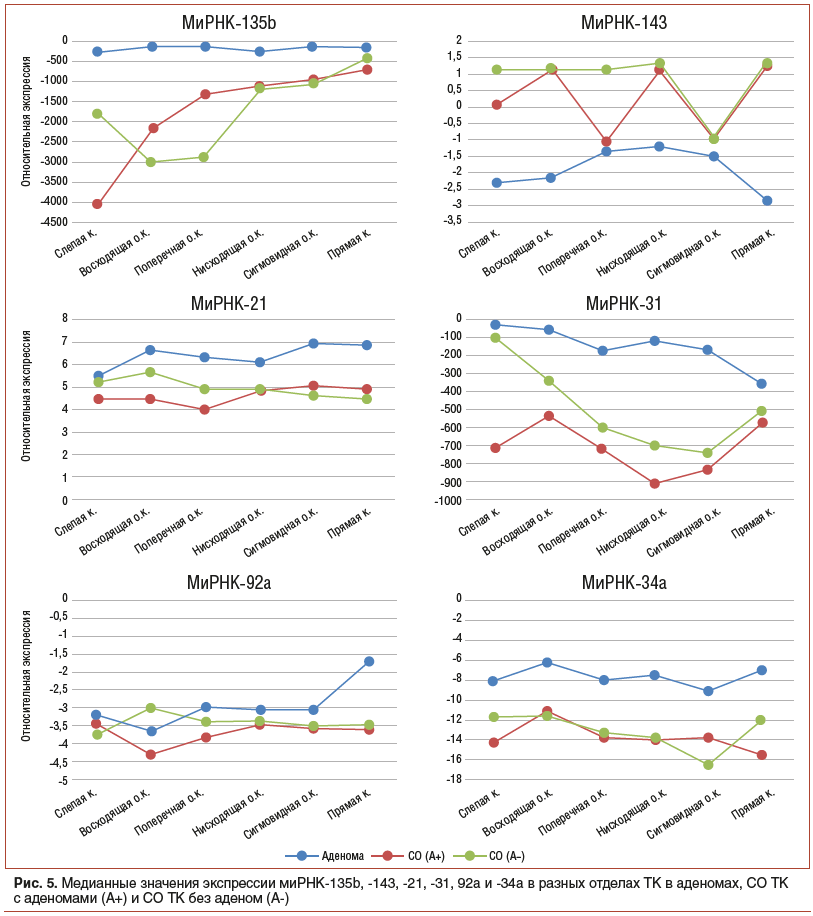
Наибольшее количество статистически значимых различий между отделами было выявлено для миРНК-135b, -143, -31 и гена MS4A12. Только для ПНС статистически значимые различия были выявлены для миРНК-21, -34a и генов LGR5, TIMP1, Ki-67. Для восходящей кишки была зафиксирована статистически значимая разница между СО от пациентов с аденомами и СО пациентов без аденом для миРНК-92a.
С использованием данных относительной экспрессии миРНК и мРНК были рассчитаны значения площади под кривой ошибок (area under the ROC curve — AUC ROC) для оценки способности различения аденом и неизмененной СО соответствующего отдела ТК с помощью каждого молекулярного маркера в отдельности (табл. 3).
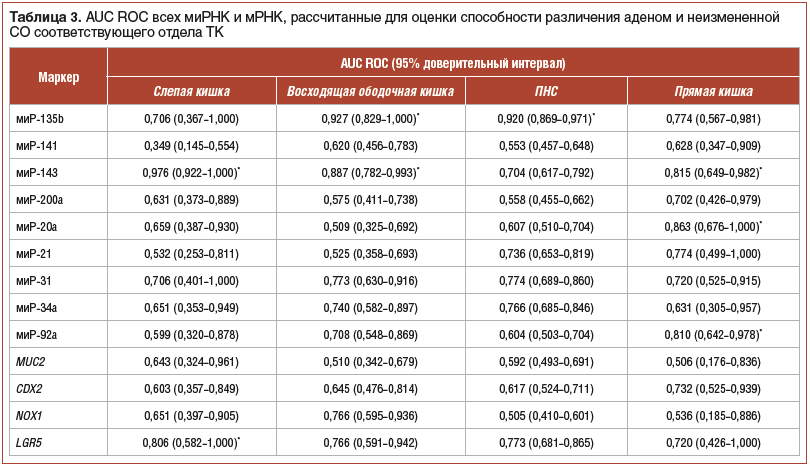
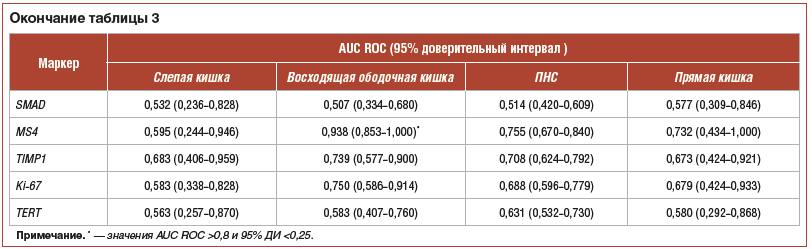
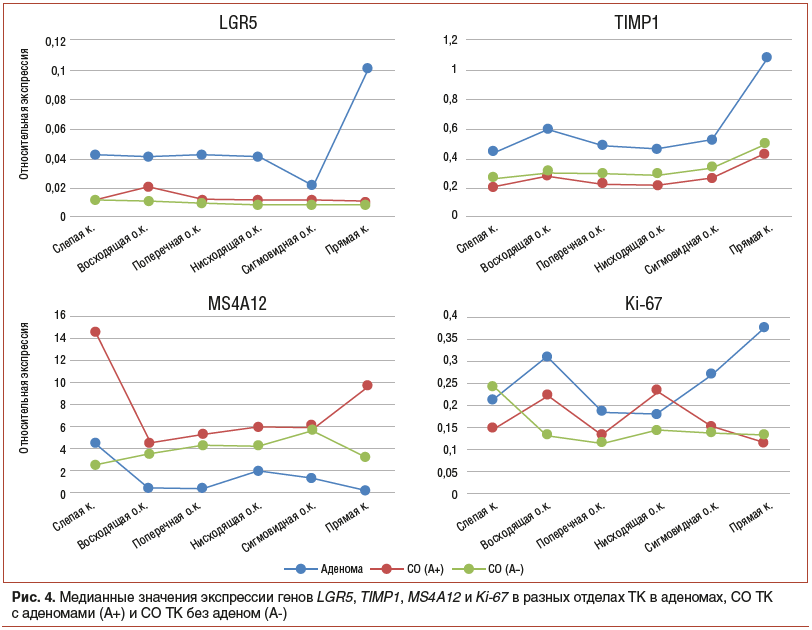
Рассматривая экспрессию генов, кодирующих белки (для которых были показаны значимые различия экспрессии между аденомами и нормой), — LGR5, TIMP1, MS4A12 и Ki-67, можно отметить следующие закономерности (рис. 4, 5):
-
экспрессия генов LGR5 и TIMP1 выше в аденомах во всех отделах (особенно в прямой кишке) и практически совпадает в СО ТК как с аденомами, так и без аденом (см. рис. 4);
-
экспрессия MS4A12 понижена в аденомах относительно СО ТК без аденом во всех отделах, кроме слепой кишки. А в СО ТК с аденомами, наоборот, экспрессия MS4A12 совпадает с СО ТК без аденом во всех отделах, кроме слепой и прямой кишки, где она значительно повышена (см. рис. 4);
-
для экспрессии Ki-67 явные закономерности сложно выявить для всех отделов, но можно отметить, что в сигмовидной и прямой кишке экспрессия этого гена в аденомах повышена относительно СО ТК без аденом и СО ТК с аденомами.
Обсуждение
Вопрос своевременной профилактики и выявления КРР остается актуальным. На данный момент самые ранние стадии прогрессирования КРР изучены плохо, общее представление состоит в том, что это последовательный процесс накопления в стволовых клетках определенных мутаций, которые передаются примерно всем 2000 дифференцированным клеткам, составляющим крипту. Считается, что появление таких стволовых клеток предшествует развитию КРР [2]. Эта схема является сильно упрощенной, например, диаметр аденомы всегда превосходит диаметр крипты, что не объясняется идеей возникновения опухоли из одной крипты, и это нельзя связать с распространением измененных клеток на другие крипты. Возможны два предположения: если развитие аденом связано со случайными событиями в отдельных криптах, то результаты оценки состояния и изменения для СО ТК с аденомами и без аденом должны совпадать, если же развитие аденом связано с системным действием на СО каких-то факторов, то характер и уровень изменений для СО ТК с аденомами будет ближе, собственно, к самим аденомам, чем к СО ТК без аденом. Эти соображения важны для объяснения и поиска синхронных новообразований ТК при выявлении одиночной опухоли. Однако какие изменения СО сопряжены с ростом аденом, пока неясно [28].
В настоящем исследовании было показано, что профили экспрессии мРНК и миРНК СО ТК с аденомами отличаются от профилей и аденом, и СО ТК без аденом, хотя и ближе к последним, т. е. имеют меньше статистически значимых различий, но они есть даже с учетом поправки Бонферрони. Экспрессия генов, для которых были показаны значимые различия между аденомами и СО ТК без аденом (LGR5, TIMP1, MS4A12 и Ki-67), довольно значимо соотносится с экспрессией этих генов при КРР. Так, повышенная экспрессия LGR5 является маркером столбчатых стволовых клеток основания крипты [29], и если считать, что аденома — это опухоль, возникшая из стволовых клеток, то и уровень экспрессии LGR5 должен быть выше в аденоме, чем в нормальной СО ТК. Повышенная экспрессия гена TIMP1 при КРР тоже хорошо известна. Считается, что TIMP1 играет центральную роль в модуляции иммунного микроокружения при КРР, способствуя инфильтрации различных субпопуляций макрофагов и нейтрофилов. Можно предположить, что для развития опухоли, даже доброкачественной, требуется определенное взаимодействие клеток опухоли с клетками иммунной системы с целью избегания атак с ее стороны. Ген MS4A12, кодирующий кальциевый канал, специфически экспрессируется в апикальной мембране эпителия ТК и связан с пролиферацией и подвижностью клеток при КРР [30]. При аденоме и карциноме ТК экспрессия этого гена значительно снижается по сравнению с нормальной СО ТК [18]. В нашем исследовании экспрессия этого гена в аденомах была понижена относительно СО ТК во всех отделах ТК, кроме слепой кишки, но в то же время значительно повышена в СО ТК с аденомами относительно аденом и СО ТК без аденом в слепой и прямой кишке. Возможно, этот факт требует дополнительного исследования, поскольку он не укладывается ни в логику развития аденом, ни в логику развития СО ТК. Ki-67 экспрессируется только в клетках, проходящих митоз, и не экспрессируется в фазе покоя (G0).
Таким образом, экспрессия Ki-67 может отражать долю делящихся клеточных популяций. Кроме того, в результатах многочисленных исследований было показано, что высокие уровни экспрессии Ki-67 связаны с неблагоприятной общей выживаемостью и безрецидивной выживаемостью пациентов с КРР [31]. В нашем исследовании повышенная экспрессия Ki-67 в аденомах относительно СО ТК была выявлена в восходящей, сигмовидной и прямой кишке. Что касается экспрессии этого гена в СО ТК с аденомами, то получилось, что в правом отделе она связана с экспрессией в аденомах, а в левом отделе — с СО ТК без аденом. Вероятно, это может быть объяснено особенностями эмбриогенеза.
Изучение экспрессии миРНК показало соответствие профилей экспрессии в аденомах и нормальной СО ТК опубликованным ранее данным. Так, экспрессия известной онкогенной миРНК-21 повышена в аденомах во всех отделах, кроме слепой кишки [32]. Экспрессия онкогенной миРНК-31 повышена во всех отделах, кроме слепой и прямой кишки [33]. Значительно повышена экспрессия миРНК-135b в аденомах во всех отделах ТК, кроме прямой кишки. Одной из мишеней миРНК-135b является ген APC, компонент сигнального пути Wnt, мутации этого гена или снижение его экспрессии является одним из первых этапов в развитии аденом [34]. МиРНК-92а тоже считается онкогенной в случае КРР, но ее экспрессия оказалась повышена только в прямой кишке [32]. Из двух онкосупрессорных миРНК — 143 и 34а пониженный уровень экспрессии в аденомах оказался только в случае миРНК-143, которая подавляет экспрессию ДНК-метилтрансферазы 3A (DNMT3A) и, таким образом, контролирует уровень метилирования ДНК. Что касается миРНК-34а, то есть данные, что снижение экспрессии миРНК-34а способствует пролиферации, миграции и инвазии клеток, а ее повышенная экспрессия способствует развитию апоптоза [35]. Тем не менее в нашем исследовании было показано, что уровень ее экспрессии выше в аденомах относительно СО ТК примерно в 1,5 раза во всех отделах ТК. Сравнение экспрессии миРНК СО ТК без аденом и СО ТК с аденомами показало те же тенденции, что и в случае экспрессии белок-кодирующих генов, т. е. для некоторых миРНК экспрессия совпадает во всех отделах ТК — миРНК-21, -92a, -34. В случае миРНК-31 экспрессия не совпадает только в слепой кишке, а в случае миРНК-135b и -143 — в правой части ТК.
Возвращаясь к первоначальным предположениям — если развитие аденом связано со случайными событиями в отдельных криптах, то результаты для СО ТК с аденомами и без аденом должны быть идентичными, если же развитие аденом связано с системным действием на СО каких-то факторов, то сходство результатов для СО ТК с аденомами будет ближе к самим аденомам, чем к СО ТК без аденом, — можно утверждать, что наши данные в большей степени указывают на первое предположение. Однако полного совпадения экспрессии всех генов и миРНК в СО ТК без аденом и с аденомами все же установлено не было, особенно это касается слепой и прямой кишки. Причем эти различия не сближают СО ТК с аденомами с самими аденомами, а имеют свои уникальные профили экспрессии.
Явное превалирование частоты выявления единичных неворсинчатых аденом сопровождается существенно разной встречаемостью аденом в разных сегментах ТК (см. рис. 2). Это связано с вопросом тождественности изменений СО сегментов ТК спорадического явления против системного. Приведенные результаты молекулярно-генетического анализа СО ТК в целом указывают на одинаковость СО в норме и при аденомах с некоторыми различиями в экспрессии генов по сегментам ТК (см. табл. 2). Эти данные ставят под сомнение возможность выявления пренеопластических изменений для неворсинчатых аденом как предшественников КРР по одному «случайному» биоптату СО без аденом. Вместе с тем выявленные нами в 1,2% случаев мутации в неизмененной СО (при отсутствии аденом) могут быть тем критерием поиска преднеопластических изменений, позволяющим говорить о возможности предсказания появления неворсинчатых аденом на фоне визуально нормальной СО ТК.
Тем не менее наши данные по частоте как одиночных неоплазий, так и скудных мутационных и микросателлитных посегментных изменений СО при аденомах указывают на отсутствие прямой связи неворсинчатых аденом с канцерогенезом и требуют поиска и объяснения иных механизмов возникновения КРР. Изучение профилей миРНК/мРНК при имеющейся аденоме, по-видимому, может оценить только риск дальнейшей трансформации. Вместе с тем, как указано выше, СО при аденомах все же имеет в некоторых сегментах ТК особенности экспрессии генов.
Возможно, в создании эффективных прогностических моделей для неворсинчатых аденом следует использовать отношения уровней отдельных миРНК по биоптатам нескольких сегментов ТК. Доказанная эффективность снижения частоты КРР при удалении аденом, по-видимому, имеет иные, не ясные пока механизмы реализации [1, 36]. Наблюдаемые нами различия для слепой и прямой кишки могут быть вызваны случайными факторами (нет достоверных различий по критерию Манна —Уитни) и требуют дополнительного изучения. Однако так как правые и левые отделы ТК имеют эмбриональные отличия, при КРР экспрессионный профиль генов эпителиальных клеток слепой и прямой кишки различен для 154 генов [23]. Это подтверждают и наши данные при исследовании нормальной СО ТК. Однако при сравнении СО правой и левой половин ТК были выявлены существенные различия (см. табл. 3). Изменения СО в правой половине ТК позволяют обосновать поиск и предвидение неворсинчатых аденом в левой половине. С другой стороны, выявлена и подтверждена, в том числе и по нашим данным, связь между отделом кишки и частотой эпителиальных новообразований — в сигмовидной, нисходящей и прямой кишке [37]. Отсутствие мутаций и различий в уровне экспрессии генов в СО индексных сегментов ТК и неизмененной СО указывает на отсутствие явных преднеопластических изменений, которые можно было бы определить при скрининговой колоноскопии.
Заключение
Разная частота выявления одиночных неворсинчатых аденом при колоноскопии не имеет прямой связи с посегментарными особенностями молекулярно-генетических изменений СО ТК и не может быть объяснена системными/диффузными изменениями СО ТК. Выявленные различия между сегментами ТК — слепой, восходящей, комплексом ПНС и прямой кишкой — отличаются от рекомендованного деления на правую и левую половины [10]. Тем не менее СО ТК у пациентов с неворсинчатыми аденомами имеет некоторые посегментарные отличия от нормальной СО, требующие учета при совершенствовании скрининговых программ при КРР. Требуются дальнейший поиск и объяснение механизмов связи возникновения неворсинчатых аденом с КРР.
Информация с rmj.ru






