Современные представления о
патофизиологических основах синдрома
функциональной диспепсии
И.В. Маев, Д.Н. Андреев, Ю.А.
Кучерявый, Д.Т. Дичева, Ю.С. Субботина
ГБОУ ВПО «Московский государственный
медико-стоматологический университет им. А.И.
Евдокимова» Минздрава России, Москва,
Российская Федерация
Цель обзора. Предоставить
современные данные о патофизиологических
механизмах, лежащих в основе синдрома
функциональной диспепсии (ФД).
Основные положения. На текущий
момент этиопатогенез ФД рассматривается как
сложный мультифакторный процесс,
причинно-следственные связи которого
продолжают активно изучаться. Нарушения
моторики (замедление эвакуаторной функции,
нарушение релаксационной аккомодации) и
сенситивности желудка (висцеральная
гиперчувствительность к растяжению) считаются
одними из основных патофизиологических
механизмов ФД. Указанные изменения выявляются
в среднем у 40% таких больных. Помимо этого, в
генезе ФД значимую роль могут играть и
механизмы альтерации дуоденальной
сенситивности как к соляной кислоте, так и
липидам.
Заключение. Патофизиология ФД
базируется на большом количестве гетерогенных
механизмов, затрагивающих моторную и
сенситивную функции желудка и
двенадцатиперстной кишки. С учетом столь
значимой роли нарушений моторной активности
желудка приоритетной группой препаратов для
лечения ФД являются прокинетики.
Ключевые слова: функциональная
диспепсия, нарушения моторики, эвакуаторная
функция желудка, релаксационная аккомодация,
висцеральная гиперчувствительность, соляная
кислота, прокинетики.
Функциональная диспепсия (ФД) является
чрезвычайно распространенной патологией,
охватывающей около 15–20% популяции и в
значительной степени снижающей качество жизни
пациентов [1–3]. В соответствии с современной
дефиницией, предложенной Римскими критериями
третьего пересмотра (2006 г.), ФД определяется
как гетерогенное расстройство, представляющее
собой комплекс симптомов, включающих боли и
чувство жжения в подложечной области, ощущение
переполнения в эпигастрии после еды и раннее
насыщение, которые отмечаются у пациента в
течение 3 последних месяцев (при общей
продолжительности жалоб не менее 6 месяцев) и
не могут быть объяснены органическими,
системными или метаболическими заболеваниями
[4].
В зависимости от превалирования в
клинической картине диспептических жалоб
выделяют два основных клинических варианта ФД:
синдром эпигастральной боли (СЭБ) и
постпрандиальный дистресс-синдром (ПДС) [4].
Согласно современным данным, преобладающей
формой ФД является ПДС (55%), реже выявляются
СЭБ (30%) и сочетание ПДС и СЭБ (15%) [1].
СЭБ проявляется периодическими болями в
эпигастрии (как минимум умеренной
интенсивности) с частотой не менее одного раза
в неделю. Боль не генерализованная, имеет
четкую локализацию, не изменяется после
дефекации и отхождения газов. Признаков
нарушения функции желчного пузыря и сфинктера
Одди не наблюдается. Дополнительными
критериями служат: жгучий характер боли без
ретростернального компонента, связь с приемом
пищи или возникновение натощак, а также
сопутствующий постпрандиальный синдром [4, 5].
Диагностическими критериями ПДС являются
возникающее несколько раз в неделю беспокоящее
больного чувство переполнения (тяжести в
эпигастрии) после еды при приеме обычного
объема пищи и (или) чувство раннего насыщения,
не дающее завершить прием пищи. Данные
симптомы могут сопровождаться тошнотой,
отрыжкой, ощущением вздутия в верхней части
живота, эпигастральной болью [4–6].
Применяемые сегодня методы лечения ФД
нельзя признать высокоэффективными, что во
многом связано с не до конца изученным
патогенезом данного заболевания [6].
Действительно, несмотря на существенные
продвижения в исследовании механизмов,
индуцирующих симптоматику ФД, к настоящему
времени единой этиопатогенетической модели
формирования рассматриваемой патологии не
существует [7]. На текущий момент
этиопатогенез ФД расценивается как сложный
мультифакторный процесс, причинно-следственные
связи которого продолжают активно изучаться.
Наиболее вероятно, что сочетание ряда
физиологических, генетических, экологических и
психологических факторов у конкретного
пациента ведет к развитию определенных
комбинаций моторных нарушений
желудочно-кишечного тракта (ЖКТ) и, как
следствие, к проявлению симптомов диспепсии
[1, 6–8].
Традиционно нарушения моторики (замедление
эвакуаторной функции, нарушение адаптивной
релаксации) и сенситивности желудка
(висцеральная гиперчувствительность к
растяжению) считаются одними из основных
патофизиологических механизмов ФД (см.
рисунок) [6, 9, 10]. Тем не менее, недавние
исследования продемонстрировали, что в генезе
изучаемой патологии значимую роль могут играть
и механизмы альтерации дуоденальной
сенситивности как к соляной кислоте, так и
липидам [8].
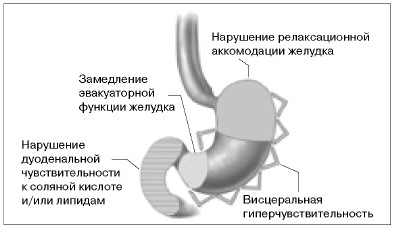
Рис. Основные патофизиологические
механизмы ФД
Замедление эвакуаторнои функции желудка
Повторяющиеся тонические сокращения
проксимального отдела желудка способствуют
дистальному продвижению его содержимого, а
далее за счет перистальтической активности
тела органа химус перемещается в направлении
антрального отдела [11]. Вместе с сокращениями
проксимальных и дистальных отделов происходит
открытие и закрытие привратника желудка, т. е.
контролируемая желудочная эвакуация [12].
Нарушения этого процесса ассоциированы с
замедлением эвакуаторной функции, обуславливая
длительную задержку частиц химуса, индуцируя
симптоматику ФД [8].
Именно замедление эвакуаторной функции
желудка рассматривается как один из ведущих
патофизиологических механизмов ФД. Согласно
ряду исследований, данный механизм выявляется
у 20–50% пациентов с ФД [13–15]. Относительную
гетерогенность результатов по идентификации
этого явления можно объяснить небольшим
размером выборки больных и лиц группы контроля
в некоторых работах. В крупных исследованиях,
включавших 343, 344 и 392 пациента, замедление
эвакуаторной функции желудка регистрировалось
в 33,5, 30 и 23% соответственно [14, 16, 17].
В одном из крупнейших мета-анализов (868
больных с симптомами диспепсии и 397 лиц
контрольной группы) было показано, что функция
опорожнения желудка существенно замедлена
примерно у 40% пациентов [15].
Таким образом, роль замедления эвакуаторной
функции в генезе ФД не вызывает сомнений. С
другой стороны, далеко не во всех
исследованиях была выявлена связь между этим
механизмом и симптоматикой, характерной для ФД.
В ряде крупномасштабных исследований была
продемонстрирована высокая распространенность
таких симптомов, как тошнота, рвота,
постпрандиальное чувство переполнения у
пациентов со сниженной эвакуаторной функцией
[16–18]. Так, по данным G. Karamanolis и соавт.
, у больных с симптомами ПДС задержка
опорожнения желудка выявлялась в 38% [19]. В
свою очередь, многоцентровое исследование,
включившее 551 пациента с ФД, не смогло
выявить вышеописанные закономерности [20].
Отдельно стоит отметить, что имеются
единичные сообщения, свидетельствующие,
напротив, о повышенной эвакуаторной функции
желудка при ФД. Два исследования выявили
высокую распространенность этого явления у 43%
больных при корреляции данного механизма с
интенсивностью симптомов, характерных для ПДС
[21, 22].
Нарушение релаксационной аккомодации
желудка
Большое внимание в контексте патогенеза ФД
в последнее время уделяется нарушению
адаптивной релаксации (релаксационной
аккомодации) желудка. Как известно, несмотря
на анатомическую близость проксимальный и
дистальный отделы желудка выполняют различные
моторные функции. Проксимальный отдел является
главным образом резервуаром для принятия
пищевого комка, в то время как в дистальном
отделе происходит его смешивание и «дробление»
на более мелкие части для дальнейшего
продвижения через пилорический канал [11].
Идеально скоординированная работа между дном,
телом и антральным отделом желудка крайне
важна для нормальной желудочной аккомодации и
эвакуации содержимого в двенадцатиперстную
кишку (ДПК) [6, 8].
Процесс желудочной аккомодации состоит из
расслабления проксимального отдела, что
позволяет обеспечить резервуар для
проглоченной пищи без увеличения
внутрипросветного давления. При этом
релаксация мышечных волокон дна желудка
управляется блуждающим нервом, т. е. требует
участия ацетилхолина [11]. При нарушении
релаксационной аккомодации не происходит
адекватного расслабления проксимального отдела
органа, что приводит к быстрому попаданию пищи
в антральный отдел желудка, его растяжению и
появлению симптоматики заболевания [23].
При проведении сцинтиграфии и
ультрасонографии желудка у пациентов с ФД, как
правило, выявляется нарушенное
внутрижелудочное распределение пищи с
преобладающим накоплением химуса в дистальном
отделе [24, 25]. Помимо этого, при проведении
баростат-теста у пациентов с ФД отмечается
снижение расслабления проксимального отдела
после принятия пищи [26].
В целом нарушение релаксационной
аккомодации выявляется примерно у 40%
пациентов с ФД, однако значение этого
механизма в индукции симптоматики заболевания
обсуждается [26, 27].
В одном из ранних исследований при анализе
взаимосвязи нарушения аккомодации желудка и
симптома «раннего насыщения» данный
патофизиологический механизм был выявлен у
более чем 90% больных с диагностированной ФД
по сравнению с 40% в группе контроля [26].
Однако в более поздних исследованиях подобных
ассоциаций не выявлено [27, 28]. Вероятнее
всего, такую диссоциацию результатов можно
объяснить гетерогенностью популяций пациентов,
их культурно-лингвистическими различиями при
интерпретации симптомов, а также
неоднородностью применявшихся диагностических
методик для оценки сократительной активности
желудка.
Каузативные факторы, ассоциированные с
нарушением аккомодации желудка при ФД,
остаются неизвестными. Концептуально этот
механизм может быть связан с нарушением
ваго-вагального рефлекса, дисфункцией
ингибирующего звена межмышечного нервного
сплетения или гладких миоцитов проксимального
отдела желудка [8, 11].
Висцеральная гиперчувствительность
Помимо нарушений желудочной моторики
ключевую роль в патогенезе ФД играет феномен
висцеральной гиперчувствительности (ВГ) [1, 8,
10, 29]. Наличие данного патологического
состояния нервно-мышечного аппарата желудка
свидетельствует о нарушении сенсорных и
афферентных связей между центральной нервной
системой (ЦНС) и ЖКТ [29, 30].
Некоторые исследования наглядно
продемонстрировали, что у пациентов с ФД
имеется повышенная чувствительность к
растяжению проксимального отдела желудка [30,
31]. Экспериментально установлено, что у
пациентов с ВГ боли в эпигастральной области
возникают при значительно меньшем повышении
внутрижелудочного давления по сравнению со
здоровыми лицами за счет феномена гипералгезии
[30]. В ряде исследований ВГ к растяжению
желудка выявлялась у 34–66% больных,
страдающих ФД [28, 31, 32].
С учетом того, что симптомы диспепсии, как
правило, развиваются или усугубляются после
приема пищи, ВГ к растяжению желудка в
постпрандиальный период может иметь
непосредственное отношение к генерации
проявлений болезни. Тем не менее, не всеми
авторами признается наличие достоверных
ассоциаций между ВГ и симптоматикой
заболевания. Небольшие исследования не выявили
достоверной связи между ВГ и паттерном
симптоматики ФД [28, 32, 33]. Однако в
систематическом анализе 160 пациентов с ФД и
80 лиц группы контроля было
продемонстрировано, что ВГ к растяжению
желудка ассоциирована с такими симптомами, как
отрыжка, боли после приема пищи, а также
снижение массы тела [31].
Феномен формирования ВГ при ФД до конца не
изучен. Скорее всего он базируется на
нарушении механизмов передачи болевого
импульса от желудка к мозгу, таких как
увеличение частоты передаваемых сигналов от
желудка, амплификация нормального сигнала при
прохождении через спинной мозг или
амплификация сигнала в головном мозге [8, 29].
Определенную роль в развитии ВГ у больных с
ФД могут играть и генетические факторы [34]. В
ряде исследований, проведенных в США и Европе,
было установлено, что полиморфизмы гена GNB3
С825T и T825T являются характерными для
пациентов с ФД [35, 36]. Данный ген кодирует
белок G-семейства, функционирующий в качестве
мембранного рецептора. Альтерация функций
указанного семейства белков может опосредовать
нарушения внутриклеточной сигнальной
трансдукции, играя непосредственную роль в
формировании ВГ и моторных нарушений. Помимо
гена GNB3 в недавнем исследовании в Японии
была выявлена достоверная ассоциация ФД с
полиморфизмом G315C гена TRPV1 [37]. Этот ген
кодирует одноименный полимодальный рецептор,
воспринимающий различные стимулы, в том числе
болевые, и играет непосредственную роль в
формировании феномена ВГ [34].
Нарушение дуоденальной чувствительности
к соляной кислоте
Как известно, место соляной кислоты в
патогенезе ФД оценивается неоднозначно. С
одной стороны, у превалирующего большинства
таких больных секреция соляной кислоты в
желудке находится в пределах нормы, с другой,
антисекреторная терапия эффективна у ряда
пациентов, преимущественно с СЭБ, что может
указывать на роль этого фактора в генезе ФД
[1, 10, 38]. В ставшем классическим
исследовании S. Klatt и соавт. достоверных
различий непосредственно в уровне
чувствительности слизистой оболочки желудка к
соляной кислоте у больных ФД с наличием
болевого синдрома в эпигастрии по сравнению с
группой контроля не обнаружено [38]. В
недавнем исследовании T. Oshima и соавт. было
установлено, что при инфузии кислоты
непосредственно в полость желудка такие
симптомы, как вздутие живота, тошнота и
чувство переполнения возникали быстрее и чаще
у пациентов с ФД по сравнению с группой
контроля [39]. Однако, как показывают недавние
исследования, патогенетическая роль соляной
кислоты может проявляться за счет ее
недостаточного клиренса в ДПК и как следствие
более длительной экспозиции и контакте со
слизистой [8].
Действительно, несмотря на то, что при ФД
обычно отмечается нормальный уровень секреции
соляной кислоты в желудке, рядом авторов
продемонстрирована повышенная экспозиция
кислоты в ДПК (в дневное время и после еды) у
этой категории больных [40–42].
В некоторых исследованиях показано, что
перфузии соляной кислоты в ДПК приводили к
возникновению тошноты у пациентов с ФД, но не
у здоровых лиц [43, 44]. В другой работе была
выявлена гиперчувствительность ДПК к соляной
кислоте при ФД. Так, ацидификация ДПК в
достоверно существенно большей мере вызывала
появление диспептических симптомов у этой
категории пациентов в сравнении со здоровыми
лицами (p<0,05) [45].
Особо следует подчеркнуть, что исследования
на здоровых добровольцах обозначили роль
ацидификации ДПК в регуляции моторной функции
желудка, осуществляемой через сенсомоторные
дуоденогастральные рефлекторные пути [46–48].
В частности, опорожнение желудка ингибируется
пропорционально концентрации кислоты
(выраженности ацидификации) в ДПК [46].
Предполагается, что длительная экспозиция
соляной кислоты в ДПК напрямую не способствует
генерации симптомов ФД, однако приводит к
усилению других механизмов (замедлению
эвакуаторной функции, нарушению релаксационной
аккомодации желудка, висцеральной
гиперчувствительности к его растяжению) и
таким образом вносит свой вклад в
возникновение симптоматики заболевания [8,
41]. Тем не менее, можно констатировать, что
необходимы дальнейшие более детальные
исследования в этом направлении.
Патофизиологические
механизмы, лежащие в основе генерации
симптомов при ФД
|
Механизм |
Распространенность у пациентов с ФД,% |
Преимущественная связь с симптоматикой |
| Замедление эвакуаторной функции желудка |
20–50 | Симптомы ПДС |
| Нарушение релаксационной аккомодации желудка |
40 | Чувство раннего насыщения |
| Висцеральная гиперчувствительность к растяжению желудка |
34–66 | Боль в эпигастрии |
| Нарушение дуоденальной чувствительности к соляной кислоте |
Нет данных |
Симптомы ПДС |
| Нарушение дуоденальной чувствительности к липидам |
Нет данных |
Симптомы ПДС, боль в эпигастрии |
Нарушение дуоденальнои чувствительности
к липидам
Как правило, при расспросе пациенты
отмечают, что симптомы ФД обострялись или
возникали после приема пищи, богатой жирами
[49]. Помимо этого, сегодня известно, что
инфузии липидов в ДПК увеличивают
чувствительность к растяжению желудка [50,
51]. Так, у большинства больных с ФД в ответ
на инфузии липидов наблюдаются тошнота и
вздутие живота, в то время как в контрольной
группе указанных симптомов не отмечается [51].
Такой эффект липидов обуславливается
процессом их переваривания с активацией
выработки холецистокинина (ХЦК) [52]. У
пациентов с ФД внутривенное введение ХЦК
вызывает такие симптомы, как боли в эпигастрии,
вздутие живота, чувство переполнения, тошноту,
а иногда и рвоту [53]. При этом прием
антагонистов холецистокининовых CCK-A
рецепторов на фоне инфузии липидов приводит к
возникновению менее выраженной симптоматики
[54]. Вместе с тем до сих пор неизвестно,
насколько внутривенное введение ХЦК
воспроизводимо с действием эндогенного
гормона. Тем не менее, в целом эти результаты
демонстрируют, что эндогенный ХЦК, через
активацию CCK-A рецепторов, участвует в
формировании диспептических симптомов на фоне
инфузии липидов [55]. С учетом того, что во
время инфузии липидов уровни ХЦК плазмы как у
пациентов с ФД, так и у здоровых людей
сопоставимы, механизм формирования симптомов
обусловлен именно повышенной чувствительностью
к ХЦК, а не истинной гиперсекрецией этого
гормона [51].
Терапевтические подходы
Безусловно, принимая во внимание столь
значимую роль нарушений моторной активности
желудка, приоритетной группой препаратов для
лечения ФД являются прокинетики. Частота
ответа на терапию при их использовании
составляет 42%, что выше по сравнению с
другими распространенными методами лечения ФД
(эрадикация инфекции Helicobacter pylori 38%,
антисекреторный эффект 34%) [56].
Эффективность прокинетиков заметно выше при
ПДС, при СЭБ она ниже [57].
В случае СЭБ приоритет должен отдаваться
ингибиторам протонной помпы (ИПП) или
сочетанию их с прокинетиками [9, 57, 58].
Отметим, что среди ИПП зарегистрированное
показание для лечения симптомов диспепсии
имеют только омепразол и лансопразол [57–59].
В схемах эрадикационной терапии могут быть
использованы любые ИПП, однако предпочтение
следует отдавать препаратам «второго
поколения» — рабепразолу и эзомепразолу,
эффективность которых для эрадикации H. pylori
оказывается выше [60].
Среди средств с прокинетическим действием в
настоящее время наиболее широкое
распространение получили антагонисты
дофаминовых D2-рецепторов (метоклопрамид,
домперидон) и прокинетики с двойным
комбинированным механизмом действия (итоприда
гидрохлорид) [6, 57]. Эффективность данной
группы препаратов у больных с ФД подтверждена
в ряде работ. В частности, в мета-анализе из
Кохрановской библиотеки, обобщившем результаты
24 исследований (3178 пациентов),
эффективность прокинетиков в лечении ФД
составила 57%, что значительно превышало
таковую при приеме плацебо (47%) [61].
В настоящее время с учетом субоптимального
профиля безопасности метоклопрамида (экстрапирамидальные
эффекты, акатизия, фокальная дистония и пр.)
его применение в клинической практике
ограничено. У домперидона за счет низкой
пенетрации гематоэнцефалического барьера
уровень побочных эффектов со стороны ЦНС в
сравнении с метоклопрамидом минимальный [62].
Однако способность домперидона действовать на
аденогипофиз, лишенный гематоэнцефалического
барьера, приводит к повышению содержания
пролактина в сыворотке крови и возникновению
соответствующих побочных эффектов —
гиперпролактинемии, галактореи, гинекомастии,
нарушениям менструального цикла. Кроме этого,
домперидон имеет электрофизиологические
свойства, аналогичные III классу
антиаритмических средств, а следовательно,
может продлевать интервал Q–T и тем самым
предрасполагать к желудочковой аритмии [63]. В
наиболее крупном популяционном исследовании
дизайна случай–контроль был продемонстрирован
высокий риск внезапной сердечной смерти у лиц,
принимающих домперидон (ОШ=3,72; 95% ДИ
1,72–8,08) [64].
В связи с этими сообщениями комиссия по
фармаконадзору Европейского медицинского
агентства (аналога FDA в Европе) рекомендовала
применять домперидон не более 1 недели, а
также ограничить показания к его назначению:
домперидонсодержащие препараты могут быть
использованы только при наличии симптомов
тошноты и рвоты, но не должны применяться для
лечения симптомов изжоги (т.е. ГЭРБ). Также
было рекомендовано снизить максимально
допустимые суточные дозы до 30 мг/сут. Данные
рекомендации должны быть в ближайшее время
введены в инструкции по применению
домперидонсодержащих средств.
Итоприда гидрохлорид (Ганатон®; «Abbott
GmbH & Co. KG», Германия) — современный
прокинетик с двойным комбинированным
механизмом действия, представляет собой
антагонист дофаминовых D2-рецепторов
и ингибитор ацетилхолинэстеразы. Такой
фармакологический профиль препарата дает
возможность активизации высвобождения
ацетилхолина, одновременно препятствуя его
деградации [65]. Итоприда гидрохлорид обладает
минимальной способностью проникать через
гематоэнцефалический барьер, не влияет на
продолжительность интервала Q–T и не
взаимодействует с лекарственными средствами,
метаболизирующимися ферментами системы
цитохрома Р-450, в том числе с ИПП, часто
применяемыми при ФД. Препарат оказывает также
противорвотное действие, усиливает
пропульсивную моторику желудка и ускоряет
опорожнение. Безусловно, его использование при
ФД из-за минимального спектра побочных
эффектов в терапевтическом диапазоне доз
предпочтительнее при коротких и длительных (не
менее месяца) курсах лечения [66].
Вышеперечисленные характеристики итоприда
гидрохлорида делают его препаратом выбора для
лечения ФД, что подтверждено многочисленными
мультицентровыми исследованиями эффективности
данного препарата у больных с ФД [67, 68]. В
работе В.Т. Ивашкина и соавт. применение
итоприда гидрохлорида в дозе 50 мг 3 раза в
сутки в течение 4 нед привело к полному
нивелированию клинической симптоматики
заболевания у 46,6% пациентов и значительному
уменьшению их выраженности у 47,3% больных
[69]. Недавний мета-анализ, включивший в себя
9 контролируемых исследований (2620 пациентов
с ФД), подтвердил эффективность итоприда
гидрохлорида, особенно у больных с
преобладанием ПДС, при низком риске развития
побочных явлений [70]. Согласно современным
рекомендациям Российской
гастроэнтерологической ассоциации (РГА),
пациентам с ФД, особенно с ПДС, показан прием
итоприда гидрохлорида в дозе 50 мг 3 раза в
сутки продолжительностью 4 недели (в среднем)
[71, 72].
Заключение
Резюмируя вышеизложенное, можно отметить,
что ФД является одной из наиболее
распространенных патологий ЖКТ и отличается
крайним разнообразием симптомов, предъявляемых
пациентами. Патогенез ФД базируется на большом
количестве гетерогенных механизмов,
затрагивающих моторную и сенситивную функции
желудка и ДПК (см. таблицу). Дальнейшее
изучение патофизиологических процессов,
вовлеченных в формирование ФД, в перспективе
позволит выработать концепции новых
лекарственных препаратов и новых подходов к
лечению данной группы пациентов.
Авторы выражают благодарность компании «Эбботт
Лэбораториз» за помощь, оказанную при
размещении статьи в журнале. Сотрудники
медицинского отдела компании имели возможность
ознакомиться с предлагаемым текстом и сделать
свои комментарии, однако все решения по
окончательному варианту статьи были приняты
исключительно авторами.
Список литературы
- Маев И.В., Андреев Д.Н., Дичева Д.Т.,
Субботина Ю.С., Яшина А.В. Функциональная
диспепсия: современное состояние проблемы.
Мед вест МВД 2013; 4:38-45. (Maev I.V.,
Andreev D.N., Dicheva D.T., Subbotina Yu.S.,
Yashina A.V. Functional dyspepsia: the
current state of the problem. Med vest MVD
2013; 4:38-45.). - El-Serag H.B., Talley N.J. Systemic
review: the prevalence and clinical course
of functional dyspepsia. Aliment Pharmacol
Ther 2004; 19:643-54. - Aro P. , Talley N.J., Agréus L.,
Johansson S.E., Bolling-Sternevald E.,
Storskrubb T., Ronkainen J. Functional
dyspepsia impairs quality of life in the
adult population. Aliment Pharmacol Ther
2011; 33(11):1215-24. - Drossman D.A. The functional
gastrointestinal disorders and the Rome
III process. Gastroenterology 2006;
130:1377-90. - Tack J., Talley N.J., Camilleri M.,
Holtmann G., Hu P., Malagelada J.R.,
Stanghellini V. Functional gastroduodenal
disorders. Gastroenterology 2006;
130:1466-79. - Маев И.В., Самсонов А.А., Андреев Д.Н.
Болезни желудка. М.: ГЭОТАР-Медиа, 2015. (Maev
I.V., Samsonov A.A., Andreev D.N. Stomach
diseases. M.: GEOTAR-Media, 2015). - Vanheel H., Tack J. Therapeutic
options for functional dyspepsia. Dig Dis
2014; 32(3):230-4. - Vanheel H., Farré R. Changes in
gastrointestinal tract function and
structure in functional dyspepsia. Nat Rev
Gastroenterol Hepatol 2013; 10(3):142-9. - Tack J. Dyspepsia. In.: Sleisenger and
Fordtran’s Gastrointestinal and liver
disease: pathophysiology, diagnosis,
management / Eds. M.Feldman, L.S. Friedman,
L.J. Brandt.— 10th ed. 2015. - Miwa H., Watari J., Fukui H., Oshima
T., Tomita T., Sakurai J., Kondo T.,
Matsumoto T. Current understanding of
pathogenesis of functional dyspepsia. J
Gastroenterol Hepatol 2011; 26 (Suppl.
3):53-60. - Kindt S., Tack J. Impaired gastric
accommodation and its role in dyspepsia.
Gut 2006; 55(12):1685-91. - Caldarella M.P., Azpiroz F.,
Malagelada J.R. Antro-fundic dysfunctions
in functional dyspepsia. Gastroenterology
2003; 124(5):1220-9. - Rahim M.K., Durr-e-Sabih, Mateen A.,
Najam-Uddin, Yousaf M. Studies of gastric
emptying time in patients with non-ulcer
dyspepsia. Nucl Med Commun 2007; 28:852-8. - Maes B.D., Ghoos Y.F., Hiele M.I.,
Rutgeerts P.J. Gastric emptying rate of
solids in patients with nonulcer dyspepsia.
Dig Dis Sci 1997; 42(6):1158-62. - Quartero A.O., de Wit N.J., Lodder
A.C., Numans M.E., Smout A.J., Hoes A.W.
Disturbed solid-phase gastric emptying in
functional dyspepsia: a meta-analysis. Dig
Dis Sci 1998; 43(9):2028-33. - Stanghellini V., Tosetti C., Paternico
A., Barbara G., Morselli-Labate A.M.,
Monetti N., Marengo M., Corinaldesi R.
Risk indicators of delayed gastric
emptying of solids in patients with
functional dyspepsia. Gastroenterology
1996; 110(4):1036-42. - Sarnelli G., Caenepeel P., Geypens B.,
Janssens J., Tack J. Symptoms associated
with impaired gastric emptying of solids
and liquids in functional dyspepsia. Am J
Gastroenterol 2003; 98(4):783-8. - Perri F., Clemente R., Festa V.,
Annese V., Quita-damo M., Rutgeerts P.,
Andriulli A. Patterns of symptoms in
functional dyspepsia: role of Helicobacter
pylori infection and delayed gastric
emptying. Am J Gastroenterol 1998;
93(11):2082-8. - Karamanolis G., Caenepeel P., Arts J.,
Tack J. Association of the predominant
symptom with clinical characteristics and
pathophysiological mechanisms in
functional dyspepsia. Gastroenterology
2006; 130:296-303. - Talley N.J., Verlinden M., Jones M.
Can symptoms discriminate among those with
delayed or normal gastric emptying in
dysmotility-like dyspepsia? Am J
Gastroenterol 2001; 96(5):1422-8. - Delgado-Aros S., Camilleri M.,
Cremonini F., Ferber I., Stephens D.,
Burton D.D. Contributions of gastric
volumes and gastric emptying to meal size
and postmeal symptoms in functional
dyspepsia. Gastroenterology 2004;
127(6):1685-94. - Kusano M., Zai H., Shimoyama Y.,
Hosaka H., Kuribayashi S., Kawamura O.,
Mori M. Rapid gastric emptying, rather
than delayed gastric emptying, might
provoke functional dyspepsia. J
Gastroenterol Hepatol 2011; 26 (Suppl.
3):75-8. - Piessevaux H., Tack J., Walrand S.,
Pauwels S., Geubel A. Intragastric
distribution of a standardized meal in
health and functional dyspepsia:
correlation with specific symptoms.
Neurogastroenterol Motil 2003; 15:447-55. - Gilja O.H., Hausken T., Wilhelmsen I.,
Berstad A. Impaired accommodation of
proximal stomach to a meal in functional
dyspepsia. Dig Dis Sci 1996; 41(4):689-96. - Troncon L.E., Rosa-e-Silva L.,
Oliveira R.B., Iazigi N., Gallo L.Jr.,
Foss M.C. Abnormal intragastric
distribution of a liquid nutrient meal in
patients with diabetes mellitus. Dig Dis
Sci. 1998; 43(7):1421-9. - Tack J., Piessevaux H., Coulie B.,
Caenepeel P., Janssens J. Role of impaired
gastric accommodation to a meal in
functional dyspepsia. Gastroenterology
1998; 115(6):1346-52. - Kim D.Y., Delgado-Aros S., Camilleri
M., Samsom M., Murray J.A., O’Connor M.K.,
Brinkmann B.H., Stephens D.A., Lighvani
S.S., Burton D.D. Noninvasive measurement
of gastric accommodation in patients with
idiopathic nonulcer dyspepsia. Am J
Gastroenterol 2001; 96(11):3099-105. - Boeckxstaens G.E., Hirsch D.P., Kuiken
S.D., Heisterkamp S.H., Tytgat G.N. The
proximal stomach and postprandial symptoms
in functional dyspeptics. Am J
Gastroenterol 2002; 97(1):40-8. - Keohane J., Quigley E.M.M. Functional
dyspepsia: The role of visceral
hypersensitivity in its pathogenesis.
World J. Gastoenterol 2006; 12:2672-6. - Vandenberghe J., Vos R., Persoons P. ,
Demyttenaere K., Janssens J., Tack J.
Dyspeptic patients with visceral
hypersensitivity: sensitisation of pain
specific or multimodal pathways? Gut 2005;
54:914-9. - Tack J., Caenepeel P., Fischler B.,
Piessevaux H., Janssens J. Symptoms
associated with hypersensitivity to
gastric distention in functional dyspepsia.
Gastroenterology 2001; 121(3):526-35. - Mertz H., Fullerton S., Naliboff B.,
Mayer E.A. Symptoms and visceral
perception in severe functional and
organic dyspepsia. Gut 1998; 42(6):814-22. - Rhee P.L., Kim Y.H., Son H.J., Kim
J.J., Koh K.C., Paik S.W., Rhee J.C., Choi
K.W. Evaluation of individual symptoms
cannot predict presence of gastric
hypersensitivity in functional dyspepsia.
Dig Dis Sci 2000; 45(8):1680-4. - Sarnelli G., D’Alessandro A., Pesce
M., Palumbo I., Cuomo R. Genetic
contribution to motility disorders of the
upper gastrointestinal tract. World J
Gastrointest Pathophysiol 2013;
4(4):65-73. - Camilleri C.E., Carlson P.J.,
Camilleri M., Castillo E.J., Locke
G.R.3rd, Geno D.M., Stephens D.A.,
Zinsmeister A.R., Urrutia R. A study of
candidate genotypes associated with
dyspepsia in a U.S. community. Am J
Gastroenterol 2006; 101(3):581-92. - Van Lelyveld N., Linde J.T., Schipper
M., Samsom M. Candidate genotypes
associated with functional dyspepsia.
Neurogastroenterol Motil 2008;
20(7):767-73. - Tahara T., Shibata T., Nakamura M.,
Yamashita H., Yoshioka D., Hirata I.,
Arisawa T. Homozygous TRPV1 315C
influences the susceptibility to
functional dyspepsia. J Clin Gastroenterol
2010; 44(1):1-7. - Klatt S., Pieramico O., Guethner C.
Glasbrenner B., Beckh K., Adler G. Gastric
hipersensitivity in non-ulcer dyspepsia:
an inconsistent finding. Dig Dis Sci 1997;
2(4):720-3. - Oshima T., Okugawa T., Tomita T.,
Sakurai J., Toyoshima F., Watari J.,
Yamaguchi K., Fujimoto K., Adachi K.,
Kinoshita Y., Kusunoki H., Haruma K., Miwa
H. Generation of dyspeptic symptoms by
direct acid and water infusion into the
stomachs of functional dyspepsia patients
and healthy subjects. Aliment Pharmacol
Ther 2012; 35(1):175-82. - Collen M.J., Loebenberg M.J. Basal
gastric acid secretion in nonulcer
dyspepsia with or without duodenitis. Dig
Dis Sci 1989; 34(2):246-50. - Lee K.J., Demarchi B., Demedts I.,
Sifrim D., Raeymaekers P., Tack J. A pilot
study on duodenal acid exposure and its
relationship to symptoms in functional
dyspepsia with prominent nausea. Am J
Gastroenterol 2004; 99(9):1765-73. - Bratten J., Jones M.P. Prolonged
recording of duodenal acid exposure in
patients with functional dyspepsia and
controls using a radiotelemetry pH
monitoring system. J Clin Gastroenterol
2009; 43(6):527-33. - Samson M., Verhagen M.A., van
Berge-Henegouwen G.P. Abnormal clearance
of exogenous acid and increased acid
sensitivity of the proximal duodenum in
dyspeptic patients. Gastroenterology 1999;
116:515-20. - Schwartz M.P., Samsom M., Smout A.J.
Chemospecific alterations in duodenal
perception and motor response in
functional dyspepsia. Am J Gastroenterol
2001; 96(9):2596-602. - Ishii M., Kusunoki H., Manabe N.,
Kamada T., Sato M., Imamura H., Shiotani
A., Hata J., Haruma K. Evaluation of
duodenal hypersensitivity induced by
duodenal acidification using transnasal
endoscopy. J Gastroenterol Hepatol 2010;
25(5):913-8. - Hunt J.N., Knox M.T. The slowing of
gastric emptying by four strong acids and
three weak acids. J Physiol 1972;
222(1):187-208. - Woodtli W., Owyang C. Duodenal pH
governs inter-digestive motility in humans.
Am J Physiol 1995; 268(1 Pt 1):146-52. - Lee K.J., Vos R., Janssens J., Tack J.
Influence of duodenal acidification on the
sensorimotor function of the proximal
stomach in humans. Am J Physiol
Gastrointest Liver Physiol 2004;
286(2):278-84. - Mullan A., Kavanagh P., O’Mahony P.,
Joy T., Gleeson F., Gibney M.J. Food and
nutrient intakes and eating patterns in
functional and organic dyspepsia. Eur J
Clin Nutr 1994; 48(2):97-105. - Barbera R., Feinle C., Read N.W.
Abnormal sensitivity to duodenal lipid
infusion in patients with functional
dyspepsia. Eur J Gastroenterol Hepatol
1995; 7(11):1051-7. - Björnsson E., Sjöberg J., Ringström
G., Norström M., Simrén M., Abrahamsson H.
Effects of duodenal lipids on gastric
sensitivity and relaxation in patients
with ulcer-like and dysmotility-like
dyspepsia. Digestion 2003; 67(4):209-17. - Feinle C., D’Amato M., Read N.W.
Cholecystokinin-A receptors modulate
gastric sensory and motor responses to
gastric distension and duodenal lipid.
Gastroenterology 1996; 110(5):1379-85. - Chua A.S., Dinan T.G., Rovati L.C.,
Keeling P.W. Cholecystokinin
hyperresponsiveness in dysmotility-type
nonulcer dyspepsia. Ann N Y Acad Sci 1994;
713:298-9. - Chua A.S., Bekkering M., Rovati L.C.,
Keeling P.W. Clinical efficacy and
prokinetic effect of the CCK-A antagonist
loxiglumide in nonulcer dyspepsia. Ann N Y
Acad Sci 1994; 713:451-3. - Van Boxel O.S., ter Linde J.J., Oors
J., Otto B., Weusten B.L., Feinle-Bisset
C., Smout A.J., Siersema P.D. Functional
dyspepsia patients have lower mucosal
cholecystokinin concentrations in response
to duodenal lipid. Eur J Gastroenterol
Hepatol 2014; 26(2):205-12. - Chen S.L. A review of drug therapy for
functional dyspepsia. J Dig Dis 2013; 14;
623-5. - Маев И.В., Самсонов А.А., Андреев
Д.Н., Кочетов С.А. Дифференцированная
тактика лечения синдрома функциональной
диспепсии. Мед совет 2012; 9:13-20. (Maev
I.V., Samsonov A.A., Andreev D.N.,
Kochetov S.A. Differentiated treatment of
functional dyspepsia syndrome. Med sovet
2012; 9:13-20.). - Кучерявый Ю.А., Андреев Д.Н. Синдром
функциональной диспепсии: актуальные
подходы к диагностике и лечению. Фарматека
2014; 2:80-6. (Kucheryavyy Yu.A., Andreev
D.N. The syndrome of functional dyspepsia:
Current approaches to diagnosis and
treatment. Farmateka 2014; 2:80-6.). - Кучерявый Ю.А., Андреев Д.Н.
Функциональная диспепсия: современный
алгоритм терапии и реалии российской
практики. Consilium Medicum.
Гастроэнтерология 2014; 1:27-32. (Kucheryavyy
Yu.A., Andreev D.N. Functional dyspepsia:
modern treatment algorithm and the
realities of the Russian practice.
Consilium Medicum. Gastroenterology 2014;
1:27-32.). - McNicholl A.G., Linares P.M., Nyssen
O.P. , Calvet X., Gisbert J.P.
Meta-analysis: esomeprazole or rabeprazole
vs. first-generation pump inhibitors in
the treatment of Helicobacter pylori
infection. Aliment Pharmacol Ther 2012;
36:414-25 - Moayyedi P. , Soo S., Deeks J..,
Delaney B., Innes M., Forman D.
Pharmacological interventions for
non-ulcer dyspepsia. Cochrane Database
Syst Rev 2006; 4:CD001960. - Маев И.В., Дичева Д.Т., Андреев Д.Н.
Возможности применения домперидона в
комплексной терапии гастроэзофагеальной
рефлюксной болезни. Мед совет 2012;
2:56-60. (Maev I.V., Dicheva D.T., Andreev
D.N. Domperidone in the treatment of
gastroesophageal reflux disease. Med sovet
2012; 2:56-60.). - Drolet B., Rousseau G., Daleau P. ,
Cardinal R., Turgeon J. Domperidone should
not be considered a no-risk alternative to
cisapride in the treatment of
gastrointestinal motility disorders.
Circulation 2000; 102:1883-5. - Van Noord C., Dieleman J.P., van
Herpen G., Verhamme K., Sturkenboom M.C.
Domperidone and ventricular arrhythmia or
sudden cardiac death: a population-based
case-control study in the Netherlands.
Drug Saf 2010; 33(11):1003-14. - Iwanaga Y., Kimura T., Miyashita N.,
Morikawa K., Nagata O., Itoh Z., Kondo Y.
Characterization of
acetylcholinesterase-inhibition by
itopride. Jpn J Pharmacol 1994; 66:317-22. - Talley N.J., Tack J., Ptak T., Gupta
R., Giguère M. Itopride in functional
dyspepsia: results of two phase III
multicentre, randomised, double-blind,
placebo-controlled trials. Gut 2008;
57:740-746. - Li Y.H., Gong P. L., Hou X.H., Chen
J., Liu N.Z., Tian D.A., Tang F.A., Feng
C.W., Yang Y.X., Li H.B. Itopride in
treatment of 104 patients with functional
dyspepsia: a randomized, double-blind
controlled clinical trial. Zhongguo Xinyao
Yu Linchuang Zazhi 2005;7:524-8. - Holtmann G., Talley N.J., Liebregts
T., Adam B., Parow C. A placebo-controlled
trial of itopride in functional dyspepsia.
N Engl J Med 2006; 354:832-40. - Ивашкин В.Т., Шептулин А.А., Трухманов
А.С. Эффективность применения ганатона (итоприда
гидрохлорида) в лечении больных
функциональной диспепсией. Фарматека 2009;
13:50-4. (Ivashkin V.T., Sheptulin A.A.,
Trukhmanov A.S. The effectiveness of
Ganaton (itopride hydrochloride) in the
treatment of patients with functional
dyspepsia. Farmateka. 2009; 13:50-4.). - Huang X., Lv B., Zhang S., Fan Y.H.,
Meng L.N. Itopride therapy for functional
dyspepsia: a meta-analysis. World J
Gastroenterol 2012; 18(48):7371-7. - Ивашкин В.Т., Шептулин А.А., Лапина
Т.Л., Картавенко И.М., Киприанис В.А.,
Охлобыстина О.З., Новожилов Н.В.
Диагностика и лечение функциональной
диспепсии. Методические рекомендации для
врачей. М.: РГА, 2011. (Ivashkin V.T.,
Sheptulin A.A., Lapina T.L., Kartavenko
I.M., Kiprianis V.A., Okhlobystina O.Z.,
Novozhilov N.V. Diagnosis and treatment of
functional dyspepsia. Guidelines for
doctors. M.: RGA, 2011.). - Ивашкин В.Т., Шептулин А.А., Лапина
Т.Л., Картавенко И.М., Киприанис В.А.,
Охлобыстина О.З., Новожилов Н.В.
Рекомендации Российской
гастроэнтерологической ассоциации по
диагностике и лечению функциональной
диспепсии. Рос журн гастроэнтерол гепатол
колопроктол 2012; 22(3):80-92. (Ivashkin
V.T., Sheptulin A.A., Lapina T.L.,
Kartavenko I.M., Kiprianis V.A.,
Okhlobystina O.Z., Novozhilov N.V.
Guidelines of the Russian
gastroenterological association on
diagnostics and treatment of functional
dyspepsia. Ros zhurn gastroenterol gepatol
koloproktol 2012; 22(3):80-92.).
Статья опубликована на сайте
http://www.gastroscan.ru
материал MedLinks.ru