Для цитирования: Чусляева А.А. Современные подходы к наружной терапии атопического дерматита у детей // РМЖ. 2014. №8. С. 626
Атопический дерматит (АД) занимает ведущее место в структуре аллергических заболеваний. Частота встречаемости АД среди детей в развитых странах составляет от 10 до 20% [1–3], причем эта цифра неуклонно растет. Острота проблемы АД в педиатрии обусловлена ранним началом заболевания, быстротой развития хронических форм.
Приблизительно у 45% пациентов проявления данного заболевания появляются в течение первых 6 мес. жизни, в 60% – дебют АД наблюдается в течение первого года жизни, в 85% – в возрасте от 1 года до 5 лет [4]. У 70% больных тяжелыми формами АД в дальнейшем развивается бронхиальная астма или аллергический ринит [5, 6].
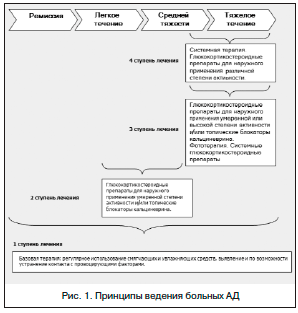
Целью лечения АД является сокращение количества и тяжести обострений и продление периодов ремиссии. В настоящее время полное излечение от АД не представляется возможным, т. к. это хроническое заболевание, требующее длительного контроля за своим течением. В соответствии с международным согласительным документом по лечению АД [7] принят ступенчатый подход к терапии в зависимости от стадии заболевания, предусматривающий использование топических глюкокортикостероидов, ингибиторов кальциневрина, увлажняющих и смягчающих средств, в комплексе с элиминационными мероприятиями на всех стадиях заболевания (рис. 1). Терапия может меняться как с усилением (переход на более высокую ступень лечения) при утяжелении клинических проявлений, так и с применением более щадящих методов терапии (понижение ступени лечения) в случае положительной динамики заболевания.
Рекомендации по терапии ребенка с АД должны содержать следующие позиции:
1. Мероприятия по устранению воздействия причинно-значимого аллергена (элиминационная диета и изменения аллергенного окружения) и других триггерных факторов.
2. Фармакотерапия:
- местная;
- системная;
3. Уход за кожей.
Поскольку в основе клинической манифестации АД лежит аллергическое воспаление кожи [8], наружная терапия является неотъемлемой составляющей комплексного лечения заболевания, положительно воздействует на различные стороны патогенеза АД. Наружная терапия направлена, прежде всего, на уменьшение и устранение субъективных ощущений (зуда, боли, жжения), купирование кожных проявлений аллергии в острой и хронической фазах болезни, профилактику и лечение вторичной инфекции, уменьшение или устранение сухости кожи как в очагах, так и вне очагов поражения, защиту кожи от неблагоприятных воздействий внешней среды.
Как известно, клинические проявления АД существенно зависят от возраста больных [8], что позволяет выделить три стадии заболевания: младенческую (с 3–4 мес. до 1,5–2 лет), детскую (от 2 до 10–12 лет) и взрослую (старше 12 лет). С учетом возрастной стадийности патологического процесса в коже выделяют 5 форм АД: экссудативную, эритематозно-сквамозную, эритематозно-сквамозную с лихенификацией, лихеноидную и пруригинозную [9]. У детей раннего возраста в клинической картине заболевания преобладает экссудативный компонент. Младенческая и детская стадии АД наиболее часто проявляются экссудативной или эритематозно-сквамозной (иногда эритематозно-сквамозной с лихенификацией) формами, что обусловлено физико-анатомическими особенностями строения детской кожи. У детей более старшего возраста в клинической картине заболевания преобладают элементы хронического воспаления. Взрослая стадия АД характеризуется формами, протекающими с явлениями лихенификации (лихеноидная, эритематозно-сквамозная с лихенификацией и пруригинозная).
Учитывая различные клинические проявления АД, назначение тех или иных средств наружной терапии каждому конкретному больному должно быть строго индивидуальным. Кроме того, необходимо постоянное наблюдение за динамикой кожного процесса с целью своевременной замены лекарственной формы и/или лекарственного препарата.
Для того чтобы добиться успеха при проведении наружной терапии и избежать осложнений, необходимо соблюдать определенную последовательность применения местных лекарственных препаратов соответственно эволюции кожного процесса [10]:
1. При остром мокнущем воспалительном процессе используются примочки, аэрозоли, влажно-высыхающие повязки.
2. При остром воспалительном процессе без мокнутия – примочки, аэрозоли, водные болтушки, присыпки, пасты, кремы.
3. При подостром воспалительном процессе – кремы, пасты, присыпки.
4. При хроническом неспецифическом воспалительном процессе – мази, согревающие компрессы.
5. При выраженной инфильтрации в очагах – мази и кремы с кератолитическими свойствами.
6. В стадии регресса кожного процесса – мази, бальзамы и кремы с биологическими добавками и витаминами.
Стандартная противовоспалительная наружная терапия проводится с использованием двух классов средств: топические глюкокортикостероиды и топические ингибиторы кальциневрина.
Топические глюкокортикостероиды являются препаратами первой линии в наружной терапии АД, оказывают выраженный клинический эффект как при остром, так и хроническом воспалении. Топические глюкокортикостероиды действуют как на раннюю, так и на позднюю фазу аллергического воспаления. Терапевтический эффект топических глюкокортикостероидов обусловлен их противовоспалительным, сосудосуживающим, антиаллергическим и антипролиферативным действием. Механизм противовоспалительного эффекта этих препаратов заключается в блокаде фосфолипазы А2, следовательно, происходят снижение продукции лейкотриенов, выраженный и длительный ангиоспазм, торможение синтеза глюкозаминогликанов, коллагена и эластина, повышение связывания гистамина и других медиаторов, снижение выброса лизосомальных ферментов, уменьшение в эпидермисе клеток Лангерганса, тучных клеток и т. д.
Правильное применение топических глюкокортикостероидов позволяет быстро стабилизировать процесс, минимизировать развитие побочных эффектов (атрофия кожи, стрии, телеангиэктазии, гипертрихоз и т. д.). Для предупреждения развития побочных эффектов необходимо соблюдать следующие правила:
- максимальная площадь нанесения гормонального препарата не должна превышать 20% поверхности тела;
- использовать только высокоэффективные безопасные наружные глюкокортикостероиды, обладающие длительным действием;
- длительность лечения – до 14 дней, для современных препаратов – до 3–4 нед.;
- при отсутствии положительной динамики в течение 5–7 дней необходимо пересмотреть тактику лечения;
- не использовать под повязку.
Эффективность местных кортикостероидных препаратов зависит от возможности их проникновения в эпидермис и дерму. Наиболее оптимальным профилем безопасности и более высокой лечебной эффективностью обладают нефторированные топические глюкокортикостероиды [11]. После местного применения кортикостероида его проникновение вглубь кожи осуществляется тремя основными путями: через роговой слой эпидермиса, волосяные мешочки и сальные или потовые железы. Достаточное увлажнение рогового слоя эпидермиса в несколько раз увеличивает проникновение местных кортикостероидных препаратов.
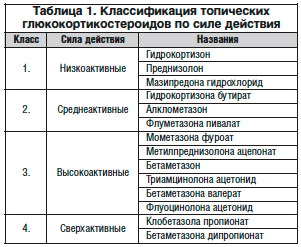
Выбор силы топических глюкокортикостероидов для начальной терапии представляет собой один из самых сложных вопросов, он зависит от нозологии, возраста, места и распространенности поражения. Как известно, топические глюкокортикостероиды подразделяют по активности на 4 класса – слабые, умеренной силы, сильные и очень сильные (табл. 1). Выбор лекарственной формы (мазь, крем, лосьон) определяется выраженностью воспалительного процесса в коже и необходимой глубиной воздействия.
Скорость проникновения кортикостероидов достигает наибольшей величины при применении мази и, в значительно меньшей степени, при применении крема. Также следует отметить и значимость липофильности кортикостероидного препарата. Чем липофильнее кортикостероид, тем в большей концентрации он накапливается в клетках кожи и тем самым медленнее попадает в кровь.
Чем активнее воспаление, тем более щадящей должна быть терапия. Различные кожные поверхности отличаются по способности к всасыванию топических глюкокортикостероидов. Тонкая кожа век быстро заживает при использовании низкоактивных кортикостероидов, тогда как такие участки кожи, как ладони и стопы представляют значительный барьер для пенетрации местных препаратов и требуют применения более сильных топических глюкокортикостероидов. Интертригинозные области (подмышечная, паховая, ректальная, под молочной железой) отвечают на слабые крема. Наличие двух соприкасающихся поверхностей выполняет функцию, аналогичную окклюзионной повязке, что резко повышает пенетрацию препарата. В связи с возрастными особенностями строения кожа детей грудного и раннего возраста более чувствительна к топическим кортикостероидам и стремительно отвечает уже при использовании препаратов слабой силы. Воспаленная кожа абсорбирует местные препараты более интенсивно, что объясняет тот факт, что воспаленная область быстро отвечает на лечение даже слабыми стероидами.
У 90% пациентов с АД выявляется колонизация кожи Staphylococcus aureus [8]. Последние исследования свидетельствуют о том, что Staphylococcus aureus способен усиливать или поддерживать воспалительный процесс на коже больных АД, являясь продуцентом энтеротоксинов, обладающих свойствами суперантигенов, стимулирующих активацию Т-клеток и макрофагов. Поскольку стафилококковые энтеротоксины по своей природе являются белками с молекулярной массой 24–30 кД, было высказано предположение, что они могут выступать в качестве аллергенов. Основными энтеротоксинами, секретируемыми Staphylococcus aureus, являются энтеротоксины А, B, эксфолиативный токсин и токсин стафилококкового шокового синдрома. У большинства пациентов с АД выявляются специфические IgE к стафилококковым суперантигенам, концентрация которых коррелирует с тяжестью течения АД [12]. Некоторые авторы придерживаются мнения, что назначение системных антибиотиков значительно уменьшает проявления АД, что, вероятно, связано с их подавляющим действием на суперантигены Staphylococcus aureus [13].
Присоединение вторичной бактериальной инфекции – наиболее частое осложнение АД, требующее назначения местных антибактериальных, антисептических препаратов (1–2% растворы анилиновых красителей, примочек с 2% раствором фурациллина, 2–4% паст и мазей с антибиотиками, мупироцин и др.). При наличии распространенных пустулезных высыпаний, локализации элементов пиодермии на лице, общих нарушениях (лихорадка, лимфоаденопатия, изменения гемограммы), а также при недостаточной эффективности наружной антибактериальной терапии целесообразно назначение системных антибиотиков.
Грибковые инфекции также могут осложнять течение АД и вносить определенный вклад в активность заболевания. Необходимо учитывать определенную вероятность развития сенсибилизации к грибковым аллергенам, в частности к Malassezia furfur, которая является одним из факторов, способствующих упорному течению сочетанного АД, особенно при локализации высыпаний на лице и шее. В данной ситуации показано наружное использование препаратов с противогрибковой активностью (клотримазол крем, тербинафин, кетоконазол и др.). Однако инфекция кожи у детей с АД чаще всего носит смешанный характер. При сочетании бактериальной и грибковой инфекции, а также выраженной воспалительной реакции кожи целесообразно назначение комбинированных препаратов, содержащих в своем составе топический глюкокортикостероид и противомикробные компоненты с антибактериальной и противогрибковой активностью (пимафукорт, бетаметазон + гентамицин + клотримазол).
Необходимо подчеркнуть, что изменение концентрации топических глюкокортикостероидов имеет различный эффект на их биологические функции, в связи с чем разведение патентованных препаратов или добавление в них ингредиентов не рекомендуется.
Наличие очагов лихенификации, выраженной сухости и шелушения кожи представляет собой наиболее яркую диагностическую черту АД. При хроническом воспалительном процессе, выраженной инфильтрации в очагах целесообразно использовать комбинированные кортикостероидные мази с кератолитическими свойствами. Комбинация топического кортикостероида бетаметазона и салициловой кислоты (Редерм) эффективно применяется для лечения сухих гиперкератических дерматозов. Cалициловая кислота обладает противовоспалительным, отшелушивающим и кератолитическим действиями. 3% концентрация салициловой кислоты в мази Редерм достаточна для эффективного удаления роговых чешуек и увлажнения кожи за счет гигроскопичности салициловой кислоты. При этом данная концентрация салициловой кислоты не повреждает кератиноциты. В мази Редерм используется топический кортикостероид дипропионат бетаметазона – наиболее сильная модификация этого кортикостероида. Эффективность комбинированной терапии заметна уже на 1-й нед. лечения при ежедневном нанесении мази Редерм 2 р./сут. Доказаны безопасность и минимальный риск побочных эффектов при длительном применении препарата курсом до 3-х нед. с максимальной площадью нанесения препарата на пораженную поверхность кожи, не превышающую 20% поверхности тела. По данным проведенных исследований, не отмечено снижения уровня кортизола в сыворотке крови пациентов при использовании бетаметазона 50 г/нед. на протяжении 3 нед., что свидетельствует об отсутствии подавления функции коры надпочечников.
Хронические дерматозы требуют длительной терапии, небольшая экономия при покупке одной тубы препарата выливается в значительную выгоду на 3–4-й нед. лечения. Альтернативным лекарственным препаратом для наружной терапии АД, обладающим высокой противовоспалительной активностью, является топический ингибитор кальциневрина – такролимус. Механизм противовоспалительного действия такролимуса связан с блокированием эффектов внутриклеточного белка кальциневрина, который участвует в передаче внутриклеточного кальций-зависимого сигнала клетками иммунной системы, что препятствует образованию и высвобождению провоспалительных цитокинов (ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ФНОα, интерферона-γ) и пролиферации Т-лимфоцитов.
Показаниями к назначению такролимуса являются среднетяжелое и тяжелое течение АД в случае резистентности к стандартной терапии.
Использование топического ингибитора кальциневрина является предпочтительным при локализации высыпаний на тонкой коже лица, шеи, крупных складок и аногенитальной области. Обосновано применение такролимуса в период ремиссии заболевания в качестве противорецидивной терапии (нанесение области обычной локализации высыпаний 2 раза в неделю в течение 6–12 мес.), что позволяет значительно сократить частоту и тяжесть обострений АД [14, 15].
Таким образом, терапия АД у детей, направленная на блокирование развития аллергического воспаления, должна быть строго индивидуальной и базироваться на выявлении особенностей патогенеза у конкретного ребенка.
Одной из важных проблем наружной терапии больных АД является устранение сухости кожных покровов. Острое или хроническое воспаление, а также нарушение барьерной функции кожи приводит к повышенной трансэпидермальной потере воды и развитию ее сухости. В связи с этим особое внимание необходимо уделять и уходу за кожей с использованием современных увлажняющих средств, как в период обострения, так и в период ремиссии заболевания.
Литература
- Leung D., Boguniewicz M., Howell M. et al. New insights into atopic dermatitis // J. Clin. Invest. 2004. Vol. 113. P. 651–657.
- Odhiambo J., Williams H., Clayton T. et al. Global variations in prevalence of eczema symptoms in children from ISAAC Phase Three // J. Allergy Clin. Immunol. 2009. Vol. 124. P. 1251–1258.
- Shaw T., Currie G., Koudelka C., Simpson E. Eczema prevalence in the United States: data from the 2003 National Survey of Children’s Health // J. Invest. Dermatol. 2011. Vol. 131. P. 67–73.
- Li S., von Mutius E., Lau S. et al. The natural course of atopic dermatitis from birth to age 7 years and the association with asthma // J. Allergy Clin. Immunol. 2004. Vol. 113. P. 925–931.
- Spergel J. Atopic march: link to upper airways // Curr. Opin. Allergy Clin. Immunol. 2005. Vol. 5. P. 17–21.
- Zheng T., Yu J., Oh M.H., Zhu Z. The atopic march: progression from atopic dermatitis to allergic rhinitis and asthma // Allergy Asthma Immunol. Res. 2011. Vol. 3. P. 67–73.
- Akdis C., Akdis M., Bieber T. et al. Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology/PRACTALL Consensus Report // J. Allergy Clin. Immunol. 2006. Vol. 118(1). P. 152–169.
- Leung D., Bieber T. Atopic dermatitis // The Lancet. 2003. Vol. 361. P. 151–160.
- Балаболкин И.И., Гребенюк В.Н. Атопический дерматит у детей. М.: Медицина, 1999. С. 238.
- Наружная терапия атопического дерматита у детей // Методические рекомендации под ред. Казначеевой Л.Ф. Новосибирск, 2000. С. 50.
- Феденко Е.С. Атопический дерматит. Когда и как использовать топические глюкокортикостероиды // Рос. аллерголог. журнал. 2012. № 3. С. 32–36.
- Breuer K., Wittmann M., Bosche B. et al. Severe atopic dermatitis is associated with sensitization to staphylococcal enterotoxin B (SEB) // Allergy. 2000. Vol. 55. P. 551–555.
- Werfel T., Kapp A. The role of environmental factors in the provocation of atopic dermatitis// Allergy Clin. Immunol. 1999. Vol. 11. P. 49–54.
- Wollenberg A., Reitamo S., Girolomoni G. et al. Proaktive treatment of atopic dermatitis in adults with 0,1% tacrolimus ointment // Allergy. 2008. Vol. 63. P. 742–750.
- Thaci D., Reitamo S., Gonzales Ensenat M. et al. Proaktive disease management with 0,03% tacrolimus ointment for children with atopic dermatitis: results of a randomized, multicenter comparative study // Br. J. Dermatol. 2008. Vol. 159. P. 1348–1356.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






