Современные подходы к базисной терапии бронхиальной астмы у
детей раннего возраста. Роль и место антилейкотриеновых препаратов
Г. А. Новик, доктор медицинских наук, профессор
Е. Г. Халева
ГБОУ ВПО СПбГПМУ МЗ РФ, Санкт-Петербург
Бронхиальная астма (БА) — это наиболее частое хроническое заболевание
детского возраста и одна из основных причин детской смертности от хронических
заболеваний. Обострение БА является частой причиной пропусков школы, поступления
в отделение интенсивной терапии и госпитализации [1].
Для того чтобы выработать единый подход к диагностике и лечению БА, были
созданы несколько важных международных рекомендаций: Национальная программа по
обучению и профилактике бронхиальной астмы (NAEPP), Британское руководство по
лечению астмы, Международный консенсус по астме у детей (ICON), Глобальная
инициатива по лечению и профилактике бронхиальной астмы (GINA). GINA — это
важный документ, определяющий дальнейшее направление диагностики, лечения и
профилактики бронхиальной астмы, основанный на новейших достижениях в области
медицины, фармакологии и молекулярной биологии. Многие национальные
рекомендации, в том числе и рекомендации Союза педиатров России, практически
полностью базируются на принципах Глобальной стратегии лечения и профилактики
бронхиальной астмы.
Согласно новому определению, бронхиальная астма — это гетерогенное
заболевание, которое характеризуется хроническим воспалением дыхательных путей и
диагностируется по респираторным симптомам свистящего дыхания (визинга), одышки,
стеснения в груди или кашля, вариабельных по длительности и интенсивности, в
сочетании с обратимой обструкцией дыхательных путей. Диагностика БА должна
основываться на анамнезе и характерной симптоматике, особенно это актуально для
детей раннего возраста, а также на доказательстве обратимой обструкции
дыхательных путей по тесту с бронходилататором или по другим тестам. Постановка
тестов, подтверждающих диагноз БА, рекомендована до начала базисного лечения.
Следует учесть, что на фоне базисной терапии, иногда достаточно длительной, не
удается подтвердить обратимость и наличие скрытого бронхоспазма. Это не значит,
что у больного нет БА. Если невозможно подтвердить диагноз БА с помощью теста с
бронходилататором, то необходимо снова повторить этот тест позже или начать
проводить пробное лечение для исключения или подтверждения диагноза БА.
Назначение пробного базисного лечения может значительно облегчить диагностику и
выбор дальнейшей тактики лечения.
Оценивая уровень контроля, БА подразделяют на хорошо контролируемую, частично
контролируемую и плохо контролируемую. Критерии остались такие же, как в
предыдущем издании GINA, — наличие дневных симптомов более чем 2 раза в неделю,
ночные пробуждения из-за астмы, прием препаратов неотложной помощи более чем 2
раза в неделю и наличие любых нарушений деятельности вследствие БА. Однако
оценка объема форсированного выдоха за первую секунду (ОФВ1) отнесена
к факторам риска для неблагоприятного прогноза. Тяжесть БА оценивается
ретроспективно по уровню терапии, необходимой для контроля симптомов и
обострений.
У многих пациентов БА начинается в раннем возрасте. В GINA-2015 акцентируется
внимание на наличии у детей младше 5 лет трех паттернов свистящего дыхания (рис.
1). Первая группа детей — это дети с такими характерными симптомами, как кашель,
затрудненное дыхание и визинг, которые длятся менее 10 дней в течение инфекции
верхних дыхательных путей (ВДП), повторяются 2–3 раза в год, и данные симптомы
отсутствуют между эпизодами затрудненного дыхания и/или визинга. Следующая
группа включает пациентов, у которых длительность симптомов увеличена (> 10 дней
в течение инфекции ВДП), частота эпизодов > 3 в год или тяжелые эпизоды и/или
ночные ухудшения, между эпизодами ребенок может иметь редкий кашель, визинг или
затрудненное дыхание. И третий паттерн — то же самое, как и в предыдущем случае,
плюс отягощенная наследственность по атопии, или у ребенка уже есть проявления
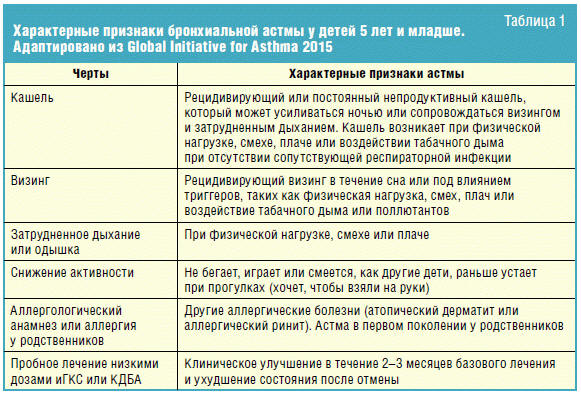
той или иной аллергической патологии. Характерные признаки БА у детей 5 лет и
младше: кашель, визинг, затрудненное дыхание или одышка, снижение активности,
положительный эффект от пробного лечения низкими дозами ингаляционными
глюкокортикостероидами (иГКС) и бета-2-агонистами короткого действия (КДБА)
(табл. 1).

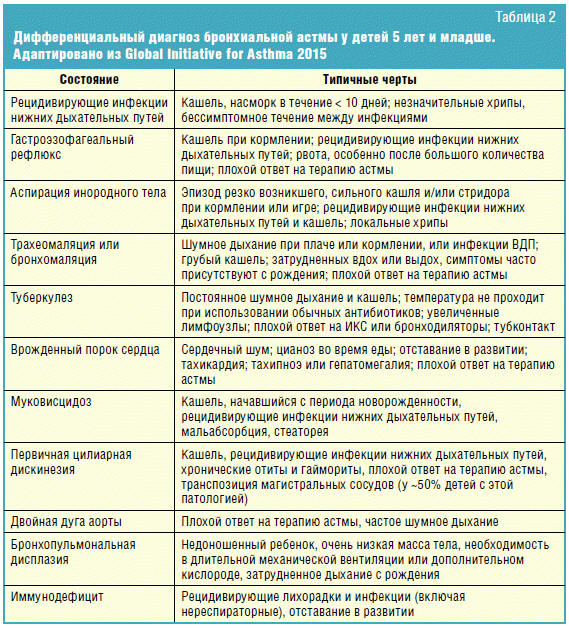
Круг дифференциальной диагностики бронхиальной астмы у детей младшего
возраста широк и требует тщательного сбора анамнеза и проведения дополнительных
тестов. При наличии у ребенка младшего возраста кашля и визинга необходимо
исключить рецидивирующие инфекции нижних дыхательных путей (НДП), бронхолегочную
дисплазию, аномалии развития трахеи и бронхов, врожденные пороки сердца,
гастроэзофагеальный рефлюкс, инородное тело, туберкулез, врожденные и
наследственные заболевания, муковисцидоз, гипотиреоз, узелковый периартериит,
объемные процессы в грудной клетке и целый ряд более редко встречающихся
заболеваний (табл. 2).
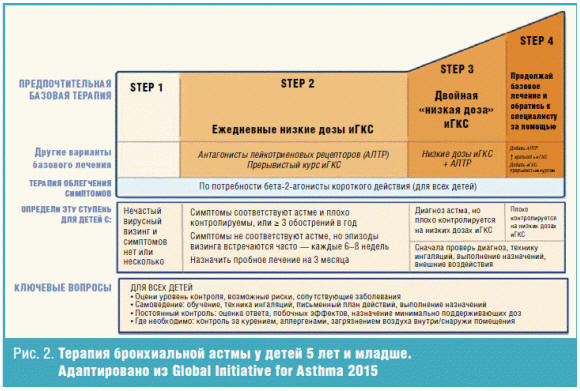
Главная цель терапии больных бронхиальной астмой — это достижение контроля и
управление бронхиальной астмой. Согласно схеме, приведенной в GINA-2015 для
детей младше 5 лет, из терапии полностью исключены кромоны в связи с
недостаточной эффективностью, но имеющие хороший профиль безопасности. Длительно
действующие бета-2-агонисты (ДДБА) в комбинации с иГКС также исключены в связи с
отсутствием в настоящее время достаточной доказательной базы по безопасности их
использования в этой возрастной группе. На первой ступени следует использовать
по требованию КДБА. На второй ступени — ежедневные низкие дозы иГКС или
антагонистов лейкотриеновых рецепторов (АЛТР). Двигаясь step-up, на
третьей ступени — двойная низкая доза иГКС или сочетание низких доз иГКС с АЛТР.
И на четвертой ступени — увеличение дозы иГКС (рис. 2). В GINА-2014 года было
введено такое понятие, как краткосрочная step-up-терапия на 1–2 недели,
например, при вирусной инфекции или экспозиции аллергенов. Данное изменение
плана лечения позволяет усилить противовоспалительную терапию (добавив к
получаемым иГКС антилейкотриеновые препараты или назначить препарат из этой
группы «наивным» больным астмой) и уменьшить риск обострения заболевания при
возникновении острой респираторной инфекции.
Создание и широкое использование в первую очередь иГКС существенно повлияло
на возможности достижения контроля течения астмы. иГКС, обладая мощным
противовоспалительным действием, воздействуют на основные механизмы формирования
БА. Но, несмотря на использование иГКС, у части больных все же не удается
достигнуть контроля над течением заболевания. И данное обстоятельство диктует
необходимость использовать в лечении БА препараты, относящиеся к другим
фармакологическим группам. За последние 50 лет разрешены к использованию в
лечении БА у детей только две новые группы препаратов: антилейкотриеновые
препараты и анти-IgE-антитела.
В настоящее время в клинической практике широко используют высокие дозы иГКС
через небулайзер в сочетании с небулированными формами КДБА при появлении
обструкции на фоне респираторной вирусной инфекции. Помимо купирования
бронхообструкции при вирус-индуцированном визинге предполагается получение и
протективного эффекта иГКС для предотвращения последующих рецидивов визинга.
Так, при рецидивирующих эпизодах острого визинга лечение высокими дозами иГКС
(1600–2000 мкг/день по беклометазону, разделенной на 4 приема/день, 5–10 дней с
начала вирусной респираторной инфекции или ухудшении астмы) ассоциировалось с
некоторым улучшением клиники у новорожденных и маленьких детей [2–4]. По
результатам других исследований данная тактика не привела к изменению эволюции
формирования БА у детей из группы риска по аллергическим заболеваниям. Было
проведено трехлетнее наблюдение за 301 новорожденным, получавшим будесонид 400
мкг/день или плацебо после первого эпизода визинга в течение 2 недель начиная с
третьего дня каждого эпизода визинга. В результате не было получено различий в
количестве бессимптомных дней или в необходимости назначения оральных
кортикостероидов (ОКС) как в группе получавших иГКС, так и в группе плацебо [5].
В исследовании MIST изучали назначение иГКС при инфекции респираторного
тракта у дошкольников с рецидивирующим визингом, риском развития БА и эпизодами
визинга [6]. Сравнивался ежедневный прием низких доз будесонида в ингаляциях и
эпизодический прием высоких доз будесонида в ингаляциях на ночь в течение 7
дней. Был получен одинаковый эффект при регулярном и эпизодическом приеме иГКС.
Выбор схемы назначения иГКС (регулярный, интермиттирующий и режим по
потребности) у детей с визингом в клинической практике до сих пор является
предметом дискуссий.
Большинство исследований, оценивающих системные эффекты иГКС, брали за основу
результаты, полученные у детей старше 5 лет. Международные согласительные
документы утверждают, что у детей младшей возрастной группы, как и у старших
детей, индивидуально подобранные дозы иГКС безопасны и потенциальный риск
побочного действия обоснован их клинической эффективностью [7–9]. В целом низкие
дозы иГКС не ассоциировались с любыми серьезными побочными системными эффектами
в клинических исследованиях, поэтому эта терапия рассматривается как безопасная
[3, 8–17]. Хотя существуют данные, указывающие на то, что высокие дозы
ассоциировались с заметными системными эффектами (темповая задержка роста и
влияние на гипоталамо-гипофизарно-надпочечниковую систему) даже в первый год
терапии [3, 7–17]. Эти эффекты такие же, как и в исследованиях, проведенных у
старших детей. Влияние на рост было накопительное при продолжении длительного
лечения [18–20]. Дети, которые находились на лечении флутиказоном пропионатом в
течение двух лет в возрасте двух или трех лет [7], догнали в росте своих
сверстников через два года после прекращения терапии иГКС. Ретроспективный
анализ показал, что у детей младше двух лет и при весе < 15 кг не был
зафиксирован этот скачок в росте [21]. Согласно двум систематическим обзорам,
опубликованным в кокрайновской библиотеке, дети с персистирующей БА, находящиеся
на ежедневной терапии иГКС, растут на 0,5 см меньше в течение первого года
лечения [22, 23]. Первый систематический обзор включал 25 исследований: 8471
ребенок с легкой и среднетяжелой БА, из которых 5128 были на лечении иГКС, а
остальные дети получали плацебо. иГКС давали в низкой или средней дозе на
протяжении от 3 месяцев до 4–6 лет. Средние показатели прибавок роста за год
лечения были в среднем 6–9 см в группе контроля и на 0,5 см меньше в группе иГКС
[22]. Второй систематической обзор также оценивал влияние низких или средних доз
иГКС на рост у 728 детей с легкой и среднетяжелой персистирующей БА в течение
года. В результате дети на низких дозах имели более высокую прибавку в росте на
четверть сантиметра (5,74 в год, по сравнению с 5,94 см в год при терапии
средними дозами) [23]. Еще один метаанализ, состоящий из 16 рандомизированных
клинических исследований, также показал, что годовая терапия иГКС значительно
снижает скорость роста у детей с различной степенью тяжести бронхиальной астмы
[среднее различие –0,48 см/год (95% ДИ от –0,66 до –0,29)]. Окончательный рост у
взрослого больного бронхиальной астмой был снижен в среднем на 1,20 см (95% ДИ
от –1,90 см до –0,50 см) при лечении будесонидом по сравнению с плацебо [24].
Другая группа препаратов, широко использующаяся у детей, — это АЛТР, которые
также имеют выраженный противовоспалительный эффект и высокий профиль
безопасности. Лейкотриены — это важнейшие провоспалительные медиаторы,
синтезируемые de novo клетками дыхательных путей (альвеолярными макрофагами и
тучными клетками) и воспалительного инфильтрата (эозинофилами и нейтрофилами)
при их активации. Цистеиниловые лейкотриены С4, D4, Е4 образуются из
арахидоновой кислоты при участии 5-липоксигеназы и пептидаз. Они являются
ключевыми медиаторами в патогенезе бронхиальной астмы: индуцируют продукцию
слизи, развитие отека, эозинофилии и бронхоспазма.
Согласно рекомендациям Британского торакального общества (British Thoracic
Society, BTS), АЛТР могут назначаться как альтернатива иГКС или в качестве
добавочной терапии у тех детей, кто не полностью ответил на лечение иГКС [25].
Гайдлайн, опубликованный Национальным институтом здравоохранения (National
Institute of Health, NIH), рекомендует назначение АЛТР для маленьких детей в
качестве преодоления трудности использования ингаляционных устройств или когда
присутствует низкий комплаенс [26].
Эффективность монтелукаста (оригинальный препарат Сингуляр) в качестве
базового препарата при рецидивирующим вирус-индуцированном визинге у маленьких
детей была подтверждена в нескольких крупных рандомизированных исследованиях.
Было проведено проспективное, открытое, рандомизированное исследование 595 детей
раннего возраста из группы высокого риска развития аллергических заболеваний. У
всех детей был диагностирован визинг после РС-вирусной инфекции и назначен
монтелукаст (Сингуляр) курсом в течение 12 недель. Эффективность монтелукаста
оценивалась по шкале оценки клинических симптомов, функции легких, использованию
КДБА и постановке диагноза инфантильной астмы. После 12 недель лечения получены
значительные различия в оценке по шкале симптомов в отношении кашля, визинга,
явления визинга на нагрузку, а также уменьшение числа госпитализаций и дней с
использованием КДБА (р < 0,05). Диагноз бронхиальной астмы был поставлен в 9,6%
(57 детей из 595). В результате авторы приходят к выводу, что монтелукаст
клинически эффективен в лечении вирус-индуцированного визинга, улучшении функции
легких и снижении риска инфантильной астмы [27].
Хорошо известен факт нарастания частоты обращений за оказанием экстренной
помощи для детей с БА в осенне-зимний период в связи с увеличением случаев
острых респираторных инфекций. Было проведено мультицентровое, рандомизированное
двойное слепое плацебо-контролируемое исследование в течение 12 месяцев у 220
детей 2–14 лет с интермиттирующей БА. 113 детей получали плацебо, 107 получали
монтелукаст (Сингуляр) в дозе 4 мг для детей 2–5 лет и 5 мг для 6–14 лет. Было
важно, что лечение инициировалось родителями в начале каждой инфекции ВДП или
симптомов астмы. Лечение продолжали минимум 7 дней или до тех пор, пока симптомы
были компенсированы в течение 48 часов, но максимум 20 дней. В результате
терапии монтелукастом симптомы БА были снижены на 14% и ночные пробуждения от БА
на 8,6% (p = 0,043). Количество выданных справок школьникам уменьшилось на 37% и
больничных листов по уходу за ребенком на 33% (p < 0,0001) [28].
Представляет интерес еще одно исследование выраженного противовоспалительного
эффекта монтелукаста (Сингуляра) у маленьких детей. В плацебо-контролируемом
исследовании с участием 42 детей с бронхиальной астмой в возрасте 2–5 лет
монтелукаст был добавлен к базовой терапии на 45 дней в осенний период, и это
привело к уменьшению числа дней обострения БА у мальчиков, но не у девочек [29].
Особенно важно учитывать возможность использования АЛТР для снижения
стероидной нагрузки у детей с бронхиальной астмой. Было проведено
рандомизированное, двойное плацебо-контролируемое исследование у 76 детей с
астмой в возрасте 6–14 лет, с сенсибилизацией к клещам домашней пыли.
Исследовали возможность снижения дозы иГКС, частоту обострений, функцию легких,
АСТ-тест и изменение ОФВ1 при выполнении теста на беговой дорожке в
группе детей, получающих иГКС, иГКС + монтелукаст и иГКС + плацебо. В результате
исследования авторы приходят к выводу, что целесообразно добавление
монтелукаста к терапии иГКС у детей с астмой для снижения кумулятивной дозы иГКС
при хорошем контроле над симптомами. Кроме того, сочетание иГКС и монтелукаста
привело к снижению числа обострений и достижению лучшего контроля
бронхоконстрикции, индуцированной физической нагрузкой [30].
Еще одно исследование, оценивающее на протяжении 12 недель эффективность
монтелукаста в качестве монотерапии или в комбинации с иГКС, подтвердило
эффективность использования АЛТР у детей, больных астмой. Это мультицентровое,
открытое, обсервационное исследование у детей (6,9 ± 3,4 года) с
неконтролируемой астмой. Было обследовано 328 пациентов, из которых 76 (23,2%)
были на монотерапии монтелукастом и 252 (76,8%) на комбинированной: иГКС +
монтелукаст. Через 4 недели 61,3% и 52,9% пациентов с моно- и комбинированной
терапией соответственно достигли контроля над астмой, и через 12 недель эта
пропорция увеличилась до 75% и 70,9%. В группе детей с монотерапией по
результатам ACQ-теста по контролю над астмой было отмечено улучшение симптомов
(среднее ± SD 1,67 ± 0,69, 0,71 ± 0,70 и 0,50 ± 0,52 исходно, 4 и 12 недель
соответственно; p < 0,001). В группе иГКС + монтелукаст средняя оценка ACQ-теста
значительно улучшилась с 2,02 ± 0,83 исходно до 0,90 ± 0,86 в 4 недели и 0,64 ±
0,86 в 12 недель (p < 0,001). После 12 недель лечения монтелукастом в качестве
добавочной терапии 22,6% пациентов снизили дозу иГКС. Одинаковые результаты были
получены в группе школьников и дошкольников. Авторы исследования пришли к
выводу, что монотерапия монтелукастом или в комбинации с иГКС является
эффективной стратегией в достижении контроля над астмой у детей [31].
Учитывая существенно более высокую безопасность антилейкотриеновых препаратов
по сравнению с иГКС, были проведены многочисленные исследования по сравнению
эффективности этих двух групп лекарственных средств. В канадское исследование
были включены 227 детей в возрасте от 2 до 17 лет с легкой или средней тяжести
астмой, получавшие либо иГКС (в низкой или средней дозе 250 мкг/день по
беклометазону или его эквиваленту), или АЛТР в виде монотерапии. Дети, которые
получали АЛТР, были соотнесены 1:3 с детьми на иГКС по возрасту, полу,
предыдущей истории обострений. Результаты оценивались по необходимости в приеме
пероральных кортикостероидов, их дозировке и длительности приема, наличию
обострений и госпитализации, использованию КДБА. В результате, в отличие от АЛТР,
монотерапия иГКС незначительно снижает потребность в назначении ОКС или влияет
на число обращений за неотложной помощью и ассоциировалась с более высоким
уровнем госпитализаций и использованием КДБА. Эти, на первый взгляд, неожиданные
результаты могут быть объяснены превалированием недостаточной продолжительности
приема иГКС и низким комплаенсом в группе детей, получающих иГКС в виде
монотерапии, чем в группе детей, получающих АЛТР [32].
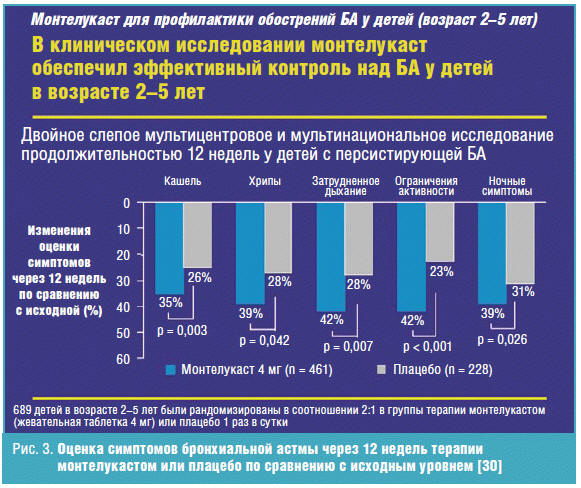
Целью другого двойного слепого, мультицентрового, мультинационального
исследования в 93 центрах по всему миру, включая 56 в США и 21 в странах Африки,
Австралии, Европе, Северной и Южной Америке, было оценить эффективность
монтелукаста у детей младшего возраста с персистирующей неконтролируемой
бронхиальной астмой. Обследовано 689 детей в возрасте 2–5 лет, которые в течение
12 недель принимали монтелукаст в дозе 4 мг (461 пациент) или плацебо (228
пациентов). У всех детей была диагностирована персистирующая бронхиальная астма,
требующая использование бета-2-агонистов. В результате через 12 недель терапия
монтелукастом значительно улучшила уровень контроля над бронхиальной астмой по
сравнению с плацебо в отношении наличия дневных и ночных симптомов, ежедневном
использовании бета-2-агонистов, количестве бессимптомных дней, частоте
обострений бронхиальной астмы, необходимости использования терапии по
требованию, качестве жизни и уровне эозинофилов в периферической крови.
Клинический эффект был виден уже с первого дня терапии монтелукастом. Не было
отмечено значимых различий в частоте выявления клинических побочных эффектов,
лабораторных находок или повышенных уровней трансаминаз в сыворотки крови [33].
Основные клинические ситуации, при которых назначается монтелукаст,
суммированы в табл. 3. Они включают доказанные и дискутабельные положения, при
которых до сих пор изучаются возможности назначения монтелукаста. Монтелукаст —
это безопасный препарат с хорошим противовоспалительным эффектом в респираторных
путях [34] и сильным бронхопротекторным эффектом [35]. Отличный профиль
безопасности монтелукаста и возможность однократного приема через рот
способствуют хорошему комплаенсу и отражают основные преимущества его
использования у детей младшего возраста. Более того, монтелукаст является
хорошей альтернативой иГКС у детей с плохим комплаенсом или у детей с побочными
эффектами от длительной терапии стероидами.

Заключение
Антагонисты лейкотриеновых рецепторов являются эффективными
противовоспалительными препаратами для лечения БА у детей с аллергической
астмой, наличием вирус-индуцированного визинга и бронхоконстрикции, вызванной
физической нагрузкой. Существенное значение данной группы препаратов в
профилактике обострений бронхиальной астмы. Со времени первых клинических
испытаний до сегодняшнего дня область применения этого класса лекарств постоянно
расширяется. Будущие исследования в этой области должны включать в себя
разработку критериев отбора пациентов для монотерапии монтелукастом или в виде
комбинированной терапии, а также поиск биомаркеров для прогноза ответа на
терапию.
Литература
-
Masoli M., Fabian D., Holt S., Beasley R. The global burgen of
asthma: executive summary of the GINA Dissemination Committee report //
Allergy. 2004; 59: 469–478. -
Ducharme F. M., Lemire C., Noya F. J. et al. Preemptive use of
high-dose fluticasone for virus-induced wheezing in young children // N Engl J
Med. 2009; 360: 339–353. -
Connett G., Lenney W. Prevention of inviral induced asthma
attacks using inhaled budesonide // Arch Dis Child. 1993; 68: 85–87. -
Wilson N. M., Silverman M. Treatment of acute, episodic asthma in
preschool children using intermittenthigh dose inhled steroids t home // Arch
Dis Child. 1990; 65: 470–410. -
Bisgaard H., Hermansen M. N., Loland L., Halkjaer L. B., Buchvald F.
Intermittent inhaled corticosteroids in infants with episodic wheezing // N
Engl J Med. 2006; 354: 1998–2005. -
Zeiger R. S., Mellon M., Chipps B. et al. Test for Respiratory
and Asthma Control in Kids (TRACK): clinically meaningful changes in score //
J Allergy Clin Immunol. 2011; 128: 983–988. -
Guilbert T. W., Morgan W. J., Zeiger R. S. et al. Long-term
inhaled corticosteroids in preschool children at high risk for asthma // N
Engl J Med. 2006; 354: 1985–1997. -
Baker J. W., Mellon M., Wald J., Welch M., Cruz-Rivera M.,
Walton-Bowen K. A multiple-dosing, placebo-controlled study of budesonide
inhalation suspension given once or twice daily for treatment of persistent
asthma in young children and infants // Pediatrics. 1999; 103: 414–421. -
Teper A. M., Colom A. J., Kofman C. D., maffey A. F., Vidaurreta S.
M., Bergada I. Effects of inhaled fluticasone propionate in children less
than 2 years old with recurrent wheeezinf // Pediatr Pulmonol. 2004; 37:
111–115. -
Nielsen K. G., Bisgaard H. Thee effect of inhaled budesonide on
symptoms, lung function, and cold air and methacholine responsiviness in 2-to
5-year-old asthmatic children // Am J Respir Crit Care Med. 2000; 162:
1500–1506. -
Roorda R. J., Mezei G., Bisgaard H., Maden C. Response of
preschool children with asthma symptoms to fluticasone propionate // J Allergy
Clin Immunol. 2001; 108: 540–546. -
Bisgaard H., Gillies J., Gronewald M., Maden C. The effect of
inhaled fluticasone propionate in the treatment of young asthmatic children: a
dose comparison study // Am J Respir Crit Care Med. 1999; 160: 126–131. -
Chavasse R. J., Bastian-Lee Y., Richter H., Hilliard T., Seddon P.
Persistent wheezing in infants with an atopic tendency responds to inhaled
fluticasone // Arch Dis Child. 2001; 85: 143–148. -
Hofhuis W., van der Wiel E. C., Nieuwhof E. M. et al. Efficacy of
fluticasone propionate on lung function and symptoms in wheezy infants // AM J
Respir Crit Care Med. 2005; 171: 328–333. -
IIangovan P., Pedersen S., Godfrey S., Nikander K., Noviski N., Warner
J. O. Treatment of severe steroid dependent preschool asthma with
neubulised budesonide suspension // Arch Dis Child. 1993; 68: 356–359. -
Murray C. S., Woodcock A., Langley S. J., Morris J., Custovic A.
Secondary prevention of asthma by the use of Inhaled Fluticasone propionate in
Wheezy Infants (IFWIN): doublr-blind, randomized, control study // Lancet
2006; 368: 754–762. -
Pao C. S., McKenzie S. A. Randomized controlled trial of
fluticasone in preschool children with intermittent wheeze // Am J Respir Crit
Care Med. 2002; 166: 945–949. -
Pedersen S. Do inhaled corticosteroids inhibit growth in children?
// Am J Respir Crit Care Med. 2001; 164: 521–535. -
Agertoft L., Pedersen S. Effect of long-term treatment with
inhaled budesonide on adult height in children with asthma // N Engl J Med.
2000; 343: 1064–1069. -
Kelly H. W., Sternberg A. L., Lescher R. et al. Effect of inhaled
glucocorticoids in childhood on adult height // N Engl J Med. 2012; 367:
904–912. -
Guilbert T. W., Mauger D. T., Allen D. B. et al. Growth of
preschool children at high risk for asthma 2 years after discontinuation of
fluticasone // J Allergy Clin Immunol. 2011; 128: 956-63.e1-7. -
Zhang L., Prietsch S. O. M., Ducharme F. M. Inhaled
corticosteroids in children with persistent asthma: effects on growth //
Cochrane Database Syst Rev. 2014; 7: CD009471. http://doi.wiley.com/10.1002/14651858.CD009471.pub2. -
Pruteanu A. I., Chauhan B. F., Zhang L., Prietsch S. O. M., Ducharme
F. M. Inhaled corticosteroids in children with persistent asthma: dose
response effects on growth // Cochrane Database Syst Rev. 2014; 7: CD009878.
http://doi.wiley.com/10.1002/14651858.CD009878.pub2.1. -
Loke Y. K., Blanco P., Thavarajah M., Wilson A. M. Impact of
Inhaled Corticosteroids on Growth in Children with Asthma: Systematic Review
and Meta-Analysis // PLoS ONE. 2015; 10 (7): e0133428.doi:
10.1371/journal.pone.0133428. - British Thoracic Society, Scottish Intercollegiate Guidelines Network:
British Guideline on the management of asthma. - National Heart, Lung, and Blood Institute, National Asthma Education and
Prevention Program: Expert Panel Report 3. Guidelines for the Diagnosis and
Management of Asthma. http://www.nhlbi.nih.gov. Last access on: 09 February
2012. -
Zou Y.-X. et al. Clinical efficacy of montelukast sodium in
treating infantile wheezing // European Review for Medical and Pharmacological
Sciences. 2014; 18: 775–780. -
Colin F. Robertson et al. Short-course Montelukast for
intermittent asthma in children // Am J Respir Crit Care Med. 2007. Vol 175. p.
323–329. -
Johnson N. W, Mandhane P. J., Dai J. et al. Attenuation of the
September epidemic of asthma exacerbations in children: a randomized,
controlled trial of montelukast added to usual therapy // Pediatrics. 2007;
120: e702–712. -
Stelmach et al. Do children with stable asthma benefit from
addition of montelukast to inhaled corticosteroids: Randomized, placebo
controlled trial/Pulmonary Pharmacology & Therapeutics. 2015, 31, 42–48. -
Bérubé et al. Effectiveness of montelukast administered as
monotherapy or in combination with inhaled corticosteroid in pediatric
patients with uncontrolled asthma: a prospective cohort study // Allergy,
Asthma & Clinical Immunology. 2014, 10: 21. -
Ducharme F. M., Gingras J., Allen-Ramey F. C., Maiese E. M., Noya F.
J. D. // Current Medical Research & Opinion. 2012, Vol. 28, № 1, 111–119. -
Knorr B. et al. Montelukast, a Leukotriene Receptor Antagonist,
for the Treatment of Persistent Asthma in Children Aged 2 to 5 Years //
Pediatrics. 2001. Vol. 108. № 3. -
Straub D. A., Minocchieri S., Moeller A., Hamacher J., Wildhaber J. H.
The effect of montelukast on exhaled nitric oxide and lung function in
asthmatic children 2 to 5 years old // Chest. 2005, 127: 509–514. -
Bisgaard H., Nielsen K. G. Bronchoprotection with a leukotriene
receptor antagonist in asthmatic preschool children // Am J Respir Crit Care
Med. 2000, 162: 187–190. -
Montella et al. Update on leukotriene receptor antagonists in
preschool children wheezing disordersItalian // Journal of Pediatrics. 2012,
38: 29.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru



