Для цитирования: Васильева Е.С., Савостьянова О.В. Состояние микроэкологии кишечника у больных угревой болезнью // РМЖ. 2007. №19. С. 1398
В последние годы внимание дерматологов и косметологов все чаще привлекает проблема взаимосвязи заболеваний кожи и органов желудочно–кишечного тракта. Многими клиническими исследованиями доказано существенное влияние микрофлоры кишечника на проявления различных кожных заболеваний [2,7].
Так, частота обнаружения дисбактериозов у детей с атопическим дерматитом составляет 89% [3]. Отмечается снижение количества бифидо– и лактобактерий, увеличение числа энтеробактерий с измененными свойствами. Выраженность дисбиотических отклонений коррелирует с распространенностью и тяжестью кожного поражения.
Установлена патогенетическая роль микробиоценоза кишечника при угревой болезни [4,6].
В 2003 году утвержден Приказом № 231 Минздрава России от «9» июня 2003 г. ОТРАСЛЕВОЙ СТАНДАРТ «Протокол ведения больных. Дисбактериоз кишечника», в котором дисбактериоз кишечника определен, как клинико–лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений с возможным развитием желудочно–кишечных расстройств.
Основные функции нормальной микрофлоры кишечника весьма разнообразны и представлены в таблице 1 [1].
Под колонизационной резистентностью понимают механизмы, обеспечивающие постоянство и стабильность нормофлоры в определенных биотипах, защищающие их от заселения несвойственной ему условнопатогенной или патогенной флорой. Представители нормофлоры продуцируют органические кислоты, перекись водорода, лизоцим и другие бактерицидные вещества, обусловливающие антагонистическую активность этих бактерий. Учитывая эту роль, нормофлора является первым барьером на пути проникновения в организм чужеродных субстанций.
Иммуностимулирующий эффект под воздействием нормофлоры кишечника проявляется в:
• усилении фагоцитарной активности макрофагов, моноцитов и гранулоцитов;
• стимуляции пролиферации плазматических клеток;
• увеличении уровня специфического IgА;
• индукции синтеза цитокинов;
• стимуляции клеточных иммунных механизмов защиты [1,8].
Детоксикационная функция нормофлоры выражается в защите организма от токсического эффекта экзогенных и эндогенных субстратов различного происхождения (в том числе микробного) и метаболитов за счет ее активного участия в их метаболизме. Прежде всего, ферментации глюкозы, лактозы, фруктозы и других углеводов, а также более сложных соединений, содержащих углеводы (крахмал, пектины и др.). Бактерии нормофлоры кишечника участвуют в гидролизе белков, в рециркуляции желчных кислот и активно влияют на метаболизм билирубина и холестерина [8,10].
Синтетические функции нормофлоры ЖКТ проявляются в продуцировании анаэробными микроорганизмами биологически активных органических соединений – летучих жирных кислот, регуляции абсорбции ионов натрия, калия, хлора, кальция, магния и воды для поддержания водного, электролитного и кислотно–щелочного баланса в организме.
Известно, что бактерии ЖКТ синтезируют витамины группы В, никотиновую кислоту, витамин К [8,9,10].
Доказано, что основная роль в защите слизистой оболочки кишечника, продукции органических кислот и модификации рН среды в кислую сторону, в биосинтезе аминокислот, некоторых сахаров, витаминов группы В и РР принадлежит бифидо– и лактобактериям [10–13]. Важное значение эти бактерии имеют и в иммуногенезе слизистой кишечника, в характере метаболического функционирования и водно–солевого баланса, т.е. поддержании гомеостаза организма [5,10]. В норме на долю бифидобактерий приходится 60– 90% всех микроорганизмов кишечника взрослого человека [10].
Нарушение нормальной микроэкологии кишечника отрицательно влияет на иммунологическую реактивность организма, метаболизм нутриентов, обмен витаминов и микроэлементов [6]. Продукты метаболизма микроорганизмов при условии снижения детоксикационных способностей макроорганизма, иммунной реактивности и нарушении моторики кишечника могут стать причиной аутоинтоксикации.
Цель работы: выявить особенности состояния микрофлоры толстого кишечника у больных с угревой болезнью.
Обследовано 62 пациента с воспалительными формами угревой болезни, среди них – 17 (27%) мужчин и 45 (73%) женщин в возрасте от 15 до 37 лет.
Длительность заболевания у 72% (45) пациентов – свыше 5 лет.
Согласно классификации Pochi P.E. et al. (1991), были выделены основные клинические формы заболевания: папуло–пустулезная (64% случаев) и узловатая – (36%).
Степень тяжести заболевания определяли по методу С.Н. Соок et al. [1979] в модификации B.S. Allen, J.G. Smith [1982], на основании шкалы от 0 до 8 в зависимости от выраженности акне–элементов, их количества и площади поражения.
У наблюдаемых больных отмечалась средняя и тяжелая степени тяжести, о чем свидетельствуют градации 4–6 и градации 7–8 по шкале Кука. Средняя степень тяжести преобладала у 84% больных папуло–пустулезной формой акне и у 62% – узловатой.
Среди обследованных – 42 человека (68%) имели в анамнезе сопутствующую гастро–дуоденальную патологию (хронический эзофагит, гастрит, дуоденит, язвенную болезнь 12–перстной кишки, дискинезию желчевыводящих путей).
Клинические проявления дисбактериоза отмечались у 20 (32%) больных в виде запоров; в виде частого жидкого стула, метеоризма, урчания в животе – у 14 (23%) пациентов.
Все пациенты были обследованы с применением стандартных методов анализа дисбактериоза кишечника, рекомендованных МНИИЭМ им. Г.Н. Габричевского. Микробиологическое исследование включало в себя определение содержания патогенных и условно–патогенных микроорганизмов (УПМ), типичных и атипичных (лактозодефицитных и гемолизирующих) эшерихий, стрептококков, энтерококков, стафилококков, бацилл, бифидобактерий, лактобактерий, клостридий, анаэробных грамположительных кокков, дрожжеподобных грибов.
Идентификацию выделенных микроорганизмов проводили с учетом морфологических, тинкториальных, культуральных и ферментативных свойств, с помощью «рутинных» методик (постановка «пестрого ряда» на 12 тестах или с использованием тест–системы СТАФИ–тест 16, НФЕРМ–тест 24, СТРЕПТО–тест 16, ЭНТЕРО–тест 16 производства «PLIVA–Lachema» (Чехия) на микробиологическом анализаторе с автоматизированной системой i EMS Reader, Labsystems (Финляндия) с применением программ «МИКРОБ» и «МИКРОБ – АВТОМАТ».
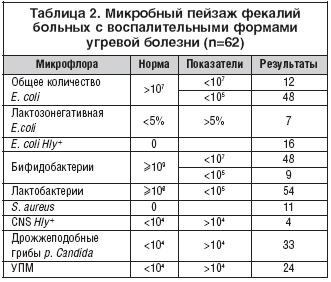
Из 62 обследованных пациентов практически у всех наблюдалось снижение титров нормальной кишечной палочки.
Увеличение титров лактозанегативной E.coli встречалось у 7 пациентов (11%), достаточно большая встречаемость E. coli Hly+ (гемолитическая кишечная палочка) – 16 (26%).
Псевдомонады (неферментирующие Гр«–» палочки) выявлялись в 3 случаях (5%). Представители кишечной УПМ (цитробактер, энтеробактер, клебсиеллы и др.) обнаруживались у 24 больных (38,7%). Из них: клебсиеллы 3 (12,5%), энтерококки (25%), превышающие количество Е. coli. Значительно реже высевались протеи – Pr. vulgaris (4%), микроорганизмы рода Энтеробактер aerogenes (4%), микроорганизмы рода Citrobacter (4%). Дрожжеподобные грибы p. Candida были выделены у 33 пациентов (53,2%).
Кокковая флора представлена S. аureus в 11 случаях (17,7%), снижением титров фекального энтерококка <104 в 9 случаях , CNS Hly+ (гемолитический коагулазонегативный стафилококк) – >104 – 4 случая.
Намного хуже дело обстоит с представителями анаэробной нормальной микрофлоры: прослеживается значительное снижение лактобактерий и бифидобактерий <105 практически у всех пациентов (табл. 2).
Выводы. Результаты проведенных исследований микрофлоры толстой кишки позволяют сделать вывод, что одним из наиболее часто встречающихся нарушений кишечного микробиоценоза является недостаточность бактерий нормальной микрофлоры (дисбактериоз I ст.) – дефицит кишечной палочки, бифидобактерий и лактобактерий (практически у всех обследованных пациентов). Снижение количества бифидобактерий сопровождается ростом и развитием условно–патогенных микроорганизмов, что является признаком глубинных дисбиотических нарушений (дисбактериоз II и III ст.).
Дефицит нормофлоры усугубляется утяжелением кожного процесса, длительным, вялым течением заболевания, торпидностью к проводимому лечению. В связи с этим при лечении больных угревой болезнью, особенно с заболеваниями органов пищеварения в анамнезе, предъявляющих диспептические жалобы, следует учитывать состояние микрофлоры кишечника и включать в лечебный комплекс мероприятия, направленные на восстановление нарушенного микробиоценоза кишечника, что, в свою очередь, будет способствовать устранению микронутриентного и витаминного дефицита, восстановлению моторно–эвакуаторной функции желудочно–кишечного тракта, функциональной активности печени и иммунной системы.

Литература
1. Бондаренко В.М., Боев Б.В. и др. Дисбактериоз желудочно–кишечного тракта // Гастроэнтер. гепатол. колопрокт., 1998, Т. 8 №1.
2.Бурнашева Р.Х., Рахматуллина Н.М., Гумерова А.М. Крапивница и хронические очаги инфекции // Казан. мед. журнал, 1995; 1: 50–52.
3. Вахромеева С.Н., Денисова С.Н. Частота обнаружения дисбактериозов у детей с атопическим дерматитом. // Всерос. НПКонф. посвящен. 100 лет. МНИИЭМ им. Габричевского.
4. Волкова Л.А., Халиф И.Л., Кабанова И.Н. Влияние дисбактериоза кишечника на течение вульгарных угрей // Клиническая медицина, 2001, 79. № 6. С. 39–41.
5. Григорьев Е.Г., Коган А.С. Хирургия тяжелых гнойных процессов. – Новосибирск: Наука, 2000; 314.
6. Ким О.В. Усовершенствование метода патогенетической терапии угревой болезни с использованием «Веторона ТК», «Неоселена» и «Лактобактерина–3». Автореф. дис. …канд. мед. наук. Алматы, 2003.
7. Федорова Е.Р. Микрофлора толстого кишечника у детей, страдающих аллергическими заболеваниями. Автореф. дис. …канд. мед. наук. – Новгород, 1992.
8. Шендеров Б.А. «Иммунология инфекционного процесса». Руководство для врачей / под редакцией Покровского В.И.–М., 1994.
9. Шендеров Б.А., Манвелова М.А., Степанчук Ю.Б., Скиба Н.Э. Пробиотики и функциональное питание. // Антибиотики и химиотерапия. 1997, т. 42, № 7, с. 30–34.
10. Шендеров Б.А. «Медицинская микробная экология и функциональное питание» – 11 т. – М., 1998.
11. Duffy L.C., Zielezny M.F., Riepenhoff–Talty M. et al. “Effectivness of Bifidobacterium bifidum in mediating the clinic course of murine rotavirus riarrhea” pediatr. Res., 1994., v. 35, 690–695.
12. Frank J.F. “Mechanisms of Pathogen inhibition by Lactic Acid Bacteria”. 7th Intern. Symp. Lactic Acid Bacteria and Human Health. 1991., September, 12, Seul, Publ. R.&D. Center, Korea Yakult Co., Ltd, 1998, 293–300.
13. Freter R., M.E.N. De Macias. “Factore affecting the colonization of the gut by lactobacilli and other bacteria”. In: Probiotics: prospects of the use in opportunists infections. Old Herborn University seminar Monograph (eds. Fuller R. et al.). Inst. Microbiol. Biochem. Herborn–Dill, Germany, 1995, 1–8.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






