Сочетание функциональных
заболеваний органов пищеварения
Шульпекова Ю.О.,
Русяев В.Ю., Шептулин Д.А., Шульпекова Н.В.
Первый Московский государственный медицинский
университет им. И.М. Сеченова (Сеченовский
Университет); 119991, Россия, Москва, ул.
Трубецкая, д. 8, стр. 2.
Резюме
Проблеме сочетания двух или нескольких
функциональных заболеваний (ФЗ) органов
пищеварения посвящено немало публикаций и крупных
популяционных исследованиях. В материалах Римского
консенсуса IV термин «перехлест ФЗ» применяется по
отношению к случаям сочетаний в пределах одного
органа и подчеркивается, что по современным
представлениям синдром раздраженного кишечника в
любой его форме следует скорее рассматривать как
«континуум различных клинических вариантов». В
качестве возможного объяснения существования
перехлеста ФЗ рассматривают нарастание степени
висцеральной гиперчувствительности, расширение
зоны гиперчувствительности, прогрессирование
моторных нарушений.
При сочетании ФЗ число и интенсивность жалоб
увеличиваются, снижаются показатели качества
жизни, растет среднее число сопутствующих
соматических симптомов и принимаемых препаратов. В
составе сочетаний ФЗ чаще встречается
функциональная диспепсия. При этом
постпрандиальный дистресс-синдром чаще сочетается
с синдромом раздраженного кишечника с запором,
синдром эпигастральной боли — с синдромом
раздраженного кишечника с диареей, а также с
эндоскопически негативной гастро-эзофагеальной
рефлюксной болезнью. Помимо пищевых компонентов,
особую роль в развитии висцеральной сенситизации
отводят персистенции воспаления после перенесенной
инфекции, воздействию глютена, нарушениям
кишечного микробиома, условиям депрессии и
тревоги.
При сочетании двух или нескольких ФЗ органов
пищеварения целесообразно выбирать методы лечения,
направленные на устранение действия
внутрипросветных раздражителей и формирование
«болевой памяти». Применяются препараты,
нормализующие кишечную перистальтику и секрецию,
выбор которых определяется клиническим вариантом
течения, пробиотики, а также средства, влияющие на
состояние центральной нервной системы. При
сочетании двух или нескольких ФЗ органов
пищеварения целесообразно выбирать препараты,
которые воздействуют на их общие патогенетические
механизмы.
Ключевые слова: функциональные заболевания
органов пищеварения, висцеральная
гиперчувствительность, сочетание функциональных
заболеваний, «болевая память», гистамин
Для цитирования: Шульпекова Ю.О., Русяев
В.Ю., Шептулин Д.А., Шульпекова Н.В. Сочетание
функциональных заболеваний органов пищеварения.
Медицинский совет. 2020;(5):96–102. doi:
10.21518/2079-701X-2020-5-96-102.
Конфликт интересов: авторы заявляют об
отсутствии конфликта интересов.
ВВЕДЕНИЕ
В повседневной практике врачу нередко
приходится встречаться со случаями сочетания двух
или нескольких функциональных заболеваний (ФЗ)
органов пищеварения (в статье для краткости
употребляется термин «функциональные заболевания»
взамен более корректного, но длинного
«заболевания, обусловленные нарушением
взаимодействия по оси „желудочно-кишечный тракт –
центральная нервная система“»). Этой проблеме
посвящено немало публикаций, в которых проводится
анализ распространенности таких сочетаний, влияния
на качество жизни, обращаемость к врачу и другие
параметры [1–6]. В материалах Римского консенсуса
IV применяется термин «перехлест ФЗ» (англ. –
overlap). Однако в рассматриваемых случаях речь
идет только о сочетаниях в пределах одного органа:
признается возможность существовании
гиперчувствительности к рефлюксу одновременно
с гастро-эзофагеальной рефлюксной болезнью,
вероятность развития смешанного типа
функциональной диспепсии; представлена новая точка
зрения, согласно которой синдром раздраженного
кишечника следует рассматривать как континуум
различных клинических вариантов [7]. В качестве
возможного объяснения перехлеста ФЗ рассматривают
нарастание степени висцеральной
гиперчувствительности и расширение ее зоны, а
также прогрессирование моторных нарушений [7].
В крупном перекрестном эпидемиологическом
исследовании, проведенном в популяции экономически
развитых стран, примерно у трети обследуемых
установлено наличие хотя бы одного ФЗ по Римским
критериям IV. В этой группе в 64% случаев
отмечалось одно, в 24% – два, в 8% – три, в 4% –
четыре ФЗ. Наиболее часто регистрировались ФЗ
кишечника (≈80% случаев), ФЗ желудка и 12-перстной
кишки (≈30%), аноректальные расстройства (≈21%),
ФЗ пищевода (≈20%). Наиболее часто отмечались
сочетания ФЗ кишечника, желудка и 12-перстной
кишки, ФЗ кишечника и функциональных аноректальных
расстройств (особенно при преобладании запора), ФЗ
желудка, 12-перстной кишки и пищевода [2].
При сочетании ФЗ число и интенсивность жалоб
увеличивается. При наличии лишь одного ФЗ доля
пациентов со значительной выраженностью симптомов
составляет порядка 22–30%, при сочетании двух она
возрастает до 37–55%, при сочетании трех – до
65–73%. Растет доля пациентов, обращающихся за
медицинской помощью в течение года: 30–50, 33–59 и
64–67% соответственно [8].
Для части пациентов с ФЗ характерно также наличие
соматических жалоб, в частности хронической
головной боли, хронической тазовой боли, боли в
спине (без явных органических причин), дисфункции
височно-нижнечелюстного сустава, признаков
интерстициального цистита и гиперактивного
мочевого пузыря, фибромиалгии и даже фибрилляции
предсердий, а также нервно-психических нарушений
(тревоги, депрессии, бессонницы) [5]. По мере
увеличения числа сочетанных ФЗ снижаются
показатели качества жизни по шкале PHQ-12, растет
среднее число соматических симптомов; при
сочетании 3–4 ФЗ оно, как правило, составляет уже
7–8. При этом отчетливо снижаются параметры
физического и ментального компонентов качества
жизни [2]. При сочетании трех-четырех ФЗ пациенты,
в среднем, принимают 3–4 лекарственных препарата
(против 1–2 препаратов при наличии 1–2 ФЗ).
Повышается частота хирургических вмешательств (в
среднем 0,7 на одного пациента с сочетанием 3–4 ФЗ
против 0,35–0,42 на одного пациента при наличии
1–2 ФЗ). В составе сочетаний ФЗ и сочетаний с
соматическими жалобами чаще всего встречается
функциональная диспепсия; отмечено, что у таких
больных чаще отмечаются указания на стрессовые
ситуации в раннем возрасте [5].
Одно из наиболее типичных сочетаний –
функциональная диспепсия и синдром раздраженного
кишечника (примерно 7–8% от всех случаев ФЗ
функциональных заболеваний органов пищеварения).
Постпрандиальный дистресс-синдром чаще сочетается
с синдромом раздраженного кишечника с запором,
синдром эпигастральной боли – с синдромом
раздраженного кишечника с диареей.
При синдроме эпигастральной боли наблюдается
большая частота сочетания с неэрозивной рефлюксной
болезнью (с доказанным наличием патологического
рефлюкса) – до 50%, а эффект терапии ингибиторами
протонной помпы в купировании диспепсии выражен более отчетливо [9]. Такое
сочетание может объясняться расширением зоны
висцеральной гиперчувствительности [7].
При сочетании функциональной диспепсии и синдрома
раздраженного кишечника выше выраженность таких
симптомов, как распирание в животе, чувство
раннего насыщения, и ниже порог восприятия
внутрипросветного давления в желудке в виде
дискомфорта при раздувании баллона [10]. При обоих
ФЗ клинические проявления усугубляются под
влиянием алиментарных факторов – употреблении
жирной пищи, глютена, олиго-, ди- и моносахаридов
(FODMAP), перца чили (в состав которого входит
капсаицин), лука, шоколада, кофе, газированных
напитков, майонеза, орехов, цитрусовых [11, 12].
При оценке с помощью Опросника выраженности
психопатологической симптоматики SCL-90-R у
пациентов с сочетанием функциональной диспепсии и
синдрома раздраженного кишечника более отчетливо,
чем при изолированном синдроме раздраженного
кишечника, выражены психопатологические черты –
обсессивно-компульсивное расстройство, депрессия,
тревога, гневливость, фобии, параноидные идеи,
психотизм [13].
Как упомянуто выше, cочетание ФЗ можно объяснить
«расширением» поля сенситизации периферического
отдела нервной системы к подпороговым
раздражителям (химическим – пищевым компонентам,
гормонам, веществам микробного происхождения,
воспалительным медиаторам – и механическим), а
также центральной сенситизацией [4].
ПЕРИФЕРИЧЕСКАЯ СЕНСИТИЗАЦИЯ
Развитие периферической сенситизации во многом
обусловлено тем, что рецепторы первичных
афферентных нервных волокон слизистой оболочки
желудочно-кишечного тракта являются полимодальными
и возбуждаются от механических и химических
стимулов, тогда как первичные афферентные нейроны
глубоких слоев реагируют на механические стимулы
(растяжение). В условиях повторного и избыточного
воздействия Н+, капсаицина и других компонентов
специй, температуры, биогенных аминов,
простагландина Е2 и других веществ, а также
повторных спазмов и растяжения эфферентная
импульсация усиливается. Периферические рецепторы
«перестраиваются»; возрастает плотность
ваниллоидных рецепторов 1-го типа (англ. –
transient receptor potential vanilloid type 1,
сокр. англ. – TRPV1), реагирующих на температурные
стимулы, ионы водорода, капсаицин, и
кислотозависимых ионных каналов (acid-sensitive
ionic channels, ASIC), пуринергических рецепторов
(P2X), рецепторов простагландина E2 в слизистой
пищевода, рецепторов к брадикинину; снижается
порог возбудимости. В результате учащенной
импульсации на синаптической поверхности
интернейрона активируются NMDA-рецепторы (ионотропные
рецепторы глутамата, селективно связывающие
N-метил-D-аспартат), что создает основу для
закрепления периферической сенситизации и
формирования «болевой памяти» [4].
Отдельную роль в развитии висцеральной
сенситизации отводят мастоцитам и эозинофилам,
содержание которых в слизистой оболочке, наряду с
Т-клетками, повышено у многих пациентов с
функциональной диспепсией и синдромом
раздраженного кишечника с диареей. При этом также
определяются ультраструктурные признаки
ступенчатой дегрануляции мастоцитов; последнее
характерно скорее для неаллергической активации
тучных клеток [14].
Подобные изменения объясняют персистенцией после
перенесенной инфекции, непереносимостью белков
пшеницы, первичными или вторичными нарушениями
микробиома [15].
Как функциональная диспепсия, так и синдром
раздраженного кишечника в немалой доле случаев
развиваются после перенесенной кишечной инфекции
или паразитоза; в соответствии с этим затянувшееся
воспаление, повышенная проницаемость эпителия и
изменения состава микробиоты могут объяснять
развитие последующей периферической сенситизации.
Такая связь была прослежена еще в 1960-е гг., и
сегодня подобные случаи обозначают как
«постинфекционный вариант ФЗ». Многие
исследователи рассматривают его как классическую
модель, объясняющую развитие сенситизации и
висцеральной гиперчувствительности. Наиболее
велика роль сальмонеллезной инфекции: в течение
ближайшего года функциональная диспепсия
развивается у одного из 10, а синдром
раздраженного кишечника – у одного из 7 пациентов,
перенесших сальмонеллезный гастроэнтерит [16].
Есть мнение, что обострения ФЗ могут развиваться
вследствие заселения таких распространенных во
внешней среде условно патогенных для взрослого
человека простейших, как Blastocystis hominis
hominis, Dientamoeba fragilis, Giardia lamblia
[17]. Описана ассоциация
случаев СРК без запора с обнаружением спирохеты
Brachyspira в биоптатах толстой кишки. По
данным шведских исследователей, этот микроорганизм
выявляется в общей популяции в частотой 2%; при
СРК встречается более чем в 3 раза чаще, чем у
здоровых, а косвенными признаками инфицирования
могут быть повышенное содержание эозинофилов и
увеличение лимфоидных скоплений толстой кишки [18,
19].
Значительные изменения со стороны мастоцитов
побудили американских экспертов по проблеме ФЗ
органов пищеварения провести анализ частоты
сочетания ФЗ с атопическими заболеваниями. При
анализе 23471 истории болезни показано, что если у
лиц без атопических заболеваний ФЗ регистрируются
с вероятностью ≈0,3, при наличии атопии частота ФЗ
растет, достигая 0,6 при сочетании трех ФЗ. При
раздельном анализе частоты встречаемости
бронхиальной астмы, экземы, ринита, конъюнктивита
показана та же закономерность [20]. Авторы этого
исследования предлагают выделять особый, «атопический»
вариант ФЗ. Поскольку мастоциты реагируют не
только на иммунные, но и на неиммунные стимулы,
можно предположить, что спектр раздражителей при
ФЗ органов пищеварения не ограничивается
специфическим IgE и может включать компоненты
микроорганизмов, а также вещества, продуцируемые
клетками-участниками неаллергического воспаления
(Т-клетки, IgG, комплемент С5а) [21].
Провоцировать появление симптомов может прием
продуктов, богатых гистаминолибераторами.
ЦЕНТРАЛЬНАЯ СЕНСИТИЗАЦИЯ
В развитии центральной сенситизации, помимо
врожденных особенностей, важную роль играют
перенесенные стрессы (особенно в раннем периоде
жизни) и неправильно сформированное
противострессовое «совладающее поведение» (англ. –
poor coping), что, в свою очередь, связано с
особенностями воспитания и предыдущим опытом [4,
5]. В результате формируется «фенотип,
предрасположенный к боли» [22]. Структуры
центральной нервной системы, вовлеченные в
формирование сенситизации к боли, включают, прежде
всего, отделы лимбической системы,
нейро-эндокринные центры гипоталамуса, блуждающий
нерв.
Как показали функциональные методы
нейровизуализации, в происхождение хронических
болевых синдромов, в том числе ФЗ органов
пищеварения, вовлечены такие области мозга и
функциональные связи, как первичная сенсомоторная
кора, средняя и задняя поясная кора, островок,
средняя префронтальная кора, таламус и др. [23].
Эти области отчасти вовлечены в реализацию
когнитивных, эмоциональных, исполнительных и
поведенческих функций, контроля внимания и общего
гомеостаза. Устойчивые функциональные связи
формируют своеобразный «нейроматрикс» хронической
боли [24]. В работах с электроэнцефалографией
показано, что ощущение боли может «управляться»
эмоциональными стимулами и повышенной активностью
внимания [25].
Вообще при хронических болевых синдромах
центрального происхождения (как ФЗ органов
пищеварения, так и болях соматического типа)
описаны нарушения нисходящей антиноцицептивной
регуляции, избыточная глутаматергическая
стимуляция, возможная пониженная чувствительность
к эндогенным опиоидам [22]. При ФЗ сенситизация
ассоциирована с нарушениями моторики, однако
остается неясным, носят ли они первичный или
реактивный характер [4]. Как показано в
экспериментах, в результате повторяющихся спазмов
и растяжений мышечных волокон желудочно-кишечного
тракта выделяются фактор роста нервов (англ. –
nerve growth factor, NGF), мозговой
нейротрофический фактор (brain-derived
neurotrophic factor, BDNF), активируется
циклооксигеназа 2-го типа и наблюдается
гиперпродукция простагландина Е2; все это создает
условия для сенситизации нейронов заднего рога
спинного мозга [26].
Вследствие того, что механизмы сенситизации играют
определенную роль и в происхождении симптомов
органических заболеваний, возникают сложности в
дифференциальной диагностике ФЗ. Для исключения
органических заболеваний принципиальное значение
имеет исключение «симптомов тревоги» и оценка
результатов эмпирической терапии [27, 28]. Нередко
вызывает сложности дифференциальная диагностика
неэрозивной рефлюксной болезни и ФЗ пищевода –
функциональной изжоги и гиперчувствительности к
рефлюксу. При всех этих состояниях снижен порог
чувствительности к разнообразным стимулам, включая
воздействие слюны, тепла и растяжения [29]. При «эндоскопически
негативной изжоге», помимо оценки ответа на
терапию ингибиторами протонной помпы, показано
проведение дополнительных исследований –
эндоскопии с биопсией пищевода, суточной рН-метрии/рН-импедансометрии,
манометрии высокого разрешения [30].
Дифференциальная диагностика функциональной
диспепсии требует исключения инфекции
Helicobacter pylori [28, 31].
В связи с тем, что расспрос пациентов не всегда
носит достаточно целенаправленный характер и не
выявляются показания к проведению
высокоинформативных инструментальных методов
диагностики – аноректальной манометрии и
дефекографии, в повседневной практике недостаточно
распознаются аноректальные расстройства. В то же
время эта проблема чрезвычайно актуальна [32].
Алгоритмы обследования и ведения пациентов,
рекомендованные в материалах Римского консенсуса,
представлены на рис. 1, 2 и в табл.
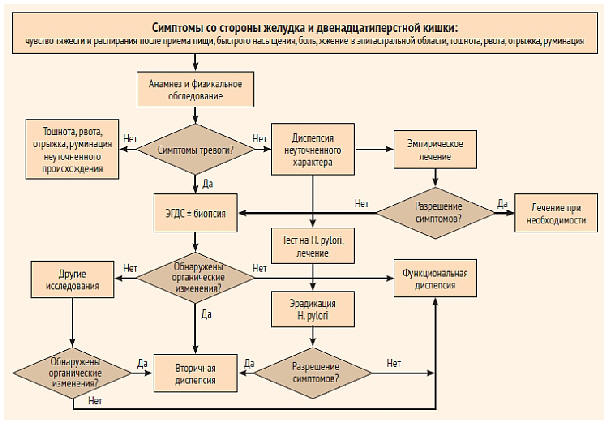
Рисунок 1. Общие принципы
обследования пациента с симптомами заболевания
верхних отделов желудочно-кишечного тракта (по
материалам Римского консенсуса IV; некоторые из
указанных препаратов не зарегистрированы в России)
[28]
Figure 1. General principles of
examination of a patient with symptoms of upper
gastrointestinal tract disease (based on the
materials of the Roman Consensus IV; some of these
drugs are not registered in Russia) [28]
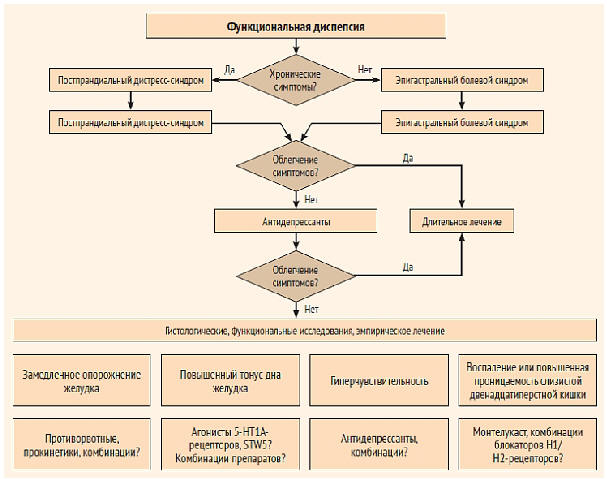
Рисунок 2. Общие принципы ведения
пациентов с функциональной диспепсией (по
материалам Римского консенсуса IV; некоторые из
указанных препаратов не зарегистрированы в России)
[28]
Figure 2. General principles of
management of patients with functional dyspepsia (based
on the materials of the Roman Consensus IV; some
of these drugs are not registered in Russia) [28]
Таблица. Принципы лечения синдрома
раздраженного кишечника исходя из доминирующих
симптомов (по материалам Римского консенсуса IV;
некоторые из указанных препаратов не
зарегистрированы в России) [27]
Table. Principles of irritable bowel
syndrome treatment based on dominant symptoms (according
to Roman consensus IV; some of these drugs are not
registered in Russia) [27]
| Симптом | Группа препаратов | Примеры, дозировки |
|---|---|---|
| Диарея | Агонисты опиоидных рецепторов | Лоперамид 2–4 мг «по требованию» |
| Диета | Ограничить/исключить потребление глютена, ограничить фруктоолиго-, ди-, моносахариды и сахарные спирты (FODMAP) |
|
| Секвестранты желчных кислот |
Холестирамин 9 г 2–3 р/д Колестипол 2 г 1–2 р/д Колесевелам 950 мг 1–2 р/д |
|
| Пробиотики | Различные типы | |
| Антибиотики | Рифаксимин 1600 мг в день 14 дней | |
| 5-НТ3- антагонисты |
Алосетрон Ондансетрон |
|
| Смешанные опиоидные агонисты-антагонисты | Элуксадолин | |
| Запор | Псиллиум | До 30 г в день |
| ПЭГ | 17–34 г в день | |
| Активаторы хлоридных каналов | Любипростон | |
| Агонисты рецепторов гуанилатциклазы типа С | Линаклотид | |
| Боль в животе | Спазмолитики | Отилониум Мебеверин |
| Эфирное масло перечной мяты |
В капсулах | |
| Трициклические антидепрессанты | Дезипрамин 25–100 мг на ночь Амитриптилин 10–50 мг на ночь |
|
| СИОЗС |
Пароксетин 10–40 мг 1 р/д Сертралин 25–100 мг 1 р/д Циталопрам 10–40 мг 1 р/д |
СОЧЕТАНИЕ ДВУХ ИЛИ НЕСКОЛЬКИХ ФУНКЦИОНАЛЬНЫХ
ЗАБОЛЕВАНИЙ ОРГАНОВ ПИЩЕВАРЕНИЯ
При сочетании двух или нескольких ФЗ органов
пищеварения целесообразно выбирать препараты,
которые воздействуют на их общие патогенетические
механизмы [3]. Нередко проводится пошаговый подбор
оптимальной диеты и лекарственных средств; выбирая
метод лечения, врач старается придерживаться
комплексного подхода с устранением действия
внутрипросветных раздражителей и устранением
дополнительных факторов, направленных на
формирование «болевой памяти». Примером препаратов
подобного действия выступают препараты, содержащие
аффинно очищенные антитела к цитокину – фактору
некроза опухоли-α (наиболее агрессивному
провоспалительному медиатору), антитела к
мозгоспецифическому белку S-100 (вовлеченному в
механизмы серотониновой регуляции и «болевой
памяти») и антитела к гистамину (ответственного за
быстрое развитие боли, нарушений моторики и
секреции) [33]. Экспериментально показано, что эти
компоненты модифицируют активность
лиганд-рецепторного взаимодействия эндогенных
регуляторов с соответствующими рецепторами:
антитела к белку S-100 – с серотониновыми
рецепторами и сигма-1 рецепторами; антитела к
фактору некроза опухоли-α – с рецепторами этого
цитокина; антитела к гистамину – с
Н4-гистаминовыми рецепторами.
ВЫВОДЫ
Таким образом, наши представления о
функциональных заболеваниях органов пищеварения в
последние годы стали развиваться в направлении
более общего и универсального понимания патогенеза
и клинических проявлений. По мере изучения
механизмов висцеральной гиперчувствительности, в
частности роли воспаления минимальных градаций,
энтероэндокринных клеток, нарушений вагусной
иннервации, становится ясным, что подобные
изменения, вероятнее всего, не будут
ограничиваться лишь одним участком – только
верхними или нижними отделами пищеварительной
системы. Нарушения по оси «желудочно-кишечный
тракт – центральная нервная система» логичнее
представлять как единый континуум, в котором
клиническая манифестация в отдельных
обстоятельствах происходит на уровне пищевода и
желудка, в другой период и в других
обстоятельствах – на уровне толстой кишки.
Внимательное наблюдение таких пациентов в течение
многих лет, безусловно, поможет лучше понять
закономерности течения ФЗ и разработать новые
эффективные подходы к их лечению и профилактике.
Список литературы / References
- Lee S.W., Chang C.S., Lien H.C., Peng Y.C.,
Wu C.Y., Yeh H.Z. Impact of Overlapping
Functional Gastrointestinal Disorders on the
Presentation and Quality of Life of Patients
with Erosive Esophagitis and Nonerosive Reflux
Disease. Med Princ Pract. 2015;24(5):491–495.
doi: 10.1159/000431370. - Aziz I., Palsson O.S., Törnblom H., Sperber
A.D., Whitehead W.E., Simrén M. The Prevalence
and Impact of Overlapping Rome IV-Diagnosed
Functional Gastrointestinal Disorders on
Somatization, Quality of Life, and Healthcare
Utilization: A Cross-Sectional General
Population Study in Three Countries. Am J
Gastroenterol. 2018;113(1):86–96. doi: 10.1038/
ajg.2017.421.
- Suzuki H., Hibi T. Overlap syndrome of
functional dyspepsia and irritable bowel
syndrome – are both diseases mutually exclusive?
J Neurogastroenterol Motil. 2011;17(4):360–365.
doi: 10.5056/jnm.2011.17.4.360. - Kim S.E., Chang L. Overlap between
functional GI disorders and other functional
syndromes: what are the underlying mechanisms?
Neurogastroenterol Motil. 2012;24(10):895–913.
doi: 10.1111/j.1365-2982.2012.01993.x. - Fujiwara Y., Arakawa T. Overlap in patients
with dyspepsia/functional dyspepsia. J
Neurogastroenterol Motil. 2014;20(4):447–457.
doi: 10.5056/ jnm14080. - Wu W., Guo X., Yang Y., Peng L., Mao G.,
Qurratulain H. et al. The prevalence of
functional gastrointestinal disorders in the
chinese air force population. Gastroenterol Res
Pract. 2013;2013:497585. doi:
10.1155/2013/497585. - Schmulson M.J., Drossman D.A. What Is New in
Rome IV. Journal of Neurogastroenterology and
Motility. 2017;23(2):151–163. doi:
10.5056/jnm16214. - Vakil N., Stelwagon M., Shea E.P., Miller S.
Symptom burden and consulting behavior in
patients with overlapping functional disorders
in the US population. United European
Gastroenterology Journal. 2016;4(3):413–422. doi:
10.1177/2050640615600114. - Xiao Y.L., Peng S., Tao J., Wang A.J., Lin
J.K., Hu P.J., Chen M.H. Prevalence and symptom
pattern of pathologic esophageal acid reflux in
patients with functional dyspepsia based on the
Rome III criteria. Am J Gastroenterol.
2010;105(12):2626–2631. doi:
10.1038/ajg.2010.351. - Corsetti M., Caenepeel P., Fischler B.,
Janssens J., Tack J. Impact of coexisting
irritable bowel syndrome on symptoms and
pathophysiological mechanisms in functional
dyspepsia. Am J Gastroenterology.
2004;99(6):1152–1159. doi:
10.1111/j.1572-0241.2004.30040.x. - Duncanson K.R., Talley N.J., Walker M.M.,
Burrows T.L. Food and functional dyspepsia: a
systematic review. J Hum Nutr Diet.
2018;31(3):390–407. doi: 10.1111/jhn.12506. - El-Salhy M., Gundersen D. Diet in irritable
bowel syndrome. Nutr J. 2015;14:36. doi:
10.1186/s12937-015-0022-3. - Piacentino D., Cantarini R., Alfonsi M.,
Badiali D., Pallotta N., Biondi M., Corazziari
E.S. Psychopathological features of irritable
bowel syndrome patients with and without
functional dyspepsia: a cross sectional study.
BMC Gastroenterol. 2011;11:94. doi:
10.1186/1471-230X-11-94. - Vanheel H., Vicario M., Boesmans W.,
Vanuytsel T., Salvo-Romero E., Tack J., Farré R.
Activation of Eosinophils and Mast Cells in
Functional Dyspepsia: an Ultrastructural
Evaluation. Sci Rep. 2018;8(1):5383. doi:
10.1038/ s41598-018-23620-y. - Jung H.K., Talley N.J. Role of the Duodenum
in the Pathogenesis of Functional Dyspepsia: A
Paradigm Shift. J Neurogastroenterol Motil.
2018;24(3):345–354. doi: 10.5056/jnm18060. - Mearin F., Pérez-Oliveras M., Perelló A.,
Vinyet J., Ibañez A., Coderch J., Perona M.
Dyspepsia and irritable bowel syndrome after a
Salmonella gastroenteritis outbreak: one-year
follow-up cohort study. Gastroenterology.
2005;129(1):98–104. doi:
10.1053/j.gastro.2005.04.012. - Shariati A., Fallah F., Pormohammad A.,
Taghipour A., Safari H., Chirani A.S. et al. The
possible role of bacteria, viruses, and
parasites in initiation and exacerbation of
irritable bowel syndrome. J Cell Physiol.
2019;234(6):8550–8569. doi: 10.1002/jcp.27828. - Walker M.M., Talley N.J., Inganäs L.,
Engstrand L., Jones M.P., Nyhlin H. et al.
Colonic spirochetosis is associated with colonic
eosinophilia and irritable bowel syndrome in a
general population in Sweden. Hum Pathol.
2015;46(2):277–283. doi:
10.1016/j.humpath.2014.10.026. - Tsinganou E., Gebbers J.O. Human intestinal
spirochetosis – a review. Ger Med Sci.
2010;8:Doc01. doi: 10.3205/000090. - Jones M.P., Walker M.M., Ford A.C., Talley
N.J. The overlap of atopy and functional
gastrointestinal disorders among 23471 patients
in primary care. Aliment Pharmacol Ther.
2014;40(4):382–391. doi: 10.1111/ apt.12846. - Thangam E.B., Jemima E.A., Singh H., Baig
M.S., Khan M., Mathias C.B. et al. The Role of
Histamine and Histamine Receptors in Mast
Cell-Mediated Allergy and Inflammation: The Hunt
for New Therapeutic Targets. Front Immunol.
2018;9:1873. doi: 10.3389/fimmu.2018.01873. - Spiegel D.R., Chatterjee A., McCroskey A.L.,
Ahmadi T., Simmelink D., Oldfield E.C. et al. A
Review of Select Centralized Pain Syndromes:
Relationship With Childhood Sexual Abuse, Opiate
Prescribing, and Treatment Implications for the
Primary Care Physician. Health Serv Res Manag
Epidemiol. 2015;2. doi:
10.1177/2333392814567920. - Zeng F., Qin W., Liang F., Liu J., Tang Y.,
Liu X. et al. Abnormal resting brain activity in
patients with functional dyspepsia is related to
symptom severity. Gastroenterology.
2011;141(2):499–506. doi:
10.1053/j.gastro.2011.05.003. - Davis K.D., Flor H., Greely H.T., Iannetti
G.D., Mackey S., Ploner M. et al. Brain imaging
tests for chronic pain: medical, legal and
ethical issues and recommendations. Nat Rev
Neurol. 2017;13:624–638. doi: 10.1038/nrneurol.
2017.122. - Ploner M., Sorg C., Gross J. Brain Rhythms
of Pain. Trends Cogn Sci. 2017;21(2):100–110.
doi: 10.1016/j.tics.2016.12.001. - Lin Y.M., Li F., Choudhury B., Winston J.H.,
Sarna S.K., Shi X.Z. Effects of mechanical
stress on myenteric neurons in the colon.
Gastroenterology. 2014;146(5):S-91. doi:
10.1016/S0016-5085(14)60330-9. - Lacy B.E., Mearin F., Chang L., Chey W.D.,
Lembo A.J., Simren M., Spiller R. Bowel
Disorders. Gastroenterology.
2016;150(6):1393–1407. doi: 10.1053/j.
gastro.2016.02.031. - Stanghellini V., Chan F.K., Hasler W.L.,
Malagelada J.R., Suzuki H., Tack J., Talley N.J.
Gastroduodenal Disorders. Gastroenterology.
2016;150(6):1380–1392. doi:
10.1053/j.gastro.2016.02.011. - Reddy H., Staahl C., Arendt-Nielsen L.,
Gregersen H., Drewes A.M., Funch-Jensen P.
Sensory and biomechanical properties of the
esophagus in nonerosive reflux disease. Scand J
Gastroenterol. 2007;42(4):432–540. doi:
10.1080/00365520600973099. - Aziz Q., Fass R., Gyawali C.P., Miwa H.,
Pandolfino J.E., Zerbib F. Esophageal Disorders.
Gastroenterology. 2016;150:1368–1379. Available
at:
https://www.gastroscan.ru/literature/authors/9938. -
Ивашкин В.Т., Шептулин А.А., Маев И.В.,
Баранская Е.К., Трухманов А., Лапина Т.Л. и
соавт. Клинические рекомендации Российской
гастроэнтерологической ассоциации по диагностике
и лечению язвенной болезни. Российский журнал
гастроэнтерологии, гепатологии, колопроктологии.
2016;26(6):40–54. Режим доступа:
https://www.gastroscan.ru/literature/authors/9886.
Ivashkin V.T., Sheptulin A.A., Mayev I.V.,
Baranskaya Ye.K., Trukhmanov A.S., Lapina T.L.
et al. Diagnostics and treatment of peptic ulcer:
clinical guidelines of the Russian
gastroenterological Association. Rossiyskiy
zhurnal gastroehnterologii, gepatologii,
koloproktologii = Russian Journal of
Gastroenterology, Hepatology, Сoloproctology.
2016;26(6):40–54. (In Russ.) Available at: https://www.gastroscan.ru/literature/authors/9886. - Ribas Y., Saldaña E., Martí-Ragué J., Clavé
P. Prevalence and pathophysiology of functional
constipation among women in Catalonia, Spain.
Dis Colon Rectum. 2011;54(12):1560–1569. doi:
10.1097/dcr.0b013e31822cb5c2. - Маев И.В., Самсонов А.А., Яшина А.В.,
Андреев Д.Н., Шестаков В.А., Караулов С.А.
Клиническая эффективность и безопасность схем
лечения синдрома раздраженного кишечника
(результаты сравнительного исследования).
Consilium Medicum. 2016;18(8):19–26. Режим
доступа: ht tps://ww w.elibrary.ru/item.asp?id=27542967.
Maev I.V., Samsonov A.A., Yashina A.V., Andreev
D.N., Shestakov V.A., Karaulov S.A. Clinical
efficacy and safety of treatment regimens for
irritable bowel syndrome (a comparative study).
Consilium Medicum. 2016;18(8):19–26. (In Russ)
Available at: h ttps://ww w.elibrary.ru/item.asp?id=27542967.
Статья опубликована на сайте
http://www.gastroscan.ru
материал MedLinks.ru






