Симультанное вмешательство на брахиоцефальных и коронарных артериях — стратегия выбора при остром коронарном синдроме (клиническое наблюдение)
Содержание статьи
Введение
В последнее десятилетие достигнуты значимые успехи в лечении острых и хронических форм ишемической болезни сердца (ИБС), но тем не менее смертность и инвалидизация от ИБС и ее осложнений остаются ведущими причинами социальных потерь в большинстве развитых стран мира [1]. Известно, что атеросклероз относится к системным патологическим процессам, поэтому в значительной части случаев атеросклеротическое поражение не ограничивается одним сосудистым бассейном, а носит мультифокальный характер.
Высокая распространенность атеросклероза брахиоцефальных артерий (БЦА) в сочетании с коронарным атеросклерозом подтверждена в двух крупных международных исследованиях: в регистре REACH (Reduction in Atherothrombosis for Continued Health) и в исследовании AGATHA (A Global Atherothrombosis Assessment), в которых от 16 до 35% пациентов имели симптомы атеросклероза более чем в одном сосудистом бассейне, а примерно у 2% больных выявлялся атеросклероз во всех 3 артериальных бассейнах [2]. В другом исследовании определено, что распространенность атеросклероза БЦА и/или артерий нижних конечностей (АНК) у пациентов с ИБС составляет 12%, и почти половина пациентов с атеросклерозом БЦА также имеют диагностированный атеросклероз коронарных артерий [3].
При этом наличие мультифокального атеросклероза нескольких артериальных бассейнов значимо ограничивает возможности полной реваскуляризации артериальных бассейнов, а также ухудшает ближайший и отдаленный прогноз у пациентов как при хронических формах ИБС, так и при остром коронарном синдроме (ОКС), вне зависимости от гемодинамической значимости некоронарных стенозов [4, 5].
Периоперационная профилактика церебральных и миокардиальных осложнений у пациентов с мультифокальным атеросклерозом продолжает оставаться дискуссионным вопросом. В силу этого поиск оптимальных хирургических стратегий имеет высокое клиническое значение. К одной из таких стратегий можно отнести одномоментное (симультанное) вмешательство на зоне БЦА и коронарных артериях при наличии критических поражений в этих двух артериальных бассейнах.
В настоящей статье представлено клиническое наблюдение пациента с неблагоприятным течением мультифокального атеросклероза. Материал для статьи собран и проанализирован по итогам подписанного пациентом информированного согласия, а также в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации.
Клиническое наблюдение
В приемное отделение ГБУЗ КО «КОККД им. акад. Л.С. Барбараша» (Кемерово) самостоятельно обратился пациент А., 60 лет, работающий.
При осмотре предъявлял жалобы на давящие, сжимающие боли за грудиной, возникающие при минимальной физической нагрузке, иррадирующие в шею и левое плечо, сопровождающиеся чувством страха и нехватки воздуха, не купирующиеся приемом нитроглицерина.
История настоящего заболевания. Артериальная гипертензия зарегистрирована с 2000 г., максимальное повышение артериального давления (АД) до 170/100 мм рт. ст., адаптирован к 140/90 мм рт. ст. В амбулаторных условиях установлен диагноз «гипертоническая болезнь». В 2004 г. перенес Q-необразующий инфаркт миокарда, однако от проведения коронароангиографии пациент ранее отказывался. В постинфарктном периоде отмечал давящие, сжимающие, жгучие загрудинные боли при умеренной физической нагрузке, купирующиеся в состоянии покоя через 2–3 мин или после приема нитратов (стенокардия II функционального класса (ФК)). С 2004 г. регистрировалась клиника хронической сердечной недостаточности (ХСН) в рамках II ФК по классификации NYHA в виде одышки и быстрой утомляемости. В течение последних 6 лет стал отмечать эпизоды головокружения при снижении АД менее 140/90 мм рт. ст. В 2012 г. диагностирован сахарный диабет 2 типа, по поводу чего регулярно принимал метформин 850 мг 2 р./сут без контроля уровня гликемии. С 2015 г. появились боли в икроножных мышцах при ходьбе на 100–200 м. В этот же период диагностирована гиперхолестеринемия с повышением общего холестерина до 7 ммоль/л. Однако регулярно назначенную терапию пациент не принимал.
С начала октября 2017 г. пациент стал отмечать увеличение частоты и продолжительности приступов стенокардии до 10 мин, а также появление их при минимальных физических нагрузках и в покое. 15 октября 2017 г. в утренние часы при бытовой физической нагрузке пациент почувствовал интенсивную давящую боль за грудиной с иррадиацией в шею, левое плечо, длительностью более 60 мин, без эффекта от нитроглицерина, сопровождавшуюся общей слабостью, чувством страха, одышкой. В последующем в течение дня болевой синдром в грудной клетке неоднократно рецидивировал, однако за помощью пациент не обратился. 16.10.2017 г. отмечал при минимальных физических нагрузках, а также в покое болевой синдром в грудной клетке (до 10 мин), без четкого эффекта от нитроглицерина, что послужило поводом для обращения в приемное отделение ГБУЗ КО «КОККД им. акад. Л.С. Барбараша». На рисунке 1 представлена графически история заболевания.
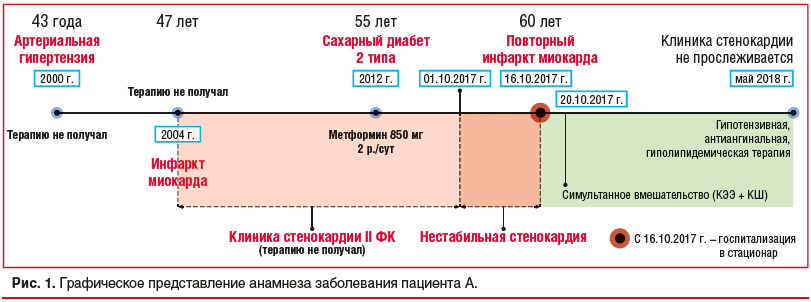
Анамнез жизни. Пациент курит в течение 20 лет (индекс пачка/лет — 20), алкоголь не употребляет. Хронические заболевания ранее не диагностированы.
Семейный анамнез: брат умер в возрасте 55 лет от острого нарушения мозгового кровообращения, сестра в возрасте 50 лет перенесла инфаркт миокарда.
Объективный осмотр (приемное отделение — 16.10.2017 г.). Общее состояние — средней степени тяжести, обусловленное ОКС. Сознание ясное, положение активное. Кожные покровы физиологической окраски, видимые слизистые — бледно-розовые. Периферические лимфатические узлы не увеличены. Отеков нет. Вес — 72,0 кг, рост — 168 см, окружность талии — 88,0 см, окружность бедер — 89,0 см. Индекс массы тела (ИМТ) — 25,5 кг/м2. Расчет ИМТ (индекс Кетле) проводился по формуле: ИМТ = вес [кг] / (рост)2 [м2].
Дыхание жесткое, хрипов нет во всех точках аускультации. В легких дыхание везикулярное, частота дыхания — 16 в минуту. Сатурация (SpO2)— 94%. При перкуссии — ясный легочный звук.
Тоны сердца приглушены, ритмичные, патологические шумы не выслушиваются. Верхушечный толчок не пальпируется. АД и пульс измерены трехкратно с интервалом 2 мин на ведущей (левой) руке через 5 мин отдыха в положении сидя: 130/87 мм рт. ст., частота сокращений сердца (пульс) — 79 ударов в минуту.
Нарушений со стороны других органов и систем (пищеварительной, мочеполовой, неврологической системы, скелетно-мышечного аппарата), нарушений обмена веществ, новообразований не выявлено.
По результатам лабораторных исследований во время госпитализации определено значимое повышение кардиоспецифических маркеров миокарда. При поступлении в стационар креатинфосфокиназа (КФК) — 356 Ед/л, креатинфосфокиназа МВ-фракция (КФК-МВ) — 79 Ед/л и в динамике через 24 ч КФК — 421 Ед/л, КФК-МВ — 88 Ед/л. Кроме того, обращает на себя внимание гипергликемия (глюкоза крови — 7,8 ммоль/л), синдром цитолиза (аспартатаминотрансфераза (АСТ) — 36 ммоль/л, аланинаминотрансфераза (АЛТ) — 40 ммоль/л) при поступлении в стационар. В показателях коагуляции крови отмечалось повышение фибриногена — 5,4 г/л и растворимых фибрин-мономерных комплексов (РФМК) — 10,0 мг%. Остальные показатели как общего, так и биохимического анализа крови находились в пределах нормальных значений.
Выявлена дислипидемия: уровень общего холестерина (ОХС) — 8,59 ммоль/л, липопротеинов низкой плотности (ЛПНП) — 4,48 ммоль/л, липопротеинов высокой плотности (ЛПВП) — 1,59 ммоль/л, триглицеридов (ТГ) — 1,3 ммоль/л, коэффициент атерогенности — 4,4.
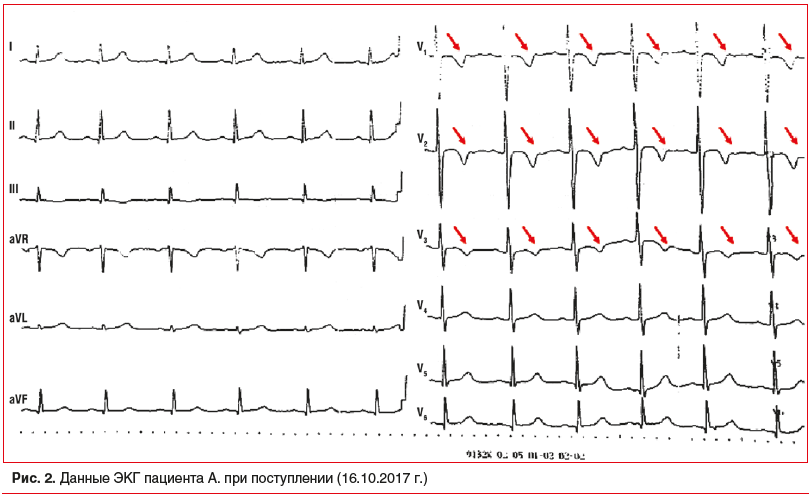
По данным ЭКГ, на момент ОКС без подъема сегмента ST (ОКСбпST) от 16.10.2017 г. регистрировалось течение Q-необразующего переднего (передневерхушечного, переднеперегородочного сегментов) инфаркта миокарда (рис. 2).
По данным эхокардиографии, на момент поступления в стационар (16.10.2017 г.): систолическая функция левого желудочка (ЛЖ) умеренно снижена (фракция выброса (ФВ) ЛЖ — 33% (измеренная по методике Симпсона), а также диагностирована гипо- и акинезия передних и переднеперегородочных, базальных и средних сегментов ЛЖ (рис. 3, адаптирован из [16]).
![Рис. 3. Данные эхокардиографии пациента А. при поступлении (16.10.2017 г.). Красным цветом выделены участки гипо- кинеза, желтым – непораженные участки миокарда (адаптирован из [16]). Рис. 3. Данные эхокардиографии пациента А. при поступлении (16.10.2017 г.). Красным цветом выделены участки гипо- кинеза, желтым – непораженные участки миокарда (адаптирован из [16]).](https://medblog.su/wp-content/uploads/2019/11/1573945334_596_simultannoe-vmeshatelstvo-na-brahiotsefalnyh-i-koronarnyh-arteriyah-strategiya-vybora-pri-ostrom-koronarnom-sindrome-klinicheskoe-nablyudenie-pecherina-t-b-kashtalap-v-v-tarasov-r-s-klimenkova-a-v.png)
С целью выявления атеросклеротического поражения некоронарного сосудистого бассейна выполнено цветное дуплексное сканирование (ЦДС) БЦА, а также АНК. По результатам ЦДС выявлены гемодинамически значимые стенозы БЦА, поражения АНК, где диагностирована окклюзия подколенной артерии (ПКА) с обеих сторон, а также стенозы (30%) поверхностной бедренной артерии (ПБА) с обеих сторон.
Результаты цветного дуплексного сканирования БЦА (16.10.2017 г.).
Комплекс интима — медиа: 0,12 см, утолщен.
Справа: ОСА (общая сонная артерия): атеросклеротическая бляшка, НСА (наружная сонная артерия): не изменена. ВСА (внутренняя сонная артерия): ход артерии прямолинейный. Визуализируется атеросклеротическая бляшка, неоднородная, преимущественно гиперэхогенная, в синусе ОСА с переходом на устье ВСА, циркулярная, протяженностью 1 см, локальное нарушение гемодинамики есть: степень стеноза по площади — 65%, степень стеноза по отношению к дистальному руслу — 60% (диаметр остаточного просвета в зоне стеноза — 0,2 см). Пиковая систолическая скорость в зоне стеноза — 110 см/с, конечная диастолическая скорость в зоне стеноза — 50 см/с. ПА (позвоночная артерия): диаметр — 0,3 см, max скорость — 40 см/с, средняя скорость — 30 см/с, RI 0,6, кровоток — антеградный. ПкА (подключичная артерия): кровоток — магистральный.
Слева: ОСА: атеросклеротическая бляшка, НСА: не изменена. ВСА: ход артерии прямолинейный. Визуализируется атеросклеротическая бляшка, неоднородная, преимущественно гиперэхогенная, в синусе ОСА с переходом на устье ВСА, циркулярная, протяженностью 2 см. Локальное нарушение гемодинамики: есть степень стеноза по площади — 80% , степень стеноза по отношению к дистальному руслу — 70%, диаметр остаточного просвета в зоне стеноза — 0,15 см. Пиковая систолическая скорость в зоне стеноза — 210 см/с, конечная диастолическая скорость в зоне стеноза — 80 см/с. ПА: диаметр — 0,3 см, максимальная скорость — 50 см/с, средняя скорость — 32 см/с, RI 0,6, кровоток — антеградный. ПкА: кровоток — магистральный.
Совместно с ангиохирургом принята консервативная тактика лечения атеросклероза нижних конечностей, в то время как для атеросклероза БЦА определена необходимость проведения эндартерэктомии в позиции левой ОСА и ВСА.
Согласно рекомендациям по ведению пациентов с ОКСбпST (ESC 2015) больной при поступлении был стратифицирован по шкале GRACE, сумма баллов по которой составила 150, что соответствует высокому риску внутригоспитальной летальности (>3%) и требует проведения коронароангиографии (КАГ) в течение 24 ч от момента поступления в стационар [6].
На этапе приемного отделения боль купирована ненаркотическим анальгетиком (кеторолак 60 мг внутривенно струйно), кроме того, пациент получил нагрузочную дозу антиагреганта (ацетилсалициловая кислота 250 мг внутрь), а также антикоагулянта (гепарин натрия 4000 ЕД внутривенно струйно). Согласно шкале оценки риска кровотечений в периоде госпитализаций у пациентов с ОКСбпST (CRUSADE) сумма баллов составила 40, что соответствует умеренному риску крупных кровотечений [6].
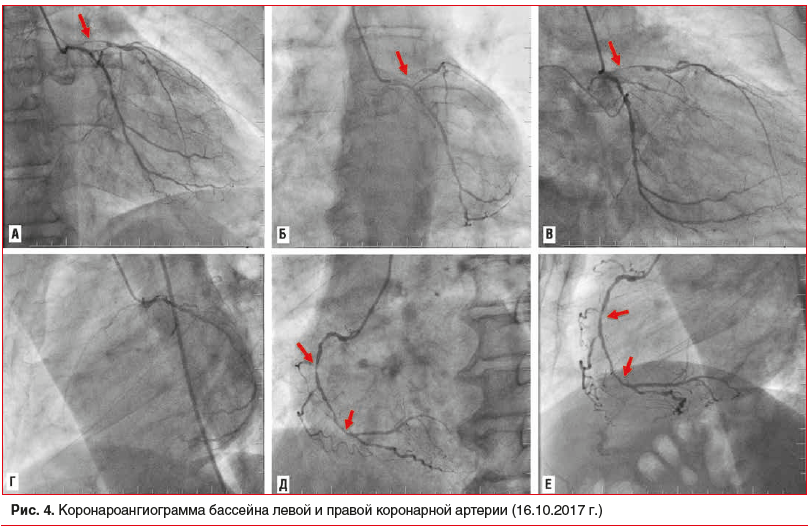
С целью определения характера поражения коронарного русла в рамках ОКС была выполнена КАГ, при проведении которой выявлено многососудистое поражение коронарных артерий. На серии коронароангиограмм визуализированы: ствол левой коронарной артерии (ЛКА) — стеноз 90%; передняя нисходящая артерия (ПНА) — стеноз в проксимальном сегменте (95%) и среднем сегменте (90%); в дистальном сегменте ПКА — стеноз 50%. Тип коронарного кровоснабжения — правый (рис. 4). По шкале SYNTAX Score пациент набрал 37 баллов, что соответствует тяжелому поражению. С учетом высокого риска возможных интраоперационных осложнений (поражения ствола ЛКА, выраженного кальциноза коронарных артерий, низкой ФВ ЛЖ) проведение чрескожного коронарного вмешательства, в т. ч. в условиях экстракорпоральной мембранной оксигенации, могло быть рассмотрено в случае отказа пациента от проведения коронарного шунтирования (КШ), как альтернативный способ реваскуляризации миокарда [6].
По результатам клинических, анамнестических, лабораторных и инструментальных данных был сформулирован окончательный диагноз: Q-необразующий инфаркт миокарда без подъема сегмента ST с выраженной систолической дисфункцией ЛЖ [6].
Основной диагноз: ишемическая болезнь сердца. Инфаркт миокарда от 15.10.2017 г., повторный (2), без подъема сегмента ST, переднеперегородочный, передневерхушечный в зоне рубцов, неосложненный. Killip I. Постинфарктный (2004 г.) кардиосклероз. ХСН IIA стадии по классификации Василенко — Стражеско, II функционального класса по классификации NYHA. EuroSCORE II (6,25%).
Фоновая патология: гипертоническая болезнь III стадии, гипертрофия миокарда ЛЖ, риск 4.
Гиперхолестеринемия (возможно семейного генеза, сумма баллов по шкале Dutch Lipid Clinic Network Criteria — 4) [7, 8]. Дислипидемия IIa типа по Фредриксону [7].
Сахарный диабет 2 типа. Макроангиопатия. Целевой уровень НbA1с <8%.
Мультифокальный атеросклероз. Хроническая ишемия головного мозга. Стенозы ВСА: справа — 65%, слева — 80%. Окклюзии ПКА, стенозы ПБА: 30% с обеих сторон.
После проведения КАГ пациент находился в блоке интенсивной терапии, где ему проводился мониторинг и коррекция показателей гемодинамики, мониторинг ЭКГ, контроль гликемического статуса. У пациента были купированы признаки сердечной недостаточности, болевой синдром в грудной клетке не рецидивировал, нарушений ритма и проводимости зарегистрировано не было.
На выбор метода реваскуляризации в данном случае влияли многие факторы, такие как ОКС высокого риска, систолическая дисфункция ЛЖ, сахарный диабет, многососудистый коронарный атеросклероз с баллом по шкале SYNTAX, превышающим 22 [9], сопутствующее критическое поражение БЦА.
В данном случае коллегиально было принято решение о выполнении срочного шунтирования коронарных артерий в условиях искусственного кровообращения в объеме маммарокоронарного шунтирования ПНА, аортокоронарного шунтирования аутовеной 2-й ветви тупого края и задней межжелудочковой ветви ПКА симультанного вмешательства — каротидной эндартерэктомии (КЭЭ).
С учетом ранних сроков после ИМ и в связи с необходимостью проведения КЭЭ, а также с целью улучшения коронарного кровотока за день до операции пациенту был установлен внутриаортальный баллонный контрпульсатор.
В госпитальном периоде пациент получал: бета-блокатор, ингибитор ангиотензинпревращающего фермента (иАПФ), cтатин в максимальной терапевтической дозировке (аторвастатин 80 мг), антагонист альдостерона (ввиду сниженной ФВ ЛЖ), ацетилсалициловую кислоту, нефракционированный гепарин (под контролем АЧТВ). Совместно с эндокринологом проводилась коррекция гипергликемии инсулином короткого действия для поддержания гликемии в пределах от 5 до 11 ммоль/л.
На 5-е сут (20.10.2017 г.) от развития ОКС проведено сочетанное оперативное вмешательство на коронарном и брахиоцефальном (слева) бассейнах: первым этапом проведена эндартерэктомия слева из ОСА, устья ВСА и НСА, с последующей пластикой артерий заплатой из ксеноперикарда (длина — 6 см, ширина — 5 мм). Время пережатия сонной артерии составило 29 мин.
Вторым этапом выполнена реваскуляризация миокарда в условиях искусственного кровообращения в объеме: маммарокоронарный анастомоз с ПНА, аортокоронарное шунтирование аутовеной задней межжелудочковой ветви ПКА и 2-й ветви тупого края. Длительность искусственного кровообращения — 92 мин. Время пережатия аорты — 60 мин. Остановка сердечной деятельности проведена посредством 3 антеградных калиевых фармако-холодовых кардиоплегий, минимальная температура составила 35,5 °С. Сердечная деятельность восстановлена одним разрядом электроимпульсной терапии. Установлены 2 активных дренажа в переднее средостение и 1 дренаж в рану шеи. Также к правому желудочку и ушку правого предсердия подшито по 2 электрода для временной электрокардиостимуляции (ЭКС). Общее время проведения симультанного хирургического вмешательства на БЦА и коронарных артериях составило 5 ч. В конце оперативного вмешательства проведена трансфузия донорской эритроцитарной массы в объеме 556 мл.
В послеоперационном периоде осложнений не наблюдалось. Заживление ран проходило первичным натяжением. Пациент продолжил получать терапию: бета-блокатор, иАПФ, спиронолактон, статин, ацетилсалициловую кислоту, клопидогрел, кроме того, инсулин короткого действия для коррекции гипергликемии. ФВ ЛЖ к моменту выписки из стационара составила 42%.
Пациент в удовлетворительном состоянии выписан из стационара (31.10.2017 г.) на этап реабилитации в отделение кардиологии и реабилитации ГБУЗ КО «КОККД им. акад. Л.С. Барбараша».
Рекомендации при выписке из стационара:
ацетилсалициловая кислота 100 мг 1 р./сут, в обед;
клопидогрел 75 мг 1 р./сут, утром;
эплеренон 25 мг 1 р./сут;
периндоприл 2,5 мг 1 р./сут, на ночь;
бисопролол 2,5 мг 1 р./сут, утром;
аторватстатин 80 мг 1 р./сут, вечером;
метформин 1000 мг 2 р./сут.
Через 6 мес. при плановом осмотре кардиологом клиники стенокардии не прослеживается. Пациент находится на регулярном диспансерном наблюдении и принимает рекомендованную терапию. Клиника ХСН в рамках II ФК по классификации NYHA. По липидограмме были достигнуты целевые значения для ЛПНП (1,23 ммоль/л). Гликозилированный гемоглобин (HbA1c) составил 7,1%. По ЭхоКГ определено улучшение сократительной способности миокарда ЛЖ с 33% до 51%. Сохраняются симптомы перемежающейся хромоты в рамках хронической ишемии нижних конечностей IIа.
Обсуждение
В последнее время увеличилось число работ, свидетельствующих о преимуществах симультанного подхода при планировании реваскуляризации сочетанных атеросклеротичес-ких поражений, однако национальные и международные
руководства не достигли консенсуса в уровне доказательности этого подхода из-за отсутствия результатов проспективных рандомизированных клинических исследований [10, 11].
Актуальные европейские рекомендации 2017 г. также не предоставляют окончательных ответов на имеющиеся спорные вопросы. Так, в них говорится о том, что рутинное выполнение превентивной КЭЭ при КШ пациентам с асимптомными стенозами ВСА не показано [11]. Отсутствие четких международных рекомендаций по выбору оптимальной стратегии реваскуляризации у пациентов с гемодинамически значимым поражением ВСА и коронарного русла связано с крайней вариабельностью клинических и инструментальных данных в этой группе больных с мультифокальным атеросклерозом, что вызывает дискуссии среди сосудистых и кардиохирургов относительно выбора оптимальной хирургической стратегии. Кроме того, отсутствуют рекомендации по выбору оптимального хирургического подхода у пациентов с мультифокальным атеросклерозом при ОКС. В этой связи не может существовать универсальной хирургической стратегии реваскуляризации. Речь может идти лишь о совершенствовании персонифицированного способа определения хирургической стратегии, ассоциированной с минимальной вероятностью развития неблагоприятных кардиоваскулярных событий у конкретного пациента. Рекомендации Европейского общества кардиологов (European Society of Cardiology, ESC) 2018 г. не отличаются от рекомендаций 2017 г. по данным вопросам.
Основываясь на данных собственных исследований [13], можно предположить, что создание модели персонифицированного выбора оптимальной стратегии лечения пациентов с симультанным поражением ВСА и коронарных артерий может внести существенный вклад в улучшение отдаленного прогноза для данной тяжелой категории пациентов, в т. ч. пациентов с ОКС. Исследователями Кузбасского кардиоцентра разработана модель комплексной оценки факторов риска неблагоприятного исхода при реализации той или иной стратегии реваскуляризации миокарда и головного мозга, существующая в виде специально созданной программы, на основании ряда клинико-демографических и ангиографических показателей [14].
Доля пациентов с ОКСбпST, которым проводится КШ во время первичной госпитализации, составляет не более 10% [15]. Между тем, с учетом того, что не менее половины пациентов данной когорты имеют многососудистое поражение, потребность в КШ как в методе, обеспечивающем полную реваскуляризацию миокарда, существенно выше. Безусловно, фактором, ограничивающим широкое распространение КШ как метода оптимальной реваскуляризации миокарда при ОКС, является необходимость назначения таким пациентам агрессивной антитромботической терапии. При принятии решения о проведении КШ пациенту с ОКС следует учитывать повышенный риск геморрагических осложнений на фоне агрессивной антитромботической терапии [15]. Однако применение 2 или 3 антитромботических препаратов рассматривают только как относительное противопоказание к раннему КШ, хотя в таких случаях во время операции следует принять меры, чтобы свести к минимуму риск кровотечения. Если неотложную операцию проводят до завершения отмывочного периода тиенопиридинов, то для профилактики кровотечений рекомендуется выполнять КШ в режиме off-pump или свести к минимуму искусственное кровообращение, а также использовать трансфузию тромбоцитарной массы [15]. По данным литературы [16], КШ должно проводиться в максимально ранние сроки от начала ОКС, только в этом случае можно говорить об эффективной профилактике ранних и отдаленных повторных ишемических событий. Именно такой подход был реализован в представленном клиническом случае.
Следует отметить, что выбор оптимальной тактики реваскуляризации у пациентов с ОКС и мультифокальным атеросклерозом представляется сложной задачей для практикующего врача, оптимальному решению которой были посвящены ряд отечественных и зарубежных клинических исследований [17, 18]. Однако ввиду отсутствия данных рандомизированных испытаний рекомендации на этот счет имеют уровень мнения экспертов, в связи с чем сложные клинические случаи требуют коллегиального подхода к обсуждению и утверждению оптимальной стратегии ведения.
Заключение
Представлены результаты успешного проведения одномоментного симультанного вмешательства на двух сосудистых бассейнах на фоне ОКС, тяжелой систолической дисфункции миокарда ЛЖ, длительно текущего сахарного диабета 2 типа. Междисциплинарный подход в данном случае обеспечил эффективность выбранной тактики ведения, а симультанное вмешательство явилось вариантом выбора хирургической стратегии в лечении пациента с крайне высоким сердечно-сосудистым риском.
Информация с rmj.ru






