Введение
Бесплодие как глобальная медико-социальная проблема является довольно серьезным вызовом для мирового здравоохранения и занимает одно из первых мест по значимости в сфере акушерства и гинекологии.
Национальный институт здравоохранения и совершенствования помощи Великобритании (NICE) определяет бесплодие как неспособность зачать ребенка на протяжении двух лет при условии регулярных половых контактов без предохранения [1]. В свою очередь, Американское общество репродуктивной медицины трактует бесплодие как неспособность забеременеть на протяжении года или более при тех же условиях [2–5].
По данным многих исследователей, распространенность первичного бесплодия составляет около 3,5%, а вторичного — 18,4% [6, 7]. По данным A. Sharma et al. [8], в 40–55% всех случаев бесплодия его причиной является женский фактор, а в 20–40% — мужской. Согласно данным N.H. Hazlina et al. [9], 33–41% всех случаев бесплодия обусловлено женским фактором, на мужской фактор приходится 25–39%. Бесплодие, обусловленное комбинацией мужского и женского факторов, по данным различных авторов, встречается в 9–39%, а по некоторым наблюдениям — в 50% случаев [10, 11]. По данным A. Sharma et al. [12], приблизительно у 30% пациентов бесплодие классифицируется как идиопатическое.
Состояние и толщина эндометрия — наиболее важные факторы, влияющие на частоту наступления беременности, в том числе в программах вспомогательных репродуктивных технологий (ВРТ). Корреляция между рецептивностью и толщиной эндометрия как фактора нарушения имплантации упоминается во многих исследованиях [13–17].
Одна из распространенных причин бесплодия, связанных с повреждением эндометрия, — синдром Ашермана, который представляет собой приобретенное состояние, сопровождающееся возникновением внутриматочных спаек или синехий, что приводит к бесплодию или аменорее. Спайки представляют собой полосы фиброзной ткани, образующиеся между стенками матки в ответ на травму или воспаление.
Не менее важна оценка толщины эндометрия. С точки зрения продуктивности зачатия пограничной считают толщину эндометрия 7 мм. Интерес вызывает синдром «тонкого» эндометрия — феномен современной репродуктологии, требующий конкретной научной формулировки. В работе Т. El-Toukhy et al. [18] «тонкий» эндометрий определен как «эндометрий, толщина которого ниже порога, необходимого для имплантации эмбриона человека».
Сходство анамнеза пациенток с «тонким» эндометрием позволяет выделить несколько основных причин, ведущих к его истончению: внутриматочные вмешательства, влекущие за собой повреждение базального слоя эндометрия, хронический эндометрит, нарушение гемодинамики маточных сосудов, сопровождающееся высоким сосудистым сопротивлением, снижение уровня эстрогенов или их эффекта. Не только толщина, но и структура эндометрия играет ключевую роль в процессе имплантации. Данные литературы подтверждают существующее мнение о ключевой роли эндометрия в имплантации и плацентации [19–22].
В числе причин формирования «тонкого» эндометрия необходимо выделить гипоталамический гипогонадизм, преждевременную недостаточность яичников, аномалии Мюллеровых протоков и радиационное воздействие [23, 24].
По данным М. Von Wolff et al. [25], «тонкий» эндометрий следует рассматривать как независимый негативный прогностический фактор при проведении программ ВРТ в естественных циклах. Частота наступления беременности у пациенток при толщине эндометрия <7 мм составила 7,4%, а при толщине эндометрия >7 мм — 30,8% (n=105, р=0,03). Авторы сообщают, что разница в частоте живорождения не была статистически значимой. В циклах стимуляции функции яичников частота наступления беременности при толщине эндометрия <7 мм составила 3%, в то время как при толщине эндометрия ≥8 мм — 28%. В случае переноса размороженных эмбрионов пациенткам с эндометрием толщиной <7 мм частота наступления беременности составила 5%, а при толщине эндометрия ≥8 мм — 30,9% [26].
Новым подходом, предложенным недавно для лечения «тонкого» эндометрия, служит применение регенеративных методов с использованием стволовых клеток или интраутеринные инфузии обогащенной тромбоцитами плазмы (Platelet-Rich Plasma, PRP), приготовленной из свежей цельной крови. PRP производят из аутологичной крови, что предотвращает такие проблемы, как передача инфекций и иммуногенные реакции. Тромбоциты оказывают положительное влияние на локальное восстановление тканей и содержат значительное количество факторов роста, которые стимулируют пролиферацию и увеличение концентрации сосудистого эндотелиального фактора роста (VEGF), эпидермального фактора роста (EGF), тромбоцитарного фактора роста (PDGF), трансформирующего фактора роста (TGF) и других цитокинов [27, 28]. Более 10 лет PRP в форме инъекций или геля используют для лечения различных состояний в офтальмологии, ортопедии, хирургии: для заживления ран, стимуляции регенерации как мягких тканей, таких как жировая ткань, кожа и слизистые оболочки, так и сухожилий и костей. Однако его эффективность в стимулировании роста эндометрия до конца не изучена [29–34].
У женщин с «тонким» эндометрием PRP используют в форме внутриматочной инфузии с целью индуцирования роста эндометрия, что в последующем приводит к увеличению количества наступивших беременностей. Y. Chang et al. [35] были первыми, кто применил PRP у женщин с «тонким» эндометрием, после чего было продемонстрировано увеличение толщины эндометрия и улучшение исходов беременностей.
Цель исследования: изучение влияния PRP-терапии на толщину и структуру эндометрия в рамках улучшения репродуктивного потенциала женщины.
Материал и методы
В исследование было включено 60 пациенток в возрасте 25–35 лет. Средний возраст составил 30,3±3,3 года.
Критерии включения в исследование: репродуктивный возраст, диагностированное бесплодие, толщина эндометрия (измеренная на 12–15-й день менструального цикла) 6–7 мм, отсутствие острых воспалительных заболеваний, экстрагенитальной патологии в стадии декомпенсации, согласие пациенток на участие в исследовании.
Критерии невключения в исследование: возраст <18 лет или >40 лет, толщина эндометрия >8 мм, наличие воспалительных, онкологических, экстрагенитальных заболеваний, несогласие пациентки участвовать в исследовании.
Пациентки были распределены в 3 группы.
Группа 1 включала 12 (20%) пациенток с первичным бесплодием, средняя толщина эндометрия у которых составила 6,72±0,29 мм, а преобладающим этиологическим фактором бесплодия была преждевременная недостаточность яичников. У женщин этой группы отмечался повышенный уровень фолликулостимулирующего гормона (ФСГ), среднее значение которого составило 18,0±2,36 мМЕ/мл, что указывало на дисфункцию яичников и нарушение овуляторных процессов. Вначале пациенткам проводили заместительную гормональную терапию (ЗГТ) с целью реализации репродуктивной функции с последующим мониторингом в течение 6 мес. Однако на фоне такого лечения значительного клинического улучшения в отношении увеличения толщины эндометрия не наблюдалось, что позволило сделать вывод о недостаточной эффективности ЗГТ в качестве единственного метода лечения, направленного на улучшение состояния эндометрия. В связи с этим в дополнение к ЗГТ применили терапию PRP.
В группу 2 вошли 18 (30%) пациенток с первичным бесплодием, которые ранее перенесли инфекции, передающиеся половым путем (ИППП). Средняя толщина эндометрия у пациенток данной группы составила 6,57±0,28 мм. Пациентки получили эффективное лечение ИППП более чем за 2 года до начала исследования. В течение этого периода осложнений после проведенного лечения не наблюдалось, однако возникли трудности с наступлением беременности. Для этих пациенток терапию PRP применяли в качестве целевого метода восстановления эндометрия.
Группа 3 включала 30 (50%) пациенток со вторичным бесплодием, средняя толщина эндометрия у которых составила 6,67±0,31 мм. В данную группу вошли пациентки с синдромом Ашермана (группа 3.1) (n=20, средняя толщина эндометрия 6,59±0,35 мм), развившимся после различных хирургических вмешательств, таких как выскабливание полости матки после прерывания беременности, родов, гистероскопические процедуры, включая удаление полипов, миомэктомию и адгезиолизис. У остальных 10 пациенток (группа 3.2) (средняя толщина эндометрия 6,67±0,25 мм) был длительный (>5 лет) анамнез использования внутриматочного контрацептива (ВМК). Для пациенток с синдромом Ашермана PRP-терапию назначали после гистероскопического адгезиолизиса, тогда как у пациенток с длительным использованием ВМК в анамнезе применяли только PRP-терапию.
После отбора и распределения по группам пациенткам проводили PRP-терапию. Следует отметить, что за счет обогащения аутологичной плазмы тромбоцитами в ней увеличивается концентрация факторов роста с высоким противовоспалительным и митогенным потенциалом. PRP-терапию проводили в середине менструального цикла 2 раза через день 3 менструальных цикла подряд.
Статистический анализ проводили с использованием программы StatTech v.4.8.1 (Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова — Смирнова. Вычисляли средние арифметические величины показателей (M) и стандартные отклонения (SD). Для сравнения ≥3 связанных групп по нормально распределенному количественному признаку применяли однофакторный дисперсионный анализ с повторными измерениями. Статистическую значимость изменений показателя в динамике оценивали с помощью F-критерия Фишера. Апостериорный анализ проводили с помощью парного t-критерия Стьюдента с поправкой Холма. Различия считали статистически значимыми при p<0,05.
Содержание статьи
Результаты исследования
Пациентки всех групп были сопоставимы по возрасту. Значимых различий между пациентками разных групп по особенностям менструальной или детородной функций не наблюдалось. Длительность первичного и вторичного бесплодия у пациенток составила от 2 до 7 лет (табл. 1).
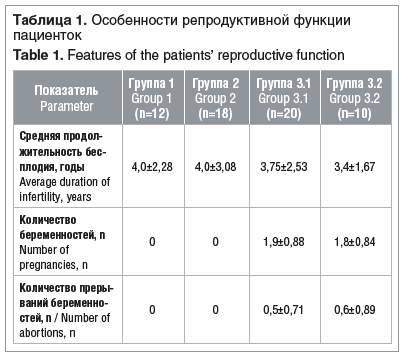
Обращает на себя внимание то, что чаще внутриматочные вмешательства встречались в анамнезе пациенток с синдромом Ашермана. Так, у 10 (50%) пациенток данной группы в анамнезе было прерывание беременности по желанию, причем у 6 из 10 было по 2 медицинских аборта. У 6 (30%) пациенток проводили раздельное диагностическое выскабливание под контролем гистероскопии, причем у 2 (10%) пациенток гистероскопию повторяли дважды в течение 2 лет. У 4 (20%) пациенток в анамнезе была гистерорезектоскопия по поводу полипа эндометрия.
Результаты проводимого лечения оценивали через 4 мес. от начала исследования (через 1 мес. после окончания PRP-терапии). Изменения толщины эндометрия представлены в таблице 2.
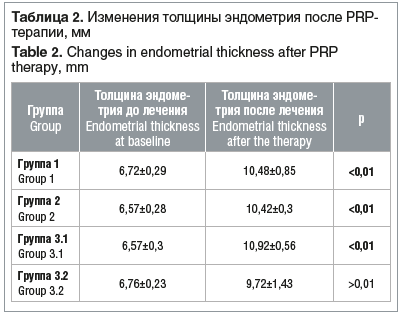
Были получены статистически значимые результаты лечения во всех группах пациенток, кроме пациенток с длительным ношением ВМК, где также отмечалось увеличение толщины эндометрия, однако различия оказались статистически незначимы. Представленные данные указывают на более выраженное травмирующее воздействие на эндометрий длительного использования ВМК, нежели других факторов.
Необходимо отметить, что среди пациенток группы 1 с преждевременной недостаточностью яичников, у которых отмечался повышенный уровень ФСГ, на фоне проводимого комбинированного лечения, включающего ЗГТ, отмечалось снижение его уровня (до лечения концентрация ФСГ составляла 18,0±2,36 мМЕ/мл, после лечения — 8,27±1,17 мМЕ/мл). У всех пациенток (n=12) с гормональными нарушениями было отмечено утолщение эндометрия в среднем до 10,48±0,85 мм, что свидетельствует о положительном влиянии комбинированной терапии.
У 7 (77,8%) пациенток группы 2 с ИППП в анамнезе толщина эндометрия увеличилась до значений >10 мм (в среднем до 10,42±0,3 мм), что также подтверждает эффективность PRP-терапии в восстановлении эндометрия.
Лечение продемонстрировало высокую эффективность среди пациенток с вторичным бесплодием: у 16 (80%) пациенток группы 3.1 с синдромом Ашермана удалось добиться утолщения эндометрия >10 мм (среднее значение 10,92±0,56 мм). В группе 3.2 положительные изменения отмечены у 6 (60%) пациенток, в том числе увеличение толщины эндометрия в среднем до 9,72±1,43 мм, что указывает на положительный, но меньший эффект по сравнению с другими группами. Это может свидетельствовать о том, что ВМК, возможно, оказывает выраженное травмирующее воздействие на эндометрий при его длительном ношении.
Репродуктивную функцию оценивали в течение 1 года после проводимого лечения. В группе 1 у 10 (83,3%) пациенток наступила беременность, причем у 3 (25%) спонтанная, а 7 (58,3%) пациенткам пришлось прибегнуть к ВРТ. Все беременности закончились своевременными родами. У 14 (77,8%) пациенток группы 2 наступила беременность, у 10 из них беременность закончилась своевременными родами, у 4 — самопроизвольным выкидышем на малом сроке беременности. Среди пациенток группы 3.1 у 17 (85%) наступила беременность, которая у 14 из них закончилась своевременными родами, а у 3 — самопроизвольным выкидышем на малом сроке. У 6 (60%) пациенток группы 3.2 наступила беременность, закончившаяся у 5 пациенток родами в срок, а у 1 пациентки самопроизвольным выкидышем на малом сроке беременности.
Таким образом, результаты проводимого лечения показали, что после PRP-терапии у 47 (78,3%) пациенток наступила беременность, у 39 (83%) из них она завершилась своевременными родами, а у 8 (17%) — самопроизвольным выкидышем на малом сроке беременности. В 13 (21,7%) случаях ожидаемый эффект достигнут не был.
Обсуждение
Полученные в ходе исследования результаты согласуются с данными, представленными в литературе.
В трех исследованиях было показано, что у 100% пациенток с бесплодием после одного или двух внутриматочных введений PRP толщина эндометрия достигла значения 7 мм [36–38], а еще два исследования продемонстрировали, что инфузия PRP привела к значительному увеличению толщины эндометрия по сравнению с контрольной группой [3, 39].
Рандомизированное исследование, проведенное M. Eftekhar et al. [3], включало 83 пациентки с бесплодием, из которых 40 получали внутриматочную инфузию PRP (0,5–1,0 мл) на 13-й день цикла ЗГТ, а 43 женщины составляли контрольную группу и проходили эмбриотрансфер без внутриматочного введения PRP. У пациенток, получавших лечение PRP, толщина эндометрия значительно увеличилась с 6,09±0,47 до 8,67±0,64 мм, в то время как у пациенток контрольной группы, которым не вводили PRP, толщина эндометрия на фоне приема ЗГТ увеличилась в меньшей степени: с 6,15±0,37 до 8,04±0,27 мм (р=0,001).
Представленные данные согласуются с результатами, полученными в ходе нашего исследования. Так, на фоне проводимой PRP-терапии толщина эндометрия в исследуемых группах 1, 2 и 3.1 статистически значимо увеличивалась (см. табл. 2).
До настоящего времени было описано лишь несколько случаев лечения синдрома Ашермана при помощи внутриматочной инфузии PRP. В одном из таких случаев пациентке 31 года, у которой в анамнезе было выскабливание полости матки в послеродовом периоде, был диагностирован синдром Ашермана [40]. В качестве лечения ей ввели внутриматочно 1 мл PRP на 12-й день менструального цикла на фоне ЗГТ. Процедуру повторили через 3 дня, что привело к восстановлению эндометрия с увеличением его васкуляризации, толщины и функции, что в конечном итоге позволило наступить беременности.
В исследовании L. Aghajanova et al. [1] сообщается о двух женщинах с синдромом Ашермана, перенесших повторные выкидыши после применения различных методов лечения. Обе женщины успешно забеременели после PRP-терапии, несмотря на то, что эндометрий оставался тонким. Эти результаты могут указывать на то, что применение PRP, вероятно, не только способствует росту эндометрия, но и улучшает его функциональные свойства. В 4 исследованиях, между которыми не было значительной гетерогенности (I2=16,6%, р=0,309) [3, 36, 37, 41], включающих 306 пациенток, оценивали частоту имплантации, которая в группе PRP была значительно выше, чем в контрольной группе (RR 2,71, 95% ДИ от 1,91 до 3,84, р=0,001).
Результаты проведенного нами исследования подтвердили результаты, полученные другими авторами. Лечение продемонстрировало высокую эффективность: у 80% пациенток с синдромом Ашермана удалось добиться утолщения эндометрия >10 мм.
Заключение
Настоящее исследование подтверждает высокую эффективность PRP-терапии в восстановлении эндометрия и улучшении репродуктивной функции у пациенток с различными формами бесплодия.
Так, PRP-терапия показала положительные результаты у пациенток с первичным бесплодием, обусловленным гормональными нарушениями и перенесенными ИППП, а также при синдроме Ашермана. Подтверждено положительное влияние PRP-терапии на восстановление толщины эндометрия у пациенток с вторичным бесплодием, связанным с длительным использованием ВМК, хотя результаты были менее выраженными по сравнению с группой пациенток с синдромом Ашермана.
Для более глубокого понимания долгосрочных эффектов PRP-терапии необходимы дальнейшие исследования с длительными периодами наблюдения и более разнообразной выборкой пациенток. Будущие исследования должны быть направлены на разработку оптимальных схем лечения для повышения эффективности терапии.
Сведения об авторах:
Хачатрян Азнар Сааковна — к.м.н., преподаватель кафедры акушерства и гинекологии лечебного факультета ЕГМУ им. М. Гераци; 0025; Армения, Ереван, ул. Корюна, д. 2; ORCID iD 0009-0000-2767-8995
Симонян Мариам Ашотовна — клинический ординатор кафедры акушерства и гинекологии лечебного факультета ЕГМУ им. М. Гераци; 0025; Армения, Ереван, ул. Корюна, д. 2; ORCID iD 0009-0003-7251-1002
Абраамян Лусине Размиковна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета ЕГМУ им. М. Гераци; 0025; Армения, Ереван, ул. Корюна, д. 2; ORCID iD 0009-0001-7013-3082
Ильина Ирина Юрьевна — д.м.н., профессор кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-8155-8775
Контактная информация: Хачатрян Азнар Сааковна, e-mail aznardoc@yahoo.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 07.07.2025.
Поступила после рецензирования 30.07.2025.
Принята в печать 22.08.2025.
About the authors:
Aznar S. Khachatryan — C. Sc. (Med.), Lecturer at the Department of Obstetrics and Gynecology, Faculty of General Medicine, Yerevan State Medical University named after Mkhitar Heratsi; 0025; 2, Koryun str., Yerevan, Armenia; ORCID iD 0009-0000-2767-8995
Mariam A. Simonyan — Resident Doctor at the Department of Obstetrics and Gynecology, Faculty of General Medicine, Yerevan State Medical University named after Mkhitar Heratsi; 0025; 2, Koryun str., Yerevan, Armenia; ORCID iD 0009-0003-7251-1002
Lusine R. Abraamyan — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Faculty of General Medicine, Yerevan State Medical University named after Mkhitar Heratsi; 0025; 2, Koryun str., Yerevan, Armenia; ORCID iD 0009-0001-7013-3082
Irina Yu. Il’ina — Dr. Sc. (Med.), Professor of the Department of Obstetrics and Gynecology, Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0001-8155-8775
Contact information: Aznar S. Khachatryan, e-mail aznardoc@yahoo.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 07.07.2025.
Revised 30.07.2025.
Accepted 22.08.2025.
Информация с rmj.ru






