Содержание статьи
Актуальность
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти и инвалидизации населения во всем мире, несмотря на значительные успехи в лечении и профилактике [1]. В то же время хроническая сердечная недостаточность (ХСН), развивающаяся вследствие раннего постинфарктного ремоделирования левого желудочка (ЛЖ), занимает одно из первых мест в структуре смертности от ССЗ. Ремоделирование миокарда, возникающее после инфаркта миокарда (ИМ), обусловлено изменением структуры внеклеточного матрикса (ВКМ) [2]. В свою очередь, повышение уровня матриксных металлопротеиназ (ММП) взаимосвязано с ремоделированием ЛЖ, его дисфункцией и, как следствие, развитием ХСН.
Характер ремоделирования миокарда после ИМ зависит от степени поражения артериального русла, выраженности воспалительного ответа и многих других процессов, которые происходят во время формирования рубцовой зоны. В ответ на повреждение кардиомиоцитов запускается ряд защитных механизмов — воспаление, пролиферация и созревание клеток [3]. Каждый из них вносит свой вклад во временные изменения уровней ММП в миокарде. ММП в зоне формирования рубца секретируются различными клетками: нейтрофилами, макрофагами, эндотелиальными клетками, поврежденными кардиомиоцитами и фибробластами. Процессы, происходящие в некротизированном и ишемизированном миокарде, делают MMП ключевыми медиаторами в прогрессирующем ремоделировании миокарда ЛЖ [4–7].
Внеклеточный матрикс и процесс ремоделирования миокарда ЛЖ
Внеклеточный матрикс составляет основу соединительной ткани, обеспечивающей механический каркас клеток и транспорт химических веществ (табл. 1) [8].
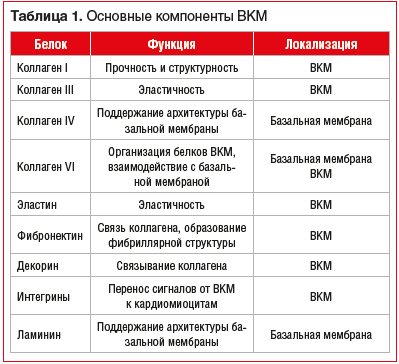
Благодаря трехмерно организованной структуре, которая взаимосвязана с волокнами миокарда, достигается прочность и эластичность ВКМ. Коллаген I типа составляет примерно 70–85% общей массы ВКМ и обеспечивает его прочность. Коллаген III типа составляет около 10% общего сердечного коллагена, обеспечивая эластичность ВКМ [9–13].
Ремоделирование миокарда при ИМ патофизиологически обусловлено гибелью кардиомиоцитов в результате длительной ишемии, которая приводит к активации ММП, что в свою очередь становится причиной деградации ВКМ, нарушающей структурную целостность. Все это в конечном счете приводит к снижению как систолической (из-за гибели кардиомиоцитов), так и диастолической (деградация ВКМ) функции [14].
Ремоделирование миокарда ЛЖ в области ИМ проходит в несколько этапов [15, 16]. Эти этапы (воспаление, пролиферация и отложение коллагена) последовательны и важны для ограничения зоны инфаркта. Исход ремоделирования миокарда зависит от выраженности каждого из этих этапов и их соотношения.
Гомеостаз кардиомиоцитов ухудшается сразу после ишемии, и уже через 30 мин клетки погибают, что в свою очередь провоцирует активацию нейтрофилов и макрофагов, т. е. острую воспалительную реакцию [17–19]. Нейтрофилы и макрофаги, проникая в область ИМ, высвобождают медиаторы воспаления, в т. ч. ММП и тканевой ингибитор металлопротеиназ. Примерно на 5-й день после ИМ начинает формироваться рубец, богатый коллагеном, восполняющий потерю кардиомиоцитов в области инфаркта [20].
Базальная мембрана кардиомиоцитов
В дополнение к коллагенам I и III типов, формирующим основу ВКМ, существуют белки, находящиеся в базальной мембране кардиомиоцитов: коллаген IV, V, VII, X и XIV типов, а также ламинин [10–13].
Базальная мембрана представляет собой плотную сеть различных белков, которая окружает кардиомиоциты, включает ламинин, коллаген IV типа и ряд протеогликанов [21, 22]. Она рассматривается как самостоятельная форма ВКМ, поскольку содержит коллаген IV типа, обнаруженный только в базальной мембране, и является слоем, отграничивающим ВКМ от кардиомиоцитов.
Фрагментация базальной мембраны происходит уже через 1 ч после ИМ и продолжается до 7 дней после реперфузии [23]. В исследованиях было показано увеличение толщины базальной мембраны, что способствует нарушению диффузии кислорода и возникновению гипоксического стресса [24]. Кроме того, после начала ИМ начинают вырабатываться антитела против коллагена IV типа, что также приводит к нарушению структурной целостности базальной мембраны и, следовательно, дисфункции эндотелиальных клеток [25]. В свою очередь, белки, образующиеся после распада ламинина, стимулируют заживление зоны некроза и ангиогенез [26]. Белки, являющиеся результатом деградации коллагена IV типа, напротив, играют критическую роль в подавлении ангиогенеза, нарушении структурной целостности сосудов и межклеточных взаимодействий после ишемического повреждения миокарда [27].
Матриксные металлопротеиназы
ММП представляют собой семейство цинкзависимых эндопептидаз, которые регулируют обмен белков соединительной ткани, а также влияют на процесс нормального развития и ремоделирования ВКМ. ММП широко изучаются в качестве маркеров для прогнозирования ремоделирования ЛЖ после ИМ и развития СН [28, 29]. Большое количество публикаций подчеркивают важность этого фермента в списке перспективных и важных биомаркеров, которые могут быть использованы для улучшения диагностики и повышения эффективности лечения ССЗ [30].
В таблице 2 перечислены наиболее изученные ММП и их биологические функции [8].
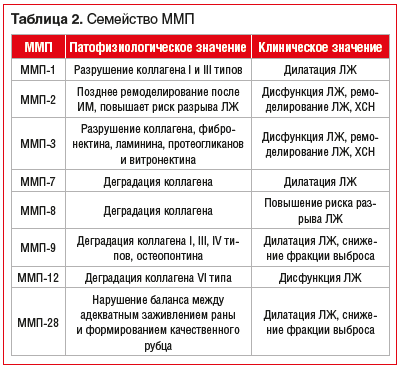
ММП-9, или желатиназа B, — одна из наиболее хорошо изученных протеаз, регулирующих патологические процессы ремоделирования. MMП-9 играет главную роль в деградации ВКМ при различных физиологических и патофизиологических процессах, которые включают ремоделирование ткани.
ММР-9 секретируется большим количеством клеток, включая кардиомиоциты, эндотелиальные клетки, нейтрофилы, макрофаги и фибробласты [30]. S. Blankenberg et al. первыми стали использовать ММП-9 в качестве нового прогностического биомаркера развития дисфункции ЛЖ и поздней выживаемости [31]. Вместе с другими исследователями [32] они показали взаимосвязь повышенного содержания MМП-9 с высокой концентрацией интерлейкина 6, C-реактивного белка и фибриногена в плазме, что свидетельствует о высоком прогностическом значении ММП-9.
I.B. Squire et al. [33] продемонстрировали, что увеличение содержания MMП-9 ассоциируется с большими объемами ЛЖ и дисфункцией ЛЖ после ИМ. Оценив количественный уровень ММП-9 в течение 5 дней после ИМ у 60 пациентов, авторы пришли к выводу, что, опираясь на уровень ММП-9, можно судить о характере ремоделирования миокарда после ИМ: чем он выше, тем хуже прогностический результат.
ММП-9 регулирует ремоделирование миокарда, непосредственно разрушая ВКМ и активируя цитокины и хемокины [30]. Воздействие ММП-9 является как вредным, так и полезным для регенерации зоны инфаркта. С одной стороны, под действием ММП-9 снижается фагоцитоз макрофагов и пролонгируется воспалительный ответ нейтрофилов, что приводит к увеличению ЛЖ после ИМ [34]. С другой стороны, происходит расщепление остеопонтина, что сопровождается образованием двух биологически активных пептидов, которые увеличивают скорость миграции фибробластов сердца, что, в свою очередь, ускоряет заживление инфарцированной зоны [35]. По этой причине использование ММП-9 в качестве диагностического маркера в различные дни после ИМ может помочь в прогнозировании и предотвращении дисфункции ЛЖ после ИМ.
Отдельно стоит отметить роль ММП-9 в разрушении коллагена базальных мембран кардиомиоцитов, в частности коллагена IV типа. В недавно опубликованной работе авторы, используя иммуногистохимический метод исследования, показали накопление ММП-9 в цитоплазме кардиомиоцитов, которое сочеталось с частичным или полным разрушением базальных мембран кардиомиоцитов, образованных коллагеном IV типа [36].
Заключение
ССЗ являются наиболее распространенной причиной смерти в развитых странах [37], а ИМ вносит значительный вклад в смертность от ССЗ [38]. По разным оценкам, распространенность ССЗ увеличится на 10% в течение следующих 20 лет и к 2030 г. станет причиной 23,6 млн смертей ежегодно во всем мире [39]. Кроме того, расходы на общественное здравоохранение в связи с ИМ увеличатся в 3 раза в течение следующих двух десятилетий [40].
После ИМ ЛЖ претерпевает ряд изменений на молекулярном и клеточном уровнях. Изменяется и ВКМ, со временем изменяя геометрию ЛЖ и нарушая его функцию [41]. Деградация ВКМ определяет прогноз в раннем и отдаленном периодах после ИМ [42]. Оценка ВКМ в различные периоды после ИМ может дать ранние диагностические или прогностические показатели ремоделирования ЛЖ и позволить группировать пациентов, учитывая их индивидуальные риски и дальнейшее лечение. В настоящее время используются различные биомаркеры для своевременной диагностики ИМ, однако их применение ограниченно
из-за отсутствия специфичности и селективности [43].
Определение роли MMП-9 в ремоделировании после ИМ является важной задачей [44]. Лучшее понимание патофизиологических процессов, в т. ч. биологической функции ММП-9, возможно, позволит разработать новые стратегии диагностики и лечения для пациентов, перенесших ИМ.
Биомаркеры ремоделирования ВКМ, которые возможно обнаружить при структурных изменениях во время ИМ, могут помочь в прогнозировании дальнейшего развития ХСН. В частности, одним из таких маркеров может выступать коллаген IV типа, находящийся в базальных мембранах кардиомиоцитов и разрушающийся под воздействием ММП-9. Одновременный анализ уровня ММП-9 и содержания коллагена IV типа в миокарде позволит ввести критерии прогноза выживаемости данной группы больных, определения тактики лечения, а также лучшего понимания процессов ремоделирования.
.
Информация с rmj.ru






