Роль и место антилейкотриеновых препаратов в лечении аллергических заболеваний
Г. А. Новик, доктор медицинских наук, профессор
ГБОУ ВПО СПбГПМУ МЗ РФ, Санкт-Петербург
Сегодня аллергические болезни входят в число самых распространенных хронических заболеваний. По данным Всемирной организации здравоохранения (ВОЗ) в мире насчитывается около 1 млрд людей, страдающих хроническими неинфекционными заболеваниями органов дыхания, из которых 300 млн больных бронхиальной астмой (БА), 400 млн больных аллергическим ринитом. В 2008 г. под эгидой ВОЗ Глобальный альянс по борьбе с хроническими респираторными заболеваниями (Global Alliance Against Chronic Respiratory Diseases, GARD) определил приоритетные направления, включающие сердечно-сосудистые заболевания, хронические респираторные заболевания, онкологию и сахарный диабет. Были сформулированы 6 задач, одной из которых является повышение значения и создание интегрированной профилактики и контроля заболеваний. Отдельно было подчеркнуто, что аллергия — один из известных факторов риска формирования хронических респираторных заболеваний [1].
«…Астма является хроническим воспалительным заболеванием, связанным с приходящей и изменяющейся по своей выраженности обструкцией дыхательных путей и гиперреактивностью бронхов, проявляющимся повторяющимися эпизодами хрипов, кашля, одышки и чувством стеснения в груди…» [2].
Создание и широкое использование в первую очередь ингаляционных глюкокортикостероидов (ИГКС) существенно повлияло на возможности достижения контроля течения заболевания. ИГКС, обладая мощным противовоспалительным действием, воздействуют на основные механизмы формирования БА.
В связи с высокой эффективностью ИГКС вполне правомочен вопрос, нужны ли другие препараты, способные подавить хроническое аллергическое воспаление у больных БА?
Несмотря на широкое использование ИГКС, у части больных не удается достигнуть контроля течения заболевания. В большинстве стран Европы больше половины пациентов с БА имеют неконтролируемое течение заболевания (рис. 1).
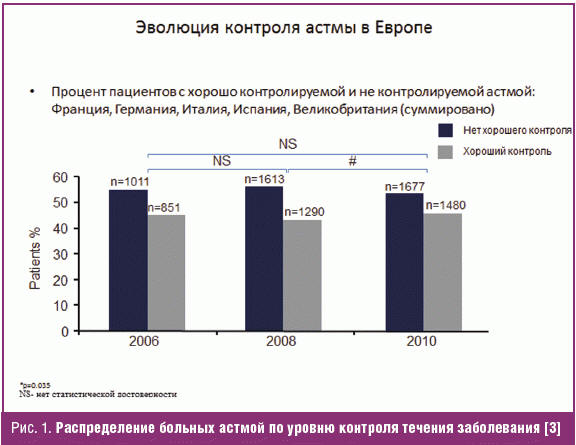
Причинами неконтролируемого течения БА являются отсутствие приверженности пациентов к проводимой базисной терапии, нежелание выполнить все предписания врача, отсутствие элиминации из окружения больного всех причинных аллергенов, поздняя диагностика и неадекватная терапия на ранних этапах заболевания, наличие различных фенотипов и эндотипов астмы, избирательная чувствительность к различным средствам базисной терапии астмы.
Согласно основным международным документам, регламентирующим тактику лечения детей с БА, к средствам базисной терапии, влияющим на хроническое воспаление дыхательных путей, относятся: глюкокортикостероиды, антагонисты лейкотриеновых рецепторов, пролонгированные ß2-агонисты в комбинации с ингаляционными глюкокортикостероидами, кромоны (кромоглициевая кислота, недокромил натрия), пролонгированные теофиллины и антитела к IgE. Пролонгированные ß2-агонисты могут лишь усиливать противовоспалительный эффект ИГКС и никогда не используются в качестве монотерапии астмы, кромоны по данным ряда исследований оказывают эффект, близкий к плацебо, а пролонгированные теофиллины редко используются у детей в связи с выраженными побочными действиями (Международный консенсус по астме у детей (ICON, International Consensus on Pediatric Asthma), 2012).
В области лечения БА в последнем десятилетии успешно прошли испытания две группы препаратов: это антилейкотриеновые препараты (АЛТП) и анти-IgE-препараты.
К АЛТП относятся:
1) ингибиторы 5-липооксигеназы (5-LO, биосинтез лейкотриенов): зилейтон (Зифло)*, используется главным образом в США;
2) цистеиниловые лейкотриеновые (CysLT1) антагонисты: монтелукаст (Сингуляр), зафирлукаст (Аколат) и пранлукаст (Онон)**.
Проводятся клинические исследования (еще нет в клинической практике) так называемых ингибиторов FLAP, которые препятствуют 5-LO-активации белков.
АЛТП классифицируются как препараты, контролирующие течение БА, и характеризуются высокой эффективностью контроля течения БА у детей [1, 36].
Показания к назначению антагонистов лейкотриеновых рецепторов:
- профилактика и длительное лечение БА, включая предупреждение дневных и ночных симптомов заболевания у взрослых и детей с 2 лет;
- лечение аспиринчувствительных пациентов с БА;
- предупреждение бронхоспазма, вызванного физической нагрузкой;
- возможность использования препаратов из группы ингибиторов лейкотриеновых рецепторов в комбинации с любым базисным препаратом, а также возможность использования их как монотерапии при легкой персистирующей форме БА у детей;
- купирование дневных и ночных симптомов сезонных аллергических ринитов (у взрослых и детей с 2-летнего возраста) и постоянных аллергических ринитов (у взрослых и детей с 2-летнего возраста).
Согласно международным согласительным документам антагонисты лейкотриеновых рецепторов используются начиная с 1-й ступени терапии в качестве монотерапии или со 2-й ступени терапии в комбинации с ИГКС (рис. 2).

Лейкотриены являются одними из основных медиаторов формирования хронического воспаления дыхательных путей у больных БА. Бронхоспазм, который вызывают лейкотриены, в 1000 раз более мощный, чем гистамин. Лейкотриены вызывают повышение проницаемости сосудов, увеличение продукции и секреции слизистыми железами дыхательных путей, увеличение клеточной инфильтрации слизистой оболочки дыхательных путей, ремоделирование бронхов. Ремоделирование бронхов характеризуется массовой гибелью эпителиальных клеток, большим количеством слизистых пробок в бронхах, утолщением базальной мембраны, гипертрофией и гиперплазией бокаловидных клеток и серозных желез, гипертрофией гладких мышц стенки бронхов (более чем на 200%), активным ангионеогенезом [4, 5].
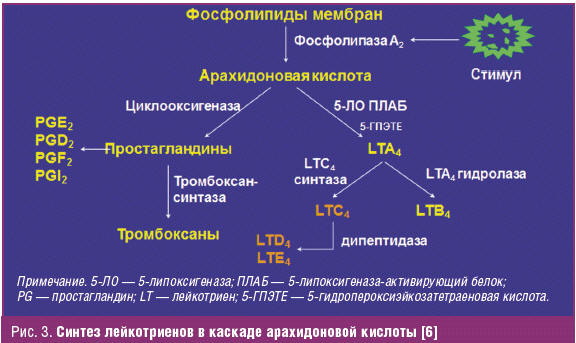
Лейкотриены образуются при взаимодействии фермента 5-липоксигеназы (5-ЛО) и 5-липоксигеназа-активирующего белка (ПЛАБ) (рис. 3). В результате этого взаимодействия арахидоновая кислота (высвобождающаяся в ответ на различные стимулы) превращается в 5-гидропероксиэйкозатетраеновую кислоту (5-ГПЭТЕ), затем в лейкотриен A4 (LTA4), отличающийся крайней нестабильностью. В дальнейшем под действием LTA4 гидролазы нейтрофилов, моноцитов периферической крови и альвеолярных макрофагов он превращается в лейкотриен B4 (LTB4) или происходит его конъюгация с образованием лейкотриена C4 (LTC4). Дальнейшее превращение LTC4 в лейкотриен D4 (LTD4), а затем LTD4 в лейкотриен E4 (LTE4) катализируется широко распространенными в тканях и циркулирующими в крови ферментами — соответственно гамма-глутамилтранспептидазой и дипептидазой. LTC4, LTD4 и LTE4 называют цистеиниловыми лейкотриенами (старое название этой группы лейкотриенов — медленно реагирующая субстанция анафилаксии), так как в их состав входит цистеин. Цистеиниловые лейкотриены, являясь ключевыми медиаторами в патогенезе БА, повышают продукцию слизи, вызывают развитие отека, эозинофилию и бронхоспазм. LTB4 играет менее важную роль в патогенезе БА. К основным биологическим эффектам LTB4 относятся влияние на хемотаксис и иммуномодуляция. Лейкотриены синтезируются в активированных эозинофилах, нейтрофилах, тучных клетках, моноцитах и макрофагах. В активированных эозинофилах и тучных клетках преимущественно образуется LTC4, в то время как моноциты и макрофаги синтезируют как LTB4, так и LTC4. Цистеиниловые лейкотриены LTC4, LTD4 и LTE4 вырабатываются у чувствительных лиц в ответ на различные стимулы, в том числе аллергены, физическую нагрузку и Аспирин. LTA4 образуется и высвобождается многими клетками, и в дальнейшем он превращается при участии других клеток в LTB4 и/или цистеиниловые лейкотриены. Как для ранней, так и для поздней фазы аллергического ответа характерно индуцированное аллергеном высвобождение цистеиниловых лейкотриенов из клеток воспаления, в том числе тучных клеток, эозинофилов, базофилов, макрофагов и моноцитов [6].
Цистеиниловые лейкотриены (LTC4, LTD4, LTE4) участвуют в развитии бронхиальной обструкции, гиперреактивности и образовании воспалительного экссудата в дыхательных путях при БА благодаря четырем основным механизмам:
- привлечение эозинофилов в дыхательные пути — важный этап патогенеза БА, сопровождающийся повреждением эпителия и повышением бронхиальной реактивности;
- повышение проницаемости микрососудов, приводящее к экссудации плазмы в бронхиальную стенку и просвет и формированию отека;
- увеличение секреции слизи, которая вместе с белками плазмы и распадающимися клетками образует слизистые пробки;
- выраженный бронхоспазм, обусловленный констрикторным действием лейкотриенов на гладкомышечные клетки дыхательных путей. Кроме того, цистеиниловые лейкотриены могут способствовать гипертрофии и ремоделированию гладкой мускулатуры бронхов [6, 15].
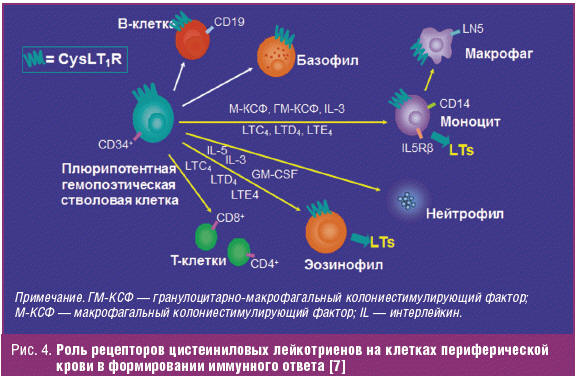
Эффекты цистеиниловых лейкотриенов опосредуются рецепторами. У человека найдены, по меньшей мере, два вида таких рецепторов (подтипы 1 и 2). Рецептор к цистеиниловым лейкотриенам 1-го подтипа (CysLT1) — это основной рецептор, опосредующий эффекты цистеиниловых лейкотриенов при БА. Рецепторы CysLT1 были обнаружены в перибронхиальных гладкомышечных клетках и ключевых клетках воспаления: эозинофилах, моноцитах и макрофагах, B-клетках, а также клетках-предшественниках CD34+ (плюрипотентные гемопоэтические стволовые клетки).
У пациентов с атопической БА обнаружены повышенные уровни CD34+ клеток в слизистой бронхов. Экспрессия на этих клетках рецептора CysLT1 позволяет предположить, что при определенных условиях лейкотриены могут воздействовать на пути дифференцировки CD34+ клеток в различные виды клеток воспаления. Цистеиниловые лейкотриены могут подготавливать клетки-предшественники CD34+ к созреванию с образованием эозинофилов, моноцитов, макрофагов и определенных лимфоцитарных клеток периферической крови. При обострении БА лейкотриены, образованные в легких при участии эозинофилов и макрофагов, могут активировать рецепторы CysLT1 гладкой мускулатуры бронхов, вызывая бронхоспазм. Кроме того, цистеиниловые лейкотриены могут усиливать непосредственное повреждение легочной ткани и расширять популяции клеток воспаления в легких вследствие аутокринного и паракринного воздействия на рецепторы CysLT1, расположенные на интерстициальных предшественниках гранулоцитов, эозинофилов и/или макрофагов. Такой механизм положительной обратной связи может объяснять наблюдаемые в клинических условиях прогрессирующие бронхоспазм и воспаление, характерные для БА [7, 14].
Согласно современным представлениям БА рассматривают как гетерогенное заболевание, имеющее множество фенотипов. Выделяют эозинофильный, нейтрофильный и пауцигранулоцитарный (обедненный по клеточным элементам) фенотипы.
При эозинофильном фенотипе БА ключевой клеткой воспаления является эозинофил, активация которой происходит под влиянием интерлейкина 5 (ИЛ-5), образующегося после взаимодействия аллергена и Т-хелперов 2 (Th2) клеток. Активированный эозинофил высвобождает эозинофильный катионный белок (ECP), основной белок эозинофилов (MBP) и матриксную металлопротеиназу-9 (MMP9) с формированием аллергического воспаления дыхательных путей у больных БА. При нейтрофильном воспалении ключевыми клетками являются макрофаги и эпителиальные клетки. Высвобождающийся из этих клеток интерлейкин 8 (ИЛ-8) приводит к привлечению к месту воспаления нейтрофилов с высвобождением нейтрофильных факторов, приводящих и поддерживающих воспаление бронхов у больных БА. Использование ИГКС приводит у больных БА к подавлению в первую очередь эозинофильного воспаления. Нейтрофильное воспаление у больных БА значительно хуже реагирует на использование данной группы базисных препаратов. В ряде исследований было показано, что монтелукаст в терапевтической дозе подавляет воспаление в дыхательных путях у больных БА, вызванное не только эозинофилами и моноцитами, но и кортикостероид-нечувствительными нейтрофилами [8].
Для воздействия на разные звенья каскада арахидоновой кислоты были разработаны различные классы лекарственных препаратов. К ингибиторам синтеза лейкотриенов относятся ингибиторы 5-ЛО, которые напрямую блокируют каталитическую активность 5-ЛО, а также ингибиторы ПЛАБ, которые вытесняют арахидонат из места связывания с молекулой ПЛАБ и препятствуют поступлению арахидоната — субстрата для синтеза лейкотриенов — к 5-ЛО. Антагонисты рецепторов цистеиниловых лейкотриенов селективно угнетают активность цистеиниловых лейкотриенов на рецепторе LTD4 [9–11]. К этому классу относятся монтелукаст, пранлукаст и зафирлукаст [12].
Хотя считается, что кортикостероиды угнетают образование фосфолипазы A2, тем самым предотвращая формирование всех продуктов арахидонового каскада, исследования показали, что они не оказывают влияния на стимулированное аллергеном высвобождение цистеиниловых лейкотриенов в жидкость бронхоальвеолярного лаважа у пациентов с БА [14].
Z. Csoma с соавт. (2002) исследовали воспаление в дыхательных путях у детей с БА с помощью измерения уровней цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха. В исследование включали детей в возрасте 7–14 лет, в том числе детей без БА и атопии (контрольная группа), детей с легкой интермиттирующей БА, детей с легкой, среднетяжелой и тяжелой персистирующей БА, получавших ИГКС. Исследование конденсата выдыхаемого воздуха показало, что у детей с персистирующей БА уровни цистеиниловых лейкотриенов были статистически значимо выше, чем у здоровых детей. У детей с легкой интермиттирующей БА уровни цистеиниловых лейкотриенов статистически значимо не отличались от уровней у здоровых детей. На фоне терапии ИГКС уровни цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха были повышены у детей с легкой, среднетяжелой и тяжелой БА. Таким образом, дозы ИГКС, обеспечивающие контроль клинических проявлений БА у детей, могут не полностью угнетать воспалительный процесс. Длительное лечение астмы ИГКС, не обеспечивая явного угнетения синтеза лейкотриенов, может приводить к дальнейшему высвобождению медиаторов воспаления, участвующих в привлечении клеток воспаления и, тем самым, поддержании хронического воспаления в дыхательных путях [16].
В другом открытом перекрестном исследовании с двумя периодами участвовали 23 ребенка в возрасте 6–11 лет, страдавших среднетяжелой БА, имевших значение объема форсированного выдоха за первую секунду (ОФВ1) 60–85% от должного. При этом прирост ОФВ1 после ингаляции ß-агониста у включенных в это исследование больных составил ≥ 12%. После двухнедельного вводного периода детям назначали терапию монтелукастом (таблетка 5 мг один раз в сутки) или кромолином (2 ингаляции по 1 мг 4 раза в сутки) в течение 4 недель с последующим периодом «отмывки» между разными видами терапии продолжительностью 2 недели. По потребности применялись ß2-агонисты. До и после лечения каждого вида измеряли концентрации LTC4 в смывах со слизистой полости носа. Терапия монтелукастом в течение 4 недель приводила к статистически значимому снижению концентраций LTC4 (p < 0,005), а применение кромолина сопровождалось статистически не значимым увеличением концентраций. На следующем этапе исследования дети, получавшие ранее монтелукаст, стали ингалировать кромоны, а дети, получавшие кромоны, стали получать монтелукаст. У детей, которые сначала получали монтелукаст, уровни LTC4 не вернулись к исходным в течение периода «отмывки» и оставались низкими на протяжении периода лечения кромолином. У детей, которые сначала получали кромолин, уровни LTC4 вернулись к исходным в период «отмывки», затем произошло их дальнейшее уменьшение на фоне терапии монтелукастом. Во время лечения монтелукастом 75% детей использовали ß2-агонист < 2 ингаляций в сутки. На фоне лечения кромолином такая потребность в ß2-агонистах отмечалась только у 27% детей (p < 0,04). Ни у одного ребенка не развилось обострения БА во время приема монтелукаста, а на фоне терапии кромолином у двух детей отмечены обострения, приведшие к исключению их из исследования. В данном исследовании было показано, что монтелукаст угнетал высвобождение лейкотриенов в дыхательных путях детей с персистирующей БА, а прием кромонов не приводил к снижению образования лейкотриенов и контролю течения заболевания [17].
С. Lex с соавт. (2006) измеряли уровни цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха у детей 4–15 лет, страдавших среднетяжелой и тяжелой персистирующей БА. Помимо оценки функции внешнего дыхания у больных определяли концентрацию цистеиниловых лейкотриенов в выдыхаемом воздухе, проводилась бронхоскопия и биопсия слизистой бронхов. Все обследуемые (24 ребенка) получали ИГКС в дозе > 400 мкг. Часть детей получала дополнительную терапию системными кортикостероидами перед бронхоскопией. Монтелукаст получали 10 из 24 больных, включенных в данное исследование. Результаты исследования конденсата выдыхаемого воздуха показали, что концентрации цистеиниловых лейкотриенов у детей, получавших монтелукаст, были значительно ниже, чем у тех детей, которые получали только ИГКС (p = 0,004). Кроме того, в группе терапии ИГКС отмечена статистически значимая корреляция концентраций цистеиниловых лейкотриенов со степенью утолщения ретикулярной базальной мембраны, отражающая степень ремоделирования бронхов (p = 0,003) [18].
Хорошо известен факт нарастания частоты обращений для оказания экстренной помощи детей с БА в осенне-зимний период в связи с увеличением частоты острых респираторных инфекций в этот сезон. Изучение эффективности монтелукаста для профилактики обострений БА, индуцированной вирусной инфекцией (исследование PREVIA), было проведено, чтобы оценить влияние терапии монтелукастом в течение 12 месяцев по сравнению с плацебо на симптомы БА, связанные с простудными заболеваниями, у детей в возрасте 2–5 лет, страдающих БА.
PREVIA — это многоцентровое рандомизированное двойное слепое плацебо-контролированное исследование в параллельных группах продолжительностью 12 месяцев. После двухнедельного вводного периода (пациенты принимали плацебо, не зная, какой препарат принимают) соответствующие критериям включения пациенты были рандомизированы двойным слепым методом в группы терапии монтелукастом или плацебо на протяжении 12 месяцев. Монтелукаст назначали в виде жевательной таблетки 4 мг один раз в сутки перед сном. Критерием включения в исследование был возраст (от 2 до 5 лет), в анамнезе наличие не менее трех обструкций на фоне ОРИ, требовавших применения ß-агониста, длительностью ≥ 3 дней, развившихся за последние 12 месяцев, и если хотя бы один из этих эпизодов развился в течение 6 месяцев перед включением. Кроме того, пациенты должны были страдать легкой БА. По сравнению с плацебо монтелукаст статистически значимо снижал частоту обострений (32%, p ≤ 0,001). Рассчитанная частота обострений составила 1,60 эпизода в год в группе монтелукаста по сравнению с 2,34 эпизода в год в группе плацебо. В результате исследования был сделан вывод, что у детей с БА в возрасте 2–5 лет монтелукаст в дозе 4 мг является эффективным, удобным и хорошо переносимым средством достижения контроля над БА, обеспечивая уменьшение выраженности дневных и ночных симптомов БА и уменьшение частоты обострений [19].
Продукты метаболизма арахидоновой кислоты имеют существенное значение в развитии астмы, индуцированной физической нагрузкой. Использование антилейкотриеновых препаратов предупреждает развитие бронхоспазма, вызванного физической нагрузкой [20]. В исследовании, проведенном J. P. Kemp и соавт. (1998), монтелукаст предупреждал бронхоконстрикцию, вызванную физической нагрузкой, у детей 6–14 лет. Целью этого двойного слепого рандомизированного плацебо-контролируемого перекрестного исследования с двумя периодами, включавшего 27 детей с астмой 6–14 лет, являлась оценка влияния монтелукаста по сравнению с плацебо на бронхоконстрикцию, обусловленную физической нагрузкой. Дети, включенные в исследование, имели снижение ОФВ1 ≥ 20% после стандартизованной нагрузки на тредмиле до начала терапии. Во время каждого периода исследования дети получали монтелукаст 5 мг или плацебо 1 раз в сутки вечером в течение 2 дней. Провокационный тест со стандартизованной нагрузкой проводили вечером примерно через 20–24 ч после приема второй дозы исследуемого препарата. Длительность периода вымывания между периодами исследования составляла ≤ 4 дней. По сравнению с плацебо монтелукаст обусловливал статистически значимое уменьшение выраженности падения ОФВ1 (–18%) по сравнению с –26% (p = 0,009). Кроме того, время восстановления ОФВ1 к значению до нагрузки на фоне терапии монтелукастом было меньше, чем на фоне плацебо (соответственно 18 минут и 28 минут) [21].
Аллергический ринит — частое сопутствующее заболевание у больных БА. Изолированный аллергический ринит увеличивает риск развития астмы. Клинические исследования монтелукаста показали его эффективность при монотерапии сезонного аллергического ринита, сопоставимую с эффективностью антигистаминных препаратов нового поколения. В случае комбинации препаратов этих групп эффективность терапии сопоставима с эффективностью лечения интраназальными стероидами. В случае легкого течения аллергического ринита монтелукаст может быть препаратом выбора. Отмечается улучшение качества жизни и у больных с симптомами риноконъюнктивита [31, 32]. Также обосновано применение данной группы препаратов при бронхиальной астме, сопровождающейся аллергическим ринитом.
Аспириновая астма диагностируется у детей очень редко. Это связано с тем, что классическая триада симптомов (астма, полипозные образования в придаточных пазухах носа и непереносимость нестероидных противовоспалительных препаратов) появляется в более старшем возрасте и редко симптомы появляются одновременно. Однако у детей с неатопической астмой следует всегда исключать аспириновую астму, даже если нет всей классической симптоматики, характеризующей данную форму у взрослых. Кроме того, не следует забывать, что возможно сочетание как аллергической, так и аспириновой астмы у одного больного. У больных с аспириновой астмой отмечается повышенный синтез цистеиниловых лейкотриенов. В качестве базисной терапии следует использовать ИГКС в сочетании с АЛТП. Назначение АЛТП уменьшает рост назальных полипов. К лучшему ответу на АЛТП предрасположены больные с БА, имеющие «мутации» в промоторной зоне гена, кодирующего LTC4 синтазу [22].
Другой редко диагностируемой формой астмы является «кашлевая» астма (CVA). Длительно кашляющие дети представляют собой достаточно большую группу больных, имеющих различные заболевания. Диагностировать данную форму астмы следует согласно имеющимся критериям, опубликованным в международных согласительных документах Всемирной инициативы по борьбе с бронхиальной астмой (Global Initiative for Asthma, GINA). Подбор терапии таким детям не всегда прост, и к диагнозу аллергического поражения бронхов врач подходит, как правило, исключив другие заболевания.
По данным Т. Kita с соавт. (2010), обследовавшего 75 больных с «кашлевым» вариантом астмы, монтелукаст может эффективно использоваться для лечения в качестве монотерапии [23]. У больных CVA 2-недельное лечение монтелукастом, кленбутеролом и монтелукастом плюс кленбутерол оказалось эффективным. В группе больных, получающих монтелукаст в комбинации с кленбутеролом, значение пиковой скорости выдоха (ПСВ) в утренние и в вечерние часы значительно увеличились после 2 недель лечения по сравнению со значениями ПСВ до лечения. У пациентов с аллергическим трахеобронхитом 2-недельное лечение монтелукастом, кленбутеролом и комбинацией «монтелукаст плюс кленбутерол» оказалось неэффективным и достоверных различий получено не было.
У больных с легкой персистирующей астмой или на 1-й ступени в качестве базисного препарата можно использовать либо низкие дозы ИГКС, либо АЛТП [2]. Исследование MOSAIC ставило перед собой цель сравнить уровень контроля астмы, достигнутый на фоне терапии пероральным монтелукастом и низкими дозами ингаляционного флутиказона по проценту дней без применения препаратов по экстренным показаниям через 1 год лечения у детей в возрасте 6–14 лет при легкой персистирующей БА. Исследование MOSAIC являлось рандомизированным одногодичным двойным слепым исследованием в двух параллельных группах. После 4 недель простого слепого вводного периода, в течение которого пациенты получали плацебо, пациентов рандомизировали в соотношении 1:1 в группы терапии: либо монтелукаст 5 мг в виде жевательной таблетки один раз в сутки перед сном или флутиказон 2 ингаляции 50 мкг 2 раза в сутки. Длительность лечения составляла 1 год. Все пациенты могли использовать ß2-агонисты короткого действия по требованию или пероральные стероиды. Интервалы между визитами в клинику составляли 4 месяца. Оценка контроля астмы проводилась с помощью раздела «контроль» Педиатрического опросника для оценки терапии астмы — PATAQ (Control domain of the Paediatric Asthma Therapy Assessment Questionnaire). Доля пациентов без приступов астмы составила 67,8% в группе монтелукаста и 74,4% в группе флутиказона. Отношение рисков составило 1,38 в пользу флутиказона (95% ДИ: 1,04, 1,84). В двух группах отмечены сходные изменения ОФВ1 по сравнению с исходным уровнем: ОФВ1 увеличился после лечения как в группе монтелукаста, так и в группе флутиказона. В среднем использование ß2-агониста снизилось с 7,0 (исходно) до 2,6 ингаляции в неделю после терапии монтелукастом и с 7,2 до 2,3 ингаляции в группе флутиказона (статистически достоверной разницы нет). Средняя доля дней использования ß2-агониста уменьшилась с 38,0% (исходно) до 15,4% (после лечения) в группе монтелукаста и с 38,5% до 12,8% в группе флутиказона. После терапии монтелукастом количество эозинофилов периферической крови снизилось как в группе монтелукаста, так и в группе флутиказона (без статистически достоверной разницы).
Результаты исследования MOSAIC показали, что у детей в возрасте 6–14 лет с легкой персистирующей астмой монтелукаст был сопоставим с флутиказоном по увеличению доли дней без терапии астмы по экстренным показаниям. Оба препарата в целом хорошо переносились [24].
Для оценки приверженности к терапии в современной медицинской литературе используются ряд терминов: «сompliance», «adherence», «concordance».
Комплаенс («сompliance» — «приверженность») описывает степень, в которой пациент следует назначениям при приеме лекарств. Есть еще термин «соблюдение» («adherence»), который обладает меньшим количеством негативных смысловых связей («отцовская» модель отношений вместо партнерской). Альтернативный термин «concordance» («соответствие», «идентичность»), предложенный с целью отразить суть лечения как достижение общей цели врача и пациента, не получил широкого распространения. По мнению большинства исследователей, недостаточная приверженность к терапии БА ухудшает контроль над болезнью [25], увеличивает риск госпитализации [26], а также смертность, связанную с астмой [27], приводит к необоснованному увеличению дозировки лекарства или назначению дополнительного лечения, усложняя режим приема лекарств и увеличивая стоимость лечения [28]. Несоблюдение больными предписанного режима обходится американской системе здравоохранения в $300 млрд/год [29].
Достаточно интересные результаты были получены при сравнении использования таблетированного препарата (монтелукаст) и ИГКС (беклометазон) в виде дозированного ингалятора. Цель исследования была оценить предпочтения/приверженность терапии при сравнении монтелукаста и ИГКС. Было обследовано 124 ребенка с астмой в возрасте 6–14 лет. Фаза наблюдения составила 6 месяцев [30]. Дети, участвовавшие в исследовании, чаще выполняли назначения по применению монтелукаста, чем беклометазона. Средняя доля дней, в течение которых пациенты полностью выполняли назначения, составила 98% в группе монтелукаста и 83% в группе беклометазона. Различия между группами достигали 15% и были статистически значимыми (p < 0,001).
Выводы
- Антилейкотриеновые препараты облегчают симптомы БА и являются препаратами для базисной терапии этого заболевания.
- Монтелукаст рекомендован пациентам, страдающим астмой с сопутствующим аллергическим ринитом.
- С позиции доказательной медицины антагонисты лейкотриеновых рецепторов включаются в качестве монотерапии детей с легкой персистирующей БА.
- Монтелукаст приводит к значительному улучшению контроля БА у детей (в том числе и у детей 2–5 лет).
- Монтелукаст снижает частоту обострений БА, обусловленных вирусной инфекцией, у детей в возрасте 2–5 лет с интермиттирующей БА.
- Монтелукаст предупреждает бронхоспазм, вызванный физической нагрузкой или холодным воздухом.
- Обладает противовоспалительным эффектом, комплементарным действию глюкокортикостероидов.
Литература
- 2008–2012 Action Plan for the Global Strategy for the Prevention and Control of Noncommunicable Diseases. WHO. 2008.
- International consensus on (ICON) pediatric asthma. John Wiley & Sons A/S. 2012.
- Demoly P., Annunziata K., Gubba E., Adamek L. Repeated cross-sectional survey of patient-reported asthma control in Europe in the past 5 years // Eur Respir Rev. 2012; 21: 66–74.
- Ghosh G., Manglik A. K., Roy S. Efficacy and Safety of Montelukast as Monotherapy in Children with Mild Persistent Asthma // Indian Pediatrics. 2006; v. 43: 780–785.
- Pelkonen A. S., Malmstrom K., Sarna S., Kajosaari M., Klemola T., Malmberg L. P., Makkela M. J. The effect of montelukast on respiratory symptoms and lung function in wheezy infants // Eur Respir J. 2013; 41: 664–670.
- Holgate S. T., Bradding P., Sampson A. P. Leukotriene antagonists and synthesis inhibitors: new directions in asthma therapy // J Allergy Clin Immunol. 1996; 98: 1–13.
- Figueroa D. J., Breyer R. M., Defoe S. K. Expression of the cysteinyl leukotriene 1 receptor in normal human lung and peripheral blood leukocytes // Am J Respir Crit Care Med. 2001; 163 (1): 226–233.
- Tintinger G. R., Feldman C., Theron A. J., Anderson R. Montelukast: More than a Cysteinyl Leukotriene Receptor Antagonist? // The Scientific World Journal. 2010, v. 10, 2403–2413.
- Holgate S. T., Peters-Golden M. Introduction: the antiinflammatory role of cysteinyl leukotriene receptor antagonists in asthma // J Allergy Clin Immunol. 2003; 111 (suppl 1): S1–4.
- Krawiec M. E., Wenzel S. E. Leukotriene inhibitors and nonsteroidaltherapies in the treatment of asthma // Expert Opin Pharmacother. 2001; 2 (1): 47–65.
- Drazen J. M. Anti-leukotrienes as novel anti-infl amatory treatments in asthma // Adv Exp Med Biol. 2002; 507: 217–221.
- Parameswaran K., Liang H., Fanat A., Watson R., Snider D. P., O’Byrne P. M. Role for cysteinyl leukotrienes in allergeninduced change in circulating dendritic cell number in asthma // J Allergy Clin Immunol. 2004; 114 (1): 73–79.
- Jeffery P. K. The roles of leukotrienes and the effects of leukotriene receptor antagonists in the infl ammatory response and remodelling of allergic asthma // Clin Exp Allergy Rev. 2001; 1 (2): 148–153.
- Wenzel S. E. The role of leukotrienes in asthma // Prostaglandins Leukot Essent Fatty Acids. 2003; 69 (2–3): 145–155.
- Shibata A., Katsunuma N., Tomikawa M., Tan A., Yuki K., Akashi K., Eto Y. Increased Leukotriene E4 in the Exhaled Breath Condensate of Children With Mild Asthma // Chest. 2006; 130: 1718–1722.
- Increased Leukotriene E4 in the Exhaled Breath Condensate of Children With Mild Asthma. CHEST 2006; 130: 1718–1722.
- Csoma Z., Kharitonov S. A., Barnes P. J. et al. Increased leukotrienes in exhaled breath condensate in childhood asthma // Am J Respir Crit Care Med. 2002; 166: 1345–1349.
- Volovitz B., Tabachnik E., Nussinovitch M., Shtaif B., Blau H., Gil-Ad I., Weizman A., Varsano I. Montelukast, a leukotriene receptor antagonist, reduces the concentration of leukotrienes in the respiratory tract of children with persistent asthma // J Allergy Clin Immunol. 1999, 104: 1162–1167.
- Lex C., Zacharasiewicz A., Payne D., Wilson N. M., Nicholson A, Kharitonov S. A., Barnes P. J., Bush A. Exhaled breath condensate cysteinyl leukotrienes and airway remodeling in childhood asthma: a pilot study // Respiratory Research. 2006, 7: 63–69.
- Bisgaard H., Zielen S., Garcia M., Johnston S. L., Gilles L., Menten J., Tozzi C. A., Polos P. Montelukast Reduces Asthma Exacerbations in 2-to 5-Year-Old Children with Intermittent Asthma // Am J Respir Crit Care Med. 2005, v. 171, p. 315–322.
- Small I., Moreira A., Couto M. Practical approach to managing exercise-induced asthma in children and adults // Prim Care Respir J. 2013; 22 (1): 126–129.
- Kemp J. P., Dockhorn R. J., Shapiro G. G. Montelukast once daily inhibits exercise-induced bronchoconstriction in 6-to 14-year-old children with asthma // J. Pediatr. 1998; 133: 424–428.
- Mastalerz L., Ni?ankowska E., Sanak M. et al. Clinical and genetic features underlying the response of patients with bronchial asthma to treatment with a leukotriene receptor antagonist // Eur J Clin Inves. 2002; 32: 949–955.
- Kita T., Fujimura M., Ogawa H., Nakatsumi Y., Nomura S. Antitussive effects of the leukotriene receptor antagonist montelukast in patients with cough variant asthma and atopic cough // Allergology Internetional. 2010; 59 (2): 185–192.
- Garcia M. L., Wahn U., Gilles L., Swern A., Tozzi C. A., Polos P. Montelukast, Compared With Fluticasone, for Control of Asthma Among 6-to 14-Year-Old Patients With Mild Asthma: The MOSAIC Study // Pediatrics. 2005, v. 116, № 2, 360–369.
- Bender B., Zhang L. Negative affect, medication adherence, and asthma control in children // Journal of Allergy and Clinical Immunology. 2008, v. 122, № 3, p. 490–495.
- Bender B., Milgrom H., Rand C., Ackerson L. Psychological factors associated with medication nonadherence inasthmatic children // Journal of Asthma. 1998, v. 35, № 4, p. 347–353.
- Robertson C. F., Rubinfeld A. R., Bowes G. Pediatric asthma deaths in Victoria: the mild are at risk // Pediatric pulmonology. 1992, v. 13, № 2, p. 95–100.
- Cramer J. A. Feedback on medication dosing enhances patient compliance // Chest. 1993, v. 104, № 2, p. 333–334.
- Bender B. G., Rand C. Medication non-adherence and asthma treatment cost // Current Opinion in Allergy and Clinical Immunology. 2004, v. 4, № 3, p. 191–195.
- Lagos J. A, Marshall G. D. Montelukast in the management of allergic rhinitis / Therapeutics and Clinical Risk Management 2007:3 (2), p. 327–332
- Chowdhury M. A. N., Uddin M. S., Das S., Hoque M. Montelukast in Allergic Rhinitis: A Review / Medicine tiday 2012 Volume 24 Number 02, p. 75–78
- Brozek J. L., Bousquet J., Baena-Cagnani C. E., Bonini S., Canonica G. W., Casale T. B., van Wijk R. G., Ohta K., Zuberbier T., Scheunemann H. J. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 Revision // J Allergy Clin Immunol. 2010; 126: 466–476.
- Pedinoff A. P. G, Vandormael K., Ty mofyeyev Y., Smugar S. S., Reiss T. F., Korenblat P. E. A phase I randomized, placebo-controlled, dose-exploration study of single-dose inhaled montelukast in patients with chronic asthma // J Asthma. 2010, 47 (10): 1078–1084. Epub 2010 Nov 3.
- Majak P. Montelukast treatment may alter the early efficacy of immunotherapy in children with asthma // J Allergy Clin Immunol. 2010; 125: 1220–1227.
- Sicherer S. H. Clinical aspects of gastrointestinal allergy in childhood // Pediatrics. 2003; 111: 1609–1616.
- Capsomidis A., Tighe M. Is oral montelucast beneficial in treating acute asthma exacerbations in children? // Arch Dis Child. 2010, 95: 948–950.
* Зилейтон в РФ не зарегистрирован.
** Пранлукаст в РФ не зарегистрирован.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






