Введение
В структуре смертности от хронических неинфекционных заболеваний наибольшая доля приходится на болезни системы кровообращения, которые являются главной причиной смертности как в мире, так и в Российской Федерации. Артериальная гипертензия (АГ) является ведущим модифицируемым фактором риска сердечно-сосудистых заболеваний (ССЗ) – инфаркта миокарда (ИМ), острого нарушения мозгового кровообращения (ОНМК), ишемической болезни сердца (ИБС) и их осложнений. Имеется устойчивая связь между уровнем артериального давления (АД) и риском сердечно-сосудистых осложнений (ССО), в том числе фатальных, данная связь постоянна и не зависит от других факторов риска [1]. По результатам исследования ЭССЕ-РФ3 распространенность АГ в Российской Федерации составляет 53,9%, охват лечением — 63,4%, при этом эффективно лечатся лишь 44% пациентов [2]. АГ является причиной существенных финансовых затрат системы здравоохранения РФ. Значительны также и экономические потери, связанные с недопроизводством валового внутреннего продукта по причине преждевременной смертности лиц трудоспособного возраста, заболеваемости и инвалидизации населения вследствие ССЗ в целом [3, 4].
В XXI в. в Российской Федерации проведена радикальная реорганизация системы оказания медицинской помощи больным с ССЗ. За время реализации в 2019–2024 гг. федерального проекта «Борьба с сердечно-сосудистыми заболеваниями», являющегося одним из составляющих Национального проекта «Здравоохранение», были внедрены современные методы лечения ССЗ как на амбулаторном, так и на стационарном этапе для жителей всех регионов Российской Федерации. Итогом этих масштабных преобразований стало снижение смертности населения от болезней системы кровообращения в 2023 г. до 557 на 100 тыс. населения по сравнению с 2019 г., где данный показатель составил 573,21. В 2025–2030 гг. стартует новый Национальный проект «Продолжительная и активная жизнь», ставящий целью достижение ожидаемой продолжительности жизни 78 лет к 2030 г. В рамках реализации проекта будет продолжена борьба с ССЗ, при этом фокус усилий будет смещен на снижение влияния ключевых факторов риска возникновения этих болезней, в том числе АГ, увеличение охвата населения профилактическими медицинскими осмотрами и диспансеризацией.
Для достижения поставленных целей необходимо максимально снизить риск ССО у лиц с АГ, что в существенной степени связано с адекватным контролем АД. Эта цель может быть достигнута при помощи эффективного ведения, в том числе диспансерного наблюдения, пациентов с АГ терапевтами и кардиологами с назначением оптимальной антигипертензивной терапии (АГТ) и достижением целевых значений АД у максимального количества лиц. Большинство пациентов с АГ нуждаются в назначении сразу двух препаратов на старте терапии совместно с модификацией образа жизни. Основой АГТ для снижения АД и уменьшения числа сердечно-сосудистых событий являются 5 классов АГП: ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина II (БРА), β-адреноблокаторы, блокаторы кальциевых каналов (БКК) и диуретики. Предпочтительные комбинации для большинства пациентов должны включать ингибитор ренин-ангиотензиновой системы (РААС) (ИАПФ или БРА) и АК или диуретик2.
Ингибиторы ангиотензинпревращающего фермента и БРА являются наиболее часто используемыми АГТ, в том числе в комбинации с другими классами препаратов АГТ, при этом БРА по сравнению с другими классами характеризуются более низкой частотой отмены из-за побочных эффектов, сопоставимой с плацебо [5, 6]. ИАПФ и БРА в большей степени снижают альбуминурию, чем другие препараты, и замедляют прогрессирование хронической болезни почек (ХБП) [7]. Также данные группы препаратов предотвращают или приводят к регрессу поражения органов-мишеней (гипертрофия левого желудочка, ремоделирование сосудов) и снижают риск возникновения пароксизмов фибрилляции предсердий (ФП) [8].
Препараты, блокирующие РААС, различаются между собой по своим фармакологическим свойствам, клиническим эффектам и влиянию на прогноз [9–11]. Имеющиеся различия были подтверждены результатами рандомизированных клинических исследований, метаанализов и ретроспективных когортных исследований [12–15]. Азилсартана медоксомил является самым новым БРА — это восьмой препарат данного класса, демонстрирующий лучший контроль АД по сравнению с другими БРА, эффективность которых подтверждена большим объемом клинических исследований [14, 16–20]. Во всех этих сравнительных исследованиях азилсартан показал высокую эффективность снижения АД и может быть отнесен к одному из самых эффективных сартанов. Также азилсартана медоксомил продемонстрировал свою фармакоэкономическую эффективность. В исследовании по оценке экономической эффективности применения современных блокаторов РААС у пациентов с АГ изучалась дополнительная выгода в снижении АД и профилактике ССО. В качестве базового блокатора РААС в составе применяемой АГТ рассматривалась терапия валсартаном, эналаприлом, лизиноприлом, периндоприлом, кандесартаном, ирбесартаном, лозартаном, олмесартаном 10 мг и телмисартаном 40 мг. В результате было показано, что применение азилсартана медоксомила в дозе 80 мг наиболее эффективно и позволяет предотвратить 3,86 случая ИМ, 2,48 случая ОНМК и 1,66 случая смерти от всех причин на 1000 пациенто-лет. Сокращение затрат на купирование осложнений и сохранение жизни делает терапию азилсартана медоксомилом экономически целесообразной, сокращая итоговые общественные затраты [3].
Наиболее часто назначаемыми в клинической практике ИАПФ для лечения АГ в Российской Федерации считаются периндоприл, эналаприл и лизиноприл, в порядке убывания [21]. Максимально востребованной в клинической практике комбинацией АГП является комбинация ИАПФ или БРА с БКК. Учитывая отсутствие прямых сравнительных исследований на российской популяции наиболее часто применяемого ИАФП периндоприла с БРА азилсартана медоксомилом в комбинации с БКК амлодипином было выполнено сравнительное ретроспективное исследование применения данных комбинаций АГТ по оценке влияния на прогноз.
Целью исследования явилось изучение эффективности сочетанного применения азилсартана медоксомила и амлодипина по сравнению с приемом периндоприла и амлодипина у пациентов с АГ в реальной клинической практике в отношении риска сердечно-сосудистых событий.
Содержание статьи
Материал и методы
Проведено наблюдательное ретроспективное исследование EDARGO-CV «Оценка эффективности сочетанного применения азилсартана медоксомила (Эдарби®) и амлодипина по сравнению с приемом периндоприла и амлодипина у пациентов с артериальной гипертензией различной степени в отношении сердечно-сосудистых событий» с использованием данных электронных медицинских карт (ЭМК) пациентов с АГ, получавших в качестве гипотензивной терапии следующий список препаратов: азилсартана медоксомил 20–80 мг, периндоприл 2–10 мг, амлодипин 2,5–10 мг.
Дизайн исследования и критерии включения и невключения представлены на рисунке 1.
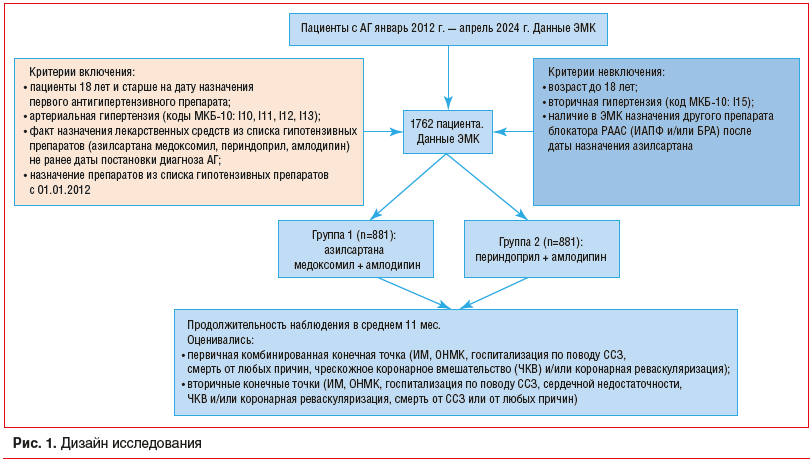
В исследование согласно критериям включения и невключения вошли записи из ЭМК 947 065 пациентов из 38 субъектов Российской Федерации из 1712 медицинских учреждений. Из них 881 пациент принимал азилсартана медоксомил + амлодипин, 25 441 пациент принимал периндоприл + амлодипин. Далее с помощью метода псевдорандомизации для пациентов, принимающих азилсартана медоксомил + амлодипин, были подобраны пары пациентов, принимающих периндоприл + амлодипин, в соотношении 1:1 по 10 признакам. Таким образом, в итоговый набор данных вошли данные 1762 пациентов. Источником данных для исследования явилась база данных сервиса Webiomed.DataSet компании ООО «К-Скай» (разработчик платформы Webiomed). Оценивались следующие данные ЭМК: протоколы врачебных осмотров, данные лабораторной и инструментальной диагностики, коды и дополнительные характеристики диагностированных заболеваний. Для реализации задач исследования использовались обезличенные медицинские записи из лечебно-профилактических медицинских организаций на основании Соглашения о передаче обезличенных данных. Для предотвращения поступления в базу данных сервиса WebiomedDataSet некорректных значений применялся форматно-логический контроль.
Началом наблюдения считалась дата назначения исследуемого препарата, окончанием — дата перехода на другой блокатор РААС (ИАПФ или БРА) или дата смерти не позднее даты формирования базы данных в апреле 2024 г. Продолжительность наблюдения в среднем составила 11±13,4 мес.
Первичная комбинированная конечная точка исследования включала факт развития следующих неблагоприятных сердечно-сосудистых событий: ИМ, инсульт, госпитализация по поводу ССЗ, смерть от любых причин, чрескожное коронарное вмешательство (ЧКВ) и/или коронарная реваскуляризация (major adverse cardiovascular events (5-MACE)).
Вторичные конечные точки в исследовании были следующими:
-
ИМ;
-
ОНМК;
-
госпитализация по поводу ССЗ;
-
госпитализация по поводу сердечной недостаточности (СН);
-
ЧКВ и/или коронарная реваскуляризация;
-
смерть от ССЗ;
-
смерть от любых причин.
Статистический анализ проводился с помощью программы Jupyter Notebook 6.5.4. Количественные показатели представлены в виде количества наблюдений, среднего арифметического, рассчитанного на основе нормального распределения, стандартного отклонения. Качественные показатели представлены в виде абсолютных частот (количества наблюдений), относительных частот (процентов). Для оценки нормальности распределения количественных переменных использовался тест Шапиро — Уилка. Для проверки гипотез о равенстве средних значений количественных нормально распределенных признаков в зависимости от категории использовался t-тест Стьюдента. Для оценки различий между двумя независимыми выборками по уровню количественных ненормально распределенных признаков в зависимости от категории в независимых выборках использовался непараметрический U-критерий Манна — Уитни, в зависимых выборках — критерий Уилкоксона.
Для оценки значимости различий между количеством исходов или качественных характеристик выборки, попадающих в каждую категорию, и теоретическим количеством, которое можно ожидать в изучаемых группах при справедливости нулевой гипотезы (оценка связи между категориальными признаками), использовался непараметрический одновыборочный тест χ2 Пирсона. В случае значений ожидаемого явления менее 10 применялся точный критерий Фишера. Для количественного определения силы связи между двумя событиями из одной статистической совокупности использовался расчет отношения шансов (ОШ) c 95% доверительным интервалом (ДИ). Для проверки гипотез был выбран уровень значимости, равный 0,05. Для устранения систематических различий при анализе количественных исходов в сравниваемых группах применялась псевдорандомизация (propensity score matching) методом K-Nearest Neighbors 1:1 [22–24]. Признаками для псевдорандомизации были: пол, возраст, курение, индекс массы тела, систолическое АД, диастолическое АД, общий холестерин, холестерин липопротеидов низкой плотности (ЛПНП), скорость клубочковой фильтрации (СКФ), глюкоза крови.
Результаты исследования
В исследование были включены данные из ЭМК 1762 пациентов, средний возраст которых составил 61,9±12,6 года (1225 (69,5%) женщин, 537 (30,5%) мужчин), с АГ различной степени тяжести. Треть больных имели избыточную массу тела — среднее значение индекса массы тела (ИМТ) составило 29,7±4,6 кг/м2. На момент включения курили 7,4%.
На основании данных ЭМК в группах исследования были проанализированы основные демографические показатели: пол, возраст, диагноз, сопутствующие заболевания — наличие сахарного диабета (СД), ХБП, ОНМК, хронической обструктивной болезни легких (ХОБЛ), данные лабораторных исследований и др. (табл. 1).
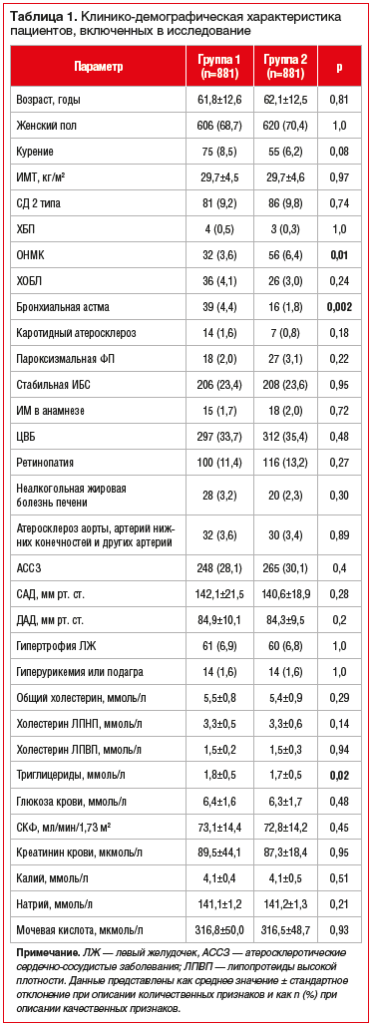
Наиболее распространенными заболеваниями были цереброваскулярная болезнь (ЦВБ), которой страдали более трети пациентов, и ИБС, которая встречалась у четверти больных, сахарным диабетом (СД) страдали порядка 10% пациентов. Реже регистрировались ХБП, ФП, ХОБЛ и др. — менее 10%. Статистически значимые различия между группами исследования наблюдались между частотой встречаемости ОНМК в анамнезе, которое чаще было у пациентов из группы 2 по сравнению с группой 1 (р=0,01), также небольшие различия были выявлены в частоте бронхиальной астмы, повышенного уровня триглицеридов и натрия крови (см. табл. 1).
В группе 1 средний уровень систолического АД (САД) при включении в исследование составил 142,1±21,5 мм рт. ст., на дату завершения исследования — 132,7±12,5 мм рт. ст. (р<0,05); диастолического АД (ДАД) — 84,9±10,1 и 82,0±6,5 мм рт. ст. на дату начала и завершения исследования соответственно (р<0,05). В группе 2 средний уровень САД при включении в исследование составил 140,6±18,9 мм рт. ст., на дату завершения исследования — 129,9±12,3 мм рт. ст. (р<0,05); ДАД — 84,3±9,5 и 81,0±6,4 мм рт. ст. на дату начала и завершения исследования соответственно (р<0,05).
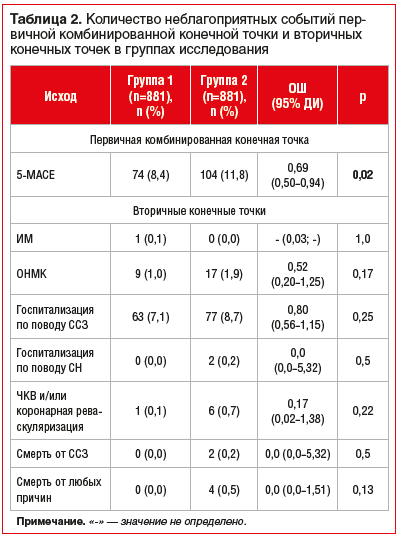
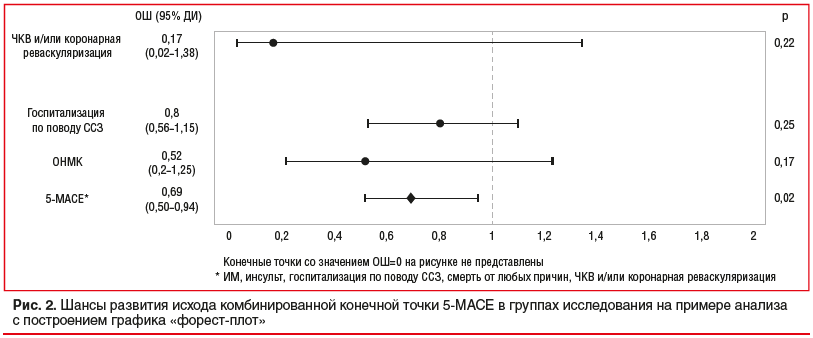
Количество неблагоприятных событий комбинированной конечной точки 5-MACE было статистически значимо больше в группе 2 по сравнению с группой 1 и составило 104 (11,8%) и 74 (8,4%) соответственно (р=0,02). Частота развития событий вторичной конечной точки (ИМ, ОНМК, госпитализация по поводу ССЗ, госпитализация по поводу СН, ЧКВ и/или коронарная реваскуляризация, смерть от ССЗ, смерть от любых причин) статистически значимо не различалась между группами (табл. 2). Шансы развития исхода комбинированной конечной точки 5-MACE в группе 1 были ниже, чем в группе 2, в 1,4 раза (ОШ 0,69, 95% ДИ от 0,5 до 0,94) (рис. 2).
Обсуждение
Впервые в Российской Федерации было проведено сравнительное исследование по влиянию на частоту клинических исходов у двух групп пациентов с АГ в зависимости от варианта комбинированной АГТ: азилсартана медоксомил (Эдарби®) + амлодипин и периндоприл + амлодипин в условиях реальной клинической практики на основе анализа большой базы ЭМК. Медицинские информационные системы и ЭМК в настоящее время активно функционируют во всех регионах Российской Федерации, и кроме преимуществ в клинической практике и системе организации здравоохранения, таких как стандартизация и доступность данных, обладают также растущим потенциалом в качестве источника научных исследований и аналитики больших баз данных реальной клинической практики. Использование данных ЭМК с целью проведения исследований и качественной аналитики в кардиологической практике в последние годы занимает большое место [25–27]. Наше исследование, проведенное с использованием данных ЭМК, полученных в реальных клинических условиях, обеспечивает широкую репрезентативность.
Применение ИАПФ в клинической практике насчитывает более 50 лет. Первым зарегистрированным ИАПФ был каптоприл, первый БРА, лозартан, используется с 1995 г. За эти годы было накоплено большое количество данных об антигипертензивных эффектах данных групп препаратов, положительном влиянии на прогноз пациентов с ССЗ и различных плейотропных эффектах. При интерпретации данных исследований важно понимание того факта, что порядка половины (14 из 32) плацебо-контролируемых исследований с ИАПФ проведено до 2000 г., а все (18 из 18) плацебо-контролируемые исследования БРА были проведены после 2000 г., 14 — после 2005 г. [28]. Ряд исследований по сравнению эффективности ИАПФ и БРА свидетельствуют об отсутствии значимых различий в эффективности между этими классами, но демонстрируют лучший профиль безопасности БРА [29]. По результатам других исследований и метаанализов, напротив, было продемонстрировано преимущество БРА, в том числе азилсартана медоксомила, в степени гипотензивного эффекта по сравнению с ИАПФ [12, 17, 30]. В одном из недавних метаанализов было показано преимущество азилсартана медоксомила по сравнению с другими БРА по эффективности снижения АД. В анализ было включено 18 исследований с участием 6024 пациентов. Азилсартан продемонстрировал статистически значимое снижение САД (средняя разница -2,85 мм рт. ст.) и ДАД (средняя разница -2,095 мм рт. ст.) по сравнению с другими БРА. Более высокие дозы азилсартана медоксомила показали большую эффективность, при этом доза 80 мг продемонстрировала наиболее существенное снижение САД [31].
Известно, что большинство пациентов с АГ нуждаются в назначении сразу двух препаратов на старте терапии, однако исследования, сравнивающие между собой конкретные комбинации препаратов, немногочисленны. В качестве еще одного класса антигипертензивных препаратов, помимо БРА и ИАПФ, в нашем исследовании был изучен БКК амлодипин, комбинация которого с ИАПФ и БРА считается рациональной2. Амлодипин — представитель антагонистов кальция из подгруппы дигидропиридинов — занимает одну из лидирующих позиций среди большого числа антигипертензивных препаратов. Имеется существенная доказательная база по его применению при АГ, препарат обладает длительным периодом полувыведения, что гарантирует поддержание постоянного уровня его концентрации в крови, с минимальным количеством побочных эффектов [3]. Важным положительным качеством всех БКК является их метаболическая нейтральность. Помимо антигипертензивного, они оказывают антиангинальное и органопротективное действие, тормозят агрегацию тромбоцитов [8, 32].
В нашем исследовании было продемонстрировано достоверно меньшее количество неблагоприятных событий комбинированной конечной точки (ИМ, инсульт, госпитализация по поводу ССЗ, смерть от любых причин, ЧКВ и/или коронарная реваскуляризация) в группе азилсартан + амлодипин по сравнению с группой периндоприл + амлодипин (104 и 74 события соответственно). Шансы развития исхода комбинированной конечной точки в группе азилсартан + амлодипин были ниже в 1,4 раза. Анализ частоты наступления событий вторичной конечной точки (инфаркт миокарда, ОНМК, госпитализация по поводу ССЗ, госпитализация по поводу СН, ЧКВ и/или коронарная реваскуляризация, смерть от ССЗ, смерть от любых причин) продемонстрировал отсутствие статистически значимых различий между группами. По таким конечным точкам, как госпитализация по поводу СН, смерть от ССЗ, смерть от любых причин, в группе лечения по схеме азилсартан + амлодипин события отсутствовали, что может быть связано с дизайном исследования, в том числе с применением метода псевдорандомизации при подборе пар и длительностью периода наблюдения. Схожие данные были получены в работе по вторичному анализу исследований ACCORD-BP и SPRINT [28]. В данной работе проводилось сравнение результатов применения ИАПФ и БРА по влиянию на сердечно-сосудистые события и общую смертность. Было включено 3298 пациентов, получавших БРА или ИАПФ. В результате было показано, что значимых различий в частоте возникновения отдельных сердечно-сосудистых событий выявлено не было, но отмечалось снижение общей смертности на фоне применения БРА по сравнению с ИАПФ (ОШ 0,56, 95% ДИ от 0,37 до 0,85). Аналогичный результат был продемонстрирован в крупном ретроспективном сравнительном когортном исследовании, куда были включены пациенты с гипертонией, получавшие ИАПФ или БРА в период с 1996 по 2018 г., из восьми баз данных США, Германии и Южной Кореи (2 297 881 пациент с лечением ИАПФ и 673 938 пациентов с лечением БРА) [29]. Первичными конечными точками были острый ИМ, СН, ОНМК и комбинированные сердечно-сосудистые события, вторичными конечными точками было 51 событие, включая ангионевротический отек, кашель, гипотонию и нарушения электролитного баланса. В результате было показано отсутствие статистически значимой разницы между группами исследования по частоте наступления событий первичной конечной точки. При анализе частоты наступления событий вторичной конечной точки у пациентов, принимавших БРА, был выявлен значительно более низкий риск развития ангионевротического отека, кашля, панкреатита и желудочно-кишечного кровотечения.
Основная гипотеза, объясняющая полученные результаты, связанные с меньшим количеством неблагоприятных событий — комбинированной конечной точки, помимо гипотензивного эффекта препарата, может быть связана с плейотропными эффектами в группе БРА в общем, и азилсартана медоксомила в частности, такими как улучшение когнитивной функции и снижение риска возникновения некоторых онкологических заболеваний [33–35]. БРА блокируют рецептор ангиотензина II типа 1 и косвенно усиливают контррегуляторные эффекты рецептора ангиотензина II типа 2, что приводит к снижению периферического воспаления и ангиогенеза и способствует улучшению когнитивных функций и апоптозу раковых клеток [36–39]. Также были описаны кардиопротективные, антифибротические свойства азилсартана медоксомила, эффекты, способные уменьшать инсулинорезистентность и проявления метаболического синдрома, антиатеросклеротическое воздействие [40–42].
Наше исследование обладает рядом достоинств, связанных в первую очередь с большой популяцией пациентов: из ЭМК 947 065 лиц из 38 субъектов Российской Федерации были включены данные 1762 пациентов. Исследование проводилось на данных, полученных в реальных клинических условиях в медицинских учреждениях Российской Федерации.
В качестве ограничений исследования стоит отметить особенности данных, полученных из ЭМК, заключающиеся в возможном неполном объеме вводимой информации о пациенте, ошибках во вводе данных, риске возникновения ошибок при извлечении информации из неструктурированных данных ЭМК. Для снижения имеющихся рисков был использован форматно-логический контроль, предотвращающий поступление в базу данных некорректных значений. Также к ограничениям стоит отнести широкие критерии включения, изменение схем лечения пациентов в процессе наблюдения, отсутствие оценки сопутствующей терапии.
Заключение
В нашем исследовании, продемонстрировавшем снижение частоты сердечно-сосудистых событий и общей смертности на фоне приема азилсартана медоксомила + амлодипин по сравнению с периндоприлом + амлодипин у пациентов с АГ, подтверждена актуальность проблемы оптимального выбора схем АГТ. Высокая распространенность АГ в Российской Федерации диктует необходимость проведения сравнительных проспективных исследований с учетом текущих целевых значений АД и схем АГТ.
Статья подготовлена при поддержке АО «Нижфарм». Мнение авторов может не совпадать с мнением компании.
1Здравоохранение в России. 2023: Стат. сб. Росстат. М.; 2023.
2Клинические рекомендации. Артериальная гипертензия у взрослых. 2024 г. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/62_3 (дата обращения: 05.10.2024).
Информация с rmj.ru

