Введение
Одно из существующих определений язвенного колита (ЯК) — хроническое рецидивирующее заболевание толстой кишки, характеризующееся нарушением регуляции врожденного и адаптивного иммунного ответа на микробиоту кишечника, что способствует сохранению воспалительных процессов в кишечнике [1]. Согласно эпидемиологическим исследованиям распространенность ЯК в России составляет от 19,3 до 29,8 случая на 100 тыс. населения [2].
Предикторами агрессивного течения и возможной колэктомии являются: молодой возраст на момент постановки диагноза (<40 лет), обширное поражение, неблагоприятная эндоскопическая картина (наличие больших и/или глубоких язв), наличие внекишечных проявлений, необходимость ранней терапии глюкокортикостероидами (ГКС) и повышение уровня маркеров воспаления [3].
Цель лечения пациентов с ЯК — добиться контроля симптомов и заживления слизистой оболочки, т. е. достичь устойчивой ремиссии без применения ГКС, тем самым предотвратив повторные госпитализации, прогрессирование болезни, и снизить риски оперативных вмешательств [4].
Пациентов с ЯК средней и тяжелой степени лечат с помощью таргетной терапии, если традиционная терапия не приводит к ремиссии [5]. Согласно имеющимся данным биологические препараты являются эффективными и безопасными средствами для лечения ЯК. Биологические препараты непосредственно воздействуют на ключевые пути воспаления, влияя на цитокины, их рецепторы и некоторые ключевые молекулы адгезии [6]. Существует широкий, но не безграничный выбор биологических препаратов, в числе которых антагонисты фактора некроза опухоли (анти-tumor necrosis factor (анти-TNF)), антиинтегрины, антиинтерлейкины (interleukin (IL)) 12 / IL-23 и ингибиторы янус-киназы. Эти препараты эффективны в 15–40% случаев для достижения и/или поддержания ремиссии, что делает необходимым оптимизацию эффективности каждого класса препаратов, а также индивидуальный подход к выбору препарата [7, 8].
Антагонисты TNF обычно используются в качестве биологических препаратов первой линии для лечения воспалительных заболеваний кишечника (ВЗК), в том числе и ЯК. Однако примерно у 10–30% пациентов наблюдается первичная невосприимчивость к лечению антагонистами TNF, а еще у большего числа пациентов со временем отмечается вторичная потеря чувствительности к препаратам. В последние годы были одобрены новые препараты с различными терапевтическими целями, такие как антагонисты интегрина α4β7 (ведолизумаб), антагонисты IL-12/IL-23 (устекинумаб) и ингибиторы янус-киназы (упадацитиниб) [3, 7–11].
Поскольку существует несколько различных вариантов применения биологических препаратов, клиницисты часто сталкиваются с дилеммой, какой тип биологических препаратов назначать и кому. Как уже упоминалось, каждый биологический препарат оказывает различное действие, подавляет различные молекулярные пути, и, кроме того, каждый пациент уникален.
К факторам, которые можно использовать в качестве биомаркеров для подбора биологических препаратов у пациентов с ВЗК, можно отнести: клинические факторы, метаболические биомаркеры, микробиоту, иммуногенность, генетические факторы, наличие провоспалительных цитокинов и хемокинов [6].
На успех биологической терапии влияют различные клинические факторы. Как и на любое другое лечение, на успех анти-TNF-терапии большое влияние оказывают ранняя диагностика, тяжесть заболевания и сами пациенты, при этом раннее применение любой биологической терапии должно быть связано с лучшим клиническим результатом [12]. Масса тела пациента может быть фактором, влияющим на его реакцию на адалимумаб и инфликсимаб, поскольку от этого зависит необходимая терапевтическая доза [6]. В отличие от лечения анти-TNF, реакция на ведолизумаб лучше у пожилых людей [13], в то время как устекинумаб показал лучшие результаты при назначении более молодым пациентам [14]. Было продемонстрировано, что курение снижает эффективность устекинумаба у пациентов с ЯК и болезнью Крона (БК) [6, 14]. У пациентов с ЯК и БК с меньшей массой тела результаты лечения биологическими препаратами лучше [6]. Имеются сообщения, что европеоидные женщины более склонны отвечать на лечение устекинумабом [6, 15], однако у мужчин, особенно у тех, у кого нет антител к TNF, дольше сохраняется ремиссия [16]. Пациенты с ЯК с меньшей протяженностью поражения (проктит или левостороннее поражение), а также с менее выраженной активностью воспаления и пациенты с БК и поражением толстой кишки демонстрируют лучшие результаты лечения ведолизумабом [6]. Применение устекинумаба также, по-видимому, менее эффективно у пациентов с БК и поражением подвздошной кишки, хотя эффективно у пациентов с поражением как подвздошной, так и толстой кишки [6].
Метаболические биомаркеры. Общие метаболические пути, по-видимому, подвержены влиянию одних и тех же механизмов, вызывающих ВЗК, поэтому некоторые маркеры следует рассматривать в качестве возможных терапевтических индикаторов. Показано, что измерение сывороточных и фекальных уровней желчных кислот и липидов, уровней гистидина и цистеина в моче может предсказать ответ на терапию препаратами анти-TNF [17]. Низкий сывороточный уровень или полный дефицит витамина D, по-видимому, также коррелирует с неэффективностью лечения препаратами анти-TNF, вероятно, из-за более низких сывороточных уровней IL-6, -8 и -12 [18]. Низкий уровень сывороточного альбумина также может свидетельствовать о неэффективности терапии анти-TNF [19]. Уровни С-реактивного белка (СРБ) были повышены у пациентов с БК [6] и оставались повышенными даже после лечения инфликсимабом у пациентов, не ответивших на лечение [6], что является многообещающим доказательством отсутствия анти-TNF-ответа. Измерение сывороточной концентрации препарата и уровня антилекарственных антител в сочетании с уровнем СРБ или сывороточного и фекального уровней кальпротектина позволяет более точно оценить ответ пациентов на терапию анти-TNF [6, 20]. Уровень сывороточного кальпротектина также указывает на реакцию на ведолизумаб, ее потерю в будущем или полное отсутствие [21]. Низкие уровни СРБ и фекального кальпротектина были отмечены уже в первые несколько недель приема устекинумаба [6, 22], что свидетельствует о снижении выраженности воспалительной реакции. Терапевтический мониторинг лекарственных средств также необходим для повышения эффективности как ведоли-зумаба, так и устекинумаба, поскольку их уровни в сыворотке крови сильно зависят от выбранной дозы, а более высокие поддерживающие концентрации этих препаратов коррелируют с лучшим ответом пациентов на терапию [6]. Помимо вышеупомянутых маркеров, обнаруженных в крови или кале, биогенные амины в моче также могут служить биомаркерами, что требует дальнейшего изучения. Недавно было обнаружено, что у пациентов с БК, которым ранее назначался азатиоприн, значительно снижались уровни серотонина и норадреналина, а также повышались уровни гистамина и спермидина [6, 23].
Иммуногенность. Для разработки успешных и точных стратегий лечения необходимо количественно оценить иммуногенность и эффективность, а также потерю ответа и возможные нежелательные реакции на эти препараты. Во-первых, было предложено оценивать наличие различных аутоантител для дифференциальной диагностики между БК и ЯК, и уровни таких антител также следует измерять перед началом терапии анти-TNF, поскольку их повышенные уровни могут способствовать выработке антител против TNF и в конечном итоге привести к тому, что организм не будет отвечать на терапию или ответ на терапию будет утрачен. Потеря ответа на терапию анти-TNF также может быть объяснена высокой выработкой антилекарственных антител и, следовательно, повышенным клиренсом препарата [6, 24]. В качестве возможных маркеров эффективности терапии анти-TNF предлагается измерение уровня лекарственного средства в сыворотке крови и кале и/или антилекарственных антител, которые выявляются при потере чувствительности к инфликсимабу [25, 26]. Более высокие уровни матриксной металлопротеиназы 3 (MMP3) также соответствуют раннему отсутствию реакции на инфликсимаб, поскольку MMP3 относится к группе протеолитических ферментов, участвующих в расщеплении компонентов препарата и, таким образом, увеличивает его клиренс [27]. Стоит отметить, что при применении устекинумаба продемонстрировано отсутствие нейтрализующих антител, что делает его безопасным и эффективным средством лечения ВЗК с меньшим количеством нежелательных реакций, несмотря на то, что этот препарат лишь недавно получил одобрение Управления по контролю качества пищевых продуктов и лекарственных средств (Food and Drug Administration — FDA) [6, 28–31].
Микробиота. В последнее время корреляция между численностью и разнообразием микробиоты кишечника и прогрессированием ВЗК стала более очевидной, и анализ численности микробиоты может быть простым ранним предиктором ответа на биологическую терапию у пациентов с ВЗК [6, 32]. У пациентов, которые ответили на терапию анти-TNF, было отмечено увеличение таксонов, принадлежащих к родам Faecalibacterium, Roseburia или Clostridium [33]. В одном из исследований было продемонстрировано, что генетически обусловленное нарушение использования триптофана имеет решающее значение для развития ЯК из-за его воздействия на кишечную микробиоту [34]. Терапия анти-TNF сопровождалась не только улучшением показателей соотношения между популяциями микроорганизмов, которые были ограничены до лечения, а после терапии были сходны по составу с микробиотой людей без ВЗК, но также индуцировала выработку бутирата и его субстратов у пациентов в ремиссии. При этом отдельные таксоны, вероятно, не оказывали прямого влияния на ответ на терапию анти-TNF, однако в этом могли участвовать их метаболиты [6, 35, 36]. Что касается устекинумаба, то в микробиоте пациентов, которые отвечали на терапию с последующим достижением ремиссии, по-видимому, было больше популяций видов Escherichia, Shigella и Faecalibacterium [6, 37].
Провоспалительные цитокины и хемокины как биомаркеры. Разнообразие циркулирующих иммунных клеток и межклеточных сигналов, которые они получают, может существенно влиять на течение ВЗК. Отсутствие ответа на биологическую терапию у пациентов с ВЗК может сопровождаться большим увеличением количества Т-клеток: Treg и Th1; повышением экспрессии онкостатина М (oncostatin M — OSM) и его рецептора OSMR в слизистой оболочке; повышением экспрессии триггерного рецептора, экспрессируемого на миелоидных клетках 1 (triggering receptor expressed on myeloid cells 1 — TREM-1) слизистой оболочки кишечника; стимуляцией Toll-подобных рецепторов (toll-like receptors — TLR); высоким уровнем IL-6 в сыворотке крови; ранней экспрессией IL-7 и его рецептора (IL-7R) и др. [6].
Генетические факторы. Анализ полиморфизмов ДНК в качестве биомаркеров может быть весьма эффективным, поскольку ДНК стабильна и ее легко выделить из образцов крови, мокроты, мочи, эндоскопических биопсий и/или образцов кала до, во время и после лечения. Генетический полиморфизм HLADQA1*05 у пациентов с ВЗК повышает у них выработку антител к анти-TNF-препаратам, что приводит к утрате последующего ответа на терапию анти-TNF [6, 38]. Согласно исследованиям в области биоинформатики некоторые гены (CCR1, CD86, CCL4, TLR1, TLR4, TLR8, HCK, FCGR2A), кодирующие белки сигнальных путей TLR и FcyR, экспрессируются по-разному и могут быть выявлены при терапии анти-TNF у пациентов, не отвечающих на терапию, причем последние три могут быть использованы в качестве сывороточных биомаркеров [6, 39]. Согласно исследованиям экспрессии генов в биоптатах слизистой оболочки гены остеопротегерина (osteoprotegerin — OPG), станниокальцина 1 (stanniocalcin-1 — STC1), простагландин-эндопероксидсинтазы 2 (prostaglandin-endoperoxide synthase 2 — PTGS2), α-2 рецептора IL-13 (IL13RA2) и IL-11 также по-разному экспрессируются у пациентов с ЯК, которые отвечают на лечение инфликсимабом [40]. Была установлена корреляция между отсутствием ответа на антиинтегриновые препараты и наличием миелоидных клеток IL1B+/LYZ+ у пациентов с ЯК [41]. Более подробная информация была получена также о ряде генов, кодирующих белки пути IL-12/IL-23, которые влияют на развитие БК, причем ключевыми являются варианты генов, кодирующих JAK2, STAT3, TYK2, IL10RA, IL12RB1 и IL12B [42–46]. Однако пока нет убедительных генетических биомаркеров, связывающих ответ организма на устекинумаб с какой-либо наследственной предрасположенностью [6].
Несмотря на расширяющиеся возможности в лечении пациентов с ВЗК, значительное число пациентов не реагируют на лечение биологическими препаратами и у них развивается рецидив. В своей статье мы хотим продемонстрировать клиническое наблюдение пациента с ЯК с эффективным применением устекинумаба после потери ответа на первый биологический препарат.
Клиническое наблюдение
Пациент, 32 года, обратился на прием в октябре 2020 г. с жалобами на диарею до 8–9 р/сут, с примесью крови в каждой порции, тенезмы, боли в левой подвздошной области перед актом дефекации, афты в ротовой полоти, кожные высыпания на левой голени, сопровождающиеся болезненностью по периферии язвенных дефектов, общую слабость, недомогание и потерю 22 кг массы тела в течение 1 года. Первые симптомы — диарея и лихорадка — появились летом 2019 г. после отдыха в южной стране. Пациент был госпитализирован в инфекционную больницу с диагнозом: кишечная инфекция неуточненная. При обследовании были верифицированы: анемия (уровень гемоглобина 115 г/л, синдром лабораторного воспаления (СРБ 12 г/л, СОЭ 44 мм/ч, лейкоциты 12,6×109/л). Проводилась инфузионная, антибактериальная терапия, что привело к кратковременному улучшению. Через 2 нед. после выписки пациент впервые стал отмечать прожилки крови в кале, начал худеть. Консультирован проктологом, при ректороманоскопии был верифицирован эрозивный проктит. Назначена местная терапия свечами с месалазином курсом на 2 мес. Обострение через 2 мес. после прекращения терапии месалазином, самостоятельная попытка повторного приема свечей с месалазином не привела к клиническому улучшению. В январе 2020 г. выполнена колоноскопия, впервые верифицирован ЯК, левостороннее поражение, 3 балла по шкале Schroeder. Пациент госпитализирован со среднетяжелой атакой ЯК в гастроэнтерологическое отделение, где была проведена инфузионная терапия, терапия ГКС (преднизолон 60 мг per os) и препаратами 5-аминосалициловой кислоты (месалазин 4,0 г/сут). На фоне терапии удалось достичь клинической ремиссии. В апреле 2020 г. после отмены ГКС ухудшение (диарея 7–8 р/сут, примесь крови в кале, появились боли в поясничном отделе позвоночника, афты в ротовой полости). Пациент повторно госпитализирован в гастроэнтерологическое отделение в мае 2020 г. с очередной атакой. Выполнена мультиспиральная компьютерная томография органов брюшной полости и колоноскопия. Выявлены признаки ЯК с левосторонним поражением, эндоскопический индекс по шкале Schroeder — 3 балла, лабораторные признаки системного воспаления, анемии легкой степени тяжести. Были исключены другие причины, которые могли привести к активизации процесса (острые кишечные инфекции, туберкулез, поражения вирусами, Clostridium difficilе). Был назначен повторный курс системных ГКС (преднизолон 60 мг per os) в сочетании с азатиоприном в стандартной дозе (2 мг/кг). На фоне терапии незначительная положительная динамика с сохранением диареи до 5–6 р/сут, периодически с прожилками крови. С июня 2020 г. проводилась коррекция терапии: были добавлены ректальные формы ГКС в виде микроклизм с гидрокортизоном, увеличена доза азатиоприна до 2,5 мг/кг, проводился курс антибактериальной терапии. Однако коррекция терапии также не привела к достижению клинической и лабораторной ремиссии. С августа 2020 г. на левой голени появилась кожная сыпь в виде пятна диаметром 0,8 см, темно-бордового цвета, болезненная, с тенденцией к быстрому прогрессированию. В сентябре 2020 г. диагностирована гангренозная пиодермия, что потребовало увеличения дозы системных ГКС (преднизолон с 20 до 60 мг).
Из анамнеза жизни известно, что пациент не курит и ранее не курил; до 2019 г. 2–3 раза в неделю употреблял по 3–4 л пива, с 16 до 20 лет употреблял насвай эпизодически. Объективно в октябре 2020 г.: индекс массы тела (ИМТ) 19,6 кг/м2, видимые слизистые бледные, на левой голени 2 кожных элемента синюшно-бордового цвета, болезненные, диаметром до 1,5 см, 1 кожный элемент в виде язвы с неровными краями диаметром 2–2,5 см, по периферии — грануляционная ткань (рис. 1). При пальпации умеренная болезненность в левой подвздошной области, печень и селезенка не увеличены; перианальная область не изменена. Лабораторные данные: нейтрофильный лейкоцитоз до 15,75×109/л, снижение уровня гемоглобина до 92 г/л, тромбоцитоз до 697×109/л, ускорение СОЭ до 48 мм/ч, гипопротеинемия до 64 г/л, снижение сывороточного уровня железа до 4,9 мкмоль/л, повышение уровня СРБ до 54 мг/л, повышение уровня фекального кальпротектина до 1878 мкг/г. При анализе крови на вирусные гепатиты, ВИЧ, сифилис — результаты отрицательные; кала на токсины А и В Clostridium difficile — отрицательные. При гастроскопии выявлена эритематозная гастропатия, хеликобактерная инфекция отсутствует, при ультразвуковом исследовании органов брюшной полости — перегиб желчного пузыря. Данных за туберкулезный процесс нет (проведены рентгенологическое исследование органов грудной клетки и квантифероновый тест). По данным колоноскопии слизистая слепой, восходящей, поперечно-ободочной кишки бледно-розовая, блестящая, гладкая, с нормальным ветвистым сосудистым рисунком; выраженные изменения слизистой кишки визуализируются от ануса и до 60 см на уровне селезеночного изгиба; слизистая ярко гиперемирована, с большим количеством сливающихся между собой эрозий и язв до 2–2,5 см длиной, между язвами визуализируются пвсевдополипы из ярко гиперемированной и отечной слизистой с микроабсцессами, складчатость сохранена, выраженная контактная кровоточивость (рис. 2). Гистологическое исследование выявило крипт-абсцессы, лимфоидную инфильтрацию, снижение числа бокаловидных клеток. Исследования на цитомегаловирусную инфекцию, вирус Эпштейна — Барр дали отрицательный результат.
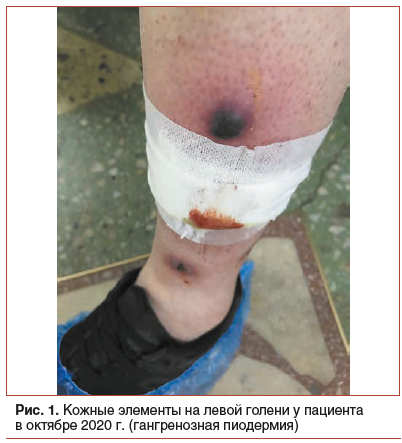
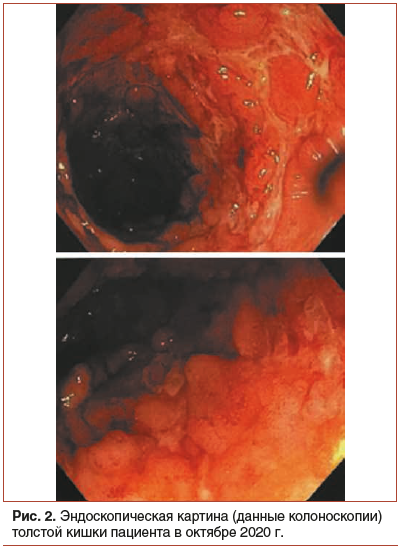
С учетом клинической картины, данных анамнеза, лабораторных и эндоскопических признаков пациенту поставлен диагноз: ЯК, левостороннее поражение, хроническое непрерывное рецидивирующее течение, среднетяжелая атака (9 баллов по шкале Мейо), стероидная зависимость. Неэффективность азатиоприна. Осевая артропатия. Афтозный стоматит. Гангренозная пиодермия. Анемия средней степени тяжести. Тромбоцитоз.
Для коррекции терапии проведен анализ факторов риска неблагоприятного прогноза. У пациента выявлено наличие 5 факторов: молодой возраст на момент дебюта заболевания, высокая эндоскопическая активность, раннее назначение системных ГКС, повышенный уровень маркеров воспаления, наличие внекишечных проявлений. Согласно клиническим рекомендациям, учитывая наличие пяти факторов неблагоприятного прогноза ЯК, стероидозависимости и стероидорезистентности, внекишечных проявлений (афтозного стоматита, гангренозной пиодермии, артропатии), было решено назначить инфликсимаб в сочетании с продолжением приема азатиоприна, препараты железа и антибактериальные средства. На 14-й день от начала индукционной терапии инфликсимабом отмечены положительная динамика клинической картины, снижение признаков лабораторного воспаления. По результатам контрольной колоноскопии в январе 2021 г. констатировали достижение эндоскопической ремиссии (по шкале Schroeder — 0 баллов). Далее в течение 1 года сохранялась клиническая, лабораторная и эндоскопическая ремиссия. Ухудшение с февраля 2022 г., вновь учащение стула до 3–4 р/сут, примесь крови в кале, рецидив афтозного стоматита. При лабораторном исследовании выявлена анемия легкой степени тяжести, повышение уровня СРБ до 68 г/л, повышение уровня фекального кальпротектина до 1322 мкг/г; Clostridium difficile — не подтверждено. По результатам колоноскопии в марте 2022 г. у пациента подтвержден ЯК, левостороннее поражение (по шкале Schroeder — 2 балла). Было принято решение о проведении эскалации дозы анти-TNF (инфликсимаб) до 10,0 мг/кг. В течение 1 года сохранялась клиническая, лабораторная и эндоскопическая ремиссия.
С января 2023 г. вновь отмечено постепенное ухудшение состояния, к маю 2023 г. — диарея до 7 р/сут, с примесью крови в каждой порции, периодические абдоминальные боли ноющего характера в левой подвздошной области, усиливающиеся перед актом дефекации, общая слабость, периодические боли в позвоночнике, скованность при движении, снижение массы тела на 15 кг. Объективно: ИМТ 19,4 кг/м2, кожные покровы и слизистые бледные, слизистая ротовой полости чистая, умеренная болезненность в левой подвздошной области, печень и селезенка не увеличены. Лабораторные данные: лейкоцитоз до 12,50×109/л, уровень гемоглобина — 102 г/л, ускорение СОЭ до 32 мм/ч, незначительное снижение сывороточного уровня железа до 8,7 мкмоль, повышение уровня СРБ до 41 мг/л и уровня фекального кальпротектина до 1917 мкг/г. Пациент регулярно обследовался на кишечные инфекции, туберкулез, вирусы, клостридиальную инфекцию. По результатам колоноскопии — ЯК, левостороннее поражение (по шкале Schroeder — 3 балла). При гистологическом исследовании — лимфоцитарная инфильтрация собственной пластинки слизистой с единичными эозинофилами, крипт-абсцессы, крипты различного диаметра. Таким образом, у пациента установлена вторичная потеря ответа на анти-TNF.
Согласно российским и зарубежным рекомендациям1 при неэффективности инфликсимаба в качестве первой линии терапии ЯК, для индукции ремиссии в качестве препарата второй линии можно использовать упадацитиниб или устекинумаб и др. [3, 47–49].
В настоящее время в литературе немного данных об эффективности биологических препаратов второй линии при ЯК. Упадацитиниб является новым селективным ингибитором янус-киназы 1. В марте 2022 г. FDA одобрило применение упадацитиниба для лечения умеренной и тяжелой формы ЯК у пациентов с неадекватным ответом или непереносимостью препаратов анти-TNF [8, 11, 50–52]. R. Panaccione et al. [51] демонстрируют, что применение упадацитиниба в дозе 45 мг для индукционной терапии и 30 мг в качестве поддерживающей терапии может быть эффективным для достижения и поддержания клинического ответа, клинической ремиссии и эндоскопического улучшения у пациентов с умеренно-тяжелой и тяжелой формой ЯК, независимо от предшествующего лечения биологическими препаратами. Упадацитиниб превосходит плацебо в достижении и поддержании как клинической, так и эндоскопической ремиссии при умеренно-тяжелой и тяжелой форме ЯК. При этом в клинических исследованиях III фазы было зарегистрировано больше случаев опоясывающего лишая и венозной тромбоэмболии у пациентов с ЯК, принимавших упадацитиниб, по сравнению с пациентами, принимавшими плацебо [52].
Исследование, основанное на данных Шведского реестра здравоохранения, показало, что эффективность и безопасность антагонистов TNF второй линии по сравнению с ведолизумабом после неэффективности антагонистов TNF были сходными [49, 53]. Другое исследование, основанное на ретроспективном наблюдении за пациентами из 8 итальянских центров лечения ВЗК, выявило более высокий риск неэффективности терапии адалимумабом на 52-й неделе по сравнению с ведолизумабом после неэффективного лечения инфликсимабом [12, 53]. В ходе сетевого метаанализа было установлено, что применение устекинумаба и тофацитиниба более эффективно в достижении клинической ремиссии по сравнению с ведолизумабом и адалимумабом у пациентов с ЯК, ранее принимавших антагонисты TNF [49]. Эффективность и благоприятный профиль безопасности устекинумаба могут быть привлекательными в свете недавних исследований в связи с опасениями по поводу венозной тромбоэмболии при применении тофацитиниба. Для разработки стратегии персонализированного подхода к ведению и лечению пациента и формирования политики здравоохранения, помимо клинических особенностей течения болезни, опыта применения препарата у лечащего врача, предпочтения врача и пациента в способе дозирования и режима приема препарата, важен баланс профиля риска и пользы выбираемого препарата, а также анализ имеющихся ресурсов и затрат, требующихся на обеспечение пациента этим препаратом [49, 50].
Устекинумаб является полностью человеческим моноклональным антителом, нацеленным на субъединицу p40 IL-12 и IL-23. IL-12 и IL-23 секретируются активированными антигенпрезентирующими клетками и стимулируют развитие воспалительных и иммунных реакций, в том числе активацию естественных киллерных клеток, дифференцировку CD4+ Т-клеток в Т-хелперы 1 и Т-хелперы 17. Данный препарат предотвращает взаимодействие IL-12 и IL-23 с поверхностными рецепторными комплексами IL-12Rb1, тем самым снижая активацию иммунных клеток [55].
Устекинумаб одобрен в качестве эффективного средства для индукционной и поддерживающей терапии пациентов с ЯК [29]. В литературе имеются многочисленные подтверждения долгосрочной эффективности и безопасности лечения БК этим препаратом [30, 49], а также все больше данных в пользу эффективности и безопасности его применения при лечении ЯК [9, 10, 28, 29, 50, 55].
Выбор устекинумаба в качестве второй линии ГИБП при неэффективности первого анти-TNF ассоциирован с лучшим результатом (достижением клинического ответа и клинической ремиссии) по сравнению с переводом пациента на другой анти-TNF или ведолизумаб [47, 50].
При проведении систематического обзора было показано, что устекинумаб является эффективным средством для лечения внекишечных проявлений, особенно при дерматологических и ревматологических проявлениях [31].
Согласно данным клинического исследования UNIFI применение устекинумаба сопровождалось высокой эффективностью и безопасностью в качестве препарата для индукции и поддержания ремиссии у пациентов со среднетяжелой и тяжелой формой ЯК после неудачной терапии анти-TNF или традиционными иммуносупрессорами [56].
По данным рандомизированных клинических исследований, устекинумаб находится на вершине пирамиды без-опасности терапии при ВЗК [50].
Все вышеперечисленное повлияло на выбор препарата второй линии у данного пациента. В мае 2023 г. ему было проведено первое инфузионное введение устекинумаба 390 мг № 1. К августу 2024 г. удалось достичь клинического, лабораторного и эндоскопического ответа: стул оформленный 2–3 раза в день без крови, купированы абдоминальные боли, прибавка массы тела 6 кг, эндоскопическая активность 1 балл. Далее следовало принять решение о том, с какой периодичностью проводить подкожное введение устекинумаба. Согласно имеющимся данным примерно четверть пациентов с БК и ЯК не реагируют на лечение, и потеря ответа на пациента в год составляет 20% [11]. Таким образом, прежде чем принимать решение о переходе на другие классы биологических препаратов, необходимо рассмотреть возможность оптимизации дозы или повторной индукции [11]. Согласно российским рекомендациям выбор режима поддерживающей терапии данным препаратом 90 мг подкожно каждые 8 или 12 нед. осуществляется в зависимости от характера течения заболевания1. Учитывая наличие пяти факторов неблагоприятного прогноза ЯК, предшествующей потери ответа на анти-TNF в анамнезе, исходно высокий уровень СРБ и уровень фекального кальпротектина, наличие стероидозависимости и стероидорезистентности, было принято решение о применении устекинумаба в качестве поддерживающей терапии каждые 8 нед.
На фоне проводимой терапии в сентябре 2024 г. состояние стабильное, достигнута клиническая, лабораторная и эндоскопическая ремиссия. Стул 1–2 раза в день без крови, прибавка массы тела 10 кг за 8 мес., рецидивов афтозного стоматита, гангренозной пиодермии не было. В течение последнего года при обследовании уровень СРБ от 2,0 до 5,0 мг/л, фекального кальпротектина от 132 до 178 мкг/г, признаков анемии не зарегистрировано, по данным колоноскопии, проведенной в июле 2024 г., — эндоскопическая ремиссия, при гистологическом исследовании — признаки ЯК слабой степени активности.
Заключение
Представленное клиническое наблюдение демонстрирует сложности ведения пациентов с ЯК, у которых в анамнезе имеется утрата ответа на первую линию биологической терапии с использованием анти-TNF. Устекинумаб продемонстрировал высокую эффективность у пациента с резистентностью к препаратам анти-TNF (инфликсимаб) и позволил добиться клинического, лабораторного и эндоскопического ответа в соответствии с современной концепцией терапии ЯК.
1Клинические рекомендации. Язвенный колит. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend (дата обращения: 10.11.2024).
Информация с rmj.ru






