Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению ахалазии кардии и кардиоспазма
В.Т. Ивашкин1, А.С. Трухманов1, Э.А. Годжелло2, И.В. Маев3, Ю.В. Евсютина1, Т.Л. Лапина1, О.А. Сторонова1
1 ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Российская Федерация
2 ФГБНУ «Российский научный центр хирургии имени академика Б.В. Петровского», Москва, Российская Федерация
3 ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А. И. Евдокимова» Минздрава России, Москва, Российская Федерация
Diagnostics and treatment of cardiac achalasia and cardiospasm: guidelines of the Russian gastroenterological association
V.T. Ivashkin1, A.S. Trukhmanov1, E.A. Godzhello2, I.V. Mayev3, Yu.V. Evsyutina1, T.L. Lapina1, O.A. Storonova1
1 State educational government-financed institution of higher professional education «Sechenov First Moscow state medical university», Ministry of Healthcare of the Russian Federation, Moscow, the Russian Federation
2 Petrovsky National Research Center of Surgery of Russian Academy of Medical Science, Moscow, the Russian Federation
3 State educational government-financed institution of higher professional education «Yevdokimov Moscow State University of Medicine and Dentistry», Ministry of Healthcare of the Russian Federation, Moscow, Russian Federation
Годжелло Элина Алексеевна — доктор медицинских наук, главный научный сотрудник, ФГБНУ «Российский научный центр хирургии им. академика Б.В. Петровского». Контактная информация: godjello(а)inbox.ru; 119991, Москва, Абрикосовский пер., д. 2
Godzhello Elina A. — MD, PhD, chief research associate, Petrovsky National Research Center of Surgery of Russian Academy of Medical Science. Contact information: godjello(а)inbox.ru; 119991, Moscow, Abrikosovsky per., 2
Трухманов Александр Сергеевич — доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова», Контактная информация: troukh(а)mail.ru ; 119991, Москва, ул. Погодинская, д. 1, стр. 1.
Trukhmanov Aleksander S. — MD, PhD, professor, Chair of internal diseases propedeutics, medical faculty, Sechenov First Moscow state medical university. Contact information: troukh(а)mail.ru; 119991, Moscow, Pogodinskaya street, 1, bid 1.
Для цитирования: Ивашкин В.Т., Трухманов А.С, Годжелло Э.А., Маев И.В., Евсютина Ю.В., Лапина Т.Л., Сторонова О.А. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению ахалазии кардии и кардиоспазма. Рос журн гастроэнтерол гепатол колопроктол 2016;26(4):36-54
For citation: Ivashkin V.T., Trukhmanov A.S., Godzhello E.A., Mayev I.V., Evsyutina Yu.V., Lapina T.L., Storonova O.A. Diagnostics and treatment of cardiac achalasia and cardiospasm: guidelines of the Russian gastroenterological association. Ross z gastroenterol gepatol koloproktol 2016;26(4):36-54
Методология
Методы, использованные для сбора/селекции доказательств:
- поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
- доказательной базой для рекомендаций являются публикации, вошедшие в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 15 лет.
Методы, использованные для оценки качества и силы доказательств:
- консенсус экспертов;
- оценка значимости в соответствии с рейтинговой схемой (схема прилагается).
Рейтинговая схема для оценки силы рекомендаций
| Сила | Описание |
| А | По меньшей мере один мета-анализ, систематический обзор или РКИ, оценённые как 1++, напрямую применимые к целевой популяции и демонстрирующие устойчивость результатов, или группа доказательств, включающая результаты исследований, оценённые как 1+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов |
| В | Группа доказательств, включающая результаты исследований, оценённые как 2++, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов, или экстраполированные доказательства из исследований, оценённых как 1++ или 1 + |
| С | Группа доказательств, включающая результаты исследований, оценённые как 2+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов, или экстраполированные доказательства из исследований, оценённых как 2++ |
| D | Доказательства уровня 3 или 4 или экстраполированные доказательства из исследований, оцененных как 2+ |
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета-анализов;
- систематические обзоры с таблицами доказательств.
Уровни доказательности (классификация Оксфордского центра доказательной медицины)
| Уровень | Тип данных |
| 1а | Доказательства, полученные в мета-анализах рандомизированных исследований |
| 1b | Доказательства, полученные как минимум в одном рандомизированном исследовании |
| 2а | Доказательства, полученные как минимум в одном хорошо спланированном контролируемом исследовании без рандомизации |
| 2b | Доказательства, полученные как минимум в одном хорошо спланированном полуэкспериментальном исследовании другого типа |
| 3 | Доказательства, полученные в хорошо спланированных неэкспериментальных исследованиях, таких как сравнительные, корреляционные исследования и описания клинических случаев ( случай—контроль ) |
| 4 | Доказательства, полученные из отчетов экспертных комиссий, на основе мнений или клинического опыта авторитетных специалистов |
Методы, использованные для формулирования рекомендаций:
- консенсус экспертов.
Экономический анализ:
- анализ стоимости не проводили и публикации по фармакоэкономике не анализировали.
Метод валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии врачей первичного звена и участковых терапевтов в отношении доходчивости изложения рекомендаций и оценки их важности как рабочего инструмента в повседневной практике.
Комментарии, полученные от экспертов, тщательно систематизированы и обсуждены председателем и членами рабочей группы. Каждый пункт обсужден, и внесенные в результате этого изменения в рекомендации зарегистрированы. Если же изменения не вносили, то регистрировали причины отказа от внесения изменений.
Консультация и экспертная оценка
Последние изменения в настоящих рекомендациях были представлены для дискуссии в предварительной версии на Российской гастроэнтерологической неделе в 2015 г.
Определение
Ахалазия кардии (синонимы: мегаэзофагус или долихоэзофагус, идиопатическое расширение пищевода, кардиоспазм и др.) — идиопатическое нервно-мышечное заболевание, проявляющееся функциональным нарушением проходимости кардии вследствие дискоординации между глотком, рефлекторным раскрытием нижнего пищеводного сфинктера (НПС) и двигательной и тонической активностью гладкой мускулатуры пищевода.
Код по МКБ 10
К.22.0. Ахалазия кардиальной части.
Эпидемиология
Ахалазию кардии считают редким заболеванием: ее распространенность составляет 10 случаев на 100000 населения, а заболеваемость — 1 на 100 000 населения. По сводным данным Б.В. Петровского (1962) и В.В. Уткина (1966), в качестве причины дисфагии она занимает третье место после рака и ожоговых стриктур пищевода, частота заболевания варьирует от 5 до 8%. По данным Т.А. Суворовой (1966) и А.З. Моргенштерна (1968), ахалазия кардии составляет 3,1-20% всех заболеваний пищевода. Идиопатическая ахалазия встречается на всех континентах, причем с одинаковой частотой у мужчин и женщин. У взрослых ахалазию кардии чаще всего диагностируют в возрастной группе от 25 до 60 лет [7, 30, 39].
История заболевания
Впервые ахалазия кардии описана в 1674 г. английским врачом Thomas Williams, который вылечил пациента с постоянной прогрессировавшей рвотой, расширив пищевод с помощью губки, насаженной на китовый ус. В 1882 г. J. Mikulich ввел в медицинскую литературу термин «кардиоспазм», объясняя сущность патологического процесса в кардии с помощью теории нарушения нервно-мышечной передачи вследствие выпадения функции блуждающих нервов, в результате чего возникает длительное сокращение гладко-мышечных волокон в области НПС. В 1914 г. в литературе появился термин «ахалазия кардии», который был предложен вначале С. Perry, а затем A. Hurst (1927), определившими ее как отсутствие релаксации (от греч. а — отсутствие, chalasis — расслабление). A. Hurst, наблюдавший около 20 пациентов с дисфагией и рвотой, предположил, что их причиной может быть отсутствие нормального рефлекторного расслабления НПС в ответ на глоток вследствие органического поражения ауэрбаховского сплетения. В последующие годы было установлено, что в патогенезе заболевания важную роль играет также нарушение тонуса и перистальтики пищевода.
В настоящее время в англоязычной литературе чаще всего используют именно термин «ахалазия кардии», тогда как в отечественных источниках встречаются оба названия заболевания — «ахалазия кардии» и «кардиоспазм». Это объясняется тем, что существуют две патогенетически разные формы функциональной непроходимости кардии, выделенные Plammer и Vinson еще в 1921 г., которые существенно различаются по клинической симптоматике, рентгенологической картине и результатам эзофагоманометрии, особенно в начальных стадиях [3, 38]. Эти различия обусловлены разными уровнями поражения парасимпатической нервной системы. Так, при морфологических исследованиях у больных с кардиоспазмом были выявлены значительные дегенеративно-дистрофические изменения в преганглионарных нейронах дорсальных ядер блуждающих нервов в стволе головного мозга, которые обусловливают нарушения центральной иннервации НПС, и менее выраженные — в постганглионарных нейронах ауэрбаховского сплетения. Считается, что в связи с нарушением центральной иннервации гладкая мускулатура НПС становится более чувствительной к ее физиологическому регулятору — эндогенному гастрину. Таким образом, при данном варианте течения заболевания наблюдается истинный спазм кардии [25]. При ахалазии кардии поражается преимущественно периферическое звено — постганглионарные нейроны интрамурального ауэрбаховского сплетения [16, 41], блуждающие нервы [14], симаптические нервные стволы и ганглии [6], в результате чего выпадает рефлекс открытия кардии в ответ на глоток. Поскольку центральная иннервация сохраняется, отсутствуют условия для возникновения повышенной чувствительности гладкой мускулатуры НПС к гастрину.
Следует отметить, что «ахалазическая» теория патогенеза этого заболевания получила распространение лишь в 50-60-х годах XX в., когда начали применять эзофаготонокимографию. В нашей стране эту методику разработал и внедрил в клиническую практику Андрей Леонидович Гребенев. Именно под его руководством были досконально изучены тонус и перистальтика пищевода у пациентов с ахалазией кардии.
Самым эффективным методом консервативного лечения ахалазии кардии всегда считали кардиодилатацию под рентгенологическим контролем, а хирургического — эзофагокардиомиотомию по Геллеру, которую необходимо дополнить неполной фундопликацией для предупреждения рефлюкса. В запущенных стадиях болезни выполняют экстирпацию пищевода с одномоментной пластикой желудочной трубкой [3, 7, 40]. Для расширения кардии вначале применяли металлический кардиодилататор, изобретенный Starck в 1924 г. (отечественную модификацию предложила Т.А. Тимофеева в 1968 г.), а в 50-х годах XX в. был создан пневматический кардиодилататор, который в нашей стране широко использовали в модификации, разработанной в 1964 г. О.Д. Федоровой и Г.М. Мельник.
А.Л. Гребенев и его ученики, имея большой опыт лечения таких пациентов, разработали показания и противопоказания к пневмокардиодилатации и тактику ведения больных после ее проведения. Однако у части больных, особенно при выраженном расширении пищевода (S-образный пищевод), проведение пневмодилататора под рентгенологическим контролем невозможно. При использовании рентгенологической методики, кроме того, отсутствует возможность оценки состояния слизистой оболочки в зоне пищеводно-желудочного перехода непосредственно после окончания вмешательства. Использование эндоскопической техники позволяет выполнить вмешательство под контролем зрения практически при любой степени ахалазии кардии и немедленно диагностировать возникшие осложнения [10, 19, 23, 26, 27, 37, 46 и др.].
Еще один способ эндоскопического лечения — интрамуральное введение ботулинового токсина. Этот метод применяют в основном за рубежом [42, 43, 55, 79 и др.], хотя и в России накоплен определенный опыт [19, 24].
В 2008 г. Н. Inoue (Япония) впервые вместо кардиодилатации и хирургической эзофагокардиомиотомии выполнил у человека пероральную эндоскопическую миотомию (РОЕМ) и в 2010 г. опубликовал результаты лечения первых 17 пациентов [62]. Эта операция, получившая к настоящему времени достаточно широкое распространение за рубежом, которую начали применять и в России, претендует на право стать «золотым стандартом» в лечении ахалазии кардии.
В настоящее время продолжается активное изучение идиопатической ахалазии кардии, и в первую очередь исследования ученых направлены на установление этиологии заболевания.
Этиология и патогенез
Перистальтика пищевода и расслабление НПС контролирует энтеральная нервная система (ЭНС), представляющая собой сложную сеть нервов и сплетений, работу которых координируют центральная нервная система и ядра блуждающего нерва, расположенные в дне IV желудочка. Нейроны, входящие в состав ЭНС, располагаются в ауэрбаховском межмышечном сплетении и контролируют двигательную активность желудочно-кишечного тракта. Существует два основных типа нейронов: тормозящие, нейротрансмиттерами которых являются оксид азота (NO) и вазоактивный интестиналъный пептид (ВИП), и возбуждающие, медиатором которых служит ацетилхолин.
Результаты гистологического исследования материала, полученного во время вскрытия и миотомии, свидетельствуют, что в межмышечных сплетениях развивается воспаление, в котором принимают участие CD3/CD8 — позитивные цитотоксические Т-лимфоциты, эозинофилы, тучные клетки, происходит потеря ганглионарных клеток и развивается фиброз. В начальных стадиях заболевания преобладает воспалительный компонент с поражением главным образом тормозящих нейронов, в которых осуществляется синтез NO и ВИП. При прогрессировании заболевания происходят полная потеря этих клеток и замещение их соединительной тканью. Потеря тормозящих NO-ергических нейронов приводит к неполному расслаблению НПС и характерному для ахалазии отсутствию перистальтики грудного отдела пищевода.
Несмотря на многовековую историю изучения ахалазии кардии, ее этиология до сих пор неизвестна. В настоящее время рассматриваются три основные гипотезы: генетическая, аутоиммунная и инфекционная.
Генетическая гипотеза. Наибольшее под тверждение эта гипотеза находит в педиатрической практике. Так, у детей самой частой причиной развития ахалазии кардии является мутация гена AAAS12q13, которая приводит к развитию аутосомно-рецессивного заболевания — так называемого синдрома Allgrove, или синдрома ААА, характеризующегося развитием ахалазии, алакримии и болезни Аддисона. Идиопатическая ахалазия кардии встречается также у детей с синдромами Дауна (примерно у 2%), Розицки и Робена.
У взрослых определенную роль в развитии заболевания играет полиморфизм некоторых генов. Так, в испанской популяции у мужчин моложе 40 лет с ахалазией кардии достоверно чаще выявляют полиморфизм гена IL23R Arg381 Gin. В той же испанской популяции гаплотип GCC промотора IL10 ассоциирован с развитием идиопатической ахалазии кардии.
Установлена также ассоциация данного заболевания со специфическим HLA-генотипом, которая выражается в том, что у пациентов с идиопатической ахалазией кардии с аллелями HLA DQA1 и DQB1 достоверно чаще выявляют ауто-антитела к межмышечным сплетениям.
Заслуживает внимания и теория о полиморфизме NO-синтазы (NOS), которая представляет собой фермент, катализирующий образование NO из аргинина, кислорода и NADPH. Существует три типа NOS: нейроналъная (nNOS), индуцибелъная (iNOS) и эндотелиальная (eNOS). Ответственные за них гены локализуются в хромосомах 12q24.2, 17q11.2-q12 и 7q36. В ряде работ показан полиморфизм всех трех генов у пациентов с ахалазией кардии, при этом чаще всего выявляли полиморфизм iNOS22*A/Ab и eNOS*4a4a.
Кроме NO, нейротрансмиттером тормозящих нейронов является ВИП. Один из его рецепторов — рецептор 1, который принадлежит к семейству секретиновых и экспрессируется различными иммунными клетками, такими как Т-лимфоциты, макрофаги и дендритные клетки. Полиморфизм этого гена (VIPR,) также может играть роль в развитии идиопатической ахалазии. VIPR, локализуется в хромосоме Зр22. В некоторых исследованиях были установлены пять его простых нуклеотидных полиморфизмов: (rs421558) Intron-1, (rs437876) Intron-4, (rs417387) Intron-6, rs896 и rs9677 (3’UTR).
Аутоиммунная гипотеза. Подтверждением этой гипотезы служит тот факт, что у пациентов с ахалазией кардии риск развития аутоиммунных заболеваний примерно в 3,6 раза выше, чем в общей популяции. По данным исследований, проведенных в Канаде, в которых приняли участие больные с ахалазией кардии, риск развития сахарного диабета 1-го типа у них выше в 5,4 раза, гипотиреоза — в 8,5 раза, синдрома Шегрена — в 37 раз, системной красной волчанки — в 43 раза, увеита — в 259 раз.
Результаты исследований в этой области свидетельствуют о наиболее частом сочетании ахалазии кардии и патологии щитовидной железы, которая в 20-25% случаев представлена гипотиреозом.
Рассматривая аутоиммунную природу заболевания, необходимо напомнить о циркулирующих аутоантителах. У пациентов с ахалазией кардии чаще всего обнаруживают следующие нейрональные аутоантитела: антитела к никотиновым рецепторам ацетилхолина — ганглионарного и мышечного типа, к кальциевым каналам — P/Q- и N-типа, к декарбоксилазе глутаминовой кислоты, к скелетным мышцам и антинейрональные нуклеарные антитела, известные также под названием anti-Hu. Так, в одном из последних крупных исследований, проведенном в клинике Мауо, установлено, что у 26% больных с идиопатической ахалазией кардии выявляют антитела к скелетным мышцам, а у 21% — к декарбоксилазе глутаминовой кислоты.
Инфекционная гипотеза. В течение многих лет болезнь Чагаса рассматривают как один из этиологических факторов в развитии ахалазии кардии. Это заболевание, называемое также «американский трипаносомоз», вызывается микроорганизмом Trypanosoma cruzi и встречается в странах Латинской Америки. Заболевание протекает в две фазы, первая из которых — острая и связана с циркуляцией паразитов в крови, а вторая проявляется в проникновении трипаносом в сердце и мышечный слой пищевода, где и происходит их кумуляция. Как следствие поражаются главным образом межмышечные сплетения пищевода, что в последующем приводит к дегенеративным изменениям в них и нарушению двигательной функции пищевода. Именно в эту фазу заболевания происходит нарушение функции расслабления НПС и развивается атония пищевода, которые проявляются дисфагией, пищеводной рвотой и болями по ходу пищевода при проглатывании пищи.
Высказано также предположение о вирусной природе идиопатической ахалазии кардии. Так, существует некая корреляция между ахалазией кардии и предшествующими инфекционными заболеваниями, в частности корью и опоясывающим герпесом (herpes zoster).
Клиническая картина
Основные симптомы заболевания — прогрессирующая дисфагия, регургитация и загрудинные боли, связанные с неполным опорожнением пищевода и хроническим эзофагитом [21, 22, 30, 34, 35, 45, 71 и др.].
Дисфагия возникает у 99% пациентов при употреблении твердой пищи и у 90-95% — жидкой. Характер возникновения дисфагии различен для двух форм заболевания. Так, при одной из них дисфагия развивается остро, обычно среди полного здоровья, после психотравмирующей ситуации. Чаще болеют молодые люди. Пациенты могут точно указать, когда они отметили появление симптомов и с чем это было связано. Часто дисфагия имеет парадоксальный характер: хорошо проходит твердая пища, а жидкость задерживается. Необходимо отметить, что нервное перевозбуждение, непривычная обстановка, разговоры во время еды и быстрый прием пищи, особенно плохо пережеванной и холодной, способствуют увеличению выраженности дисфагии. Дисфагия может сопровождаться чувством задержки пищи в пищеводе на какое-то время с последующим «провалом» ее в желудок.
Другая форма характеризуется постепенным развитием заболевания, часто в течение многих лет, без парадоксальной дисфагии. Чаще болеют лица среднего и пожилого возраста, которые не могут вспомнить, когда именно они заболели и что послужило причиной возникновения болезни: им кажется, что они болеют всю жизнь.
Пациент может самостоятельно уменьшить выраженность дисфагии, используя различные приемы: запивание пищи большим количеством жидкости, заглатывание воздуха, повторные глотательные движения, ходьба. Немаловажное значение имеет и температура принимаемой пищи: большинство больных отмечают, что лучше проходит теплая и горячая пища.
Ярким симптомом заболевания является активная и пассивная регургитация, которая отмечается у 84 и 68% больных соответственно. Активная регургитация представляет собой срыгивание только что съеденной пищи или слизи и более характерна для начальных стадий болезни. Она возникает при незначительной дилатации пищевода, тогда как значительное расширение пищевода может привести к отсроченной регургитации, объем которой значительно больше. Пассивная регургитация возникает вне приема пищи, обычно в горизонтальном положении пациента или при наклоне туловища вперед, чаще наблюдается при ахалазии кардии.
Регургитация, особенно пассивная, может сопровождаться аспирацией пищи в дыхательные пути, которая может привести к нарушению функции органов дыхания, сопровождающемуся одышкой и кашлем, и маскировать основное заболевание. Необходимо отметить, что ночной кашель наряду с симптомом «мокрой подушки» свидетельствуют о декомпенсации заболевания и служат абсолютным показанием к проведению пневмокардиодилатации.
Еще одна характерная жалоба больных — боли в груди, которые наблюдаются примерно у 59% из них, чаще в молодом возрасте. При повышении давления в НПС и грудном отделе пищевода возникает интенсивная спастическая загрудинная боль, тогда как при атонии грудного отдела пищевода отмечаются умеренно выраженные боли за грудиной распирающего характера. Боли могут возникать во время приема пищи вследствие перерастяжения стенок пищевода и проходить после срыгивания или «проваливания» пищи в желудок. Они также могут быть вызваны спазмом гладкой мускулатуры пищевода и возникать как во время приема пищи, так и без четкой связи с ним. Для 1/3 больных с ахалазией кардии характерна жгучая боль по ходу пищевода, возникающая вследствие прямого раздражающего действия на пищевод остатков задержавшихся в нем пищи и лактата, продукция которого повышена при избыточной бактериальной ферментации сохраняющихся в пищеводе углеводов.
Один из симптомов ахалазии — уменьшение массы тела, которое наблюдается у 61% больных и коррелирует с тяжестью течения заболевания. Средняя потеря массы тела составляет 5-10 кг.
Примерно у 8% пациентов возникает икота, основной причиной которой является длительная обструкция дистального отдела пищевода, приводящая к раздражению диафрагмального нерва.
Дифференциальный диагноз
Дифференциальный диагноз ахалазии кардии проводят со следующими заболеваниями:
- кардиоэзофагеальным раком, для которого характерна прогрессирующая дисфагия, как и для истинной ахалазии. Однако быстрое уменьшение массы тела, короткий анамнез, часто пожилой возраст пациентов к моменту появления дисфагии свидетельствуют о злокачественном поражении. При физикальном осмотре можно выявить пальпируемое образование в брюшной полости и лимфаденопатию. При рентгенологическом исследовании с бариевой взвесью просвет пищевода может быть умеренно дилатирован, но степень расширения не коррелирует с выраженностью дисфагии. В дистальном отделе имеется сужение, но в отличие от такового при ахалазии оно не имеет характерного вида птичьего клюва или мышиного хвостика с постепенным симметричным сужением просвета и гладкими стенками, а чаще эксцентрично, с обрывом по типу ступеньки и неровными бугристыми контурами. Для установления точного диагноза необходимо проведение эзофагогастродуоденоскопии (ЭГДС). При малейшем подозрении на наличие злокачественного процесса в области кардии обязательным является получение материала для гистологического и цитологического исследований, поскольку рак развивается у 3-8% больных с ахалазией [30]. Необходимо помнить о возможности развития рака не только в области пищеводно-желудочного перехода, но и в стенке воспаленного расширенного пищевода;
- пептической стриктурой, являющейся осложнением длительно текущей гастроэзофагеальной рефлюксной болезни (ГЭРБ). Для нее также характерна дисфагия: в начальных стадиях отмечается затрудненное прохождение по пищеводу только твердой пищи, тогда как в более поздних стадиях присоединяется нарушение пассажа кашицеобразной пищи и жидкостей. Дисфагии, как правило, предшествует длительно существующая изжога, часто возникающая в ночное время, однако к моменту формирования стриктуры изжога прекращается. Для дифференциальной диагностики важно проведение манометрии и рентгенографии пищевода с контрастированием, результаты которого свидетельствуют об отсутствии значимого расширения просвета пищевода, а в вертикальном положении больного контрастное вещество (взвесь сульфата бария) в отличие от ахалазии кардии длительно в пищеводе не задерживается. При ЭГДС могут быть выявлены эрозии;
- ишемической болезни сердца (ИБС), основное клиническое проявление которой — боли в груди. Этот симптом практически невозможно отличить от такового при ахалазии кардии, особенно если ИБС провоцируется приемом пищи. Не помогает в плане дифференциальной диагностики и эффект от приема нитроглицерина, так как боли при ахалазии, как и при ИБС, купируются после его приема. ЭКГ также не всегда позволяет уточнить диагноз, так как ишемия миокарда очень часто имеет скрытый характер и выявляется лишь при физической нагрузке. В связи с этим в спорных ситуациях необходимо проводить комплексное кардиологическое обследование, включающее велоэргометрию или тредмил-тест, эхокардиографию и комбинированное исследование — суточное холтеровское мониторирование и 24-часовую рН-метрию;
- врожденными мембранами и кольцами пищевода, которые при их небольшом размере часто остаются бессимптомными и манифестируют после введения в рацион ребенка твердой пищи такими симптомами, как дисфагия и срыгивание во время или после кормления. У детей более старшего возраста возникает характерная для идиопатической ахалазии рвота содержимым пищевода, что усложняет установление правильного диагноза;
- неврогенной анорексией, которая обычно возникает у молодых женщин в отличие от ахалазии, одинаково часто развивающейся у мужчин и женщин, и характеризуется дисфагией и рвотой содержимым желудка, часто провоцируемыми психотравмирующими ситуациями. Для данного заболевания также характерно значительное уменьшение массы тела.
Диагностика
Лабораторные исследования
Всем пациентам с ахалазией кардии необходимо выполнить общий анализ крови (определение уровня эритроцитов, гемоглобина, лейкоцитов, тромбоцитов), оценить коагулограмму (для определения риска развития кровотечения перед выполнением пневмокардиодилатации или оперативным вмешательством), установить уровень сывороточного креатинина и альбумина, провести общий анализ мочи (определение кетоновых тел, которые обнаруживают в моче при длительном голодании).
Инструментальные исследования
Для подтверждения диагноза идиопатической ахалазии необходимо использовать инструментальные методы обследования, такие как рентгенография пищевода с контрастированием, ЭГДС и манометрия, которая признана «золотым стандартом» диагностики.
Некоторые авторы рекомендуют перед проведением рентгеноконтрастного исследования выполнить обзорную рентгенографию грудной клетки, по результатам которой можно определить наличие уровня жидкости в средостении, обусловленного застоем пищевых масс в пищеводе, а также выявить расширение средостения и отсутствие газового пузыря желудка. Рентгеноконтрастное исследование выполняют с бариевой взвесью, при этом оценивают степень расширения пищевода, его деформацию (S-образный пищевод), длительность задержки контрастной массы в пищеводе, рельеф абдоминального отдела пищевода и области пищеводно-желудочного перехода в момент открытия кардиоэзофагеального сфинктера, наличие или отсутствие газового пузыря желудка и некоторые другие параметры (рис. 1).
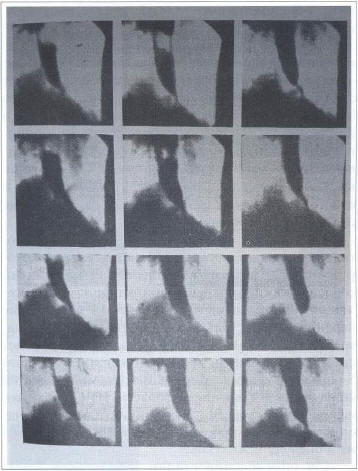
Рис. 1. Рентгенограммы пищевода. Умеренное расширение пищевода, длительная задержка в нем бариевой взвеси. Раскрытия кардии при проглатывании контрастного вещества не происходит, оно начинает поступать в желудок тонкой струей лишь при значительном наполнении пищевода, заметны слабые неперистальтические сокращения, не смыкающие стенки пищевода (данные Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепа-тологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 1. Esophageal X-ray. Moderate esophageal dilation, prolonged retention of the barium meal. Opening of the cardia does not occur at swallowing of the contrast substance, it starts to enter the stomach by a thin stream only at significant filling of the esophagus, weak peristaltic contractions not bringing esophageal walls together may be seen (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
У больных с кардиоспазмом при рентгенологическом исследовании выявляют усиление моторики пищевода с выраженными сегментарными сокращениями, при ахалазии кардии — снижение моторной активности пищевода (отсутствие первичной перистальтики в дистальных 2/3 пищевода). При обеих формах заболевания просвет пищевода расширен, иногда может иметь С- или S-образную форму, типичной находкой является конусовидное сужение в области НПС, похожее на мышиный хвостик или птичий клюв, отмечается замедление эвакуации контрастного вещества из пищевода в желудок.
Для определения стадии заболевания предложены многочисленные классификации, например четырехстадийная классификация кардиоспазма Б.В. Петровского (1962), классификация Т.А. Суворовой (1966), впоследствии дополненная А.Л. Гребеневым (1987), в которой выделены два типа ахалазии пищевода; трехстадийная классификация кардиоспазма, предложенная Г.Д. Вилявиным (1978). Однако наибольшее распространение получила классификация Б.В. Петровского:
I стадия — функциональный непостоянный спазм кардии без расширения пищевода;
II стадия — стабильный спазм кардии с нерезко выраженным расширением пищевода и усиленной моторикой стенок;
III стадия — рубцовые изменения (стеноз) мышечных слоев НПС с выраженным расширением пищевода и нарушениями тонуса и перистальтики;
IV стадия — резко выраженный стеноз кардии со значительной дилатацией, удлинением, S-образной деформацией пищевода, эзофагитом и периэзофагитом.
Для ахалазии кардии характерна положительная проба Хурста, когда начало опорожнения пищевода происходит вне акта глотания и зависит от высоты столба бариевой взвеси, при повышении гидростатического давления НПС раскрывается и контрастное вещество «проваливается» в желудок.
При проведении контрастного исследования важное значение имеют фармакологические пробы. Широкое распространение получила проба с нитроглицерином: через некоторое время после введения бариевой взвеси пациент помещает под язык 1-2 таблетки нитроглицерина, что при ахалазии приводит к снижению тонуса НПС и быстрому продвижению контрастного вещества из пищевода в желудок. Проводят также пробы с карбахолином и ацетилхолином, при введении которых возникают непропульсивные беспорядочные сокращения мускулатуры в грудном отделе пищевода и повышается тонус НПС, что приводит к длительной задержке бариевой взвеси в пищеводе. Похожий эффект дает введение синтетического аналога холецистокинина синкалида, который в норме расслабляет НПС, однако из-за утраты тормозящих нейронов развивается парадоксальный эффект в виде его стойкого сокращения, что вызывает задержку контрастного вещества в пищеводе.
При возникновении подозрения на наличие ахалазии кардии необходимо провести ЭГДС с целью исключения псевдоахалазии, которую выявляют у 2-4% пациентов с диагнозом ахалазии. При эндоскопическом исследовании в первую очередь обращают внимание на степень дилатации и девиации просвета пищевода, наличие в нем остатков пищи, принятой накануне, жидкости и слизи. Одновременно оценивают состояние слизистой оболочки пищевода, ее толщину, цвет, блеск, определяют наличие перистальтики.
После визуализации кардии, которую не всегда легко осуществить при значительно деформированном пищеводе, оценивают ее положение относительно оси пищевода, наличие воспалительных и рубцовых изменений слизистой оболочки в этой зоне, эластичность стенок, равномерность раскрытия кардии при инсуффляции воздуха и возможность проведения эндоскопа в желудок. Необходимым условием обеспечения безопасности исследования является выполнение его только под визуальным контролем, исключая проведение аппарата «вслепую» через остатки пищи и слизь, так как в этом случае высока опасность перфорации стенки пищевода, измененной в результате хронического воспалительного процесса.
Заключительный этап эндоскопического исследования включает тщательный осмотр желудка и двенадцатиперстной кишки и обязательный ретроградный осмотр кардии для исключения кардиоэзофагеального рака.
Стадию заболевания целесообразно определять, основываясь на следующих критериях [8].
При I стадии заболевания эндоскопических изменений просвета пищевода, перистальтики, состояния слизистой оболочки, положения кардии и ее открытия выявить не удается.
При II стадии определяется умеренное (до 3-4 см) расширение просвета пищевода; остатков пищи в пищеводе, как правило, нет, может быть небольшое количество прозрачной жидкости или слизи; слизистая оболочка гладкая, ровная, блестящая, ее складки расположены продольно; перистальтика усилена; кардия расположена по центру, обычно плотно сомкнута, но достаточно легко раскрывается при избыточной (по сравнению с обычным эндоскопическим исследованием) инсуффляции воздуха (рис. 2). При ретроградном осмотре складки в области нищеводно-желудочного перехода плотно обхватывают эндоскоп, слизистая оболочка мягкая, эластичная.
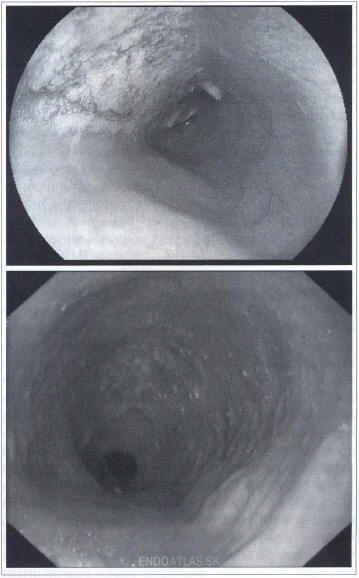
Рис. 2. Эндофото. Наличие пенистой слизи и остатков пищи в расширенном пищеводе (данные Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 2. Endoscopic photograph. Foamy mucus and food remnants are visible in non-dilated esophagus (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
В III стадии кардиоспазма и ахалазии кардии пищевод расширен до 4-8 см, в его просвете остатки жидкой и твердой пищи, много слизи. Перистальтика очень вялая или «рваная» из-за снижения мышечного тонуса пищевода, вследствие чего формируются четкообразные участки — неравномерное расширение просвета на разных уровнях. В дистальном отделе пищевода отмечается начинающаяся S-образная деформация, из-за чего кардия расположена эксцентрично, отклоняясь вначале вправо от продольной оси пищевода, а затем немного влево. Вторая часть изгиба становится более выраженной при про-грессировании болезни. Выраженный изгиб свидетельствует о начинающемся удлинении пищевода, что проявляется в увеличении расстояния от резцов до кардии: вместо 38-40 см в норме 41-45 см или более. Кардия, как правило, плотно сомкнута, раскрывается при избыточной инсуффляции воздуха. Слизистая оболочка пищевода несколько утолщена, может быть гиперемирована в дистальном отделе.
При IV стадии заболевания просвет пищевода значительно расширен (часто более 8-10 см), пищевод удлинен и извит, имеет вид неперистальтирующего мешка вследствие отсутствия мышечного тонуса. В просвете содержится большое количество жидкости и остатков пищи. Слизистая оболочка утолщена, рыхлая, местами имеет крупноячеистый вид, иногда с эрозиями, обусловленными длительным стазом пищи или развитием кандидозного эзофагита, отмечается поперечная складчатость слизистой оболочки из-за удлинения и растяжения пищевода. Очень часто пищевод заканчивается «слепым мешком», заполненным остатками пищи, а кардия резко смещена в сторону и, как правило, находится выше дна этого «мешка». Расстояние от резцов до кардии в ряде случаев значительно увеличено — от 45 до 70 см. Часто она сомкнута неплотно, возможны рубцовые изменения слизистой оболочки.
Визуализация кардии при III и особенно IV стадиях кардиоспазма может быть затруднена из-за большого количества содержимого в пищеводе и резкой деформации просвета, так как могут наблюдаться несколько изгибов пищевода. Однако необходимо отметить, что при любой стадии ахалазии кардии, в отличие от органического стеноза на уровне пищеводно-желудочного перехода (злокачественная опухоль или рубцовая стриктура), удается провести эндоскоп в желудок без сопротивления. Затруднения связаны не с преодолением спазма как такового, а с удлинением пищевода и формированием одного или нескольких «колен», в том числе в верхней трети, и эксцентричным положением кардии. Если же для проведения эндоскопа через кардию требуется заметное усилие или осуществить его не удается, отмечается выраженное «побеление» стенок пищевода и пищеводно-желудочного перехода из-за ригидности, необходимо заподозрить опухолевый характер стеноза.
Как правило, каждой клинико-рентгенологической стадии кардиоспазма и ахалазии кардии соответствует определенная эндоскопическая картина, на основании которой стадия болезни может быть установлена и без предшествующего рентгенологического исследования, если оно не может быть выполнено по каким-либо причинам (рис. 3-5).
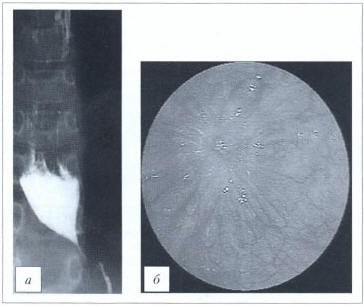
Рис. 3. Кардиоспазм II стадии. а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»)
Fig. З. Second-degree cardiac spasm. а — Х-гау film; b — endoscopic photograph (data of Petrovsky National Research Сеntег of Surgery)
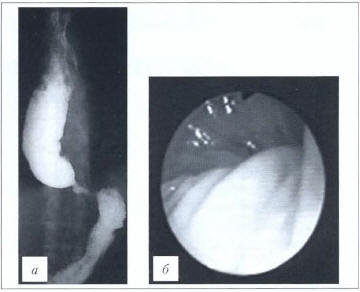
Рис. 4. Кардиоспазм III стадии. а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»
Fig. 4. Тhiгd-dеgгее cardiac spasm. а — Х-гау film; b — endoscopic photograph (data of Petrovsky National Research Сеntег of Surgery)
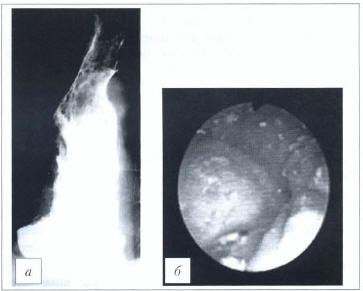
Рис. 5. Кардиоспазм IV стадии. а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»)
Fig. 5. Fоuгth-dеgгее cardiac spasm. а — Х-гау film; b — endoscopic photograph (data of Petrovsky National Research Сеntег of Surgery)
«Золотым стандартом» обследования пациентов при подозрении на ахалазию кардии является манометрия. В настоящее время для исследования двигательной функции пищевода можно использовать как метод открытых катетеров (водно-перфузионная манометрия), так и современные высокотехнологичные методы — манометрию высокой разрешающей способности (high resolution manometry — HRM) и объемную 3D-манометрию, которые имеют явные преимущества по сравнению с манометрией, выполняемой с помощью 4- или 8-канального водно-нерфузионного катетера. При расположении датчиков давления на расстоянии 5 см друг от друга большие участки перистальтической волны грудного отдела пищевода «выпадают» из анализа. Так, подтягивание НПС и укорочение грудного отдела пищевода у больных с ахалазией кардии часто принимают за истинное, хотя и недостаточное, расслабление сфинктера («псевдорелаксация»). Использование многоканальных катетеров при манометрии высокой разрешающей способности позволяет избежать подобных ошибок (рис. 6).
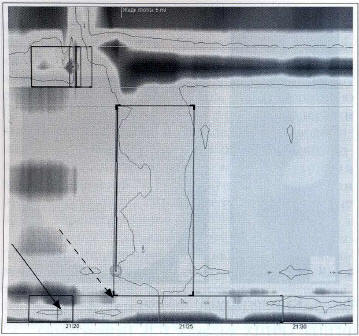
Рис. 6. Подтягивание НПС и укорочение грудного отдела пищевода у пациента с ахалазией кардии. Сплошная стрелка — истинное расположение НПС, пунктирная — подтягивание НПС (данные Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова») Fig. 6. Shifting of LES and shortening of thoracic esophagus in cardiac achalasia. Solid arrow — true location of LES, dotted arrow — shifting of LES (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
При анализе результатов обследования пациентов с ахалазией кардии, проведенного с использованием манометрии высокого разрешения, следует учитывать Чикагскую классификацию нарушений моторики пищевода, созданную в 2008 г.
Чикагская классификация нарушений моторики пищевода
| Ахалазия | Тип I Тип II Тип III Нарушение проходимости кардии |
| Заболевания, связанные с нарушением моторики | Диффузный эзофагоспазм Чрезмерная интенсивность сокращений (DCI >8000 — «отбойный молоток») Гипокинезия/отсутствие сокращений |
| Изменения перистальтики | Нарушение перистальтики с большими разрывами Нарушение перистальтики с малыми разрывами Незавершенная перистальтика Ускоренные сокращения Гиперкинезия грудного отдела пищевода («пищевод щелкунчика») |
Применение этого метода исследования позволило выделить три типа ахалазии кардии в зависимости от выявленных изменений двигательной активности грудного отдела пищевода, что дает возможность более точно прогнозировать эффективность лечения с помощью пневмокардиодилатации (рис. 7).

Рис. 7. Три типа ахалазии кардии. а — I тип; б — II тип; в — III тип (данные Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 7. Three types of cardiac achalasia. a — type I; б — type II; в — type 3 (data of Vasilcnko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
Для всех типов заболевания характерны повышение суммарного давления расслабления (выше 15 мм рт. ст.) и отсутствие перистальтической волны сокращения грудного отдела пищевода, при этом давление покоя (Resting Pressure) может быть повышено или в пределах нормальных значений (норма 10-35 мм рт. ст.). При I типе (классическая ахалазия кардии) при 100% влажных глотков отсутствует любая перистальтика грудного отдела пищевода. При ахалазии кардии II типа отсутствует нормальная перистальтическая волна сокращения, однако наблюдается равномерное спастическое сокращение умеренной интенсивности по всей длине пищевода от верхнего до нижнего пищеводного сфинктера более чем при 20% влажных глотков. Ахалазия кардии III типа характеризуется отсутствием нормальной перистальтической волны, наличием отдельных эпизодов перистальтики в грудном отделе пищевода или преждевременными спастическими сокращениями (дистальный эзофагоспазм), зарегистрированными более чем при 20% влажных глотков.
Истинную ахалазию кардии следует отличать от феномена нарушения проходимости кардии, при котором повышается суммарное давление расслабления НПС, однако сохраняется нормальная перистальтика грудного отдела пищевода или отмечается снижение интенсивности сокращения в этом отделе с малыми разрывами.
Наилучших результатов лечения достигают у пациентов с ахалазией II типа. В то же время отсутствие перистальтики (I тип) и выраженную гипермоторную дискинезию грудного отдела пищевода (III тип) можно рассматривать в качестве прогностических критериев высокого риска рецидива ахалазии кардии после кардиодилатации.
Лечение
Существующие методы лечения кардиоспазма и ахалазии кардии (консервативные, эндоскопические, хирургические) направлены на расширение кардии тем или иным способом либо снижение ее тонуса, для того чтобы улучшить прохождение пищи через область пищеводно-желудочного перехода.
Диета и модификация образа жизни
Пациентам с ахалазией кардии необходимо назначить диету по типу пищеводного стола с исключением острых и кислых продуктов; пища должна быть теплой, принимать ее нужно медленно, тщательно пережевывая. Оптимальным считается 4- или 5-разовое питание небольшими по объему порциями. Следует также отметить, что существует индивидуальный набор продуктов, усиливающих дисфагию у конкретных пациентов, которые целесообразно исключить из рациона.
После приема пищи не следует принимать горизонтальное положение во избежание ее регургитации. Во время сна пациент не должен находиться в строго горизонтальном положении, так как пища может задерживаться в пищеводе до нескольких часов, а верхний пищеводный сфинктер расслабляется во время сна, что приводит к пассивной регургитации и возможной аспирации дыхательных путей.
Лекарственная терапия
Для консервативного лечения пациентов с ахалазией кардии используют две группы препаратов: блокаторы кальциевых каналов и нитраты. Чаще всего применяют нифедипин и изосорбида мононитрат в дозе 5-10 мг, которые следует принимать за 20 — 30 мин до приема пищи. Эти лекарственные средства снижают давление НПС в среднем на 47-63%, однако полностью купировать симптомы ахалазии удается редко. Необходимо также помнить о возможных побочных эффектах этих препаратов, из которых наиболее часто возникают головная боль, артериальная гипотензия, головокружение. В связи с этим лекарственную терапию применяют в случае невозможности использовать альтернативные методы при лечении пациентов, ожидающих выполнения пневмокардиодилатации или хирургического лечения, и как сопутствующую терапию у больных с ахалазией кардии, сопровождающейся рефрактерной болью в груди.
Пневмокардиодилатация
При лечении всех больных с ахалазией кардии первично целесообразно использовать неоперативные методы, основным из которых остается ступенчатая баллонная пневматическая дилатация (ПД) под флюороскопическим контролем. Эта методика практически вытеснила применявшуюся ранее дилатацию кардии с помощью металлического дилататора Штарка благодаря существенно меньшей травматичности. Эффективность ПД варьирует от 60 до 85% [3, 4, 7, 9, 39, 92, 101, 104 и др.], снижаясь пропорционально количеству проводимых курсов лечения. У 30-40% больных возникает рецидив клинической симптоматики, в связи с чем требуется повторное лечение.
Процедура основана на расширении суженного участка пищеводно-желудочного перехода с помощью кардиодилататора, в результате чего снижается давление НПС и улучшается пассаж пищи по пищеводу. Для этого используют пневмодилататоры, смонтированные на желудочном зонде, которые имеют форму гантели для лучшей фиксации в зоне пищеводно-желудочного перехода (ЗАО «МедСил», Россия). Дилатацию выполняют под рентгенологическим контролем, однако в случаях выраженного расширения, удлинения и деформации пищевода, проявляющейся в значительном отклонении его от продольной оси (С- или S-образный пищевод), проведение пневмодилататора под рентгенологическим контролем затруднено или невозможно. Использование эндоскопической техники позволяет выполнить дилатацию под контролем зрения при заболевании в любой стадии, а также оценить состояние слизистой оболочки в зоне пищеводно-желудочного перехода непосредственно после окончания вмешательства и немедленно диагностировать возникшие осложнения. Эндоскопические вмешательства являются методом выбора при поздних стадиях кардиоспазма и ахалазии кардии у пациентов, у которых высок операционно-анестезиологический риск.
Лечебную процедуру выполняют с помощью кардиодилататора, который надевают на дистальную часть эндоскопа. Диаметр баллона для дилатации кардии в широкой части составляет 30 и 40 мм, в области «талии» — 25 и 30 мм, длина – 12-15 см. Баллон укреплен на полой трубке, внутренний диаметр которой соответствует наружному диаметру эндоскопа и составляет 9-10 мм, длина – 17-20 см. К проксимальному концу баллона присоединена трубка диаметром около 3 мм для инсуффляции воздуха или введения воды в баллон. «Талия» в средней части баллона облегчает его фиксацию в кардии.
Давление при кардиодилатации повышают постепенно — от 120-160 мм рт. ст. в начале лечения до 300-320 мм рт. ст. в конце курса. Экспозиция составляет 1-2 мин, для достижения эффекта требуется в среднем 4-5 сеансов. Уровень давления контролируют с помощью манометра.
Для проведения дилатации кардии применяют также дилататоры «Rigiflex» («Boston Scientific», MA, США), представляющие собой полиэтиленовые баллоны трех диаметров — 30, 35 и 40 мм. Аналогичные баллоны диаметром 30 и 35 мм производит фирма «Cook Medical» (США).
ПД можно проводить как под рентгенологическим контролем, так и с помощью эндоскопической техники по введенной в желудок через канал эндоскопа направляющей струне. Процедура заключается в установке баллона точно в месте перехода пищевода в желудок. При извитом пищеводе для правильного позиционирования баллона в кардии необходим визуальный контроль, для чего параллельно баллону вводят эндоскоп. Для предупреждения осложнений (перфорация, кровотечение) очень важно избегать форсированной дилатации и повышать давление в баллоне постепенно в течение нескольких сеансов от 160 до 300 мм рт. ст. в течение 40-60 с. Баллон может быть заполнен не только воздухом, но и жидкостью — водой или водорастворимым контрастным веществом для лучшей визуализации. Такая процедура называется гидродилатацией кардии, ее выпоняют, как правило, при давлении 0,5-2 атм в течение 2 мин. Уровень давления контролируют с помощью манометра.
Эффективность терапии достаточно высокая, зависит от диаметра кардиодилататора и через 3 года составляет в среднем 74, 86 и 90% при использовании баллонов диаметром 30, 35 и 40 мм соответственно.
После дилатации и для мониторирования состояния после лечения, которое необходимо проводить 1 раз в год, жалобы пациентов могут быть оценены по шкале Eckardt.
Шкала Eckardt
| Симптомы | Баллы* | |||
| 0 | 1 | 2 | 3 | |
| Дисфагия | Никогда | Периодически | 1 раз в день | Каждый прием пищи |
| Регургитация | Никогда | Периодически | 1 раз в день | Каждый прием пищи |
| Боли в груди | Никогда | Периодически | 1 раз в день | Каждый прием пищи |
| Уменьшение массы тела, кг | Нет | <5 | 5-10 | >10 |
* 0-3 балла — ремиссия, более 4 баллов — неэффективность ПД.
Кроме улучшения клинического течения заболевания, предиктором длительной ремиссии после ПД является давление НПС<10 мм рт. ст., измеренное по окончании процедуры. После ПД необходимо провести контрольное рентгенологическое исследование пищевода с контрастированием. На эффективность ПД оказывают положительное влияние ряд факторов, такие как возраст пациентов более 40 лет, II тип ахалазии кардии по данным HRM, начальная стадия заболевания, давление НПС <10 мм рт. ст. после проведенной ранее ПД, эвакуация из пищевода более 50% бариевой взвеси через 1 мин от начала проведения рентгеноскопии с контрастированием. К факторам, оказывающим негативное влияние на эффективность ПД, относят: мужской пол, I и III типы ахалазии по данным HRM, давление НПС >15 мм рт. ст. после ранее выполненной ПД, эвакуация из пищевода менее 50% бариевой взвеси через 1 мин от начала рентгеноскопии пищевода, однократно проведенная ПД с использованием баллона диаметром 30 мм.
Необходимо помнить, что самым тяжелым осложнением ПД, которое наблюдается в 1,5-3% случаев, является перфорация стенки пищевода. Однако использование современных дилататоров и опыт специалистов, выполняющих ПД, позволяют значительно снизить риск ее возникновения. После ПД могут отмечаться также боли в груди, повреждение слизистой оболочки пищевода и гематома, повышение температуры тела и аспирационная пневмония, однако риск их развития очень мал. Достаточно редко после процедуры развивается ГЭРБ.
Введение ботулинотоксина
Еще в 1994 г. в зарубежной литературе появились сообщения об использовании ботулинового токсина А для эндоскопического лечения кардиоспазма и ахалазии кардии [42, 43, 49, 60, 79 и др.]. Ботулиновый токсин оказывает расслабляющее действие на гладкую мускулатуру путем блокирования выброса медиатора парасимпатической нервной системы ацетилхолина холинергическими нейронами и нарушения нервно-мышечной передачи. При этом процесс синтеза и депонирования ацетилхолина в пресинаптической терминали синапса не нарушается [20, 55]. Введение ботулинового токсина А в зону кардии приводит к снижению базального и остаточного давления НПС.
Процедура основана на интрамуральном эндоскопическом введении ботулинового токсина А в НПС в дозе 80-100 ЕД, при этом 1 мл препарата (20-25 ЕД) вводят с помощью иглы диаметром 5 мм для склеротерапии в каждый из четырех квадрантов НПС под визуальным контролем.
Эффективность терапии составляет около 80% в течение 1-го месяца наблюдения, 70% после 3 мес, 50% через 6 мес и около 40% через 1 год, в связи с чем иногда требуется повторная инъекция ботулинового токсина.
Несмотря на безопасность и простоту выполнения, этот метод можно рассматривать в качестве альтернативного варианта только при лечении пациентов, имеющих абсолютные противопоказания к пневмокардиодилатации, эндоскопическому и оперативному вмешательству, особенно если речь идет о лицах старшей возрастной группы, наличии тяжелой сопутствующей патологии сердечно-сосудистой и бронхолегочной систем, а также при наличии S-образного пищевода [9].
К факторам, оказывающим негативное влияние на эффективность этого метода, относят: молодой возраст пациентов, мужской пол, высокое давление покоя НПС, отсутствие эффекта от предыдущих инъекций ботулинового токсина, а наиболее выраженный эффект от лечения можно ожидать у людей пожилого возраста и пациентов с ахалазией и выраженной гипермоторной дискинезией грудного отдела пищевода. Следует также отметить, что до настоящего времени в Российской Федерации препарат «Диспорт» не зарегистрирован в качестве средства для применения в гастроэнтерологии, его разрешено использовать лишь в неврологии и косметологии. Для лечения ахалазии кардии препарат применяют в Республике Татарстан по специальному разрешению Министерства здравоохранения этого субъекта РФ.
Хирургическое лечение
При неэффективности нехирургических методов лечения решают вопрос о необходимости выполнения оперативного вмешательства. Следует отметить, что выполняемая в ряде лечебных учреждений эзофагокардиомиотомия по Геллеру, заключающаяся в рассечении мышечной оболочки нижнего конца расширенного сегмента пищевода и кардиальной части желудка по передней и задней стенкам, у 15% больных осложняется развитием ГЭРБ. В связи с этим основным оперативным вмешательством является эзофагокардиомиотомия с неполной фундопликацией для предупреждения рефлюкса. Согласно отдаленным результатам, по эффективности она превосходит ПД, однако из-за травматичности любого оперативного вмешательства, необходимости анестезиологического пособия и вероятности развития послеоперационных осложнений этот метод лечения применяют при неэффективности повторных ПД.
В настоящее время для лечения кардиоспазма широко применяют лапаро- и торакоскопические операции, из которых предпочтение отдают лапароскопической миотомии с частичной фундопликацией в различных модификациях, обеспечивающей беспрепятственное прохождение пищи у пациентов с ослабленной моторикой пищевода, с одной стороны, и предупреждающей рефлюкс — с другой [1, 71, 92, 101 и др.]. Эффективность минимально инвазивных вмешательств не уступает таковой открытых хирургических операций — 94 и 84% соответственно, а частота послеоперационных осложнений ниже. К сожалению, после хирургического лечения также в ряде случаев возникает рецидив дисфагии, в связи с чем требуется повторное проведение консервативного, в том числе с использованием эндоскопических методов, или хирургического лечения.
В терминальной стадии заболевания выполняют экстирпацию или субтотальную резекцию пищевода с одномоментной пластикой желудочной трубкой, в том числе с применением лапаро-и торакоскопической техники. Показания к выбору метода оперативного вмешательства определяют индивидуально [1, 36 и др.].
В 2007 г. был предложен и апробирован на живых свиньях новый метод лечения ахалазии, заключающийся в обеспечении прямого доступа к мышечному слою пищевода через туннель, созданный в подслизистом слое (один из вариантов NOTES — внутрипросветной эндоскопической хирургии через естественные отверстия) [80]. У человека эта операция, получившая название «пероральная эндоскопическая миотомия» (РОЕМ), впервые выполнена в 2008 г. [62]. С этого времени операцию стали быстро внедрять в клиническую практику, и к настоящему времени она выполнена уже нескольким сотням пациентов [52, 63, 86, 87, 96, 109, 111 и др.].
Авторы рассматривают эту методику в качестве альтернативы баллонной кардиодилатации и эзофагокардиомиотомии по Геллеру. Суть ее состоит в следующем: с помощью специальных инструментов, введенных по инструментальному каналу гибкого эндоскопа, делают продольный надрез слизистой оболочки пищевода на протяжении 1,5-3 см примерно на 10-12 см выше пищеводно-желудочного перехода, через который в подслизистый слой вводят эндоскоп. Вместо воздуха инсуффлируют углекислый газ для предупреждения развития пневмомедиастинума и пневмоперитонеума. Под визуальным контролем на всем протяжении вплоть до малой кривизны желудка как минимум на 3 см ниже пищеводно-желудочного перехода создают туннель между слизистой оболочкой и мышечным слоем путем последовательного пересечения соединительнотканных волокон и сосудов после порционного введения изотонического раствора натрия хлорида с добавлением, как правило, раствора высокой вязкости, чаще всего на основе глицерола и гиалуроновой кислоты, подкрашенного индигокармином или метиленовым синим для лучшей визуализации. Рассечение волокон выполняют специальными ножами различной формы разных производителей («Olympus», «Fujifilm», «ERBE» и др.). Затем постепенно рассекают циркулярные мышечные волокна в направлении сверху вниз. Дефект в слизистой оболочке клипируют.
РОЕМ — эффективная и достаточно безопасная процедура. Исследователи сообщают об уменьшении выраженности симптомов дисфагии с 10 баллов до 1,3 балла, снижении давления НПС с 52,4 (14,2-80,5) до 19,8 (9,3-42,7) мм рт. ст. в течение в среднем 5 мес. При оценке жалоб пациентов по шкале Eckardt отмечается значительное улучшение состояния: если до операции средняя оценка составляла 7-8 баллов, то после нее у всех пациентов она была ниже 3 баллов, в основном 0-1 балл. Частота развития ГЭРБ варьирует, согласно данным разных авторов, от 0 до 37% [109].
Однако технически эта процедура достаточно сложная и длительная даже в руках опытных специалистов, выполняют ее под наркозом. Необходимо проведение дальнейших проспективных рандомизированных исследований для оценки ближайших и отдаленных результатов РОЕМ и определения ее места в алгоритме современных методов лечения кардиоспазма и ахалазии кардии.
Прогноз
Ахалазия кардии может быть отнесена к предраковым заболеваниям, поскольку известно, что рак развивается у 3-8% больных с кардиоспазмом и ахалазией кардии и вероятность его возникновения возрастает с увеличением продолжительности заболевания [30, 46], причем не только в кардии, но и в измененном пищеводе. В связи с этим необходимо своевременное выявление и лечение больных с данной патологией. Если оценивать длительность ремиссии после ПД как наиболее эффективного метода лечения, то в течение 5-10 лет она составляет в среднем около 75-90%.
Список литературы/References
- Аллахвердян А.С., Мазурин B.C. Неполная косая заднебоковая фундопликация при эзофагокардиомиотомии по поводу ахалазии кардии // Грудная и сердечно-сосудистая хирургия. — 2007. — № 6. — С. 32-36. [Allakhverdyan A.S., Mazurin V.S. Incomplete oblique posterolateral fundoplication at esophagocardiomyotomy four cardiac achalasia// Grudnaya i serdechno-sosudistaya khirurgiya. — 2007. — No. 6. — p.32-36].
- Аллахвердян А.С., Мазурин B.C., Титов А.Г., Фролов А.В. Эзофагокардиомиотомия с частичной переднезадней фундопликацией при лечении ахалазии кардии: Учебное пособие. — М., 2011. — 24 с. [Allakhverdyan A.S., Mazurin V. S., Titov A. G., Frolov A. V. Esophagocardiomyotomy with partial anterior-posterior fundoplication at cardiac achalasia treatment: Manual. — M., 2011. — 24 p.]
- Ванцян Э.Н., Черноусов А.Ф. Хирургия пищевода. — Современные достижения реконструктивной хирургии: Сб. научных трудов. — М.,1988. — С. 34-37. [Vantsyan E.N., Chernousov A.F. Esophageal surgery. — Modern advances in reconstructive surgery: Abstracts. — M., 1988. — P 34-37 J.
- Василенко В.Х., Суворова Т.А., Гребенев А.Л. Ахалазия кардии. — М.: Медицина, 1976. — 280 с. [Vasilenko V.Kh., Suvorova Т.A., Grebenev A.L. Cardiac achalasia. — M.: Medicine, 1976. — 280 p.]
- Вилявин Г.Д., Соловьев В.И., Тимофеева Т.А. Кардиоспазм. Патогенез, клиника и лечение. — М.: Медицина, 1971. [Vilyavin G.D., Solovyov V.I., Timofeyeva T.A. Cardiospasm. Pathogenesis, clinical presentation and treatment. — M.: Medicine, 1971].
- Воронцова Н.И. Изменения вегетативной нервной системы при функциональных заболеваниях пищевода // Клин. мед. — 1966. — № 2. — С. 33-34. [Vorontsova N.I. Changes of autonomous nervous system at functional esophageal diseases // Klin. med. — 1966. — No. 2.
- Гаджиев А.Н. Клиника, диагностика, лечение кардиоспазма, ахалазии кардии и диффузного эзофагоспазма: Дис. … д-ра мед. наук. — М., 2001. [Gadzhiyev A.N. Clinical presentation, diagnosis, treatment of cardiospasm, cardiac achalasia and diffuse esophageal spasm: PhD degree thesis. — M, 2001].
- Галлингер Ю.И., Годжелло Э.А. Оперативная эндоскопия пищевода. — М.: РНЦХ РАМН, 1999. — 273 с. [Gallinger Yu.L, Godzhello E.A. Operational endoscopy of the esophagus. — M.: RNTsH Russian Academy of Medical Science, 1999. — 273 p.]
- Гнилитский Л.А. Отдаленные результаты лечения кардиоспазма и ахалазии кардии методом пневматической кардиодилатации: Дис. … канд. мед. наук. — М., 1981. [Gnilitsky L.A. Long-term results of treatment of cardiospasm and cardiac achalasia by pneumatic cardiodilation method: PhD degree thesis. — M, 1981.
- Годжелло Э.А. Оперативная эндоскопия доброкачественных стенозирующих заболеваний пищевода: Дис. … д-ра мед. наук. — М., 2002]. [Godzhello E.A. Operational endoscopy benign stenosing esophagus diseases: MD degree thesis. — M., 2002].
- Гребенев А.Л. Клиническое значение исследования двигательной функции пищевода: Дис. …канд. мед. наук. — М.,1964. [Grebenev A.L. Clinical value of esophageal motor function investigation: MD degree thesis. — M., 1964].
- Гребенев А.Л. Ахалазия кардии (клиника, диагностика, лечение): Дис. … д-ра мед. наук. — М.,1969. [Grebenev A.L. Cardiac achalasia (clinical presentation, diagnosis, treatment): PhD degree thesis. — M., 1969].
- Гребенев А.Л. Влияние лекарственных препаратов (ацетилхолин, адреналин, папаверин, нитроглицерин и морфин) на двигательную функцию пищевода // Сов. мед. — 1987. — №7. — С. 17-21. [Grebenev A.L. Effect of drugs (acetylcholine, epinephrine, papaverine, nitroglycerin and morphine) on motor function of the esophagus//Sov. med. — 1987. — No. 7. — P. 17-21].
- Зиверт К.Н. Спазм и стеноз кардии. — В кн. Труды 26-го Всесоюзного съезда хирургов. — М., 1962. — С. 182-186. [Zievert K.N. Spasm and stenosis of cardia. -In: abstracts of the 26th АН-Union congress of surgeons. — M, 1962. — P. 182-186].
- Ивашкин В.Т., Лапина Т. Л. и др. Гастроэнтерология: Национальное руководство (краткое издание) / Под ред. В.Т. Ивашкина и Т.Л. Лапиной. — М.: ГЭОТАР-Медиа, 2011. — 480 с. [Ivashkin V.T., Lapina T.L. et al. Gastroenterology: National manuals (the brief edition) / Under the ed.: V. T. Ivashkin and T.L. Lapina. — M.: GEOTAR-Media, 2011. — 480 p.]
- Иорданская Н.И. Изменения экстра- и интрамуралытой нервной системы при кардиоспазме // Казанск. мед. журн. — 1961. — №1. — с. 49-51. [Iordanskaya N.I. Changes of extra-and intramural nervous system at cardiospasm// Kazansk. med zhurn. — 1961. — No. 1. — p. 49-51].
- Коган Е.М. Рентгенодиагностика заболеваний пищевода. — M.: Медицина, 1968. [Kogan E.M. Diagnostic radiology of esophageal diseases. — M.: Medicine, 1968].
- Моргенштерн А.З. Ахалазия пищевода. — M.: Медицина, 1968. — 160 с. [Morgenstern A.Z. Esophageal achalasia. — М.: Medicine, 1968. — 160 p.]
- Муравьев В.Ю., Бурмистров М.В., Иванов А.И. Эндоскопическое лечение ахалазии кардии // Эндоскопия. — 2013. — №2. — С. 2-6. [Muravyev V.Yu., Burmistrov M.V., Jvanov A.I. Endoscopic treatment of cardiac achalasia//Endoscopy. — 2013. — No. 2. — P. 2-6].
- Орлова О.Р., Артемьев Д.В. Лечение токсином ботулизма фокальных дистоний и лицевых гиперкинезов // Неврол. журн. — 1998. — №3. — С. 28-33. [Orlova O.R., Artemyev D.V. Treatment by botulinum toxin of focal dystonias and facial hyperkinesias//Nevrol. zhurn. -1998. — No. 3. — P. 28-33].
- Петровский Б.В. Кардиоспазм и его хирургическое значение: Труды 27-го Всесоюзного съезда хирургов. — М., 1962. — С.162-173. [Petrovsky B.V. Cardiospasm and surgical significance: abstracts of the 27th All-Union congress of surgeons. — M., 1962. — P. 162-173].
- Петровский Б.В., Ванцян Э.Н., Черноусов А.Ф., Чиссов В.И. Кардиоспазм и его лечение // Хирургия. — 1972. — №11. — С. 10-17. [Petrovsky B.V., Vantsyan E.N., Chernousov A.F., Ckissov V.I. Cardiospasm and its treatment/VSurgery. — 1972. — No. 11. — P. 10-17].
- Пинчук Т.П. Эндоскопическая диагностика и лечение поздних стадий кардиоспазма: Дис. … канд. мед. наук. — М., 1992. [Pinchuk Т.P. Endoscopic diagnosis and treatment of late stages of cardiospasm: MD degree thesis. — M, 1992].
- Сагитов И.Т. Эндоскопическое лечение ахалазии кардии: Дис… канд. мед. наук. — Казань, 2004. [Sagitov I.T. Endoscopic treatment of cardiac achalasia: MD degree thesis. — Kazan, 2004].
- Сякс Ф.Ф. Функциональная морфология пищевода. — М.: Медицина, 1987. — С. 121-164. [Saks F.F. Functional esophageal morphology. — M.: Medicine, 1987. — P. 121-164].
- Скворцов М.Б., Журавлев С.В., Шинкарев Н.В., Трухан Р.Г. Эндоскопические методики дилатации при кардиоспазме. Обеспечение безопасности: Сб. тезисов 2-го Московского международного конгресса по эндоскопической хирургии. — М., 1997. — С. 326-327. [Skvortsov M.B., Zhuravlev S.V., Shinkarev N.V., Trukhan R.G. Endoscopic dilatation techniques at cardiospasm. Safety: Abstracts of the 2nd Moscow international congress on endoscopic surgery. — M., 1997. -P. 326-327].
- Сотников В.Н., Пинчук Т.П., Сотников А.В., Логинова Т.А. Эндоскопическое лечение поздних стадий кардиоспазма // Клин. мед. — 1996. — №4. — С. 65. [Sotnikov V.N., Pinchuk T.P., Sotnikov A.V., Loginova T.A. Endoscopic treatment of late stages of cardiospasm// Klin. med. — 1996. — No. 4. — P. 65].
- Сторонова О.А., Трухманов А. С. Методика изучения двигательной функции пищевода. Клиническая медицина: Пособие для последипломного образования/ Под ред. акад. РАМН, проф. В.Т. Ивашкина. — М.: МЕДПРАКТИКА-М, 2011. — 36 с. [Storonova О.А., Trukhmanov A.S. Technique of esophageal motor function investigation. Clinical medicine. Practical guidelines for postgraduate education/ Under the ed.: academician of the Russian academy of medical science, prof. V.T. Ivashkin. — M.:Medpraktika-M., 2011. — 36].
- Суворова Т.А. Функциональные заболевания пищевода. — В кн.: Многотомное руководство по хирургии. Т. 6., кн.2. — М., 1966. — С. 317-355. [Suvorova T.A. Functional esophageal diseases. — In: multivolume set of surgery. Vol. 6., book 2. — M., 1966. — P. 317-355].
- Тамулевичюте Д.И., Витенас A.M. Болезни пищевода и кардии. — М.: Медицина, 1986. — 224 с. [Tamulevichyute D.I., Vitenas A.M. Diseases of the esophagus and cardia. — M.: Medicine, 1986. — 224 p.]
- Трухманов А.С., Нечаев В.М., Евстратова С.X. Случай кандидомикоза пищевода у больного ахалазией кардии // Клин. мед. — 1990. — №3. — С. 131-133. [Trukhmanov A.S., Nechayev V. М., Evstratova S.H. Esophageal candidiasis in a patient with cardiac achalasia// Klin. med. — 1990. — No. 3. — P. 131-133].
- Трухманов А.С. Тактика комплексного лечения ахалазии кардии: Автореф. дис… канд. мед. наук. — М.,1995. — 24 с. [Trukhmanov A.S. Comprehensive treatment approach in cardiac achalasia: MD degree thesis, author’s abstract. — M., 1995. — 24 p.]
- Уткин В.В. Кардиоспазм. — Рига: Зинатне, 1966. [Utkin V.V. Cardiospasm. — Riga: Zinatne, 1966].
- Федорова О.Д. Диагностика и лечение кардиоспазма. — М.: Медицина, 1967. — 40 с. [Fedorova O.D. Diagnosis and treatment of cardiospasm. — M.: Medicine, 1967. — 40 p.]
- Федорова О.Д. Кардиоспазм. — М.: Медицина. 1973. [Fedorova O.D. Cardiospasm. — М.: Medicine. 1973].
- Хатьков И.Е., Израилов Р.Е., Домрачев С.А. и др. Тораколапароскопические одномоментные операции на пищеводе: результаты лечения 14 больных // Хирургия. Журнал им. Н.И. Пирогова. — 2014. — № 10. — С. 45-51. [Khat’kov I.E., Izrailov R.E., Domrachev S.A. et al. Thoracic laparoscopic one-stage esophageal surgery: results of treatment of 14 patients/ZSurgery. Pirogov’s Journal. — 2014. No. 10. — P. 45-51].
- Хрусталева М.В., Годжелло Э.А., Еаллингер Ю.И., Булганина П.А. Результаты 25-летнего опыта эндоскопического лечения кардиоспазма методом баллонных дилатации // Эндоскопия. — 2013. — №1. — С. 12-16. [Khrustaleva M.V., Godzhello E.A., Gallinger Yu.L, Bulganina N.A. Results of 25 years’ experience of endoscopic treatment of cardiospasm by balloon dilation method // Endoscopy. — 2013. — No. 1. — P. 12-16].
- Черноусов А.Ф., Богопольский П.М., Курбанов Ф.С. Хирургия пищевода: Руководство для врачей. — М.: Медицина, 2000. — 350 с. [Chernousov A.F., Bogopolsky P.M., Kurbanov F.S. Esophageal surgery. Manual for physicians. — M.: Medicine, 2000. — 350 p.]
- Черноусов А.Ф., Гаджиев А.П., Шестаков А.Л. Лечение кардиоспазма и ахалазии кардии пневмо-кардиодилатацией // Анналы хирургии. — 2000. — №3. — С. 50-53. [Chernousov A.F., Gadzhiyev A.N., Shestakov A.L. Treatment of cardiospasm and cardiac achalasia by pneumocardiodilation//Annals of surgery. -2000. — No. 3. — P. 50-53].
- Черноусов А.Ф., Чернявский А.А. Показания к хирургическому лечению кардиоспазма // Хирургия. — 1986. — №5. — С. 28-32. [Chernousov A.F., Chernyavsky A.A. Indications to surgical treatment of cardiospasm// Khirurgriya. — 1986. — No. 5. — P. 28-32].
- Adams C.W.M., Marples E.A., Trounce J.K. Achalasia of the cardia and Hirschprung’s disease the amaunt and distribution of cholinesterases. Clin Sci 1960;19:474-81.
- Al Karawi M.A., Ahmed A.M., Ghandour Z. Use of botulin A toxin in achalasia. Endoscopy 1995; 27:217.
- Annesse V., Perri F., Napolitano G. et al. Botulinum toxin for achalasia: a placebo controlled trial with follow-up of six months. Gut 1995;37(2):A203.
- Andersson M., Lundell L., Kostic S., Ruth M., Lonroth H., Kjellin A. et al. Evaluation of the response to treatment in patients with idiopathic achalasia by the timed barium esophagogram: results from a randomized clinical trial. Dis Esophagus 2009; 22:264-73.
- Andrews C.N., Anvari M., Dobranowski J. Laparoscopic Heller’s myotomy or botulinum toxin injection for management of esophageal achalasia. Patient choice and treatment outcomes. Surg Endosc 1999; 13(8):742-6.
- Arima M., Tasaki K., Tobita K. et al. X-ray and endoscopic diagnosis of esophageal achalasia. Nippon Geka Gakkai Zasshi 2000;101(4):327-32.
- Booy J.D., Takata J., Tomlinson G, Urbach D.R. The prevalence of autoimmune disease in patients with esophageal achalasia. Dis Esophagus 2012 Apr;25(3):209-13.
- Campos G., Vittinghoff E., Rabl C, Takata M., Gadenstatter M., Lin F. et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg 2009; 249:45-57.
- Choudry U., Boyce H.W. A prospective study of the efficacy of botulinum toxin A (BTX) in patients with epiphrenic diverticula. Am J Gastroenterol 1996; 91:1885.
- De Leon A.R., de la Serna J.P., Santiago J.L., Sevilla C, Femdndez-Arquero M., de la Concha E.G., Nunez C, Urcelay E., Vigo A.G. Association between idiopathic achalasia and IL23R gene. Neurogastroentcrol Motil 2010;22(7):734-8.
- Eckardt V.F., Stauf В., Bernhard G Chest pain in achalasia: patient characteristics and clinical course. Gastroenterology 1999; 116:1300-4.
- Eleftheriadis N., Inoue H., Ikeda H. et al. Training in peroral endoscopic myotomy (POEM) for esophageal achalasia. Ther Clin Risk Manag 2012; 8:329-424; doi: 10.2147/TCRM.S32666. Epub 2012 Jul 23.
- Emami M.H., Raisi M., Amini J., Daghaghzadeh H. Achalasia and thyroid disease. Wld J Gastroenterol 2007 Jan 28;13(4):594-9.
- Farrokhi F., Vaezi M.F. Idiopathic (primary) achalasia. Orphanet J Rare Dis. 2007 Sep 26;2:36-8.
- Fiorini A., Corti R.E., Valero J.L. et al. Botulinum toxin is effective in the short-term treatment of esophageal achalasia. Preliminary results of a randomized trial. Acta Gastroenterol Latinoam 1996;26(3): 155-7.
- Gockel I., Eckhard V.F., Schmitt Т., Junginger T. Pseudoachalasia: a case series and analysis of the literature. Scand J Gastroenterol 2005;40:378-85.
- Gockel L, Muller M., Schumacher J. Achalasia — a disease of unknown cause that is often diagnosed too late. Dtsch Arztebl Int 2012 Mar;109(12):209-14.
- Goldblum J.R., Rice T.W., Richter J.E. Histopathologic features in esophagomyotomy specimens from patients with achalasia. Gastroenterology 1996;111:648-54.
- Hallal C., Kieling C.O., Nunes D.L., Ferreira С.Т., Peterson G., Barros S.G., Arruda С.A., Fraga J.C., Goldani H.A. Diagnosis, misdiagnosis, and associated diseases of achalasia in children and adolescents: a twelve-year single center experience. Pediatr Surg Int 2012 Dec;28(12):1211-7.
- Horgan S., Hudda K., Eubanks T. et al. Does botulinum toxin injection make esophagomyotomy a more difficult operation? Surg Endosc 1999; 13(6):576-9.
- Hurst A. The treatment of achalasia of the cardia: so-called «cardiospasm». Lancet 1927; 1:618.
- Inoue H., Minami H., Kobayashi Y. et al. Peroral endoscopic myotomy (POEM) for esophageal achalasia. Endoscopy 2010:42:265-71.
- Inoue H., Tianle K.M., Ikeda H. et al. Peroral endoscopic myotomy for esophageal achalasia: technique, indication, and outcomes. Thorac Surg Clin 2011; 21:519-25.
- Jawaheer D., Seldin M.F., Amos CI., Chen W.V., Shigeta R., Etzel C., Damle A., Xiao X., Chen D., Lum R.F. et al. Screening the genome for rheumatoid arthritis susceptibility genes: a replication study and combined analysis of 512 multicase families. Arthritis Rheum 2003;48:906-16.
- Joel E. Richter. Achalasia — An Update. Neurogastroenterol Motil 2010; 16(3):232-42.
- Kashyap P., Farrugia G. Enteric autoantibodies and gut motility disorders. Gastroenterol Clin N Am 2008;37(2):397-410.
- Katada N., Sakuramoto S., Yamashita K., Shibata Т., Moriya H., Kikuchi S., Watanabe M. Recent trends in the management of achalasia. Ann Thorac Cardiovasc Surg 2012;18(5):420-8.
- Lee H.R., Lennon V.A., Camilleri M. et al. Paraneoplastic gastrointestinal motor dysfunction: clinical and laboratory characteristics. Am J Gastroenterol 2001;96(2):373-9.
- Lee L. Swanstrom. Peroral Endoscopic Myotomy for Treatment of Achalasia. Gastroenterol Hepatol (N. Y.) 2012 Sep; 8(9):613-5.
- Leeuwenburgh I., Haringsma J., Van Dekken H. et al. Long-term risk of oesophagitis, Barrett’s oesophagus and oesophagcal cancer in achalasia patients. Scand J Gastroenterol (Suppl) 2006; 7-10.
- Maher J.W. Thoracoscopic esophagomyotomy for achalasia. Surg Clin North Am 2000; 80(5): 1501-16.
- Malagelada J.R., Bazzoli F., Elewaut A., Fried M., Krabshuis J.H., Lindberg G., Malfertheiner P., Sharma P., Vakil N. World Gastroenterology Organisation. Practice Guidelines: Dysphagia, 2007.
- Mearin F., Garcia-Gonzdlez M.A., Strunk M., Zarate N., Malagelada J.R., Lanas A. Association between achalasia and nitric oxide synthase gene polymorphisms. Am J Gastroenterol 2006;101:1979-84.
- Moore S.W. Down syndrome and the enteric nervous system. Pediatr Surg Int 2008;24:873-83.
- Moses P.L., Ellis L.M., Anees M.R., Ho W., Rothstein R.I., Meddings J.B., Sharkey K.A., Mawe G.M. Antineuronal antibodies in idiopathic achalasia and gastro-oesophageal reflux disease. Gut 2003 May;52(5):629-36.
- Moskovitz D.N., Robb K.V. Small cell lung cancer with positive anti-Hu antibodies presenting as gastroparesis. Can J Gastroenterol 2002;16(3):171-4.
- Paladini F., Cocco E., Cauli A., Cascino I., Vacca A., Belfiore F., Fiorillo M.T., Mathieu A., Sorrentino R. A functional polymorphism of the vasoactive intestinal peptide receptor 1 gene correlates with the presence of HLA-B*2705 in Sardinia. Genes Immun 2008;9:659-67.
- Paladini F., Cocco E., Cascino I., Belfiore F., Badiali D., Piretta L., Alghisi F., Anzini F., Fiorillo M.T., Corazziari E. et al. Age-dependent association of idiopathic achalasia with vasoactive intestinal peptide receptor 1 gene. Neurogastroentcrol Motil 2009;21:597-602.
- Pasricha P.J., Ravich W.J., Hendrix T.R. et al. Botulinum toxin for achalasia: a double-blind placebo-controlled trial. New Orleans, USA: Abstracts from Digestive Diseases Week; 1994. 449 p.
- Pasricha P.J., Hawarl R., Ahmed I. et al. Submucosal endoscopic esophageal myotomy: a novel experimental approach for the treatment of achalasia. Endoscopy. 2007; 39:9:761-4.
- Park W., Vaezi M.F. Etiology and pathogenesis of achalasia: the current understanding. Am J Gastroenterol 2005;100:1404-14.
- Pohl D., Tutuian R. Achalasia: an overview of diagnosis and treatment. Gastrointestin Liver Dis 2007 Sep;16(3):297-303.
- Pretap N., Kalapala R., Darrissetty S., Joshi N., Ramchandani M., Banerjee R. et al. Achalasia cardia subtyping by high-resolution manometry predicts the therapeutic outcome of pneumatic balloon dilatation. Neurogastroenterol Motil 2011; 17:48-53.
- Quidute A.R., de Freitas E.V., de Lima T.G, Feitosa A.M., dos Santos J.P., Correia J.W. Achalasia and thyroid disease: possible autoimmune connection? Arq Bras Endocrinol Metab 2012;56(9):677-82.
- Ren Y., Ke M., Fang X., Zhu L., Sun X., Wang Z., Wang R., Wei Z., Wen P., Xin H., Chang M. Response of esophagus to high and low temperatures in patients with achalasia. J Neurogastroenterol Motil 2012;18(4):391-8.
- Ren Z., Zhong Y’., Zhou P. et al. Perioperative management and treatment for complications during and after peroral endoscopic myotomy (POEM) for esophageal achalasia (EA) (data from 119 cases). Surg Endoscop 2012; 26 (10:3267-72.
- Von Renteln D., Inoue H., Minami H. et al. Peroral endoscopic myotomy for the treatment of achalasia: a prospective single center study. Am J Gastroenterol 2012; 107(3):411-7.
- Robert E. Kraichely, Gianrico Farrugia, Sean J. Pittock, Donald O. Castell, Vanda A. Lennon. Neural Autoantibody Profile of Primary Achalasia. Dig Dis Sci 2010 Feb; 55(2):307-ll.
- Ruiz-de-Leon A., Mendoza J., Sevilla-Mantilla C. et al. Myenteric antiplexus antibodies and class II HLA in achalasia. Dig Dis Sci 2002;47:15-9.
- Santiago J.L., Martinez A., Benito M.S., Ruiz de Leon A., Mendoza J.L., Ferndndez-Arquero M., Figueredo M.A., de la Concha E.G., Urcelay E. Gender-specific association of the PTPN22 C1858T polymorphism with achalasia. Hum Immunol 2007;68:867-70.
- Seng-Kee Chuah, Pin-I Hsu, Keng-Liang Wu, Deng-Chyang Wu, Wei-Chen Tai and Chi-Sin Changchien. 2011 update on esophageal achalasia. Wld J Gastroenterol 2012 April 14; 18(14):1573-8.
- Schneider J.H., Manncke K., Grund K.E., Becker H.D. Differential achalasia therapy. Langenbecks Arch Chir Suppl Kongressbd 1998; 115:1139-42.
- Spechler S.J., Souza R.F., Rosenberg S.J., Ruben R.A., Goyal R.K. Heartburn in patients with achalasia. Gut 1995;37:305-8.
- Spechler S.J. Clinical manifestation and diagnosis of achalasia. Vol. 33. In: Wellesley R., editor. UpToDate in Gastroenterology and Hepatology, UpToDate Inc. Last assessed Nov; 2008.
- SreedharanS.P., Huang J.X., Cheung M.C., Goetzl E.J. Structure, expression, and chromosomal localization of the type I human vasoactive intestinal pcptide receptor gene. Proc Natl Acad Sci USA 1995;92:2939-43.
- Stavropoulos S.N., Modayil R.J., Friedel D., Savides T. The International Per Oral Endoscopic Myotomy Survey (IPOEMS): a snapshot of the global POEM experience. Surg Endoscop 2013; 27(9):3322-38.
- Stavros N. Stavropoulos, David Friedel, Rani Modayil, Shahzad Iqbal, James H. Grendell. Endoscopic approaches to treatment of achalasia. Ther Adv Gastroenterol 2013 March; 6(2): 115-35.
- Fullio-Pelet A., Salomon R., Hadj-Rabia S. et al. Mutant WD-repeat protein in triple-A. Nat Genet 2000;26:332-5.
- Uday C. Ghoshal, SunilB. Daschakraborty, Renu Singh. Pathogenesis of achalasia cardia. Wld J Gastroenterol 2012 June 28; 18(24):3050-7. 100.
- Ulla J.L., Fernandez-Salgado E., Alvarez V., Ibanez A., Soto S., Carpio D., Vazquez-Sanluis J., LedoL., V’azquez-Astray E. Pseudoachalasia of the cardia secondary to nongastrointestinal neoplasia. Dysphagia 2008 Jun;23(2): 122-6.
- Vaezi M.F., Richter J.E. Current therapies for achalasia: comparison and efficacy. J Clin Gastroenterol 1998; 27(0:21-35.
- Van Oene M., Wintle R.F., Liu X., Yazdanpanah M., Gu X., Newman В., Kwan A., Johnson В., Owen J., Greer W. et al. Association of the lymphoid tyrosine phosphatase R620W variant with rheumatoid arthritis, but not Crohn’s disease, in Canadian populations. Arthritis Rheum 2005;52:1993-8.
- Vantrappen G., Hellemans J., Deloof W., Valembois P., Vandenbroucke J. Treatment of achalasia with pneumatic dilatations. Gut 1971;12:268-75.
- Vecchio R., Palazzo F., Di Franco F. et al. Esophageal achalasia. Personal experience with 76 patients. G Chir 1999; 20(8-9):345-7.
- Vela M.F., Vaezi M.F. Cost-assessment of alternative management strategies for achalasia. Exp Opin Pharmacother 2003;4:2019-25.
- Vigo A.G., Martinez A., de la Concha E.G., Urcelay E., Ruiz de Leon A. Suggested association of NOS2A polymorphism in idiopathic achalasia: no evidence in a large case-control study. Am J Gastroenterol 2009;104:1326-7.
- Villanacci V., Annese V., Cuttitta A., Fisogni S., Scaramuzzi G., De Santo E., Corazzi N., Bassotti G. An immunohistochemical study of the myenteric plexus in idiopathic achalasia. J Clin Gastroenterol 2010;44:407-10.
- Williams T. Pharmaceutice ratioalis sive diatribe de medicamentarum operationibus in humano corpore. London: Hagia Comitis, 1674.
- Yang D., Wagh M.S. Peroral Endoscopic Myotomy for the Treatment of Achalasia: An Analysis. Diagnostic and Therapeutic Endoscopy Volume 2013 (2013), Article ID 389596, 8 pages http: // dx. doi. org/10.1155/2013/389596.
- Zarate N., Mearin F., Gil-Vernet J.M., Camarasa F., Malagelada J.R. Achalasia and Down’s syndrome: coincidental association or something else? Am J Gastroenterol 1999;94:1674-7.
- Zhou P.H., Yao L., Zhang Y.-Q. et al. PerOral Endoscopic Myotomy (POEM) for Esophageal Achalasia: 205 Cases Report. Gastrointestinal Endoscopy 2012;75(4. Suppl.):AB132-AB133.
Статья опубликована на сайте http://www.gastroscan.ru
материал с сайта MedLinks.ru





