Введение
Коронавирусная болезнь (COVID-19) — новое инфекционное заболевание, вызванное коронавирусом (SARS-CoV-2), особенностью которого является быстрое распространение, часто тяжелое течение и высокий уровень летальности, составляющий, по различным данным, от 0,1 до 25%. 11 марта 2020 г. ВОЗ объявила вспышку SARS-CoV-2 пандемией из-за постоянно растущего числа случаев заболевания во всем мире. В настоящее время коронавирусная инфекция рассматривается как системное заболевание, поражающее не только легкие, но и другие органы и ткани. Довольно часто у больных COVID-19, особенно при тяжелом течении, выявляется поражение печени [1–3]. Под COVID-19-ассоциированным поражением печени подразумеваются любые изменения функции печени (повышение уровня хотя бы одного из параметров биохимического анализа крови: аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), γ-глутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ) или общего билирубина), которые отмечаются во время прогрессирования заболевания и лечения у пациентов с COVID-19 при наличии сопутствующих заболеваний печени или без них [4]. Механизмы, лежащие в основе влияния SARS-CoV-2 на функцию печени, до конца не изучены. Так, известно, что в более ранних вспышках, связанных с инфицированием коронавирусами рода Betacoronavirus (SARS-CoV в 2002–2003 гг. и MERS-CoV в 2012 г.), повреждение печени встречалось достаточно часто и ассоциировалось с наиболее тяжелым течением заболевания [5, 6]. В настоящее время не исключается, что SARS-CoV-2 может вызывать прямое повреждение гепатоцитов и холангиоцитов. Вторичное воздействие на печень может быть связано с развитием системной воспалительной реакции, «цитокинового шторма» и иммунной дисрегуляции, гипоксемии в результате поражения легких, полиорганной недостаточности, а также с использованием гепатотоксичных лекарственных средств [7–9].
По данным литературы, у 14–55% пациентов с COVID-19 регистрируются изменения показателей состояния и функции печени. На догоспитальном этапе большая часть больных могут иметь отклонения уровня печеночных трансаминаз, не превышающие двух верхних границ нормы (ВГН). В исследовании, представленном A. Olry et al. [10], около 90% пациентов с COVID-19 при поступлении имели повышение уровня АЛТ в пределах 1–2 ВГН, менее чем у 4% уровень АЛТ превышал 2 ВГН. По данным зарубежной литературы, продолжительность госпитализации пациентов с повреждением печени была значительно больше, чем у пациентов без повреждения печени, а аномальное повышение уровня АСТ было чаще связано с риском смерти у пациентов с COVID-19 [11–14]. Эти данные подтверждаются собственными исследованиями. Было установлено, что повышение значений АЛТ и/или АСТ наблюдалось у большей части (80%) пациентов с коронавирусной инфекцией при их направлении в больницу, при этом к середине стационарного лечения количество больных с повышенными значениями аминотрансфераз достигало 92%. Наряду с этим отмечалось, что уровень АСТ более 70 Ед/л сопровождался повышенным риском наступления летального исхода [15].
Несмотря на высокую частоту встречаемости поражения печени при COVID-19, вопрос лечения таких пациентов остается открытым. Отсутствует алгоритм, определяющий тактику ведения пациентов с COVID-19-ассоциированным поражением печени. До сих пор нет достаточных данных о безопасности препаратов, используемых для лечения пациентов с COVID-19 и нарушением функции печени. С учетом патогенеза поражения печени при COVID-19, клинических рекомендаций / протоколов лечения пациентов с хроническими заболеваниями гепатобилиарной системы и рисков гепатотоксичных эффектов от проводимой терапии, для предотвращения тяжелых осложнений COVID-19 со стороны печени в качестве патогенетически обоснованного средства применяется препарат урсодезоксихолевой кислоты (УДХК), которая ингибирует выработку провоспалительных цитокинов фактора некроза опухоли α, интерлейкинов 1β, 2, 4, 6, играющих важную роль в развитии так называемого «цитокинового шторма» при COVID-19 [16]. В этой связи изучение эффективности и безопасности УДХК в комплексной терапии у взрослых пациентов c признаками поражения печени и COVID-19 представляется целесообразным.
Цель исследования: оценить эффективность и безопасность применения УДХК у взрослых пациентов с COVID-19 и признаками поражения печени.
Содержание статьи
Материал и методы
В открытое наблюдательное неинтервенционное исследование было включено 140 пациентов старше 18 лет с коронавирусной инфекцией и поражением печени, находившихся на стационарном лечении в инфекционных госпиталях ОГБУЗ «Клиническая больница № 1» г. Смоленска с 20.01.2022 по 10.06.2023. Проведение исследования было одобрено этическим комитетом при ФГБОУ ВО СГМУ Минздрава России.
Наблюдаемые больные были разделены на 2 группы: основную и контрольную. В основную группу (n=70) были включены пациенты, имевшие верифицированный диагноз COVID-19 и признаки поражения печени, подтвержденные лабораторными методами, и получавшие препарат УДХК (Урдокса®, АО «АЛИУМ», Россия). В контрольную группу (n=70) были включены пациенты, имевшие подтвержденный диагноз COVID-19 и признаки поражения печени, не получавшие препарат УДХК.
Урсодезоксихолевая кислота была назначена с момента установления повышения уровня печеночных ферментов по данным биохимического анализа крови, при наличии показаний, в соответствии с инструкцией по медицинскому применению в дозе 15 мг/кг массы тела в течение 2 мес. Все пациенты получали стандартную терапию основного заболевания в соответствии с действующими Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19).
В ходе исследования было предусмотрено 7 визитов согласно протоколу исследования: визит 1 — в момент госпитализации, визит 2 — через 5±3 дня от визита 1, визит 3 — через 10±3 дня, визит 4 — через 15±3 дня, визит 5 (по телефону) — через 30±3 дня, визит 6 (по телефону) — через 45±3 дня, визит 7 — через 60±3 дня.
Визиты включали: оценку критериев включения/исключения, стратификацию группы наблюдения, получение письменного информированного согласия пациента, сбор медицинского анамнеза, определение основных показателей жизнедеятельности, сбор и анализ информации о результатах лабораторных и инструментальных методов исследования, заполнение опросника SF-36, заполнение шкалы Мориски — Грин. Демографические и анамнестические данные, клинические особенности течения коронавирусной инфекции, сопутствующая патология, а также предшествующая и проводимая терапия, результаты лабораторных и инструментальных методов исследования были получены при физикальном обследовании пациента, а также из медицинских карт стационарного больного.
На основании полученных данных, которые были анонимизированы, составлена и заполнена индивидуальная регистрационная карта (ИРК). Информация, внесенная в ИРК, была введена в специально разработанную электронную базу данных, созданную на основе системы OpenClinica, версия 3.14, с использованием двойного ввода данных. Статистическая обработка данных проводилась с помощью компьютерной программы RStudio v. 1.1.353 for Windows (RStudioInc., USA), R v. 3.4.1. Описательную статистику выполнили для всех анализируемых показателей в зависимости от типа переменной (качественные, количественные). Сравнительный анализ осуществляли с использованием точного теста Фишера. При проверке статистических гипотез использовался уровень значимости α=0,05.
Результаты исследования
В исследование было включено 140 взрослых пациентов в возрасте от 22 до 89 лет. Средний возраст больных составил 67,43±14,40 года. Среди всех наблюдаемых пациентов женщин было 52,14%, мужчин — 47,86%. На момент поступления в стационар у 92,14% больных, включенных в исследование, состояние было расценено как среднетяжелое течение COVID-19 (см. таблицу). Транскутанная сатурация кислорода при дыхании комнатным воздухом ниже 93% была выявлена у 13,57% пациентов без статистически значимых различий между группами наблюдения. Признаки поражения легких по данным компьютерной томографии органов грудной клетки (КТ ОГК) имели 109 (77,86%) пациентов, у 31 (22,14%) больного отмечались симптомы острого трахеобронхита или обострения хронического бронхита. Процент поражения легочной ткани менее 25% объема легких по данным КТ ОГК (КТ-1) был зафиксирован у 57,14% пациентов (см. таблицу).
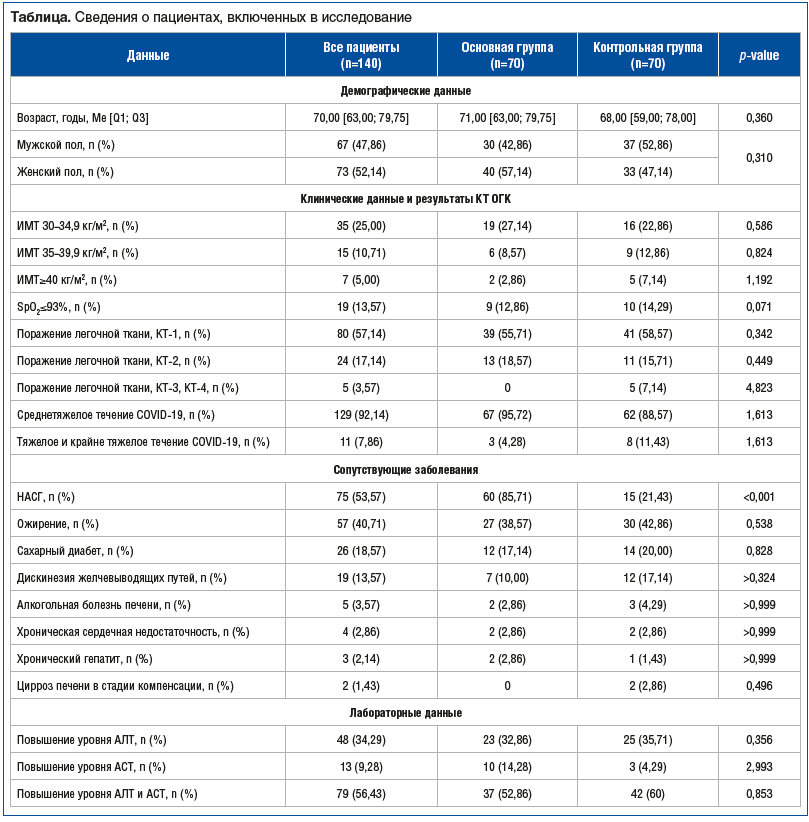
Поражение печени выражалось в повышении уровня аминотрансфераз. При госпитализации наиболее часто отмечалось сочетанное повышение уровня АЛТ и АСТ — в 56,43% случаев. Изолированное повышение уровня АЛТ более чем в 2–3 раза выше ВГН среди всех пациентов на момент включения в исследование выявлялось у 34,29%, уровня АСТ — у 9,28%. При этом исходно уровни АЛТ и АСТ были выше ВГН в 2 раза у 25%, в 3 раза — у 20% пациентов обеих групп. Гепатоцеллюлярное повреждение печени было диагностировано у 62,85% больных в группе УДХК и у 57,14% пациентов в группе контроля. Статистически значимых различий между группами пациентов, включенных в исследование, по демографическим характеристикам, степени тяжести COVID-19, результатам КТ ОГК, изменениям печеночных трансаминаз и сопутствующей патологии получено не было (p>0,05). Исключение составляет неалкогольный стеатогепатит (НАСГ), который являлся показанием для назначения УДХК и критерием включения пациентов в основную группу наблюдения. НАСГ был установлен у 85,71% больных основной группы против 21,43% пациентов контрольной группы (р<0,001) (см. таблицу).
Средняя продолжительность госпитализации включенных в исследование пациентов составила 14,66±5,48 койко-дня. Было установлено, что пациенты основной группы, принимавшие УДХК, находились в стационаре статистически значимо меньше (в среднем на 2 дня), чем пациенты контрольной группы. Длительность госпитализации больных основной и контрольной групп составила 13,71±5,10 и 15,61±5,71 койко-дня соответственно (р=0,046). Все пациенты, включенные в исследование, были переведены на амбулаторный этап наблюдения и лечения.
При оценке динамики уровней отдельных печеночных трансаминаз было установлено, что в биохимическом анализе крови отмечалась статистически значимо более быстрая, уже на 5-й день наблюдения, и выраженная положительная динамика уровня АЛТ в основной группе наблюдения на фоне приема УДХК. На визите 1 в основной группе медиана значений АЛТ составляла 67,00 [40,00; 96,00] Ед/л, в контрольной — 65,20 [44,00; 87,50] Ед/л (р=0,674); на 5-й день наблюдения в основной группе — 43,00 [29,00; 67,00] Ед/л, в контрольной — 56,00 [41,00; 78,00] Ед/л (р=0,025); на 10-й день в основной группе — 35,00 [24,35; 49,50] Ед/л, в контрольной — 48,65 [36,67; 85,75] Ед/л (р=0,002); на 60-й день в основной группе — 17,85 [10,00; 20,25] Ед/л, в контрольной — 20,00 [16,02; 30,00] Ед/л (р=0,011). Статистически значимую положительную динамику значений АСТ удалось установить через 2 мес. терапии УДКХ по сравнению с контрольной группой. Однако уже к 5-му дню значения АСТ у пациентов, принимавших УДХК, уменьшились более чем в 2 раза. Так, на визите 1 в основной группе медиана значений АСТ составляла 65,10 [48,00; 83,50] Ед/л, в контрольной — 49,00 [37,00; 71,97] Ед/л (р=0,014); на 5-й день наблюдения в основной группе — 29,40 [20,50; 39,00] Ед/л, в контрольной — 31,00 [21,20; 45,00] Ед/л (р=0,683); на 10-й день в основной группе — 23,00 [18,00; 27,00] Ед/л, в контрольной — 25,00 [17,00; 30,00] Ед/л (р=0,445); на 60-й день в основной группе — 17,35 [12,00; 23,90] Ед/л, в контрольной — 22,50 [18,00; 28,00] Ед/л (р<0,001) (рис. 1).
При оценке динамики значений ЩФ и общего билирубина отмечались статистически значимые различия между показателями пациентов основной и контрольной групп на 60-й день наблюдения. Оказалось, что параметры ЩФ и общего билирубина были ниже у пациентов, получающих УДХК, чем у пациентов контрольной группы, однако такая динамика не имела клинического значения, так как показатели находились в пределах референтных значений. Так, к 60-му дню наблюдения в основной группе медиана значений ЩФ составила 47,00 [41,00; 71,75] Ед/л, в контрольной — 74,00 [59,70; 88,00] Ед/л (р<0,001); по уровню общего билирубина в основной группе медиана значений составила 10,10 [8,05; 11,22] мкмоль/л, в контрольной — 12,40 [10,17; 16,85] мкмоль/л (р<0,001). Уровни ГГТ были одинаковыми в обеих группах на всех визитах.
Гепатомегалия по данным ультразвукового исследования (УЗИ) при поступлении в стационар была выявлена у 34 (48,57%) пациентов основной группы и у 36 (51,43%) больных контрольной группы (p>0,05). На фоне терапии УДХК признаки гепатомегалии наблюдались у меньшего числа больных — в 15 (21,43%) случаях против 36 (51,43%) в контрольной группе (р<0,001).
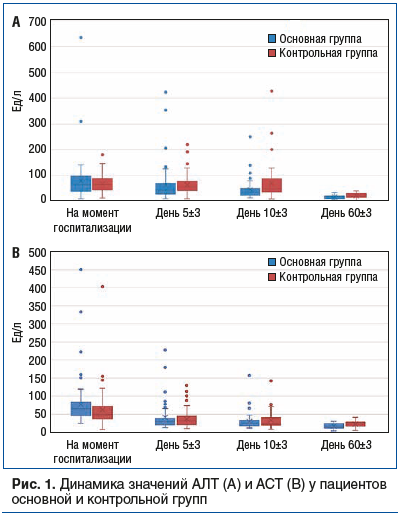
При сравнении динамики размеров печени по данным УЗИ у пациентов, принимавших УДХК, и у пациентов контрольной группы также были выявлены статистически значимые различия. Медиана значений косовертикальных размеров печени к 60-му дню наблюдения у больных основной группы снизилась до нормальных значений и составила 148,00 [140,00; 153,00] мм против увеличенных косовертикальных размеров печени контрольной группы — 155,00 [148,50; 168,00] мм (р<0,001). Медиана значений толщины правой доли печени также пришла в норму через 2 мес. приема УДХК и составила 110,00 [104,00; 122,00] мм против увеличенных значений медианы толщины правой доли печени в контрольной группе — 130,00 [118,00; 144,00] мм (р<0,001). Ультразвуковые размеры левой доли печени за период наблюдения статистически значимо не менялись. Показатели медианы значений краниокаудального размера обеих групп находились в пределах референтных величин и у пациентов после курса УДХК составили 86,00 [72,00; 94,00] мм, а в контрольной группе — 81,00 [70,00; 92,00] мм (р=0,508). Что касается толщины левой доли печени, то изначально увеличенные показатели медианы в основной группе уменьшились после приема УДХК до 71,00 [62,00; 75,00] мм, не достигнув нормальных значений. Тем временем в группе контроля была отмечена тенденция к увеличению медианы значений толщины левой доли печени от 65,50 [58,25; 82,25] до 72,50 [60,00; 82,75] мм (рис. 2).
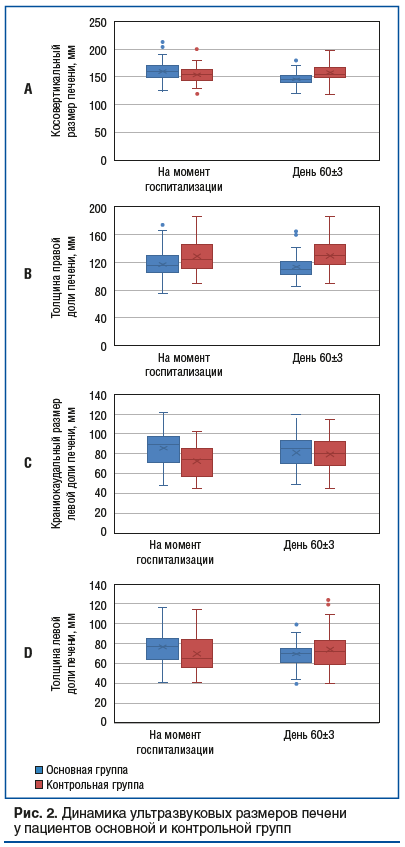
В целом положительная динамика восстановления нормальных размеров печени по данным УЗИ наблюдалась у 42 (60%) больных в группе УДХК и 5 (7,1%) пациентов в контрольной группе (p<0,01). Диффузные изменения паренхимы печени отмечались у 63 (90%) пациентов основной группы и 59 (84,29%) контрольной группы при поступлении, а к 60-му дню — у 51 (72,86%) пациента в основной группе и 53 (75,71%) пациентов в контрольной группе (р=0,847). Признаки нарушения оттока желчи по данным УЗИ были выявлены на визите 1 у 17 (24,29%) пациентов основной группы и 19 (27,14%) пациентов в контрольной группе, а к визиту 7 — у 1 (1,43%) и 11 (15,71%) больных соответственно (р=0,007). Таким образом, можно отметить, что у пациентов основной группы на фоне терапии УДХК через 2 мес. приема отмечалось восстановление нормальных размеров печени и нарушенного оттока желчи по сравнению с контрольной группой, где эти показатели оставались на прежнем уровне или уменьшились незначительно.
При оценке показателей качества жизни по опроснику SF-36 у пациентов обеих групп статистически значимых различий при включении в исследование не было. Исходно медиана показателя физического компонента здоровья в группе, принимавшей УДХК, составила 32,73 [29,30; 38,78] балла, психологического компонента здоровья — 41,19 [36,72; 43,67] балла, в контрольной группе — 31,80 [28,53; 38,49] и 39,60 [35,16; 46,69] балла соответственно. При включении пациентов в исследование показатели в обеих группах были схожи и находились значительно ниже средних величин, что говорит о негативном влиянии заболевания как на физическое, так и на эмоциональное состояние больных. Через 2 мес. показатели качества жизни пациентов в обеих группах улучшились по обоим параметрам по сравнению с начальным уровнем (p<0,001). Медиана показателя физического компонента здоровья в основной группе составила 43,42 [36,72; 48,21] балла, в контрольной — 41,70 [36,91; 47,41] балла (р=0,087). Медиана показателя психологического компонента здоровья в основной и контрольной группах пациентов составила 49,94 [45,11; 53,75] и 51,09 [45,07; 54,86] балла соответственно (р=0,963). Препарат УДХК продемонстрировал тенденцию к улучшению качества жизни пациентов с коронавирусной инфекцией и признаками поражения печени, однако статистически значимых различий между группами пациентов выявлено не было.
Обсуждение
По итогам проведенного исследования можно сделать вывод о положительном влиянии УДХК на нарушенную функцию печени при коронавирусной инфекции. На фоне терапии с применением УДХК было выявлено более быстрое и раннее снижение уровня печеночных трансаминаз, положительная динамика размеров печени и восстановления оттока желчи по данным УЗИ. Кроме того, отмечено сокращение сроков стационарного лечения пациентов с COVID-19 и признаками поражения печени.
При анализе исходных уровней печеночных трансаминаз было выявлено более частое одновременное повышение уровней АЛТ и АСТ (56,43%), что указывает на более значительное повреждение печени у пациентов с COVID-19. Это может быть связано с тем, что одним из потенциальных патофизиологических механизмов повреждения печени при COVID-19 является митохондриальная дисфункция. SARS-CoV-2, попадая в гепатоциты, взаимодействует с митохондриями, нарушает цепь переноса электронов и приводит к поражению клеток печени [14, 17, 18]. При гистологическом изучении биоптатов печени пациентов с COVID-19 были выявлены частицы вируса SARS-CoV-2 в цитоплазме гепатоцитов, наблюдалось заметное набухание митохондрий, дилатация эндоплазматического ретикулума и уменьшение гранул гликогена, отмечался массивный печеночный апоптоз и выявлялись двухъядерные гепатоциты, что в совокупности указывало на вирусное поражение печени [19].
Урсодезоксихолевая кислота оказывает гепатопротективный и цитопротективный эффект в отношении гепатоцитов. Кроме того, препарат обладает антифибротическим, иммуномодулирующим и регулирующим апоптоз действием. УДХК обладает способностью тормозить развитие фиброза и оказывать выраженное системное иммуномодулирующее и противовоспалительное воздействие не только в печени, но и в других органах и системах, что может быть актуальным для профилактики фиброза легких — типичного осложнения COVID-19 [20]. УДХК обладает мембраностабилизирующим эффектом, встраиваясь в мембрану гепатоцита, делает ее более устойчивой к воздействию токсичных факторов [21]. Посредством своих многочисленных эффектов УДХК позволяет уменьшить пагубное влияние различных повреждающих агентов на печень.
В настоящем исследовании установлено, что на фоне лечения с применением УДХК отмечается снижение уровня АЛТ почти в 1,5 раза и уровня АСТ более чем в 2 раза от исходного уровня уже к 5-му дню терапии. Это можно объяснить тем, что УДХК обладает иммуномодулирующим действием за счет уменьшения экспрессии антигенов гистосовместимости (HLA) HLA 1 на гепатоцитах. В свою очередь, это приводит к уменьшению количества сенсибилизированных к печеночной ткани цитотоксичных T-лимфоцитов, снижает «атаку» иммунокомпетентными клетками, в первую очередь IgM, клеток печени и продукцию провоспалительных цитокинов: интерлейкинов 1, 6 и интерферона γ. В настоящее время в отечественной и зарубежной литературе нет данных, подтверждающих факт влияния УДХК на экспрессию антигенов HLA в других органах и тканях, что делает целесообразным дальнейшее изучение свойств УДХК в этом отношении. Вероятно, УДХК посредством уменьшения образования воспалительных факторов будет снижать активность «цитокинового шторма» как проявление системного воспалительного ответа при коронавирусной инфекции и, соответственно, оказывать позитивное влияние на прогноз заболевания. Почему же необходимо отметить важность медикаментозной «защиты» печени в условиях COVID-19? По данным различных исследований было установлено, что у пациентов с повышенным уровнем печеночных трансаминаз при поступлении в стационар отмечалась более низкая вероятность выживаемости через 25 дней после госпитализации, чем у пациентов с нормальными показателями. В других исследованиях было убедительно показано, что уровень АСТ, более чем в 2 раза превышающий ВГН, повышает риск летального исхода почти в 2 раза [15, 20]. Таким образом, можно предположить, что УДХК может нивелировать фактор печеночного повреждения и снизить риск неблагоприятного исхода COVID-19.
Заключение
Выявлено положительное влияние УДХК в комплексном лечении пациентов с подтвержденной коронавирусной инфекцией и признаками поражения печени. На фоне перорального приема УДХК отмечается более быстрая и ранняя нормализация функции печени в виде снижения повышенного уровня печеночных трансаминаз (АЛТ, АСТ), сокращение сроков госпитализации, восстановление размеров печени и оттока желчи по данным УЗИ через 2 мес. терапии.
Источник финансирования: грант по договору № NIS-URD-22.01 ООО «Бинофарм Групп».
Информация с rmj.ru






