Введение
Эхокардиография (ЭхоКГ) плода — один из основных методов пренатальной диагностики. В Российской Федерации ЭхоКГ плода включена в программы скрининга аномалий плода, а при подозрении на какие-либо аномалии детальное исследование проводят в специализированных центрах. Вначале ЭхоКГ плода использовали для выявления врожденных пороков сердца, однако в последние годы этот метод исследования все чаще стали применять для оценки функции миокарда плода [1]. Это важно как для диагностики первичного заболевания миокарда у плода, так и для планирования лечения и прогнозирования течения других неинфекционных заболеваний, таких как синдром фето-фетальной трансфузии (СФФТ) у плодов из монохориальной диамниотической (МХДА) двойни, поскольку сердце играет центральную роль в адаптивном ответе плода при различных патологических процессах [2]. Еще недавно сократительную способность миокарда в период внутриутробного развития оценивали субъективно. В настоящее время разработаны методы ее точного количественного определения, что позволяет обнаружить изменения сердечной функции на ранних этапах и контролировать ее в динамике. Для детального исследования сердечной функции плода используют различные методы, включая М-режим, импульсную допплерографию и методы тканевой допплерографии [3–5]. Как правило, функциональная оценка миокарда плода затруднена, так как сердце плода представляет собой малую структуру внутри небольшого, подвижного объекта. Движения плода непредсказуемы, что может затруднить получение изображения. Необходимо, чтобы методика, применяемая для оценки сердца плода, была достаточно чувствительна, что позволит выявить дисфункцию миокарда до появления признаков сердечной недостаточности [6–8].
В настоящей работе представлены пилотные данные оценки сократительной способности миокарда левого желудочка (ЛЖ) и правого желудочка (ПЖ) сердца у плодов из монохориальных двоен с использованием эхокардиографической методики спекл-трекинг. Пренатальное использование данной методики у близнецов с монохориальной плацентацией представляет несомненный интерес. В то же время эта тема в мировой научной литературе представлена единичными публикациями.
Спекл-трекинг — относительно новый метод, применяемый в ЭхоКГ, впервые описанный у взрослых в 2004 г. [9]. Это полуавтоматический процесс, выполняемый автономно на ранее полученных в В-режиме двухмерных изображениях с использованием уникального программного обеспечения.
Спекл-трекинг соответствует критериям, предъявляемым к методам ЭхоКГ у плода, поскольку позволяет:
-
измерить размеры, форму, сократимость желудочков сердца за одну манипуляцию;
-
при исследовании не зависеть от угла сканирования, и, следовательно, положения плода;
-
представлять результаты с использованием переменных, не зависящих от срока беременности и биометрических показателей плода;
-
проводить все исследование в течение 5 мин.
Таким образом, оценка деформации дает новое представление о сократительной способности миокарда на ранних этапах развития плода [9].
Цель исследования: сравнительная оценка глобальной продольной деформации (ГПД) миокарда ЛЖ и ПЖ сердца у плодов при беременности МХДА-двойней (неосложненной, с СФФТ, с селективной задержкой внутриутробного роста плода (СЗВРП) одного из двойни) и неосложненной одноплодной беременности.
Содержание статьи
Материал и методы
Проведено проспективное когортное исследование на базе ФГБУ «НИИ ОММ» Минздрава России (Екатеринбург).
В исследование включено 60 беременных, которые были распределены в 2 группы: I группу составили 25 пациенток с неосложненным течением одноплодной беременности, II группу представили 35 пациенток с МХДА-двойней, беременность которых в 10 случаях осложнилась СФФТ I–III стадии по Quintero (СФФТ), в 10 случаях — селективной задержкой внутриутробного роста (СЗВРП) одного из плодов (в наших наблюдениях — II плод), и в 15 случаях беременность протекала без осложнений (МХДА). СЗВРП одного из плодов диагностировали, если окружность живота или расчетная масса плода оказывались <10-го процентиля для одного из плодов и/или дискордантность составляла >25%.
Дизайн исследования представлен на рисунке 1.
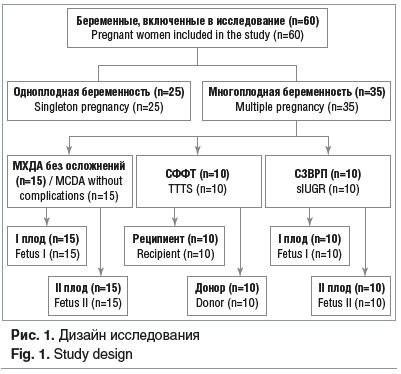
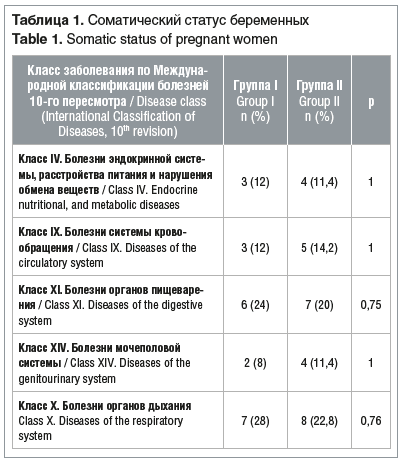
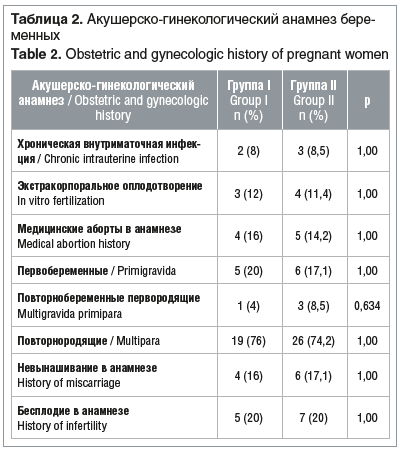
Срок беременности пациенток обеих групп на момент поступления в стационар составил 25,0 [20,0; 28,0] нед. Соматический статус и акушерско-гинекологический анамнез обследованных беременных достоверно не отличались (табл. 1, 2).
Критерий включения в I группу:
- одноплодная беременность.
Критерии включения во II группу:
-
МХДА-двойни с неосложненным течением беременности;
-
МХДА-двойни с СФФТ;
-
МХДА-двойни с СЗВРП.
Критерии невключения во II группу:
Критерии невключения для обеих групп:
-
декомпенсированная экстрагенитальная патология;
-
тяжелая преэклампсия, эклампсия, НЕLLP-синдром;
-
миома матки больших размеров и узловая форма эндометриоза;
-
инфекция вирусом иммунодефицита человека, гепатит В, гепатит С;
-
подтвержденные врожденные пороки развития одного или обоих плодов;
-
отсутствие письменного добровольного информированного согласия.
Перед началом исследования все врачи ультразвуковой диагностики были обучены оптимизации четырехкамерных кардиологических клипов для получения изображений с хорошим контрастом и максимально высокой частотой кадров (80–100 Гц). Сканирование выполняли с использованием ультразвуковых аппаратов Canon Aplio i700 (Canon, Япония) с конвексным датчиком GE-4D и Philips EPIQ Elite (Philips, Нидерланды) с конвексным датчиком C9-2. Все данные сохраняли в формате DICOM. Все клипы были обезличены, импортированы в программное обеспечение для отслеживания спеклов (QLab, Philips TomTec) и последующей постобработки.
Два независимых исследователя измеряли ГПД ЛЖ и ГПД ПЖ, которая была представлена в виде отрицательного значения (исчисляемого в процентах). Мы использовали термины «снижение деформации» для менее отрицательных значений и «увеличение деформации» для более отрицательных значений (рис. 2).
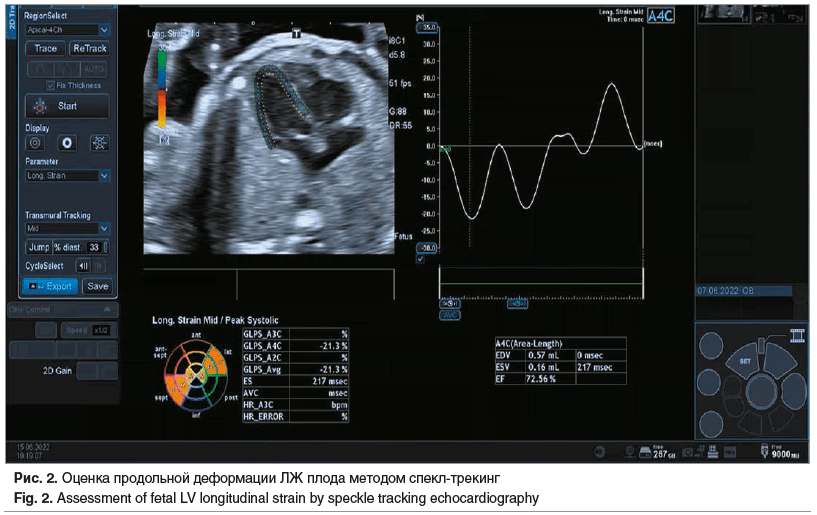
Для оценки деформации использовали апикальную четырехкамерную проекцию сердца. Сканы были собраны при средней частоте кадров 99 Гц (диапазон 36–200 Гц).
Исследование было одобрено локальным этическим комитетом ФГБУ «НИИ ОММ» Минздрава России, информированное согласие пациенток на участие в исследовании получено.
Статистический анализ проведен с помощью программы IBM SPSS Statistics 27.0 (IBM, США). Для показателей, характеризующих качественные признаки, указано абсолютное значение и относительная величина в процентах, проверку статистических гипотез осуществляли с использованием критерия χ2 и точного критерия Фишера (в случае значений ожидаемых частот <5). Для парных сравнений связанных качественных характеристик использовали критерий МакНемара, при множественном сравнении делали соответствующую поправку.
Для количественных переменных при подтверждении нормальности распределения признака рассчитывали средние арифметические значения и стандартные отклонения (m±sd), в остальных случаях — медиану и 25-й и 75-й процентиль. Нормальное распределение признаков проверяли с помощью критерия Шапиро — Уилка.
Для величин, имеющих нормальное распределение, значения в двух независимых группах сравнивали с помощью t-критерия Стьюдента. Три и более независимых групп сравнивали с помощью однофакторного дисперсионного анализа. Для дисперсионного анализа проверяли равенства дисперсий с помощью критерия Левене. При обнаружении статистически значимых межгрупповых различий осуществляли попарное апостериорное сравнение групп с помощью критерия Тьюки. Силу и направление связи измеряли с помощью коэффициента корреляции Пирсона (r). Корреляционные зависимости были распределены по силе связи в соответствии со значением коэффициента: сильная (1,0–0,8), умеренная (0,79–0,6) и слабая (0,59–0,4).
Для параметров, не имеющих нормального распределения, значения в двух независимых группах сравнивали с помощью критерия Манна — Уитни. Межгрупповые различия между тремя и более группами оценивали с помощью критерия Краскела — Уоллиса. При обнаружении статистически значимых межгрупповых различий применяли попарное апостериорное сравнение групп с U-критерием Уилкоксона — Манна — Уитни. Силу и направление связи измеряли с помощью коэффициента ранговой корреляции Спирмена. Значение коэффициента 0–0,29 отражало слабую связь между изучаемыми признаками, 0,3–0,69 — среднюю, 0,7–1,0 — сильную.
Парные сравнения двух связанных выборок проводили с помощью критерия Уилкоксона. Парные сравнения более двух связанных выборок осуществляли с помощью критерия Фридмана с последующим парным апостериорным сравнением групп, используя критерий Уилкоксона с поправкой на множественные сравнения.
Критический уровень статистической значимости был принят равным 0,05.
Результаты исследования
В таблице 3 приведены сводные данные о ГПД и фракции выброса (ФВ) ЛЖ и ПЖ в исследуемых группах.
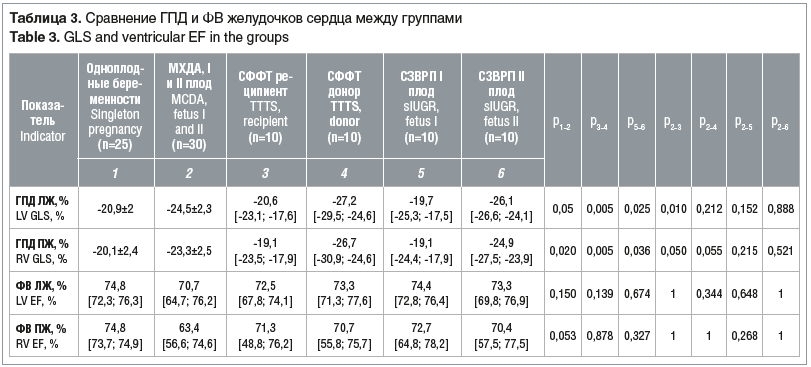
Установлены статистически значимые различия ГПД желудочков сердца плодов при одноплодной беременности и МХДА-двойне без осложнений. Усиление ГПД миокарда при монохориальном многоплодии наглядно иллюстрирует изменение гемодинамики у близнецов даже в ситуациях с неосложненным течением беременности. В случае СФФТ показано статистически значимое снижение ГПД желудочков сердца у реципиентов как по сравнению с донорами, так и по сравнению с плодами из двойни с неосложненным течением беременности. При СЗВРП наблюдается достоверное усиление ГПД желудочков сердца у II плода по сравнению с I плодом, однако отличий по сравнению с группой МХДА-двоен без осложнений выявлено не было. ФВ ЛЖ и ПЖ значимо не отличалась во всех рассматриваемых группах (см. табл. 3).
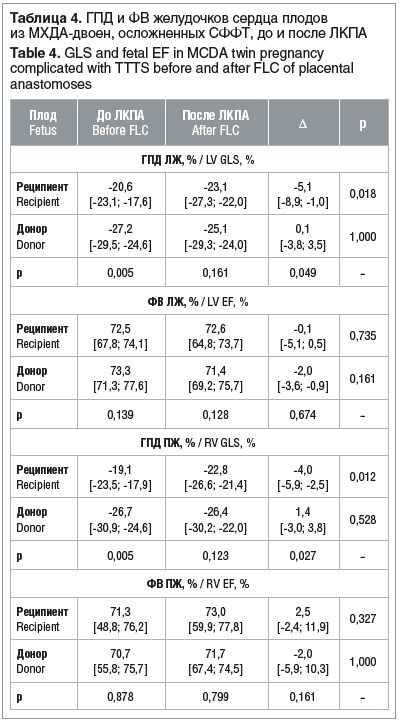
Глобальная продольная деформация ЛЖ и ПЖ после лазерной коагуляции плацентарных анастомозов при СФФТ
Выявлены значимые различия ГПД желудочков сердца у плодов-реципиентов до и после лазерной коагуляции плацентарных анастомозов (ЛКПА). После внутриутробной коррекции СФФТ ГПД миокарда желудочков сердца усилилась, что характеризует положительное влияние вмешательства на гемодинамику плодов-реципиентов, в то время как у плодов-доноров статистически значимые изменения не выявлены (табл. 4).
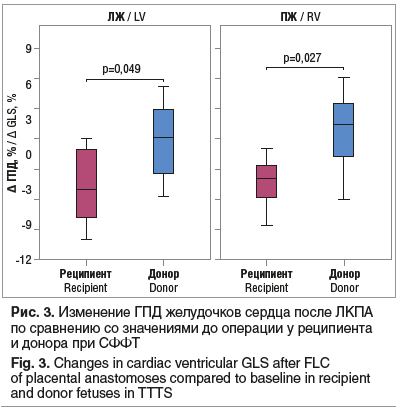
В ходе исследования продемонстрированы статистически значимые отличия между донором и реципиентом в разнице (∆) ГПД желудочков сердца после ЛКПА по сравнению со значениями до операции, что наглядно демонстрирует улучшение гемодинамических показателей у близнецов, в большей степени у плода-реципиента, после коагуляции плацентарных анастомозов. Здесь отрицательные значения ∆ ГПД означают увеличение абсолютной величины деформации (рис. 3).
Обсуждение
В ходе исследования установлены статистически значимые различия ГПД желудочков сердца плодов при одноплодной беременности и МХДА-двойней без осложнений. Продемонстрировано увеличение ГПД миокарда желудочков сердца у плодов-реципиентов после ЛКПА по сравнению с ее значениями до операции, что свидетельствует о сложном процессе восстановления функции миокарда после перенесенного СФФТ. В ходе исследования показаны значимые отличия ∆ ГПД желудочков сердца до и после ЛКПА между донором и реципиентом. Кроме того, выявлены значимые различия Δ ГПД желудочков сердца при сравнении плодов из МХДА-двойни с СЗВРП, где у плодов с низкой массой тела показатели выше, чем у плода с нормальной массой тела.
При анализе данных литературы мы столкнулись с ограниченным количеством исследований по применению методики спекл-трекинг для изучения функции мио-карда при монохориальном многоплодии и, зачастую, с противоречивыми результатами исследований разных авторов.
Особенности функции сердца при СФФТ были изучены в двух исследованиях с использованием методики спекл-трекинг [10, 11]. Ультразвуковые исследования с применением М-режима и допплеровских методик показали значительные изменения сердечной функции у пар плодов с синдромом трансфузии в сравнении с плодами из МХДА-двойни без СФФТ, особенно у близнеца-реципиента, предположительно в результате перегрузки давлением и объемом. В одном исследовании, посвященном только плоду-реципиенту, было обнаружено значительное снижение глобальной функции миокарда ПЖ по сравнению с контрольной группой (0,75±0,34 против 1,00±0,37 кратного медианы, p=0,04) [11]. Аналогичные данные были продемонстрированы в нашем исследовании.
Другое исследование показало, что у плодов-доноров из МХДА-двойни при СФФТ деформация ЛЖ была увеличена, а ПЖ — снижена [10]. У плодов-реципиентов деформация обоих желудочков была снижена, что показано и в нашем исследовании; у плодов-доноров увеличение деформации отмечено в сравнении с плодом-реципиентом, но при сравнении с плодами из неосложненной МХДА-двойни статистической разницы зафиксировано не было.
Исследование с использованием спекл-трекинг ЭхоКГ при СФФТ и СЗВРП у монохориальных двоен опубликовано в 2019 г. [12]. По результатам слепого проспективного исследования, где в первую группу входили МХДА-двойни с последующим развитием СФФТ, а во вторую — МХДА-двойни без осложнений, значительной разницы в дискордантности деформации ПЖ или ЛЖ между группами выявлено не было (p=0,338 и p=0,932 соответственно). Технические ограничения измерения деформации ставят под сомнение клиническую целесообразность применения этого метода для выявления группы риска по формированию СФФТ [12]. В цели нашей работы не входил поиск предикторов развития СФФТ.
В нашем пилотном исследовании мы подтвердили изменения ГПД миокарда желудочков сердца плодов на фоне СФФТ, а также получили значимые различия в разнице ГПД желудочков сердца при сравнении близнецов при СЗВРП. Измерение ФВ желудочков сердца не дало статистически значимых различий между группами, что позволяет признать методику спекл-трекинг более информативной для оценки сократительной способности миокарда. Мы пришли к выводу, что бивентрикулярный анализ спекл-трекинга и количественная оценка функции миокарда у монохориальных близнецов возможны. Дальнейшая проспективная проверка наших выводов и выявление прогностических показателей гемодинамики позволят определить результат хирургического лечения осложнений монохориального многоплодия и определить степень повреждения миокарда у плодов из МХДА-двойни.
Заключение
В настоящее время ЭхоКГ плода служит одним из основных методов пренатальной диагностики, который применяется повсеместно, в том числе и для скрининговых исследований у беременных. Использование эхокардиографической методики спекл-трекинг служит информативным инструментом для оценки сердечной функции плодов из монохориальных двоен, позволяя определить степень повреждения миокарда у плодов из МХДА-двойни и результат хирургического лечения осложнений монохориального многоплодия. В нашем исследовании продемонстрировано, что при монохориальном многоплодии без осложненного течения беременности увеличивается ГПД миокарда плодов по сравнению с одноплодной беременностью. Кроме того, показано, что после ЛКПА, проведенного для лечения СФФТ, улучшается гемодинамика у плода-реципиента.
Сведения об авторах:
Косовцова Наталья Владимировна — д.м.н., врач высшей категории, руководитель отдела биофизических методов исследования ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; профессор ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина»; 620002, Россия, г. Екатеринбург, ул. Мира, д. 19; ORCID iD 0000-0002-4670-798Х.
Маркова Татьяна Владимировна — к.м.н., ведущий научный сотрудник ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4882-8494.
Чумарная Татьяна Владиславовна — к.б.н., старший научный сотрудник лаборатории математической физиологии ИИФ УрО РАН; 620078, Россия, г. Екатеринбург ул. Первомайская, д. 106; научный сотрудник ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина»; 620002, Россия, г. Екатеринбург, ул. Мира, д. 19; ORCID iD 0000-0002-7965-2364.
Гусарова Евгения Олеговна — врач высшей категории, младший научный сотрудник отдела биофизических методов исследования ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0009-0002-8483-0265.
Павличенко Мария Васильевна — к.м.н., врач-педиатр высшей категории, заведующая отделением детей раннего возраста ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4941-9318.
Поспелова Яна Юрьевна — к.м.н., врач ультразвуковой диагностики ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-9988-1199.
Соловьева Ольга Эдуардовна — д.ф.-м.н, профессор, директор ИИФ УрО РАН; 620078, Россия, г. Екатеринбург, ул. Первомайская, д. 106; профессор ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина»; 620002, Россия, г. Екатеринбург, ул. Мира, д. 19; ORCID iD 0000-0003-1702-2065.
Контактная информация: Гусарова Евгения Олеговна, e-mail: evgeniyagusarova89@yandex.ru.
Прозрачность финансовой деятельности: исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках Программы развития Уральского федерального университета имени первого Президента России Ельцина Б.Н. в соответствии с программой стратегического академического лидерства «Приоритет-2030».
Конфликт интересов отсутствует.
Статья поступила 23.05.2024.
Поступила после рецензирования 17.06.2024.
Принята в печать 10.07.2024.
About the authors:
Natalya V. Kosovtsova — Dr. Sc. (Med.), Head of the Division of Biophysical Research Techniques, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; professor of the first President of Russia B.N. Yeltsin Ural Federal University; 19, Mira str., Yekaterinburg, 620002, Russian Federation; ORCID iD 0000-0002-4670-798Х.
Tatyana V. Markova — C. Sc. (Med.), leading researcher, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-4882-8494.
Tatyana V. Chumarnaya — C. Sc. (Biol.), senior researcher of the Laboratory of Mathematical Physiology, Institute of Immunology and Physiology of the Ural Branch of the RAS; 106, Pervomaiskaya str., Ekaterinburg, 620049, Russian Federation; researcher of the first President of Russia B.N. Yeltsin Ural Federal University; 19, Mira str., Yekaterinburg, 620002, Russian Federation; ORCID iD 0000-0002-7965-2364.
Evgeniya O. Gusarova — junior researcher of the Division of Biophysical Research Techniques, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0009-0002-8483-0265.
Mariya V. Pavlichenko — C. Sc. (Med.), Head of the Department of Toddlers, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-4941-9318.
Yana Yu. Pospelova — C. Sc. (Med.), sonographer, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-9988-1199.
Olga E. Solov’eva — Dr. Sc. (Phys. Math.), Professor, Director Institute of Immunology and Physiology of the Ural Branch of the RAS; 106, Pervomaiskaya str., Ekaterinburg, 620049, Russian Federation; professor of the first President of Russia B.N. Yeltsin Ural Federal University; 19, Mira str., Yekaterinburg, 620002, Russian Federation; ORCID iD 0000-0003-1702-2065.
Contact information: Evgeniya O. Gusarova, e-mail: evgeniyagusarova89@yandex.ru.
Financial Disclosure: the research was financially supported by the Ministry of Science and Higher Education of the Russian Federation within the framework of the development program of the first President of Russia B.N. Yeltsin Ural Federal University in accordance with the strategic academic leadership program «Priority-2030».
There is no conflict of interest.
Received 23.05.2024.
Revised 17.06.2024.
Accepted 10.07.2024.
Информация с rmj.ru






