Содержание статьи
Введение
По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания занимают первое место в мире в структуре причин смертности [1]. В Российской Федерации ишемическая болезнь сердца (ИБС) встречается у 13,5% населения [2], при этом 44,9% случаев смерти от всех причин у женщин и 55,4% у мужчин приходится именно на пациентов с ИБС (14% у лиц трудоспособного возраста) [3]. В настоящее время в лечении ИБС одно из ведущих мест занимает чрескожное коронарное вмешательство (ЧКВ) с имплантацией стента, которое ежегодно выполняется не менее чем у 5 млн пациентов во всем мире [4]. Внедрение в повседневную клиническую практику стентов с лекарственным покрытием (СЛП) второго поколения, которые в значительной степени заменили голометаллические стенты (ГМС), способствовало уменьшению выраженности воспалительных изменений, а также увеличению скорости заживления и эндотелизации артерии в месте имплантации стента [5]. Как следствие, при использовании СЛП наблюдалось снижение частоты осложнений, связанных со стентированием, что способствовало расширению показаний к ЧКВ. Однако проблема безопасности вмешательства остается актуальной. Настоящий обзор посвящен наиболее часто встречающимся поздним осложнениям стентирования: тромбоз стента (ТС), рестеноз, неоатеросклероз и кровотечение.
Тромбоз стента
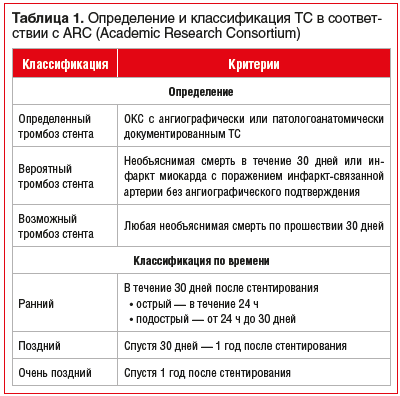
Под ТС подразумевается его тромботическая окклюзия [6]. ТС относится к большим осложнениям ЧКВ и ассоциирован с высоким риском заболеваемости и смертности. В отличие от рестеноза, на фоне которого могут возникать симптомы, характерные для стабильной стенокардии, ТС является острым процессом, который обычно манифестирует в виде острого коронарного синдрома (ОКС). Определение и классификация ТС представлены в таблице 1 [7].
По данным ранних публикаций [8, 9], ТС после ЧКВ отмечался в 16% случаев, при этом показатель 30-дневной смертности составлял 15–30%. По крайней мере отчасти, подобные результаты были обусловлены низкоэффективными схемами профилактики ТС (препараты ацетилсалициловой кислоты, дипиридамол, декстран). С совершенствованием методов стентирования и внедрением двойной антитромбоцитарной терапии (ДАТ) в клиническую практику наблюдалось выраженное снижение частоты ТС до 0,7% в течение 1 года и 0,2–0,6% в течение последующего наблюдения [10–12]. Распространенность ТС при плановом ЧКВ составляет 0,3–0,5% и увеличивается до 3,4% при ОКС. Не получено статистически значимых различий в отношении частоты ТС при использовании ГМС и СЛП. Однако для ГМС по сравнению с СЛП характерно более раннее развитие тромбоза (первые 30 дней с момента вмешательства по сравнению с 3 мес. и более) [13].
В крупных рандомизированных исследованиях и регистрах были идентифицированы факторы, ассоциированные с ТС. Так, в исследовании CHAMPION-PHOENIX инфаркт миокарда с подъемом и без подъема сегмента ST на момент поступления, ангиографические характеристики тромботических поражений и длина стента являлись независимыми предикторами острого ТС [14]. В исследовании ACUITY была установлена ассоциация между сахарным диабетом (СД), почечной недостаточностью, количеством баллов по шкале Duke Jeopardy score, минимальным диаметром просвета стента, назначением тиенопиридинов в предоперационном периоде, исходным уровнем гемоглобина, протяженностью поражений коронарных артерий и ранним ТС [15]. В субанализе HORIZONS-AMI при использовании внутрисосудистого ультразвукового исследования (ВСУЗИ) были идентифицированы следующие предикторы ТС: площадь поперечного сечения менее 5 мм, некорректное позиционирование стента, пролапс или протрузия атеросклеротической бляшки, краевая диссекция, резидуальный стеноз и бифуркационное стентирование [16]. В исследовании Triton-TIMI 38 инфаркт миокарда с подъемом сегмента ST был ассоциирован с более высоким риском ТС, который снижался на 50% при использовании некоторых антитромбоцитарных препаратов [17].
В настоящее время особое внимание уделяется позднему и очень позднему ТС. Если при развитии острого и подострого ТС основную роль, по-видимому, играют анатомические особенности коронарного русла, а также техники и технологии стентирования, то механизм отсроченных тромботических явлений представляется более сложным [18, 19]. В исследованиях идентифицированы следующие факторы риска позднего и очень позднего ТС: СД, ОКС во время исходной процедуры, почечная недостаточность, пожилой возраст, снижение фракции выброса левого желудочка, сердечно-сосудистые осложнения в течение 30 дней после исходной процедуры. Особенности ангиопластики (малый размер сосуда, бифуркационное стентирование, многососудистое поражение, наличие кальцификаций и окклюзий, использование длинных стентов), скорее всего, ассоциированы с поздним ТС как для ГМС, так и для СЛП. Риск ТС увеличивается при нарушениях, связанных с ДАТ: несоблюдение режима приема препаратов, субоптимальная дозировка, лекарственные взаимодействия, коморбидный фон, генетический полиморфизм. К позднему ТС также могут приводить неоатеросклероз (НА) в стенте и поздние реакции гиперчувствительности.
Рестеноз
Применение коронарных стентов позволило улучшить прогноз при ЧКВ по сравнению с изолированной баллонной ангиопластикой, которая сопровождалась как механическими осложнениями (окклюзия, диссекция и т. д.), так и высокой частотой рестенозов (до 40–50%). К концу 1990-х гг. до 70% ЧКВ выполнялись с имплантацией ГМС [20]. Несмотря на совершенствование технологий вмешательства и медикаментозной терапии, риск рестеноза после имплантации ГМС оставался достаточно высоким и составлял около 20%, и внедрение в клиническую практику СЛП позволило дополнительно снизить частоту рестенозов [21, 22].
Одним из наиболее важных предикторов рестенозов является СД (табл. 2). Так, у пациентов с СД, перенесших имплантацию ГМС, риск развития рестеноза увеличивается на 30–50% [23]. При этом применение СЛП у больных с СД также не позволяет полностью предотвратить данное осложнение. Механизм формирования рестеноза при СД, вероятно, является комплексным и включает в себя как системные (например, вариабельность воспалительного ответа), так и анатомические (например, стентирование сосудов малого диаметра; протяженность и диффузный характер поражений) факторы [24]. Также на распространенность рестенозов независимо влияют диаметр сосуда и протяженность поражения [22]. Кроме того, при длине стента свыше 35 мм (по сравнению с длиной менее 20 мм) наблюдалось практически двукратное увеличение частоты рестеноза. Немаловажную роль играет минимальный диаметр просвета стента [25].

Неоатеросклероз
НА называют процесс трансформации нормального слоя интимы в атерогенную неоинтиму внутри стента. Процесс опосредован накоплением липидных макрофагов и в некоторых случаях сопровождается кальцификацией в области стентирования [26]. В отличие от атеросклероза в нативных коронарных артериях, прогрессирующего в течение десятилетий, формирование неоинтимы после ЧКВ происходит в течение нескольких месяцев — нескольких лет [27].
НА в стенте проявляется инфильтрацией и апоптозом макрофагов и последующим образованием некротического ядра [28]. Точная причина высокой скорости процесса в настоящее время не установлена, однако предложено несколько механизмов, в т. ч. неполное эндотелиальное покрытие, приводящее к эндотелиальной дисфункции. На фоне данного процесса, преимущественно после имплантации СЛП, нарушается формирование клеточных соединений, снижаются экспрессия антитромботических молекул и продукция оксида азота. Кроме того, при НА имеет место проникновение липопротеинов высокой плотности и протеогликанов в субэндотелиальное пространство [29].
В исследовании [29] изучалась распространенность НА у 142 пациентов с ГМС и 157 со СЛП. Было установлено, что частота возникновения НА была выше в группе СЛП, чем в группе ГМС (31% и 16% соответственно; р<0,001). Проявления НА манифестировали через 2160 дней (интерквартильный размах 1800–2880 дней) при использовании ГЛС и 420 дней (интерквартильный размах 361–683 дней) при использовании СЛП. Аналогичные результаты были продемонстрированы в другом исследовании, где формирование НА было документировано через 111 дней (медиана) в группе СЛП и через 295 дней в группе ГМС [30]. В работе [31] с помощью оптической когерентной томографии (ОКТ) было показано, что НА отмечался в 58 (43,3%) из 134 случаев ТС [31]. Медиана времени до очень позднего ТС для всех пациентов составила 5,95 года (интерквартильный размах 2,99–8,65 года), для пациентов, перенесших имплантацию СЛП, — 4,52 года (интерквартильный размах 2,1–6,5 года), для пациентов, перенесших имплантацию ГМС, — 8,24 года (интерквартильный размах 5,0–11,49 года). У пациентов с разрывом атеросклеротической бляшки чаще наблюдалась инфильтрация макрофагами (50,2% против 22,2% у пациентов со стабильной атеросклеротической бляшкой; р<0,0001) и реже — кальцификация (4% против 17,2% соответственно; р<0,0001). Как и в предыдущих исследованиях, имплантация СЛП была сопряжена с увеличением риска НА (отношение рисков (ОР) 2,2; 95% доверительный интервал (ДИ): 1,15–4,3, р=0,02).
Для выявления механизмов недостаточности стента можно использовать ВСУЗИ или OКT [32]. Однако разрешение ОКТ (10–20 мкм) по сравнению с разрешением ВСУЗИ (80–120 мкм) делает его предпочтительным методом интракоронарной визуализации для оценки неоинтимальной ткани в стентированном сегменте.
Многоцентровой анализ показал, что среди пациентов, которым были установлены СЛП первого и второго поколения, распространенность НА, определяемого с помощью OКT, составила 27,4% (58/212) [33]. Первое поколение СЛП по сравнению со стентами второго поколения показало более высокую скорость развития НА (45,5% против 10,8%; p<0,001). Разницы между типами стентов установлено не было. Кроме того, пациенты с НА имели более высокий риск развития ОКС (19% против 3,9%; р=0,001). Многофакторный анализ показал, что хроническая болезнь почек, уровень липопротеинов низкой плотности выше 70 мг/дл и длительность наблюдения с момента установки стента были независимыми предикторами развития НА.
В недавно опубликованной работе M. Kuroda et al. были представлены результаты долгосрочного наблюдения за 175 пациентами, у которых была выполнена коронарография с ОКТ-визуализацией за период с 2005 по 2013 г. [34]. Наличие НА было независимым предиктором сердечной смерти, реваскуляризации целевого сосуда (РЦС) и очень поздним ТС. В исследовании [35] НА был ассоциирован с более высокой потребностью в РЦС (55% и 9% у пациентов с и без НА соответственно; p<0,001), выраженной клинической симптоматикой (57% и 13% у пациентов с и без НА соответственно; p<0,001). В европейском протоколе PRESTIGE Consortium из 134 пациентов с очень поздним ТС у 58 был выявлен НА по данным ОКТ. Во всех случаях НА сопровождался клиникой ОКС (77% — инфаркт миокарда с подъемом сегмента ST), при этом основной причиной тромбоза был разрыв бляшки внутри стента. Как показал проведенный в последующем многофакторный анализ, СЛП, в отличие от ГМС, являлся предиктором НА. Кроме того, предшествующий инфаркт миокарда сопровождался повышением риска разрыва бляшки у пациентов с НА (ОР 4,87, 95% ДИ: 1,73–13,73, р=0,003).
Таким образом, не вызывает сомнений, что НА является распространенным осложнением ЧКВ с имплантацией СЛП. Широкое внедрение внутрикоронарной визуализации, особенно ОКТ, неизбежно будет способствовать повышению осведомленности и более глубокому пониманию данного процесса. Следует подчеркнуть, что НА не является доброкачественным процессом и может приводить к очень позднему ТС.
Кровотечение
Кровотечения после ЧКВ являются значимой причиной общей и сердечно-сосудистой смертности [36]. После острой кровопотери повышается риск развития ТС, вероятно, за счет образования незрелых крупных тромбоцитов с большей реактивностью [37]. По данным регистра [38], частота больших кровотечений после ЧКВ составляет 1,7%, при этом до 50% случаев связаны с сосудистым доступом. В остальных случаях наиболее распространенной локализацией являются органы желудочно-кишечного тракта. Внедрение радиального доступа в клиническую практику способствовало значительному снижению распространенности больших кровотечений в послеоперационном периоде [39].
В настоящее время предложено несколько инструментов оценки риска кровотечений, полученных в регистрах и клинических исследованиях ОКС и ЧКВ. Шкала CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse out comes with Early implementation of the ACC/AHA guidelines) была разработана на когорте из 71 277 пациентов с ОКС без подъема сегмента ST и прошла валидацию на 17 857 больных [40]. При оценке риска больших кровотечений во время пребывания в стационаре используются исходные характеристики (женский пол, анамнез СД, облитерирующего атеросклероза артерий нижних конечностей, инсульта), клинические (частота сердечных сокращений, систолическое артериальное давление, признаки правожелудочковой сердечной недостаточности) и лабораторные (гематокрит, расчетное значение клиренса креатинина) параметры на момент поступления. Однако для данной модели характерна умеренная точность (с-статистика 0,68 и 0,73 для консервативного лечения и инвазивного лечения соответственно).
Шкала ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) была разработана на когорте из 17 421 пациента с ОКС с подъемом и без подъема сегмента ST, включенных в исследования ACUITY и HORIZONS-AMI [41]. По результатам анализа были выявлены независимые предикторы кровотечений (женский пол, пожилой возраст, увеличение сывороточной концентрации креатинина, концентрация лейкоцитов, анемия и инфаркт миокарда с подъемом или без подъема сегмента ST, применение низкомолекулярных гепаринов и ингибиторов гликопротеина IIb/IIIa). Модель позволила прогнозировать риск больших кровотечений, не связанных с аортокоронарным шунтированием, в течение 30 дней и смертности в течение 1 года наблюдения. Следует отметить, что представленная шкала не была валидирована на независимой когорте больных. Кроме того, для нее характерна умеренная точность (с-статистика 0,74). Изменение практики инвазивных вмешательств (например, внедрение радиального доступа), снижение дозировки низкомолекулярных гепаринов, снижение частоты использования ингибиторов GPIIb/IIIa и применение более эффективных ингибиторов рецепторов аденозиндифосфата тромбоцитов P2Y12 (ингибиторы P2Y12) потенциально могут модифицировать расчетную величину риска. Таким образом, вероятность ишемических событий и геморрагических осложнений следует оценивать индивидуально в каждом конкретном случае. Однако важно подчеркнуть, что одни и те же факторы могут быть ассоциированы с риском и тромбоза, и кровотечений.
Достижение баланса между тромботическими событиями и геморрагическими осложнениями у пациентов, получающих длительную ДАТ, вызывает определенные затруднения. Имплантация СЛП второго поколения и назначение ДАТ в течение 6 мес. представляется достаточным для предотвращения большинства случаев ТС. Внедрение шкал PRECISE-DAPT и DAPT может индивидуализировать решения относительно длительности ДАТ.
Заключение
За последние 40 лет произошли значительные изменения в области интервенционной ангиологии у пациентов с ОКС, которые позволили повысить эффективность и безопасность ЧКВ. Внедрение в клиническую практику СЛП первого поколения значительно снизило частоту рестеноза при увеличении риска позднего ТС. Использование СЛП второго поколения сопровождалось уменьшением частоты данного осложнения, однако техника и технология стентирования сами по себе препятствуют полному восстановлению структуры и функции сосудов с соответствующим риском отсроченного нарушения функции стента. В данной ситуации следует отметить роль НА как фактора риска ОКС и позднего рецидивирования симптомов у пациентов, перенесших ЧКВ. Расширенная коронарная визуализация и длительная ДАТ, возможно, будут иметь фундаментальное значение для дальнейшего понимания и лечения этого процесса.
.
Информация с rmj.ru