Введение
Аллергические заболевания органов дыхания входят в группу широко распространенных социально значимых мультифакториальных заболеваний [1–3].
Бронхиальная астма (БА) — хроническое гетерогенное заболевание, в развитии которого важную роль играют иммунологические механизмы [4, 5]. В процессе формирования иммунного ответа при аллергических заболеваниях участвуют основные и вспомогательные иммунокомпетентные клетки, различающиеся по антигенам главного комплекса гистосовместимости и продуцируемым цитокинам [6–9].
Мутации в генах цитокинов, дефекты продукции, рецепции и чрезмерная продукция отдельных цитокинов составляют значительную часть иммуноопосредованных механизмов развития и прогрессирования патологических процессов при аллергических заболеваниях [10].
Профиль продуцируемых цитокинов модулирует определенный тип клеточной кооперации, формирует вторичные эффекты Т-клеточной активации. Субпопуляции Т-хелперов (Тh) определяют направленность, специфичность и эффекторные механизмы иммунного ответа. Индукция выработки цитокинов антигеном и локальная концентрация метаболитов в лимфоидной ткани определяют дифференцировку Т-хелперов по пути Тh1, Тh2, Тh9, Тh17. Согласно современным представлениям нарушения иммунного гомеостаза с дисбалансом в соотношении Th1/Th2 лимфоцитов определяют тип иммунного реагирования и являются основой формирования аллергического воспаления при БА [11, 12].
В патогенезе БА значима роль баланса цитокинов — интерферона гамма (IFNγ) и интерлейкина IL-4, определяющих поляризацию иммунного ответа и профиль Тh1 и Тh2. IFNγ продуцируется активированными Тh1, T-цитотоксическими и натуральными киллерами (Natural killer cells — NK-клетки). IFNγ участвует в клеточном иммунном ответе, стимулирует активность Т- и В-лимфоцитов, дифференцировку Тh0 в Тh1, моноцитов/макрофагов, нейтрофилов и NK-клеток, усиливает экспрессию молекул главного комплекса гистосовместимости МНС I (Major Histocompatibility Complex) и МНС II. В аспекте БА наиболее актуальна способность IFNγ вызывать дифференцировку наивных CD4+ клеток в Тh1 и ингибировать пролиферацию Тh2. IFNγ является отрицательным сигналом для Тh2 и надежным маркером субпопуляции Тh1 [13, 14].
В исследованиях Н.И. Баранова и соавт. (2014) установлена важная роль генетических полиморфизмов IL-4, IL-10 и IL-17 в патогенезе аллергических заболеваний, отмечена ассоциация полиморфизма генов данных цитокинов с количественным отклонением цитокинов и формированием той или иной формы аллергического заболевания [15].
В литературе представлены данные о выявлении функционального полиморфизма генов цитокинов, связанного с заменами единичных нуклеотидов, вызывающих количественные изменения функционирования соответствующих генов, в отличие от мутаций, полностью выключающих функции кодируемых ими белков [16–20]. Обладая значительной вариабельностью, цитокины характеризуются наличием однонуклеотидных полиморфизмов, ассоциированных с изменением синтеза биохимических продуктов у больных с различными аллергическими заболеваниями [21–23].
Цель исследования: характеристика полиморфизмов генов цитокинов — IL-4 (С-589Т) и IFNγ (874 A/T), а также спонтанной и индуцированной продукции клетками периферической крови цитокинов IL-4, IFNγ у детей с БА.
Материал и методы
Обследованы 60 детей (в возрасте 3–11 лет) с верифицированным диагнозом БА средней степени тяжести в межприступный период, находящихся на диспансерном наблюдении в городском аллерго-респираторном центре, и 100 сопоставимых по полу и возрасту здоровых сверстников, наблюдавшихся в центре здоровья КГБУЗ «ВКДЦ». Верификация БА проводилась в соответствии с рекомендациями международного согласительного документа PRACTALL (The European Pediatric Asthma Group Diagnosis and treatment of asthma in childhood: a PRACTALL consensus report — Диагностика и лечение астмы в детском возрасте: консенсусный доклад PRACTALL. European Academy of Allergy and Clinical Immunology and the American Academy of Allergy — Европейская академия аллергологии и клинической иммунологии) по данным наследственного анамнеза, анамнеза заболевания, аллергологического обследования (скарификационные пробы, определение общего и специфического иммуноглобулина IgE к бытовым, эпидермальным, пыльцевым аллергенам в сыворотке крови). Комплексное клинико-лабораторное обследование и наблюдение проведено на кафедре клинической лабораторной диагностики, общей и клинической иммунологии и в центральной научно-исследовательской лаборатории ФГБОУ ВО ТГМУ Минздрава России.
Материалом исследования являлась венозная кровь. Геномную ДНК выделяли при помощи коммерческого набора для выделения ДНК High Pure PCR Template Preparation Kit (Roche, Швейцария) с дальнейшей оценкой генотипа IL-4 C-590T и генотипа IFNγ 874ТТ методом полимеразной цепной реакции (ПЦР; использовались наборы «Гено Технология», Россия). Оценку результатов аллель-специфической ПЦР проводили при помощи горизонтального гель-электрофореза в 2% агарозном геле («Литех», Россия).
Полученную в ходе электрофореза картину анализировали с использованием системы детекции VersaDoc Imaging System («Bio-Rad», США). Для анализа вариантов полиморфизма 874 A/T гена IFNγ использовали метод ПЦР в реальном времени по технологии TaqMan. Продукцию IFNγ и IL-4 клетками цельной крови исследовали с применением тест-системы «ЦИТОКИН-СТИМУЛ–БЕСТ» (ЗАО «Вектор-Бест», Россия).
Статистическая обработка результатов исследования проводилась с использованием прикладных программ «Статистика-10» (StatSoft, США). При сравнении двух выборочных средних в пределах одной выборки использовали критерий Вилкоксона, при сравнении групп между собой — критерий Манна — Уитни. Показатели представлены в виде медианы (Me), нижнего и верхнего квартилей (Q25; Q75). Для обработки цифровых данных использовали методы сравнения несвязанных групп по качественным признакам, оценку соответствия распределений генотипов ожидаемым значениям при равновесии Харди — Вайнберга и для сравнения распределений частот генотипов и аллелей в двух субпопуляциях использовали критерий хи-квадрат. Cилу ассоциаций оценивали в значениях отношения шансов (ОШ) с 95% доверительным интервалом (ДИ). Различия считали статистически значимыми при p<0,05.
Результаты исследования
Результаты распределения показателей частоты встречаемости генотипов полиморфизма IFNγ (874 A/T) и IL-4 (C-590T) у здоровых детей и детей с БА представлены в таблице 1. Концентрации цитокинов сыворотки крови с различными генотипами IFNγ (874 A/T) и IL-4 (C-590T) в группе здоровых детей и детей с БА указаны в таблице 2.
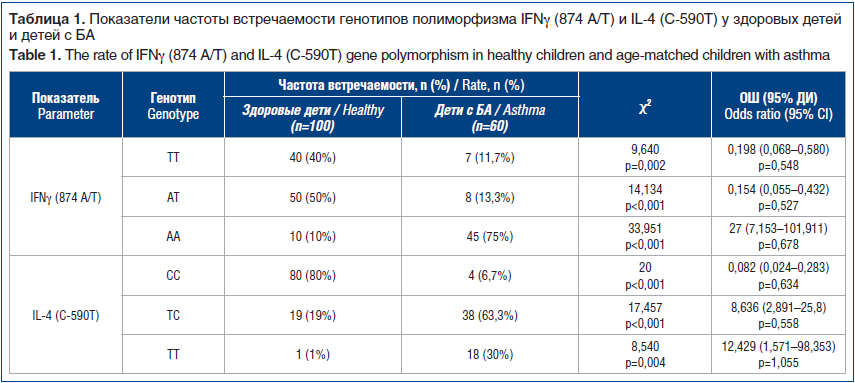
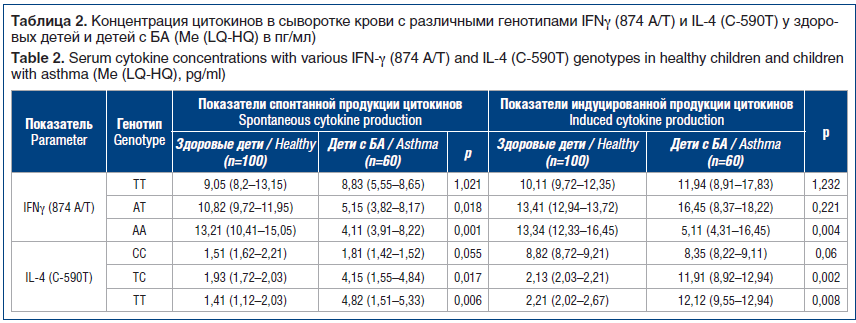
Сравнительное исследование частот генотипов IFNγ (874 A/T) показало, что генотип IFNγ (874 ТТ) статистически реже встречался у больных БА, чем у здоровых детей (ОШ=0,198; 95% ДИ 0,068–0,580). При анализе спонтанной и индуцированной митогеном продукции IFNγ с генотипом ТТ различия уровней продукции оказались статистически незначимыми. Кроме того, гетерозиготное носительство в группе контроля АТ полиморфизма (874 АТ) гена IFNγ было также достоверно выше, чем в группе детей с БА (ОШ=0,154; 95% ДИ 0,055–0,432). Отмечено достоверное снижение уровня спонтанной продукции при увеличении индуцированной митогеном продукции IFNγ. В исследуемых группах с генотипом IFNγ (874 АА) получено достоверное повышение данного полиморфизма у пациентов с БА по сравнению с контрольной группой (ОШ=0,198; 95% ДИ 0,068–0,580), а также выявлено статистически значимое различие в уровнях спонтанной и индуцированной продукции с четкой тенденцией к снижению уровня IFNγ у больных БА.
Характеристика распределения вариаций генотипов в группе здоровых детей без отягощенной аллергической наследственности в структуре генотипов IL-4 такова: гомозиготный СС встречался статистически чаще у здоровых детей (ОШ=0,082; 95% ДИ 0,024–0,283), оценка спонтанной и индуцированной митогеном продукции IL-4 с генотипом СС не выявила статистически значимого различия в уровнях продукции. При анализе варианта ТС полиморфизма IL-4 (C-590T) установлено наиболее выраженное в наблюдаемых группах повышение частоты встречаемости у детей с БА (ОШ=8,636; 95% ДИ
2,891–25,8); гомозиготный вариант ТТ полиморфизма IL-4 (C-590T) также преобладал у детей с БА (ОШ=12,429; 95% ДИ 1,571–98,353). У детей с БА и генотипами ТС и ТТ выявлено определенное статистически значимое увеличение показателей уровня спонтанной и индуцированной митогеном продукции IL-4.
Заключение
При анализе генетической вариации гена IFNγ протективный эффект выявлен при гаплотипе ТТ и гетерозиготном варианте АТ в отношении риска развития БА. Установлена связь между вариантом генотипа и вариантом синтеза цитокинов.
В результате проведенного исследования установлено значительное преобладание гетерозиготного варианта гена IL-4 в группе здоровых детей и группе детей с БА, гаплотип CC превалирует у здоровых детей. Установленные различия полиморфизма генов цитокинов при БА вносят вклад в изучение молекулярно-генетических основ формирования БА и могут быть использованы для персонификации терапии.
Сведения об авторах:
Просекова Елена Викторовна — д.м.н., профессор, заведующая кафедрой клинической лабораторной диагностики, общей и клинической иммунологии, ORCID iD 0000-0001-6632-9800;
Долгополов Максим Сергеевич — ассистент кафедры клинической лабораторной диагностики, общей и клинической иммунологии, ORCID iD 0000-0003-4657-6868;
Сабыныч Виталий Александрович — к.м.н., доцент кафедры клинической лабораторной диагностики, общей и клинической иммунологии, ORCID iD 0000-0003-3874-6433.
ФГБОУ ВО ТГМУ Минздрава России. 690002, Россия,
г. Владивосток, просп. Острякова, д. 2.
Контактная информация: Просекова Елена Викторовна, e-mail: pros.ev@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.02.2020.
About the authors:
Elena V. Prosekova — MD, PhD, Professor, Head of
the Department of Clinical Laboratory Diagnostics, General, and Clinical Immunology, ORCID iD 0000-0001-6632-
9800;
Maksim S. Dolgopolov — MD, Assistant of the Department of Clinical Laboratory Diagnostics, General, and Clinical Immunology, ORCID iD 0000-0003-4657-6868;
Vitalii A. Sabynych — MD, PhD, Associate Professor of the Department of Clinical Laboratory Diagnostics, General, and Clinical Immunology, ORCID iD 0000-0003-3874-6433.
Pacific State Medical University. 2, Ostryakov str., Vladivostok, 690002, Russian Federation.
Contact information: Elena V. Prosekova, e-mail: pros.ev@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.02.2020.
Информация с rmj.ru






