Содержание статьи
Введение
Сердечно-сосудистые заболевания относятся к числу наиболее часто встречающихся коморбидных состояний, наблюдаемых при хронической обструктивной болезни легких (ХОБЛ), причем они не просто сопутствуют, а оказывают непосредственное отрицательное влияние на течение ХОБЛ, увеличивая частоту госпитализаций и уровень смертности [1–4]. С увеличением степени тяжести ХОБЛ возрастает риск развития артериальной гипертензии (АГ) [1], что, безусловно, подтверждает патогенетическую зависимость между уровнем артериального давления (АД) и степенью бронхиальной обструкции у больных с сочетанием АГ и ХОБЛ. Это является неоспоримым доказательством существующей коморбидности, причем начиная уже с общих факторов риска. Пусковыми механизмами системного воспаления при ХОБЛ являются не только хроническая гипоксия, наблюдаемая прежде всего у больных с тяжелой ХОБЛ, но и эндотелиальная дисфункция и окислительный стресс, которые реализуются при незначительной бронхиальной обструкции [4–8] и усиливаются по мере прогрессирования заболевания. В связи с этим возникает вопрос о необходимости проведения ранней и точной диагностики нарушений со стороны сосудистой стенки и процессов перекисного окисления липидов (ПОЛ) при АГ и ХОБЛ, а значит, и о своевременных способах их коррекции. Наблюдаемая избыточная активность ренин-ангиотензин-альдостероновой системы (РААС) у больных с данной сочетанной патологией [9–11], скорее всего, и будет запускать интенсификацию ПОЛ, приводя к развитию дисфункции эндотелия. Следовательно, ключом к коррекции этих нарушений будут выступать препараты, блокирующие РААС. Однако до сих пор не решен вопрос, какому из блокаторов РААС — ингибитору ангиотензинпревращающего фермента (иАПФ) или блокатору рецепторов ангиотензина II (БРА) — следует отдавать предпочтение при лечении АГ у больных с ХОБЛ [9, 11]. Гипотензивное действие указанных групп лекарственных препаратов неоднократно изучалось [1, 9, 11], однако единого мнения относительно преимуществ одной группы перед другой до сих пор не достигнуто. Возможно, различное влияние иАПФ и БРА на систему ПОЛ и эндотелий сосудистой стенки позволит выделить преимущества одного класса перед другим при лечении больных АГ с ХОБЛ. В связи с этим предпринято настоящее исследование.
Цель исследования: провести сравнительное исследование для оценки влияния на функцию эндотелия и показатели ПОЛ применения иАПФ и БРА в течение 6 мес. у больных АГ, имеющих сопутствующую ХОБЛ.
Материал и методы
В исследование включили 60 человек, страдающих АГ 1–2 степени и имеющих сопутствующую ХОБЛ средней степени тяжести вне обострения. Не включали больных с резистентной и вторичной АГ, имеющих хроническую сердечную недостаточность со сниженной фракцией выброса и выше III функционального класса, с бронхиальной астмой. Больные получали различную антигипертензивную терапию, однако целевой уровень АД меньше 130/80 мм рт. ст. (в соответствии с последними европейскими рекомендациями по АГ 2018 г. [9]) у них достигнут не был. Для коррекции АД была выбрана комбинация диуретика гидрохлортиазида в дозе 12,5 мг/сут с блокатором РААС — иАПФ или БРА. Методом конвертов больные были рандомизированы на 2 группы. В 1-й группе пациенты получали свободную комбинацию гидрохлортиазида в дозе 12,5 мг с БРА азилсартана медоксомилом в дозе 40 мг/сут, во 2-й группе — свободную комбинацию гидрохлортиазида в дозе 12,5 мг с иАПФ фозиноприлом в дозе 20 мг/сут. Таким образом, группы отличались по назначенному блокатору РААС. Входящий в состав комбинированной терапии диуретик гидрохлортиазид, как известно, не обладает плейотропными свойствами [11], что позволило в дальнейшем трактовать полученную динамику, как связанную с действием блокатора РААС. Больные продолжали назначенную ранее бронхолитическую терапию м-холинолитиками, β2-агонистами или их комбинацией (в ходе исследования дозы указанных препаратов были постоянными). Общие характеристики пациентов обеих групп были описаны нами ранее [12].
Всем больным до и через 1 и 6 мес. от начала лечения проводили полное клинико-инструментальное обследование, включающее офисное измерение АД и частоты сердечных сокращений (ЧСС), суточное мониторирование АД (СМАД), исследование функции внешнего дыхания (ФВД). Функция эндотелия изучалась с помощью пробы с эндотелий-зависимой вазодилатацией (ЭЗВД), а также путем определения в крови метаболитов оксида азота (нитрит и нитрат ионы). При эхокардиографии акцент сделан на измерении среднего давления легочной артерии (ДЛАср.). Интенсификация ПОЛ изучалась по определению первичных и конечных продуктов методом биохемилюминесценции. Анализировались такие параметры хемилюминограммы, как индекс Imax (мВ) — максимальная интенсивность свечения, которая отражает потенциальную способность биологического объекта к свободнорадикальному окислению; индекс S (мВ) — светосумма хемилюминесценции за 30 с, т. е. величина, которая соответствует обрыву цепи свободнорадикального окисления и является обратно пропорциональной антиоксидантной активности сыворотки крови. Также оценивали в динамике уровень первичных и конечных продуктов ПОЛ: диеновых конъюгатов (ДК), триеновых конъюгатов (ТК), оснований Шиффа (ОШ). Исходно САД, ДАД, ЧСС, пульсовое давление и объем форсированного выдоха за первую секунду (ОФВ1) (%) у пациентов обеих групп были сопоставимы [12].
Диагноз АГ устанавливался на основании общепринятых критериев [9, 11]. Диагноз ХОБЛ определялся в соответствии с признаками, изложенными в отечественных рекомендациях и в международной программе «Глобальная стратегия диагностики, лечения и профилактики ХОБЛ» [10, 13].
Статистическая обработка данных проводилась с применением пакетов прикладных компьютерных программ IBM SPSS Statistics 24 (IBM), Statistica 6.0 для Windows (StatSoft) и Microsoft Office Excel 2016 (Microsoft). Различия считались статистически значимыми при уровне значимости р≤0,05.
Результаты исследования и обсуждение
Средний возраст больных в обеих группах составил 56,5±7,5 года. Через 1 мес. лечения у больных из группы азилсартана медоксомила систолическое артериальное давление (САД) снизилось до 128,0±6,4 мм рт. ст., в группе фозиноприла — до 134,2±7,0 мм рт. ст. (при сравнении показателей у пациентов обеих групп р<0,001). Диастолическое артериальное давление (ДАД) через 1 мес. лечения у пациентов из группы азилсартана медоксомила равнялось 78,7±4,5 мм рт. ст., в группе фозиноприла — 81,1±6,8 мм рт. ст. (при сравнении показателя у пациентов обеих групп р<0,001). По результатам СМАД через 6 мес. исследования всем пациентам 1-й группы удалось достичь целевых значений АД без повышения дозы препарата, тогда как 5 больным из 2-й группы пришлось увеличить дозу фозиноприла до 40 мг/сут [12].
При исследовании ФВД в динамике зарегистрировали статистически значимое улучшение ОФВ1 у пациентов из обеих групп (р<0,001), однако клинически оно было незначимым (прирост меньше 100 мл). Положительное влияние блокаторов РААС на показатели бронхиальной обструкции хорошо известно [1, 9–11] и может быть использовано в качестве дополнительного критерия эффективности проводимой антигипертензивной терапии у данной группы больных.
Исходно у пациентов обеих групп ДЛАср. было сопоставимо (18±2,0 и 19,6±3,0 мм рт. ст. в группах азилсартана медоксомила и фозиноприла соответственно, p=0,6). Через 6 мес. от начала терапии на фоне применения азилсартана медоксомила и фозиноприла отмечали статистически значимое снижение ДЛАср. до 16,9±1,8 и 18,4±2,6 мм рт. ст. соответственно (p<0,001 по сравнению с исходным в обоих случаях), при этом в группе азилсартана медоксомила снижение данного показателя было более выраженным (p=0,01).
Одним из пусковых механизмов развития легочной гипертензии у больных АГ и ХОБЛ явился окислительный стресс [6, 7]. Накопление конечных продуктов ПОЛ всегда сопровождается вазоконстрикцией артериол и повышением общего периферического сопротивления, что вносит вклад в формирование АГ у больных ХОБЛ [6, 7]. Окислительный стресс — это, прежде всего, нарушение баланса антиоксидантов и прооксидантов в периферической крови, которое носит системный характер. Эти изменения приводят к повреждению сосудистой стенки и формированию эндотелиальной дисфункции [6, 7, 14, 15].
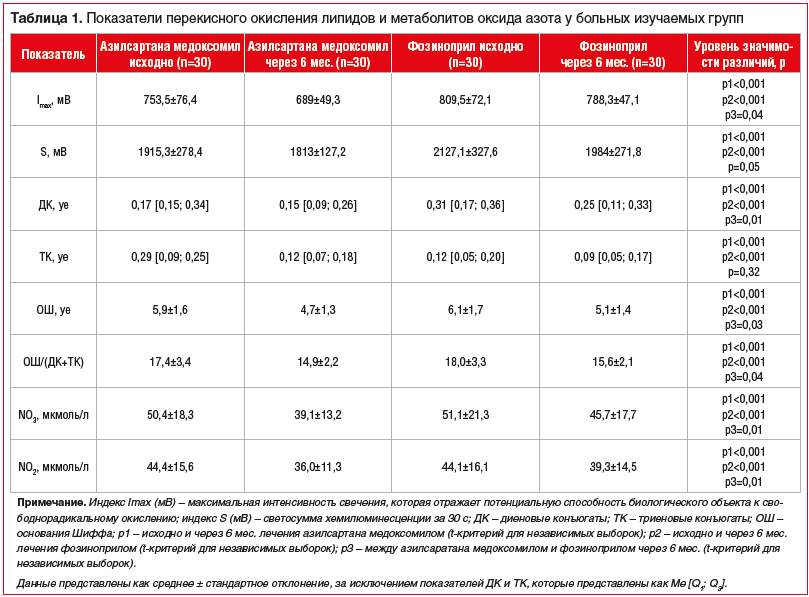
В нашем исследовании через 6 мес. лечения азилсартана медоксомилом отмечалось существенное улучшение показателей ПОЛ по сравнению с показателями у больных, получающих фозиноприл: ДК на 7,6 Δ%, ОШ на 9,3 Δ%; ОШ/(ДК+ТК) на 6,9 Δ% (табл. 1).
С точки зрения современных представлений, дисфункция эндотелия может рассматриваться как начальное звено развития многих заболеваний, способствующее их прогрессированию и присоединению осложнений, а также как одна из главных составляющих патологического процесса [6]. Одни авторы связывают ее развитие, прежде всего, с недостатком вазодилатирующего соединения оксида азота (NO), другие в качестве ключевого звена рассматривают дисбаланс между вазоконстрикторами и вазодилататорами (в т. ч. и снижение продукции NO) [6, 7, 15]. Содержание метаболитов NO косвенно отражает продукцию самого NO и может использоваться для оценки ЭД, что и было предпринято нами. Известно, что NO является медиатором эндотелий-зависимой вазодилатации (ЭЗВД) благодаря ингибирующему действию на такие вазоконстрикторы, как ангиотензин II и эндотелин. Следовательно, нарушения процессов вазодилатации позволяет оценить метод ЭЗВД.
Таким образом, эндотелиальная дисфункция — сложный процесс, в основе которого, во-первых, лежит дисбаланс между вазоконстрикцией и вазодилатацией, во-вторых, нарушение выработки факторов воспаления и пролиферации сосудов, в-третьих, повреждение в системе тромбообразования. Все это приводит к ремоделированию сосудистой стенки [1], при этом механизм окончательной реализации вышеперечисленных процессов неясен. Для полноты представления нарушений функции эндотелия следует использовать комплексную оценку. Нами была предпринята попытка такого комплексного изучения: по количеству метаболитов NO и с помощью пробы с ЭЗВД. Были получены однонаправленные изменения, которые в совокупности с определением продуктов ПОЛ позволили дать оценку плейотропных эффектов изучаемых лекарственных препаратов.
Через 6 мес. лечения отмечено снижение показателей NO2 и NO3 у пациентов из обеих групп. Однако в группе азилсартана медоксомила динамика была более заметной и составила по NO2 4,3 Δ%, по NO3 12,1 Δ% (табл. 1).
До начала терапии ЭЗВД у пациентов из групп азилсартана медоксомила и фозиноприла равнялся 8,0±1,9% и 7,1±2,1% соответственно (p=0,073). Через 6 мес. лечения показатель ЭЗВД в 1-й группе составил 9,4±2,1% (р<0,001 по сравнению с исходным), во 2-й группе — 8,5±2,3 (р<0,001 по сравнению с исходным). Степень различий ЭЗВД между азилсартана медоксомилом и фозиноприлом составила 3,7 Δ%.
Заключение
Хорошо известно, что любой блокатор РААС может приводить к улучшению функции эндотелия [11], однако от фармакокинетических характеристик лекарственного препарата будет зависеть его гипотензивное действие, его продолжительность и сила, а также плейотропные эффекты. Продемонстрированное нами преимущество азилсартана медоксомила связано с его большим сродством к рецепторам ангиотензина II, что позволяет удерживать АД в целевом диапазоне в течение 24 ч, а также положительно влиять на органы-мишени, в т. ч. на сосудистую стенку. Косвенно это отражают и сниженная интенсификация ПОЛ под воздействием лечения, и улучшение функции эндотелия, и снижение давления в легочной артерии.
Таким образом, у больных АГ и ХОБЛ через 6 мес. лечения азилсартана медоксомилом отмечается достоверно большее улучшение показателей ПОЛ, функции эндотелия, а также снижение давления в легочной артерии по сравнению с показателями при лечении фозиноприлом, что позволяет говорить о более выраженных плейотропных эффектах БРА. При выборе лекарственного препарата для лечения АГ у больных с сопутствующей ХОБЛ следует учитывать не только его гипотензивное действие, что, несомненно, важно, но и плейотропные эффекты, прежде всего влияние на сосудистую стенку. Таким критериям в полной мере отвечает последний представитель группы сартанов — азилсартана медоксомил.
.
Информация с rmj.ru






