Введение
Спондилоартриты (СпА) — это группа хронических воспалительных заболеваний позвоночника, суставов, энтезисов, характеризующаяся общими клиническими, рентгенологическими и генетическими особенностями [1]. Аксиальные спондилоартриты (аксСпА) являются подвидом СпА с обязательным вовлечением в воспалительный процесс структур осевого скелета [1]. В настоящий момент на основании особенностей поражения крестцово-подвздошных сочленений выделено две формы аксСпА — нерентгенологическая (нр-аксСпА) и рентгенологическая (анкилозирующий спондилит, АС). На основании клинических особенностей заболевания отдельно выделяют особые формы аксСпА: псориатический аксСпА; аксСпА, ассоциированный с болезнью Крона или язвенным колитом (воспалительные заболевания кишечника (ВЗК)); реактивный аксСпА [1].
Все аксСпА объединены общими путями патогенеза и, согласно современным представлениям, относятся к болезням, ассоциирующимся с особенностями главного комплекса гистосовместимости человека I типа (Main Histological Complex-I, МНС-I), или MHC-I-ассоциированным заболеваниям. При лечении MHC-I-ассоциированных заболеваний применяется ряд общих подходов, связанных с общностью патогенеза болезней [2].
Современные способы медикаментозного лечения аксСпА включают применение нестероидных противовоспалительных препаратов (НПВП), сульфасалазина (при периферическом вовлечении) и генно-инженерной биологической терапии (ГИБТ): блокаторы фактора некроза опухоли α (ФНО-α) и блокаторы интерлейкина (ИЛ) 17, а также ингибиторы янус-киназ [3, 4]. Несмотря на большое число лекарственных средств, применяемых для лечения аксСпА, показатели эффективности находятся ниже целевых значений — число лиц, достигающих низкой активности заболевания или ремиссии при аксСпА, зачастую не превышает 20% даже на фоне ГИБТ, а порядка 18% пациентов с аксСпА относятся к категории «трудный для лечения пациент» [5, 6].
В этой связи существует необходимость оптимизации подходов к лечению аксСпА как за счет улучшения понимания места и особенностей применения уже рекомендованных к применению лекарственных препаратов, так и путем разработки новых медикаментозных и немедикаментозных методов лечения аксСпА. При этом лечение, основанное на понимании этиологии и коррекции основных путей патогенеза аксСпА, представляется наиболее перспективным.
Целью настоящей работы стал анализ современных представлений об этиологии и патогенезе аксСпА и патогенетически обоснованных путях улучшения их лечения.
В основу представленной работы положен поиск литературы в системах медицинского цитирования eLibrary, PubMed Medline за период с 01.01.1948 по 01.11.2023. В обзор включали только полнотекстовые статьи на русском или английском языках, соответствующие поисковому запросу и цели исследования. Поисковые слова, применявшиеся для поиска: «аксиальный спондилоартрит», «анкилозирующий спондилит», «болезнь Бехтерева», «аксиальный спондилоартрит», «генно-инженерный препарат», «биологическое лечение», «биологические агенты», «патогенез аксСпА», «лечение аксСпА», «медикаментозное лечение», «немедикаментозное лечение» и их английские аналоги.
Содержание статьи
Результаты поиска литературы
Результаты проведенной нами работы представлены в виде анализа существующих методов лечения аксСпА с перечислением их достоинств и недостатков и мнения авторов о путях оптимизации данных методик.
Немедикаментозные методы лечения аксСпА
Коррекция образа жизни. Отказ от курения, алкоголя, гиподинамии и нормализация массы тела являются перспективными, патогенетически обоснованными способами лечения аксСпА, относящимися к коррекции образа жизни [3, 4, 7].
Курение является независимым универсальным фактором, поддерживающим системное воспаление на всех его этапах (экссудативное воспаление, пролиферативное воспаление). Доказано, что у курящих пациентов чаще формируется аксСпА [8].
Курение приводит как к повышению активности аксСпА с уменьшением вероятности достижения низкой активности заболевания или ремиссии, в том числе на фоне ГИБТ, так и к структурному повреждению суставов и позвоночника за счет увеличения темпов роста синдесмофитов и их численности [8].
Курение является независимым фактором увеличения потребности пациента с аксСпА в НПВП и фактором потери ответа на ГИБТ. Польза от незначительного седативного эффекта курения полностью нивелируется его провоспалительным негативным воздействием на организм, а потому отказ от курения должен быть рекомендован всем пациентам с аксСпА [6].
Гиподинамия, или малоподвижный образ жизни, является фактором, способствующим созданию патологических двигательных паттернов, запускающих и поддерживающих биомеханический стресс в структурах опорно-двигательного аппарата, что способствует дебюту аксСпА [7, 9].
Гиподинамия способствует увеличению массы тела с развитием ее избытка, что также запускает и поддерживает воспаление за счет гиперпродукции адипоцитокинов и формирования оксидативного стресса с усилением перекисного окисления липидов. Показано, что гиподинамия является независимым фактором формирования потери эффекта ГИБТ [9].
Нормализация массы тела способствует уменьшению выраженности системного воспаления за счет нормализации уровня адипоцитокинов. Достижению нормальной массы тела способствуют адекватная по калорийности и составу диета, движение и, при наличии особых показаний (инсулинорезистентность, сахарный диабет, хроническая сердечная недостаточность), применение агонистов глюкагоноподобного пептида I типа (семаглутид, лираглутид и др.) и других лекарственных средств, влияющих на инкретины (комплексные препараты, находящиеся в настоящий момент в разработке).
Помимо прямого положительного влияния на активность и структурное прогрессирование аксСпА, отказ от курения, нормализация двигательной активности и массы тела при аксСпА являются мерами профилактики сердечно-сосудистой заболеваемости и смертности среди указанной категории лиц [7].
Лечебная гимнастика. Патогенетической предпосылкой к созданию рекомендаций по применению лечебной гимнастики как способа лечения аксСпА явилась биомеханическая теория формирования аксСпА и MHC-I-ассоциированных заболеваний в целом [10, 11]. Согласно биомеханической теории в воспалительный процесс при MHC-I-ассоциированных заболеваниях вовлекаются места биомеханической перегрузки (например, передний и задние углы позвонков, энтезисы, угол передней камеры глаза, кожа разгибательной поверхности локтевого сустава, подвздошная кишка и др.) с развитием иммуноопосредованного воспаления на границе бессосудистых и высоковаскуляризированных тканей указанных зон (связка — позвонок, сухожилие / капсула / связка — надкостница, связка хрусталика / роговица / склера — цилиарное тело, эпидермис — дерма и др.) [10, 11]. Указанный феномен известен как феномен Кебнера или «кебнеризация» (Kebnarisation), первоначально применявшийся исключительно к псориазу, но впоследствии распространившийся на все MHC-I-ассоциированные заболевания [11]. Потому представляется патогенетически обоснованной идея уменьшения воспаления и последующего структурного прогрессирования при аксСпА путем уменьшения биомеханической перегрузки зон интереса СпА [11].
Достоинствами немедикаментозных методов лечения аксСпА являются их общедоступность, высокая экономическая целесообразность, а также отсутствие риска лекарственного поражения внутренних органов [12]. Вместе с тем реализация на практике немедикаментозного лечения имеет ряд ограничений, существенно уменьшающих его ценность.
Недостатком лечебной гимнастики как метода лечения аксСпА является низкая приверженность пациентов указанному способу лечения, невозможность создания общих рекомендаций для всех пациентов, высокий риск увеличения активности и осложнений при неправильном выполнении упражнений [3, 4, 13, 14]. Пациенты разного возраста, с разной активностью болезни, с разными структурными изменениями осевого скелета и разными сопутствующими состояниями (остеопороз, дегенеративная болезнь межпозвонковых дисков, дисплазия тазобедренного сустава и др.) нуждаются в разных видах лечебных упражнений [13, 14]. В этой связи каждому пациенту с аксСпА необходим индивидуальный подбор упражнений врачом, что в условиях отсутствия стандартов лечения приводит к резкому увеличению роли человеческого фактора в лечебной гимнастике. Нивелировать этот фактор в настоящий момент не представляется возможным, поэтому было принято решение, согласно которому любая лечебная гимнастика лучше, чем ее отсутствие, а занятия с тренером и в группе превосходят по эффективности занятия на дому без контроля профессионала [4].
Помимо низкой приверженности лечению и отсутствия возможности стандартизации лечебной гимнастики существует еще один риск — быстрое увеличение нагрузки, неадекватно подобранная нагрузка, нарушение техники или нерегулярное выполнение упражнений могут привести к обратному эффекту лечебной гимнастики — увеличению спазма перегруженных мышц и перегрузке позвоночного столба с увеличением нарушений осанки, что приведет к усилению натяжения задействованных связок, сухожилий, капсул и усугубит эффект «кебнеризации», усилив биомеханическую составляющую активности аксСпА. В этих ситуациях наблюдается повышение активности аксСпА, ускорение прогрессирования структурных изменений осевого скелета [13, 14].
Еще одним фактором, ограничивающим пользу от лечебной гимнастики, является невозможность выполнения большинства рекомендаций пациентами с поздними стадиями болезни — так, пациенты с гиперкифозом и анкилозом позвоночника ограничены в выполнении большей части упражнений ввиду высокого риска перелома синдесмофитов и других осложнений.
Мануальная терапия. Остеопатия. Аналогичные ограничения (отсутствие достаточной доказательной базы, низкая стандартизация с увеличением роли человеческого фактора, невозможность регулярного применения, риск вторичной травматизации и перегрузки опорно-двигательного аппарата) существуют и у других методов немедикаментозного лечения: мануальной терапии, остеопатии. Единичные работы о пользе акупунктуры при аксСпА не позволяют включить метод в лечение аксСпА, хотя воздействие иглы на мышцы в теории может приводить к расслаблению мышцы и уменьшению перегрузки осевого скелета.
Физиотерапия. Низкий уровень доказательности ограничивает применение физиотерапии для лечения аксСпА [4]. С учетом сведений о противовоспалительной активности нам представляется перспективным применение лазеротерапии, электрофореза с гидрокортизоном или ультрафонофореза с гидрокортизоном для уменьшения локального воспаления в отдельных энтезисах или суставах. Но доказательная база указанных методов при аксСпА скудна, они нуждаются в изучении в исследованиях с участием большой популяции пациентов. Требует накопления достаточных доказательств и применение ударно-волновой терапии для лечения энтезитов при аксСпА — в настоящий момент небольшое число доказательств не позволяет рекомендовать этот метод для лечения аксСпА — теоретически он может и оказывать положительное воздействие за счет противовоспалительного потенциала, и стимулировать MHC-I-ассоциированное воспаление за счет микроповреждения ткани энтезиса в процессе процедуры, способствуя прогрессированию болезни [4].
Локальная лучевая терапия, лазеротерапия и ударно-волновая терапия до настоящего времени рассматриваются как перспективные методы лечения резистентных энтезитов (особенно пяточной области). Указанные методы не входят в рекомендации по лечению аксСпА, но описаны в некоторых работах как эффективные в долгосрочной перспективе в связи со способностью рентгеновских лучей, длинноволнового лазерного луча проникать как в сосудистые, так и в бессосудистые части энтезисов, оказывая не только противовоспалительное, но и антипролиферативное воздействие на указанную область. Клинически по данным исследований локальное действие рентгеновских лучей или лазера проявляется уменьшением локального воспаления, замедлением роста экзостозов («пяточных шпор») и уменьшением патологической минерализации подошвенного апоневроза. Следует отметить, что с учетом большей безопасности предпочтение отдается лазеротерапии, тогда как локальная лучевая терапия применяется в исключительных случаях [15].
Системная лучевая терапия в качестве способа достижения ремиссии при аксСпА запрещена к применению, несмотря на ее высокую эффективность, из-за значимого увеличения риска осложнений (в первую очередь — риска формирования злокачественных лимфом) [16].
Медикаментозные методы лечения аксСпА
Методы медикаментозного лечения аксСпА согласно российским и международным рекомендациям. Современные способы медикаментозного лечения аксСпА включают прием НПВП, сульфасалазина (при периферическом вовлечении), глюкокортикостероидов внутрисуставно и ГИБТ — блокаторов ФНО-α, ингибиторов ИЛ-17 и блокаторов янус-киназ [3, 4].
Применение антицитокиновых препаратов основано на следующем понимании патогенеза аксСпА: в доклинической стадии аксСпА у лица, имеющего предрасположенность к MHC-I-ассоциированному заболеванию, в зонах биомеханической перегрузки, преимущественно на границе высоковаскуляризированной и бессосудистой тканей увеличивается число активных Т-лимфоцитов (доказано увеличение числа γ/δ T-лимфоцитов с потенциалом к продукции ИЛ-17 в энтезисах, цилиарном теле, аортальном клапане экспериментальных животных) [17]. Имеющееся изменение состава Т-лимфоцитарного клона и фоновое повышение продукции ИЛ-17 в органах и тканях генетически предрасположенного организма на этой стадии не вызывают развитие воспаления и отражают лишь предрасположенность к заболеванию или доклинический аксСпА.
На следующей стадии заболевания воздействие толчкового фактора, способного усилить у предрасположенного к аксСпА лица Т-лимфоцитарный дисбаланс или активировать дополнительные (моноцитарно-макрофагальные) звенья иммунитета, может сместить баланс между противовоспалительными и провоспалительными звеньями в сторону провоспалительных реакций. Особое значение в этом случае имеет активация провоспалительной экспрессии гена HLA-B27 за счет блокады Clip-рецептора антителами к CD74, а также увеличенная экспрессия генов ИЛ-17 и ИЛ-23 и ускоренное пептидирование с увеличением антигенпрезентации дендритными клетками и макрофагами за счет активации генов ERAP1 и ERAP2 (рис. 1) [10, 11, 18, 19].
Признанными факторами активации указанных патологических процессов являются хроническая перегрузка, микротравматизация или выраженная травма, которые приводят к повышению локальной активности тканевых макрофагов, участвующих в местном повышении концентрации ФНО-α; инфекции, разрешение которых стимулирует Th17-лимфоциты и повышает выше пороговой концентрацию ИЛ-17 (хламидиоз, дизентерия, сальмонеллез) и хроническое нервно-психическое перенапряжение (см. рис. 1).
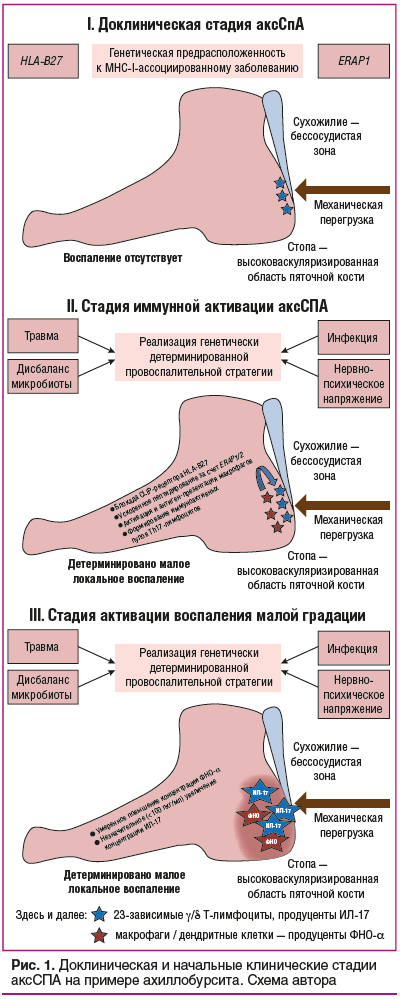
Совокупное воздействие указанных провоцирующих факторов на предрасположенное лицо приводит к усугублению исходного иммунного дисбаланса в «зоне интереса СпА», что способствует сочетанной локальной активации клеток моноцитарно-макрофагального звена, в большей степени ответственных за увеличение продукции ФНО-α и Т-лимфоцитарного звена с увеличением числа и активности Тh23-, 17- и 22- лимфоцитов, которые способствуют увеличению концентрации в ткани ИЛ-17, -22 и -23. Совокупное повышение тканевой концентрации ФНО-α, ИЛ-17, -22 и -23 приводит к увеличению концентрации простагландина E2 (PgE2) и развитию ассоциированного с циклооксигеназой 2-го типа (ЦОГ-2) воспаления (см. рис. 1) [18–21].
В понимании патогенеза аксСпА важным для практической медицины является тот факт, что особенности формирующихся у разных пациентов клеточных и цитокиновых ансамблей могут различаться. Указанные отличия определяют характер клинической картины болезни, эффективность последующего лечения, выбор лекарственного препарата и его дозы, риски формирования первичного отсутствия эффекта или вторичной потери эффекта лечения у конкретного пациента. С учетом того, что определение тканевых концентраций цитокинов в реальной клинической практике невозможно, рациональным представляется обратный подход — подбор оптимального лечения для конкретного пациента в соответствии с особенностями клинико-лабораторной картины аксСпА и предполагаемым патогенетическим вариантом болезни. Рассмотрим указанное положение применительно к отдельным группам препаратов для лечения аксСпА.
С учетом универсальности формирования ЦОГ-2-зависимой местной и системных воспалительных реакций как следствия активации PgE2 в результате последовательных иммуновоспалительных реакций в качестве патогенетической основы клинической картины СпА назначение НПВП является универсальным, патогенетически обоснованным способом лечения аксСпА. С учетом ЦОГ-2-зависимого характера воспаления при аксСпА патогенетически оправданным является выбор НПВП с высокой селективностью к ЦОГ-2 (коксибы) или лекарственных средств с преимущественной ЦОГ-2-селективностью. Следует отметить, что блокада ЦОГ-2 не только положительно сказывается на разрешении активного экссудативного воспаления, но и замедляет структурное прогрессирование аксСпА за счет уменьшения темпов формирования синдесмофитов, экзостозов и соединительной ткани, что важно для лечения аксиальных проявлений, артритов, энтезитов и увеитов. Именно способность НПВП положительно влиять как на активность болезни, так и на последующее структурное прогрессирование послужило поводом считать НПВП базисными или болезнь-модифицирующими препаратами при аксСпА [3, 4, 22].
Предметом активной дискуссии является продолжительность приема НПВП. Сторонники применения НПВП как симптоматических средств считают целесообразным их применение до разрешения клинических и лабораторных (уровень С-реактивного белка (СРБ)) признаков воспаления. Существует альтернативное мнение — о целесообразности назначения НПВП на более длительный срок, до исчезновения воспалительных изменений в осевом скелете по данным магнитно-резонансной томографии (МРТ). Наконец, существуют приверженцы концепции длительного назначения НПВП как базисного средства — до полного торможения структурного прогрессирования. Хотя эта концепция наиболее оправдана с точки зрения понимания патогенеза аксСпА, следование ей в реальной клинической практике ограничено увеличением вероятности развития нежелательных явлений при длительном (годами) применении НПВП, а также сомнением в том, что длительная блокада ЦОГ-2-зависимого воспаления приведет к подавлению экспрессии провоспалительных генов, уменьшит иммунную активацию клеток моноцитарно-макрофагального ряда и Т-лимфоцитарного звена, а также восстановит физиологические концентрации и соотношение ФНО-α и ИЛ в тканях [3, 4, 22].
Несмотря на отсутствие четкого понимания принадлежности НПВП к симптоматическим или базисным средствам для лечения аксСпА, современные рекомендации относят НПВП к препаратам первой линии в лечении аксСпА. Прием НПВП при аксСпА обязателен до разрешения клинико-лабораторных проявлений СпА, необходимость продолжения лечения после нормализации клинической лабораторной картины определяется врачом в соответствии с конкретной клинической ситуацией. Единственным фактором, лимитирующим назначение НПВП у пациентов с аксСпА, может быть наличие противопоказаний к препаратам у конкретного пациента. Следует отметить, что именно это положение регламентирует невозможность применения НПВП при аксСпА, ассоциированном с ВЗК (болезнь Крона или язвенный колит) [23].
Другие противовоспалительные средства — глюкокортикостероиды (ГКС) применяются при аксСпА только в виде внутрисуставных или периартикулярных инъекций в случае наличия небольшого числа (3 и менее) зон локальной воспалительной активности, резистентной к системным и местным формам НПВП. Локальное применение ГКС оправдано при наличии противопоказаний к НПВП. Системное применение ГКС при аксСпА в низких дозах малоэффективно, а применение высоких доз лимитировано неоправданно высоким риском осложнений и возможно только в особых ситуациях (увеит, ВЗК при невозможности немедленного начала ГИБТ) [3, 4, 22].
Сульфасалазин является препаратом, применяемым только при аксСпА с периферическим вовлечением. Патогенетически его применение определяется способностью препарата влиять на нормализацию микробиоты кишечника, роль которой в развитии аксСпА активно обсуждается. Вместе с тем применение сульфасалазина ограничено его неспособностью влиять на воспаление осевого скелета, а также относительно невысокой клинической эффективностью [3, 4].
Генно-инженерные биологические и таргетные препараты относятся к средствам, применение которых требует от врача глубокого понимания клинико-патогенетических взаимосвязей при аксСпА. Возвращаясь к клинико-патогенетическим взаимосвязям, следует отметить, что для правильного подбора ГИБТ клиницисту важно определить, пациент с каким типом воспаления находится перед ним. Для пациентов с воспалением высокой градации характерна яркая клиническая картина с болевым синдромом высокой интенсивности в спине и суставах, выраженным локальным экссудативным воспалением при вовлечении суставов (синовит, припухлость сустава), длительной и выраженной утренней скованностью, признаками астенизации, потерей массы тела вплоть до мышечной атрофии. У пациента с таким воспалением может повышаться температура тела (см. рис. 1). Важнейшим лабораторным маркером воспаления высокой градации является повышение уровня СРБ в 2 раза и более (относительно верхней границы референтного интервала), может регистрироваться анемия хронического воспаления, а при длительном течении заболевания — системный остеопороз. Патогенетической основой воспаления высокой градации является мощная активация моноцитарно-макрофагального звена иммунитета с выраженным повышением концентрации ФНО-α как в тканях, так и в сыворотке крови, с одновременной активацией Т-лимфоцитарного звена с повышением уровня ИЛ-17 и ИЛ-21/22 в сыворотке крови (см. рис. 1) [24, 25]. Именно высокий уровень ФНО-α определяет выраженность общей системной и острофазовой реакции у пациентов с аксСпА [24, 25].
С учетом патогенетической точки зрения блокада ФНО-α (препараты инфликсимаб, адалимумаб, голимумаб, цертолизумаба пэгол и этанерцепт) представляется наиболее оправданной при воспалении высокой градации [4]. Ее достоинством является способность быстро уменьшать признаки системного воспаления, что приводит к быстрой нормализации самочувствия пациента: болевой синдром, скованность, общая слабость и другие симптомы отступают, нормализуется уровень СРБ, восстанавливается уровень гемоглобина. Моноклональные антитела к ФНО-α (адалимумаб, голимумаб, инфликсимаб, цертолизумаба пэгол) хорошо справляются с воспалением при внескелетных проявлениях аксСпА (псориаз, ВЗК, увеиты) [3, 4, 23, 26].
Вместе с тем блокада ФНО-α при аксСпА имеет ряд ограничений, среди которых следует отметить уменьшение противотуберкулезного иммунитета, связанное с тем, что ограничение туберкулезного процесса при заражении микобактериями туберкулеза происходит в первую очередь посредством образования гранулемы, формирование которой запускается тканевыми (альвеолярными) макрофагами при контакте с инфекционным агентом посредством увеличения продукции растворимой и мембранных фракций ФНО-α [4, 26]. Таким образом, уменьшение концентрации ФНО-α уменьшает вероятность формирования гранулемы и увеличивает риски диссеминации микобактерии [26].
Еще одним патогенетически определяемым ограничением блокады ФНО-α является ее неспособность быстро уменьшать активность Т-лимфоцитарной системы, в связи с чем на фоне уменьшения концентрации ФНО-α и общей воспалительной реакции при аксСпА длительно остается повышенным уровень ИЛ-17 и ИЛ-22 [27, 28]. Важно, что концентрация ИЛ-23 и PgE2 на фоне блокады ФНО-α уменьшается [28]. Клинических последствий не однонаправленной динамики провоспалительных цитокинов несколько:
1. В случае сохранения локальной Т-клеточной активности при блокаде ФНО-α может сохраняться незначительная локальная активность макрофагов, в связи с чем на фоне клинического и лабораторного улучшения длительно сохраняются воспалительные изменения по данным МРТ. В исследовании ESTHER показано, что при применении этанерцепта к 48-й неделе лечения лишь у 15,4% пациентов полностью разрешаются воспалительные очаги в осевом скелете, притом что клинико-лабораторной ремиссии (ASDAS-ремиссия) достигает каждый второй пациент (рис. 2) [29].
2. Если при длительной блокаде ФНО-α достигнута локальная и системная нормализация уровня ФНО-α при сохранении высокого уровня ИЛ-17 и ИЛ-22 (в первую очередь в поврежденных тканях за счет активности Т-лимфоцитов), происходит избыточная активация репаративных процессов (см. рис. 2). Избыточность репарации и минерализации при аксСпА определяется сочетанием генетически предопределенной активности указанных Т-лимфоцитов в зонах биомеханической перегрузки с физиологическим свойством ИЛ-17 увеличиваться в концентрации в зонах повреждения [30, 31]. Избыточная продукция ИЛ-17 в зоне повреждения вне повышения концентрации ФНО-α определяет поствоспалительную репарацию, клинически проявляющуюся синтезом синдесмофитов, экзостозов, формированием поствоспалительных сгибательных контрактур суставов, а при внескелетном вовлечении — формированием стриктур кишечника при болезни Крона, образованием избыточной рубцовой ткани в области угла глаза с формированием глаукомы, формированием синехий и шварт, сращения зрачка, тракционной отслойки сетчатки и других осложнений.
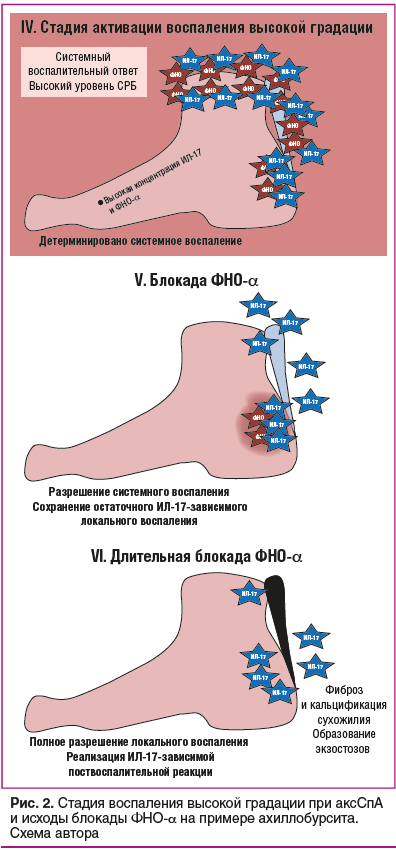
3. Избыточная концентрация ИЛ-17 при снижении воспалительной активности на фоне блокады ФНО-α приводит к разрушению кости в неповрежденных областях скелета, определяя формирование переломов в первые годы от начала применения ингибиторов ФНО-α [32].
4. Сохранение активности Тh17- и Тh22-лимфоцитов может привести к повторной активации Тh23-лимфоцитов, что, в свою очередь, приводит к повышению активности макрофагов и повторной гиперпродукции ФНО-α на фоне применения их блокаторов. В этом случае клинически наблюдается потеря ответа на лечение ингибиторами ФНО-α, не связанная с образованием нейтрализующих антител. Подобный сценарий развития событий, по данным Т.Ю. Нуриахметовой и соавт. [33], реже всего наблюдается при аксСпА и часто встречается при болезнях с большей продукцией ИЛ-23 (псориаз и ВЗК).
5. Увеличение синтеза соединительной ткани на фоне блокады ФНО-α может быть патогенетической основой увеличения объема экстрацеллюлярного матрикса у пациентов с ишемическими заболеваниями миокарда и хронической сердечной недостаточностью (ХСН), а также являться основой нарушения проводимости у пациентов с аксСпА и аортитом. Указанные особенности ограничивают применение блокаторов ФНО-α при ХСН [4].
Следует отметить, что длительная блокада ФНО-α может привести к нормализации работы как макрофагального, так и Т-клеточного звена иммунитета (см. рис. 2). И в этом случае возможно уменьшение иммуносупрессивного воздействия за счет увеличения интервалов между введением препарата [4].
При наличии у пациента c аксСпА профиля «воспаления малой градации», когда при наличии локальных признаков спондилоартрита (моноартрит, энтезит, сакроилиит, увеит, псориаз, ВЗК) отсутствуют признаки выраженной системной воспалительной активности (нет выраженной общей слабости, скованности, снижения массы тела, отсутствует анемия хронического воспаления, уровень СРБ увеличен незначительно), у пациентов нет выраженной активации моноцитарно-макрофагального звена иммунитета и применение ингибиторов ФНО-α не представляется перспективным [34, 35].
Из рекомендованных средств для лечения аксСпА с профилем «воспаление малой градации» наиболее часто применяются блокаторы ИЛ-17А (секукинумаб, иксекизумаб и нетакимаб), действие которых, в отличие от ингибиторов ФНО-α, в первую очередь реализуется на локальном уровне, способствуя быстрому разрешению локального воспаления, что, в свою очередь, приводит к подавлению активности макрофагального звена, а с ним и системного воспаления. Блокада ИЛ-17А при аксСпА представляется более перспективной, чем блокада ФНО-α, так как уменьшение активности системного воспаления при блокаде ИЛ-17А возможно только при условии подавления локального тканевого воспаления. Более того, нормализация уровня ИЛ-17 не только обеспечивает уменьшение экссудативной фазы воспаления, но и ассоциируется с уменьшением выраженности поствоспалительной репарации (рис. 3) [31].
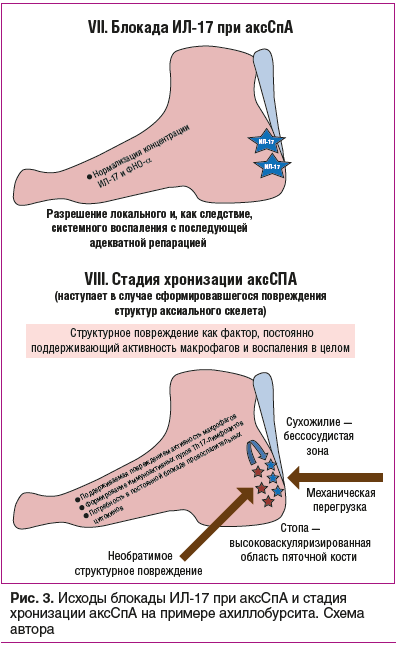
Ограничением к применению ингибиторов ИЛ-17А при аксСпА является наличие таких внескелетных проявлений, как увеит и ВЗК, при которых невозможно путем системной доставки препарата достигнуть достаточной его концентрации в зоне воспаления (стенка кишечника / глаз), что определяет недостаточный эффект или компенсаторную активацию процесса на фоне снижения уровня ИЛ-17А в находящихся рядом с воспалительным участком здоровых тканях [3, 4, 26].
Потеря эффекта от лечения ИЛ-17А, по всей вероятности, также реализуется за счет компенсаторной реактивации макрофагального звена иммунитета с выбросом ФНО-α и повторной активацией Т-клеточного звена иммунитета.
Патогенетическое место приложения действия ингибиторов янус-киназ (тофацитиниб, упадацитиниб) неясно, так как действие основных провоспалительных цитокинов при аксСпА (ФНО-α, ИЛ-17, -22, -23) не реализуется через сигнальные пути янус-киназ. Вместе с тем не исключено, что блокаторы янус-киназ оказывают воздействие на γ-интерферон, ИЛ-6, -27, -36 и другие молекулы, понижение концентрации которых уменьшает концентрацию задействованных в патогенезе аксСпА цитокинов. Применение ингибиторов янус-киназ представляется перспективным у пациентов с высокими лекарственными рисками (с учетом малого периода полувыведения), у пациентов с сочетанием аксСпА с ревматоидным артритом, атопическим дерматитом, с алопецией и с иммунологическим синдромом, ограничивающим применение ингибиторов ФНО-α [22, 26].
Перспективные методы лечения аксСпА, находящиеся в разработке
Применение бисинтетических молекул, способных одновременно уменьшить активность ФНО-α и ИЛ-17, не показало преимуществ в эффективности перед монотерапией каждой из молекул в отдельности, схемы к лечению не рекомендованы [26].
Сочетанная блокада ИЛ-17А и ИЛ-17F (бимекизумаб). Перспективной стратегией лечения аксСпА представляется блокада не только ИЛ-17А, но и ИЛ-17F — препараты, блокирующие одновременно ИЛ-17А и ИЛ-17F, успешно завершили клинические испытания и в ближайшее время могут быть допущены к применению в практике. Дополнительная блокада ИЛ-17F может усилить системную эффективность ингибиторов ИЛ-17А [36].
Блокада ИЛ-23 для псориатического варианта аксСпА и аксСпА при ВЗК: перспективными представляются блокаторы ИЛ-23 (гуселькумаб и ризанкизумаб), так как в патогенезе псориатического артрита и ВЗК наиболее активно представлена гиперпродукция ИЛ-23. Данные post-hoc анализа исследований DISCOVERY I и II показали способность гуселькумаба уменьшать активность аксиальных проявлений аксСпА.
Блокада ИЛ-36 может быть перспективной для псориаза и псориатического артрита, но способность ее уменьшать аксиальные проявления болезни нуждается в отдельном изучении, для аксСпА без псориаза применение ингибиторов ИЛ-36 с точки зрения патогенеза не представляется перспективным.
Бисфосфонаты (золендроновая кислота). Единичные сообщения демонстрируют эффективность золендроновой кислоты при аксСпА, патогенетической основой действия которой авторы исследований считают возможность коррекции воспаления в костной ткани за счет снижения активности T-лимфоцитов при подавлении активности остеокластов и остеорезорбции. Вместе с тем в условиях отсутствия клинических испытаний представляется неясным, в каких дозах и режимах бисфосфонаты демонстрируют противовоспалительный эффект и насколько эффективна подобная стратегия в долгосрочной перспективе [37, 38].
Блокада тирозинкиназ 2-го типа (деукравацитиниб), в том числе в сочетании с блокадой янус-киназ 1-го типа (брепоцитиниб) представляется перспективной для лечения псориатического аксСпА. Вместе с тем для окончательных выводов о возможности применения указанных терапевтических опций при лечении аксСпА при псориазе следует получить убедительные доказательства [39].
Пересадка мезенхимальных стромальных клеток (МСК). Наш собственный и мировой опыт применения МСК при аксСпА не показал преимуществ указанного лечения перед традиционными способами лечения при одновременном неоправданно высоком риске осложнений. Надежды на пересадку МСК как способ достижения безлекарственной ремиссии при аксСпА не оправдались. Не исключено, что стандартизация метода откроет новые перспективы указанного направления лечения [40, 41].
Блокада TRBV-лимфоцитов как новая возможность базисного лечения аксСпА. Все обсуждавшиеся выше опции противовоспалительной и генно-инженерной терапии не являлись базисной терапией в глубоком смысле, так как все указанные препараты блокируют продукты нарушенных иммунопатогенетических путей, но не влияют напрямую на базисные составляющие патогенеза. Это определяет потребность в постоянном ингибировании продуктов активированных провоспалительных путей патогенеза, что сопряжено с угнетением физиологических составляющих иммунного ответа. Кроме того, при таком подходе лечение должно проводиться постоянно. В этой связи наиболее перспективными направлениями лечения аксСпА следует считать таргетную блокаду активных иммунных клеточных клонов для предотвращения избыточного синтеза провоспалительных цитокинов при сохранении физиологической концентрации важнейших из них. Относительно недавно у носителей HLA-B27 антигена обнаружен особый клон цитотоксических CD8+ Т-лимфоцитов, в антиген-распознающем рецепторе которых имеется схожий сегмент — TRBV9 [42, 43]. TRBV9+ Т-клетки встречаются как в периферической крови, так и в тканях больных с аксСпА, при этом преобладающее количество этих цитотоксических CD8+ Т-лимфоцитов присутствует в локусах иммунного воспаления и синовиальной жидкости воспаленных суставов [44, 45].
Пул аутореактивных TRBV9+ Т-лимфоцитов может играть инициирующую роль в большом иммуновоспалительном каскаде и представляет интерес в качестве мишени для патогенетической терапии. Терапевтические стратегии, основанные на исследованиях репертуара эффекторных клеток, являются перспективными с точки зрения раннего вмешательства в патологический процесс с возможностью достижения длительной ремиссии заболевания [45].
С учетом небольшой представленности аутореактивных TRBV9+ Т-клеток в общем пуле лимфоцитов (около 4%) [44] можно предположить, что терапия с точечным влиянием на них будет обладать благоприятным профилем безопасности. Российскими учеными проведена инновационная разработка моноклональных антител к сегменту TRBV9 клеточного рецептора Т-лимфоцитов [45]. В настоящий момент высокогуманизированное моноклональное антитело BCD-180 (МНН сенипрутуг) против сегмента TRBV9 проходит необходимые этапы клинической разработки и демонстрирует эффективную деплецию таргетной популяции аутореактивных Т-лимфоцитов [45].
Ожидается, что моноклональное антитело против сегмента TRBV9 аутореактивных Т-лимфоцитов будет работать не только как индуктор ремиссии, но и как базисное средство, при редком регулярном введении препятствующее активации иммуновоспалительного ответа у носителей HLA-B27, что позволит пациентам в долгосрочной перспективе достигать нормализации работы Т-лимфоцитарного звена иммунитета, предотвращать гиперпродукцию интерлейкинов при отсутствии влияния лекарства на физиологические звенья иммунитета.
Вопрос, будет ли необходимо у пациентов с высокой градацией воспаления отдельно индуцировать ремиссию путем применения антицитокиновых ГИБТ (блокатора ФНО-α или ИЛ-17) перед инициацией лечения моноклональными антителами к сегменту TRBV9, нуждается в дальнейшем уточнении.
Последовательное применение ГИБТ с разным механизмом действия. С учетом особенностей иммунопатогенеза аксСпА постоянно обсуждается возможность последовательного применения ГИБП с разным механизмом действия для достижения максимального эффекта лечения. Действительно, перспективным может быть последовательное применение блокаторов ФНО-α при наличии воспаления высокой градации с последующим переходом на блокаду ИЛ-17 после уменьшения выраженности системного воспаления. Не исключено последовательное применение блокаторов ФНО-α и моноклональных антител к сегменту TRBV9 рецептора Т-лимфоцитов. Вместе с тем для реализации перспективных патогенетических стратегий необходимо тщательное изучение соотношения польза/риск для пациента с выполнением клинических испытаний согласно российским и международным нормам.
Нормализация микробиоты кишечника. Применение аутопробиотиков как способа поддержания ремиссии при аксСпА за счет нормализации эпигенетических механизмов реализации провоспалительных путей патогенеза в теории может быть перспективным. В настоящий момент, несмотря на мощное теоретическое обоснование целесообразности подобного лечения, создание препаратов, способных индуцировать или поддерживать ремиссию посредством нормализации микробиоты кишечника, потерпело неудачу. Не увенчались успехом и попытки пересадки микробиоты при аксСпА [46].
Обсуждение результатов анализа данных литературы
Выполненный нами анализ в очередной раз подтвердил выраженную клиническую гетерогенность аксСпА, основанную на реализации многих вариантов патогенетических путей, определяемых как наследственной предрасположенностью пациента, так и условиями ее реализации во внешней среде. Указанное разнообразие аксСпА является основой формирования «трудного пациента» и определяет потребность в разработке новых подходов к лечению аксСпА. Множество клинических перекрестов между заболеваниями группы MHC-I-ассоциированных болезней значительно затрудняет поиск лечебных стратегий и требует максимальной точности от врача, подбирающего пациенту лечение.
При анализе последовательности разработки вариантов лечения аксСпА, основанного на понимании патогенеза, обращает на себя внимание тенденция к развитию научной мысли от попыток коррекции наиболее общих механизмов, задействованных в лечении аксСпА (немедикаментозное лечение и НПВП), к более глубоким, а следовательно, узконаправленным цитокиновым технологиям (от универсальной блокады ФНО-α к узконаправленному подавлению гиперпродукции отдельных ИЛ), и к еще более универсальной ингибиции сигнальных (блокада янус-киназ) и точечной блокаде клеточных (TRBV9+ Т-лимфоцитов) путей патогенеза аксСпА [4, 22, 26, 45, 46].
Ожидается, что таргетное воздействие на отдельные звенья иммуноопосредованного воспаления должно увеличивать эффективность, а главное, безопасность лекарственного воздействия в долгосрочной перспективе.
Следует отметить, что чем более узконаправленной становится коррекция нарушений иммунного ответа, тем большей аккуратности требует подбор потенциального пациента-ответчика. Если немедикаментозная коррекция и блокада ЦОГ-2 применимы ко всем пациентам с аксСпА, не имеющим противопоказаний к лечению, то ингибиторы ФНО-α уже демонстрируют свою эффективность преимущественно у лиц с воспалением высокой градации, а ингибиторы отдельных ИЛ при общей универсальности в отношении местного и системного воспалительного процесса оказываются неэффективными у отдельных клинических категорий пациентов с аксСпА (ингибиторы ИЛ-17А менее эффективны при увеитах и ВЗК, блокаторы ИЛ-23 — при непсориатических вариантах аксиального поражения).
Следует признать, что разработка универсальной базисной терапии аксСпА вызывает определенные трудности. Оказалась несостоятельной идея тотальной перезагрузки иммунитета при аксСпА посредством пересадки МСК. Не удалось добиться и значительного прогресса при коррекции эпигенетических механизмов развития аксСпА за счет аллогенной трансплантации компонентов собственной кишечной микробиоты. Вместе с тем не исключено, что дальнейшее совершенствование клеточных технологий и стандартизация подходов к их применению приведут к ренессансу этих идей.
В этой связи наиболее перспективным разрабатываемым способом базисного лечения аксСпА в настоящий момент представляется блокада ключевых Т-клеточных звеньев иммунопатогенеза спондилоартритов. Разработанная российскими учеными технология блокады аутореактивных TRBV9+ Т-лимфоцитов потенциально может быть эффективна у пациентов с наличием носительства HLA-B27-антигена [43–45]. Указанная Т-клеточная блокада потенциально может быть эффективным болезнь-модифицирующим воздействием, идейно направленным не столько на индукцию, сколько на предотвращение патологической цитокиновой активации за счет направленной точечной деплеции основных аутоиммунных клонов Т-лимфоцитов. Невмешательство лечения в физиологические части иммунного ответа определяет возможность здорового функционирования иммунной системы пациента с аксСпА на фоне лечения. Применение подобных базисных технологий выглядит особенно перспективно для индукции и поддержания ремиссии у пациентов с недавно развившимся ранним СпА, в том числе при воспалении малой градации.
Не исключено, что элиминация TRBV9+ Т-лимфоцитов у пациентов с воспалением высокой градации может потребовать отдельной индукции ремиссии блокаторами ФНО-α или ИЛ-17. Это особенно интересно в свете того, что предпринимавшиеся ранее попытки по разработке молекул с направленностью на блокаду нескольких цитокинов сразу пока не увенчались успехом.
Следует отметить, что в настоящий момент у «трудных к лечению пациентов» с аксСпА не исчерпаны возможности сочетанной блокады нескольких цитокинов (в настоящий момент эта опция ограничена риском побочных эффектов), а также возможности последовательной запланированной смены блокаторов цитокинов с разным механизмом действия. Будущие клинические исследования необходимы для разработки оптимальных схем сочетанной ГИБТ или таргетной терапии при аксСпА.
Таким образом, в настоящий момент следует отметить не только наличие трудностей с лечением аксСпА, но и наличие обнадеживающих перспективных направлений по их коррекции. Стремительное развитие фундаментальной науки и генно-инженерных технологий повышает требования к врачу в отношении глубокого понимания клинико-патогенетических взаимосвязей при аксСпА. От правильности понимания врачом особенностей клинического течения заболевания у каждого конкретного пациента зависит точность в выборе лечения и его последующая эффективность и безопасность.
Заключение
В настоящий момент концепция лечения аксСпА «до достижения цели» не может считаться реализованной в полной мере, что определяет потребность в разработке новых способов лечения аксСпА.
Изучение этиологии и патогенеза аксСпА является наиболее перспективным путем создания новых подходов к лечению.
Разрабатываемые в настоящий момент лечебные подходы позволяют надеяться на значительное улучшение перспектив пациентов с аксСпА в ближайшей перспективе.
Информация с rmj.ru






