Ключевые слова: сахарный диабет 2-го типа, инкретины, гипогликемия.
Для цитирования: Демидова Т.Ю., Куленок С.Г., Гасанзаде П.А. Патогенетические предпосылки применения ингибиторов дипептидилпептидазы-4 в управлении сахарным диабетом 2-го типа // РМЖ. 2017. №25. С. 1860-1862
Demidova T.Yu., Kulenok S.G., Gasanzadeh P.A.
Russian Medical Academy of Continuing Professional Education, Moscow
Over the past decade, incretin-based therapy has become one of the priority areas of drug therapy for patients with type 2 diabetes mellitus (DM). The importance and necessity of realization of incretin effects in maintaining glucose homeostasis is well studied and proven, which makes the incretin-based therapy the most promising one in the modern management algorithms for type 2 diabetes (drugs do not cause hypoglycemic reactions, provide a predictable, glucose-dependent hypoglycemic effect, have a wide range of positive non-glycemic effects). Despite the high effectiveness of the incretin drugs in the majority of patients, the hypothesis of their ability to restore the impaired incretin effects is widespread but not fully justified. In type 2 diabetes, the endocrine part of the pancreas retains sensitivity to GLP-1, but becomes resistant to the influence of the GIP, which apparently is the main reason for the decrease or absence of incretin effects. The incretin-directed therapy stimulates the GLP-1 receptors and thus increases insulin secretion in response to oral and intravenous glucose stimulation, thereby eliminating the potential differences between these stimuli, but not restoring the incretin defects in the patients.
Key words: diabetes mellitus type 2, incretins, hypoglycemia.
For citation: Demidova T.Yu., Kulenok S.G., Gasanzadeh P.A. Pathogenetic reasons of using dipeptidyl-peptidase 4 inhibitors in the management of type 2 diabetes mellitus // RMJ. 2017. № 25. P. 1860–1862.
В статье рассмотрены патогенетические предпосылки применения ингибиторов дипептидилпептидазы-4 в управлении сахарным диабетом 2-го типа. Показаны эффекты инкретинов в поддержании гомеостаза глюкозы, препараты не вызывают гипогликемических реакций, обеспечивают предсказуемый, глюкозозависимый сахароснижающий эффект и обладают широким спектром положительных негликемических эффектов.
Сахарный диабет (СД) 2-го типа характеризуется снижением на 50% массы β-клеток, с несколько меньшим снижением на стадии предиабета (нарушения толерантности к глюкозе). Ранее была разработана гипотеза, согласно которой само по себе изолированное уменьшение β-клеточной массы может объяснять снижение инкретиновых эффектов. При нормально функционирующей массе β-клеток более мощный стимул — пероральное поступление углеводов вероятнее всего вызывает больший секреторный инсулиновый ответ по сравнению с менее мощной стимуляцией внутривенно вводимой глюкозой. Однако в случае критического снижения β-клеточной массы, как при СД, такой закономерности не наблюдается, т.к. уменьшение общей инсулинсекреторной способности неизбежно нивелирует различия между более и менее мощным стимулирующим эффектом глюкозы. Результаты некоторых исследований [1] подтверждают гипотезу, что уменьшение массы β-клеток вносит большой вклад в снижение инкретинового эффекта при СД 2-го типа, особенно принимая во внимание значительное увеличение корреляционной связи с уровнем HbA1c, глюкозы плазмы через 120 мин после еды и индексом массы тела. Таким образом, β-клеточная дисфункция является не только предпосылкой к развитию СД 2-го типа, но также определяет неизбежно прогрессирующее течение болезни [2]. С другой стороны, это открытие указывает на возможность улучшения инкретинового эффекта на фоне улучшения функционального состояния β-клеток, например в результате устранения глюкозотоксичности.
Так как СД 2-го типа связан с уменьшением или отсутствием инкретинового эффекта и эта связь, по-видимому, зависит от степени гипергликемии, закономерно встает вопрос: а можно ли при нормализации гликемии частично или полностью устранить эти дефекты? Неспособность эндокринной части поджелудочной железы реагировать на глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид-1 (ГПП-1) при СД 2-го типа вызывается гипергликемией и поэтому может быть обратимой. Достижение почти нормогликемии с помощью интенсифицированных режимов инсулинотерапии улучшало чувствительность β-клеток к экзогенным ГИП и ГПП-1, хотя в итоге секреторный ответ инсулина был намного ниже, чем у людей с нормальной толерантностью к глюкозе [1]. Это заключение указывает на улучшение состояния пациентов, вероятно, в результате восстановленной экспрессии рецепторов к ГИП и ГПП-1, которые могут быть снижены при СД 2-го типа. Возможно, из-за необратимого уменьшения массы β-клеток более существенного улучшения эффектов может не быть. Лечение метформином продемонстрировало некоторые преимущества в контроле гликемии, но не приводило к количественному изменению эффекта инкретина, хотя этот препарат стимулирует секрецию ГПП-1 [3].
Известно, что инкретиновые гормоны, находясь в кровеносном русле, очень быстро разрушаются ферментом дипептидилпептидазой-4 (ДПП-4). Ингибирование ДПП-4 сохраняет эффекты эндогенных инкретиновых гормонов в их интактных формах, так что эти гормоны способны более длительно взаимодействовать со своими рецепторами. Препараты этой группы повышают уровни ГИП и ГПП-1 как натощак, так и постпрандиально. В исследованиях показано, что ингибиторы ДПП-4 значительно восстанавливают массу β-клеток и морфологию островков поджелудочной железы, тем самым сохраняя функцию секреции инсулина [4], особенно на ранних стадиях СД. Также известно, что ингибиторы ДПП-4 не изменяют инкретинового эффекта у пациентов с СД 2-го типа и у людей с нормальной толерантностью к глюкозе.
Лечение
В национальных российских «Алгоритмах специализированной медицинской помощи больным сахарным диабетом» под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова начиная с первого выпуска и до его последней версии 2017 г. [5] рекомендовано, наравне с метформином, начиная с дебюта заболевания назначать ингибиторы ДПП-4 в приоритетной монотерапии, равно как и в сочетании с метформином. Последующая интенсификация терапии предусматривает активное использование препаратов этого класса для улучшения гликемического контроля, продолжительного поддержания достигнутого результата при высокой безопасности и простоте назначения. Общеизвестно, что ингибиторы ДПП-4 обеспечивают пациентам с СД 2-го типа предсказуемый глюкозозависимый сахароснижающий эффект, не вызывают гипогликемических реакций, нейтральны по отношению к массе тела и в комбинации с метформином могут уменьшать вес в среднем на 2–3 кг, а также обладают широким спектром положительных негликемических эффектов. Накопленный научный и клинический опыт показывает, что ингибиторы ДПП-4 можно с успехом использовать в управлении СД 2–го типа на разных стадиях, в сочетании с любыми противодиабетическими препаратами (кроме агонистов ГПП-1), при любой сочетанной терапии, при любых коморбидных состояниях, включая ишемическую болезнь сердца, тяжелые стадии хронической болезни почек, хроническую почечную недостаточность и др. Более того, их применение в значительной степени улучшило возможности эффективной и безопасной терапии пациентов старшего возраста, включая лиц старше 75 лет, а также пациентов с патологией почек без рисков гипогликемий. Чрезвычайно важно, что терапия ингибиторами ДПП-4 обеспечивает высокое качество жизни и комфорт, повышает приверженность рекомендациям врача. Складывается впечатление, что ингибиторы ДПП-4 становятся наиболее эффективным и безопасным средством раннего лечения подавляющей части пациентов с СД 2-го типа. Они позволяют достигать не только метаболических целей терапии, но и корректировать множество патогенетических дефектов, признанных этиологическими факторами развития и последующей прогрессии заболевания. Этот класс пероральных сахароснижающих препаратов во всем мире уверенно занимает свое место в схемах лечения СД 2-го типа, постепенно заменяя препараты сульфонилмочевины.
Последние исследования показывают, что комбинированная терапия более эффективна для улучшения гликемического контроля, чем применение каждого лекарства в отдельности, и раннее назначение такой терапии во многом улучшает прогноз. Целесообразно применять препараты, обладающие синергизмом, которые при совместном назначении действуют на несколько патофизиологических механизмов. Есть данные, которые убедительно говорят
в пользу как можно более раннего начала такой терапии, потому что, помимо устранения патофизиологических дефектов, ранняя комбинированная терапия может привести к устойчивому снижению уровня гликированного гемоглобина (НВА1с), а соответственно минимизировать глюкозотоксичность, улучшить функцию β-клеток, что позволит отсрочить многокомпонентную терапию со сложными схемами и использовать низкие дозы сахароснижающих препаратов для уменьшения побочных эффектов. Было показано, что на ранних стадиях развития СД 2-го типа прогрессированию заболевания в основном способствует постпрандиальная гликемия. Ингибиторы ДПП-4 показывают хороший гликемический контроль, уменьшают гликемию после приема пищи и, по-видимому, сохраняют функции β-клеток по меньшей мере в течение первых двух лет лечения. В связи с этим можно сделать вывод, что ранняя комбинированная терапия, включающая ингибитор ДПП-4 в дополнение к комплементарному лекарственному средству (например, метформину), помогает приостановить или замедлить прогрессию СД 2-го типа [2]. Более того, ингибиторы ДПП-4 и метформин обладают примечательными дополнительными механизмами действия. Метформин, снижая продукцию глюкозы в печени, может усиливать действие ГПП-1, увеличивая экспрессию гена ГПП–1 в L-клетках кишечника, а также усиливая эффекты ГПП–1 на β-клетки [6]. Кроме того, оба препарата несут низкий риск гипогликемии и не вызывают увеличения массы тела, а назначаемые в сочетании могут ее снижать.
Из новых препаратов класса ингибиторов ДПП-4 можно выделить алоглиптин. Он является высокоселективным ингибитором ДПП-4. Для него характерна в 10 000 раз большая селективность по отношению к ДПП-4, чем к ДПП-8 или ДПП-9. Кроме того, ингибирование фермента ДПП-4 сохраняется до 168 часов после приема препарата, что позволяет принимать его 1 раз в сутки. Эффективность алоглиптина изучалась во многих исследованиях, которые показали, что улучшение показателей гликемического контроля у пациентов с СД 2-го типа отмечается как на фоне приема препарата в виде монотерапии, так и в комбинации с другими сахароснижающими средствами: метформином, производными сульфонилмочевины, пиоглитазоном, инсулином. Согласно исследованиям, происходит снижение гликированного гемоглобина по сравнению с исходным уровнем на 0,5–0,9% [7–12].
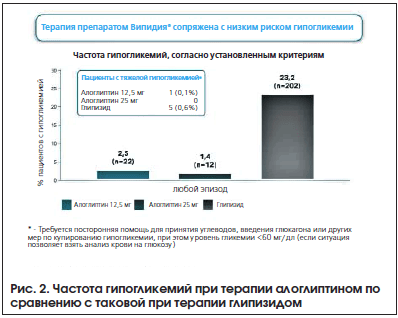
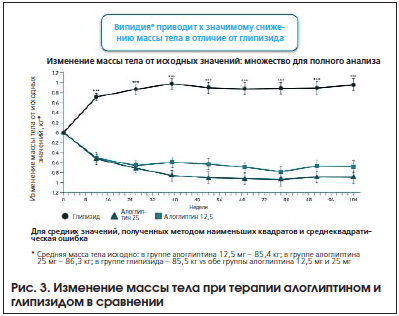
В 2014 г. были опубликованы результаты исследования ENDURE (Efficacy and Safety of Alogliptin Plus Metformin Compared to Glipizide plus Metformin in Patients With Type 2 Diabetes Melitus) [13], в котором сравнивали продолжительность эффективности и безопасности терапии алоглиптином (Випидия®) и глипизидом в их сочетании с метформином у пациентов с СД 2-го типа. Пациенты были рандомизированы на три группы: в первой группе (n=880) получали алоглиптин 12,5 мг 1 р./день плюс метформин, во второй (n=885) – алоглиптин 25 мг 1 р./день плюс метформин, а в третьей (n=874) – глипизид 5 мг, титруемый максимально до 20 мг, в сочетании с метформином. Исследование продолжалось 2 года. К концу лечения гликированный гемоглобин снизился на 0,68% в первой группе, на 0,72% во второй группе и на 0,59% в третьей группе (рис. 1). Гипогликемии при терапии алоглиптином развивались гораздо реже, чем при терапии глипизидом (рис. 2). Кроме того, оценивалась масса тела пациентов. Терапия алоглиптином не способствовала набору веса, напротив, было зарегистрировано снижение массы тела, в отличие от группы глипизида, где произошла прибавка веса (рис. 3). Следует особо подчеркнуть, что в группе терапии алоглиптином в дозе 25 мг к 104-й неделе лечения значимо большее число пациентов (48,5%) достигли уровня HbA1c ≤7% в отличие от пациентов, принимавших глипизид (р=0,004). Кроме того, терапия алоглиптином в дозе 12,5 и 25 мг сопровождалась значимо более выраженным снижением уровня глюкозы плазмы натощак на 104-й неделе по сравнению с терапией глипизидом (–0,9 мг/дл, –3,2 мг/дл, 5,4 мг/дл соответственно; р
25 мг над глипизидом по удержанию гликемического контроля к 104-й неделе терапии (р=0,010).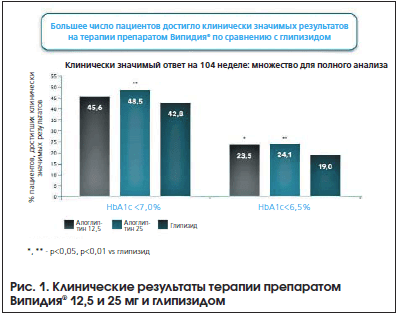
Таким образом, воздействие на патофизиологические механизмы, хорошая переносимость, отсутствие прибавки веса, низкий риск гипогликемий, сердечно-сосудистая безопасность при применении алоглиптина и других ингибиторов ДПП-4 обусловливают их значительное терапевтическое преимущество. Важность инкретинового эффекта для поддержания нормогликемии четко установлена, и терапия на основе инкретинов является одним из наиболее перспективных методов лечения СД 2-го типа. Агонисты рецепторов ГПП-1 и ингибиторы ДПП-4 стимулируют рецепторы ГИП и ГПП-1 и таким образом увеличивают секрецию инсулина в ответ на стимуляцию как при пероральном, так и при внутривенном введении глюкозы. Таким образом, эти препараты не устраняют инкретинового дефекта у пациентов, но повышают секреторный ответ. Напротив, некоторые бариатрические оперативные вмешательства усиливают ответ ГПП-1, а также восстанавливают эффект инкретина у лиц с СД 2-го типа.
Знание эффектов и биологической активности инкретиновых гормонов стало важным для полного понимания регуляции гомеостаза глюкозы и энергии. В настоящее время широко используются лекарства на основе инкретина для предотвращения ухудшения функции β-клеток, которое, как известно, в значительной степени объясняет прогрессирование СД. Поэтому терапевтическим стратегиям, замедляющим или предотвращающим ухудшение функции β-клеток, следует отдать предпочтение и включить в практику лечения СД.
Литература
1. Nauck M.A., Meier J.J. The incretin effect in healthy individuals and those with type 2 diabetes: physiology, pathophysiology, and response to therapeutic interventions // Lancet Diabetes Endocrinol. 2016. Vol. 4. P.525–536.
2. Van Genugten R.E., van Raalte D.H., Diamant M. Dipeptidyl peptidase-4 inhibitors and preservation of pancreatic islet-cell function: a critical appraisal of the evidence // Diabetes, Obesity and Metabolism. 2012. Vol. 14. P.101–111.
3. Vardarli I., Arndt E., Deacon C.F. et al. Effects of sitagliptin and metformin treatment on incretin hormone and insulin secretory responses to oral and «isoglycemic” intravenous glucose // Diabetes. 2014. Vol. 63. P.663–674.
4. Zhang X., Wang Z., Huang Y. Wang J. Effects of chronic administration of alogliptin on the development of diabetes and -cell function in high fat diet/streptozotocin diabetic mice // Diabetes, Obesity and Metabolism. 2011. Vol. 13. P.337–347.
5. Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом, 8-й вып. // Сахарный диабет. 2017. №20(1S). С. 31 [Dedov I.I., Shestakova M.V., Majorov A.Ju. Algoritmy specializirovannoj medicinskoj pomoshhi bol’nym saharnym diabetom, 8-j vyp. // Saharnyj diabet. 2017. №20(1S). S. 31 (in Russian)].
6. Hur K.Y., Lee M.S. New mechanisms of metformin action: focusing on mitochondria and the gut // J Diabetes Investig. 2015. Vol.6(6). P.600–609.
7. Официальная инструкция по применению препарата Випидия. Интернет-ресурс: https://www.rlsnet.ru/tn_index_id_73312.htm [Oficial’naja instrukcija po primeneniju preparata Vipidija. Internet-resurs: https://www.rlsnet.ru/tn_index_id_73312.htm (in Russian)].
8. DeFronzo R.A. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type-2 diabetes and inadequate glycemic control: a randomized, double-blind, placebo-controlled study // Diabetes Care. 2008. Vol. 31. P.2315–2317.
9. Pratley R.E. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes inadequately controlled by glyburide monotherapy // Diabetes Obes Metab. 2009. Vol. 11. P.167–176.
10. Nauck M.A. et al. Efficacy and safety of adding the dipeptidylpeptidase-4 inhibitor alogliptin to metformin therapy in patients with type 2 diabetes inadequately controlled with metformin monotherapy: a multicentre, randomised, double-blind, placebo-controlled study // Int J Clin Pract. 2009.Vol. 63. P.46–55.
11. Pratley R.E., Reusch J.E., Fleck P.R. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin added to pioglitazone in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study // Curr Med Res Opin. 2009. Vol. 25. P.2361–2371.
12. Rosenstock J. et al. Alogliptin added to insulin therapy in patients with type 2 diabetes reduces HbA(1C) without causing weight gain or increased hypoglycaemia // Diabetes Obes Metab. 2009. Vol. 11(12). P.1145–1152.
13. Del Prato S. et al. Durability of the efficacy and safety of alogliptin compared with glipizide in type 2 diabetes mellitus: a 2-year study // Diabetes Obes Metab. 2014. Vol. 16(12). P.1239–1246.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






