Патогенетические подходы в лечении синдрома раздраженного кишечника
Н. А. Агафонова, кандидат медицинских наук, доцент
Э. П. Яковенко, доктор медицинских наук, профессор
А. С. Прянишникова, кандидат медицинских наук, доцент
А. В. Яковенко, кандидат медицинских наук, доцент
А. Н. Иванов, кандидат медицинских наук, доцент
РГМУ, Москва
Синдром раздраженного кишечника (СРК) относится к функциональным заболеваниям, при которых патогенез развития симптомов не может быть объяснен органическими причинами. Согласно современным представлениям СРК является психосоциальным расстройством с нарушением висцеральной чувствительности и двигательной активности кишечника, обусловленных или снижением порога восприятия боли, или увеличением интенсивности ощущения болевых импульсов при нормальном пороге их восприятия [1].
В то же время практически при всех органических заболеваниях желудочно-кишечного тракта (ЖКТ): язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, злокачественные опухоли, желчно-каменная болезнь, хронический панкреатит и др. и несколько реже других органов и систем отмечаются симптомы, свойственные СРК. Этот факт позволил ряду авторов высказать предположение о существовании синдрома перекреста СРК с другими заболеваниями или обозначить их как СРК-подобные расстройства или симптомы. Важно отметить, что принципы лечения СРК и СРК-подобных расстройств однотипны [2].
СРК считается самым распространенным заболеванием внутренних органов. Во всем мире приблизительно 10–20% взрослого населения имеют соответствующие симптомы СРК. По данным большинства исследований женщины страдают приблизительно в 2 раза чаще мужчин. Пик заболеваемости приходится на самый активный трудоспособный возраст: 24–41 год. Симптомы СРК продолжаются в течение долгого времени, могут накладываться на другие функциональные расстройства и порой серьезно ухудшают качество жизни.
В патогенезе СРК рассматриваются следующие факторы: измененная моторика ЖКТ, висцеральная гиперчувствительность, расстройство взаимодействия в системе «головной мозг–кишка», вегетативные и гормональные сдвиги, генетические факторы и факторы окружающей среды, последствия перенесенных кишечных инфекций и психосоциальные расстройства.
Диагностические критерии СРК
Для установления диагноза СРК используются критерии диагностики Римского консенсуса III (2006 г.), которые включают: наличие рецидивирующей боли в животе или дискомфорта по крайней мере 3 дня в месяц за последние 3 месяца, с началом симптомов не менее 6 месяцев, связанные с двумя или более из нижеследующих признаков:
1) улучшение после дефекации;
2) начало связано с изменением частоты стула;
3) начало связано с изменением формы стула.
Симптомы, подтверждающие диагноз, но не являющиеся частью диагностических критериев СРК, включают:
1) нарушение частоты стула: стул менее 3 раз в неделю или более 3 раз в день;
2) нарушение формы кала: твердый или бобовидный, разжиженный или водянистый;
3) натуживание на протяжении акта дефекации, или императивный позыв, или чувство неполного опорожнения;
4) выделение слизи;
5) наличие метеоризма.
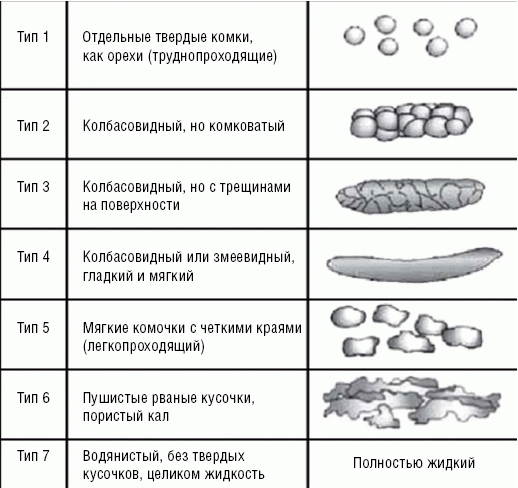
Рис. Бристольская шкала формы кала
 По Римским критериям III, опираясь на Бристольскую шкалу формы кала (рис.), предлагается классифицировать пациентов с СРК на следующие группы:
По Римским критериям III, опираясь на Бристольскую шкалу формы кала (рис.), предлагается классифицировать пациентов с СРК на следующие группы:
1. СРК с преобладанием запора при наличии твердого или бобовидного кала при более 25% из общего числа опорожнений кишечника, однако допускается и наличие разжиженного (кашицеобразного) или водянистого кала при менее 25% из общего числа опорожнений.
2. СРК с преобладанием диареи, для которого характерно наличие кашицеобразного или водянистого кала при более 25% из общего числа опорожнений кишечника, однако допускается и наличие твердого или бобовидного кала при менее 25% из общего числа опорожнений кишечника.
3. Смешанный тип СРК, при котором имеет место чередование твердого или бобовидного кала и кашицеобразного или водянистого кала при 25% и более из общего числа опорожнений кишечника.
4. Неклассифицированный тип СРК — недостаточная выраженность отклонений консистенции кала для вышеуказанных типов.
Необходимо отметить, что у одного и того же больного различные подтипы СРК могут варьировать на протяжении болезни [3].
Диагноз СРК — диагноз исключения, поэтому при его установлении обязательно выявление так называемых симптомов тревоги, указывающих на более серьезную патологию (табл. 1).
Ведущий симптом СРК — абдоминальная боль
При любом из вариантов ведущим симптомом СРК является абдоминальная боль. Клинические варианты болевого абдоминального синдрома при СРК отличаются вариабельностью и многообразием. Боли в животе могут быть: тупыми, ноющими, распирающими, неопределенными, острыми, режущими, кинжальными, схваткообразными, жгучими, различной локализации и интенсивности. Наиболее частой локализацией болей является нижняя часть живота, реже прямая кишка. При выраженной интенсивности болей возможна иррадиация их в спину. Нередко боли усиливаются в вертикальном положении или появляются в левом подреберье или левой половине грудной клетки, что связано с подъемом и накоплением кишечных газов в самом высоко расположенном отделе толстой кишки — селезеночном углу. Купирование или снижение интенсивности данного типа болей наблюдается при отхождении газов, которое облегчается в положении больного лежа на животе с поднятыми вверх ягодицами, что обозначается термином «синдром селезеночного изгиба». Наличие последнего позволяет исключить кардиальную, васкулярную и легочную патологию как причину болевого синдрома. Если наблюдается связь болей с приемом пищи, то ее появление или усиление провоцируется не столько ее составными компонентами, сколько самим актом еды [4].
Лечение больных с СРК
Программа лечения СРК состоит из двух этапов — первичного курса и последующей базовой терапии. Целью первичного курса лечения является устранение симптомов заболевания и проверка ex juvantibus правильности постановки диагноза, что исключает необходимость дальнейшего поиска органической патологии и выполнения дополнительных диагностических процедур. Продолжительность первичного курса лечения составляет не менее 6–8 недель, базовой терапии — 1–3 месяцев. Выбор программы определяется взаимодействием нескольких факторов и зависит от ведущего симптома (боль, метеоризм, диарея, запор), его тяжести и влияния на качество жизни, а также от характера поведения пациента и его психического состояния.
Больному назначают диету исключения, которая не содержит: кофеин, лактозу, фруктозу, сорбитол, уксус, алкоголь, перец, копчености, а также продукты, вызывающие чрезмерное газообразование.
Лечение больных СРК с преобладанием абдоминальной боли
Главные механизмы развития абдоминальной боли обусловлены нарушением моторики кишечника и висцеральной гиперчувствительностью. В зависимости от состояния тонуса и перистальтической активности циркулярного и продольного слоев гладкой мускулатуры формируются два типа моторных нарушений: 1) ускоренный транзит химуса по кишке, обусловленный повышением пропульсивной активности продольного мышечного слоя кишки с развитием диареи; 2) замедленный транзит кишечного содержимого за счет гипертонуса циркулярной мускулатуры (спастическая дискинезия) толстой кишки с формированием запора. Поскольку гладкомышечный спазм является одной из основных составляющих абдоминальной боли при СРК, то препаратами выбора для снятия спазма любого генеза и купирования боли, особенно при функциональных нарушениях ЖКТ, считаются миотропные спазмолитики. Они воздействуют на конечный этап формирования гиперкинезии, независимо от ее причины и механизма.
Двигательная функция кишечника находится под контролем многочисленных регулирующих влияний (центральной, периферической, энтеральной нервных систем и желудочно-кишечных пептидов), которые определяют нормальный тонус и сократительную активность гладких мышц кишечной стенки. В связи с этим воздействовать на гладкомышечную клетку можно различным способом.
В зависимости от основного механизма воздействия на этапы сокращения мышечного волокна выделяют следующие группы мышечных релаксантов (табл. 2). Антихолинергические средства снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы. Последнее обстоятельство определяет существенные различия индивидуальной эффективности препаратов данной группы. Довольно низкая эффективность, отсутствие селективности (действие практически на всю гладкую мускулатуру, включая мочевыделительную систему, сосуды и др., а также на секреторные железы) и в связи с этим широкий спектр побочных эффектов, а также опасность развития гиперрелаксации мышечного волокна ограничивают применение антихолинергических препаратов для курсового лечения при купировании болевого синдрома у значительной части больных СРК.

Блокаторы фосфодиэстеразы — миотропные спазмолитики (папаверин, дротаверин) способствуют накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Эти эффекты могут достигаться ингибированием фосфодиэстеразы, или активацией аденилатциклазы, или блокадой аденозиновых рецепторов либо их комбинацией. При использовании вышеуказанной группы спазмолитиков необходимо учитывать существенные индивидуальные различия их эффективности, отсутствие селективности, развитие гипомоторной дискинезии и гипотонии сфинктерного аппарата пищеварительного тракта, особенно при длительном применении. Данные препараты используются кратковременно (от однократного приема до недели) для купирования спазма, но не для курсового лечения, направленного на купирование и профилактику рецидива заболевания.
В регуляции моторики ЖКТ существенную роль играет серотонин. Выделяют несколько подтипов серотониновых рецепторов (5-NТ1-4), однако наиболее изучены 5-NТ3 и 5-NТ4.Связывание серотонина с 5-NТ3 способствует расслаблению, а с 5-NТ4 — сокращению мышечного волокна. В то же время точные механизмы действия серотонина на мышечные волокна ЖКТ не установлены. В настоящее время из препаратов этой группы известны антагонист 5-NТ3 алосетрон, полный агонист 5-NТ4 — прукалоприд и частичный агонист 5-NТ4 — тегасерод (в России препараты не используются).
Определенное значение в регуляции моторной функции органов ЖКТ отводится эндогенным опиатам. При связывании их с µ- (Мю) и δ- (Дельта) опиатными рецепторами миоцитов происходит стимуляция, а с κ- (Каппа) — замедление моторики. В настоящее время в лечении больных СРК используется агонист опиатных рецепторов — тримебутин (Тримедат) — регулятор моторики ЖКТ.
Однако при лечении пациентов с СРК предпочтение отдается миотропным спазмолитикам с селективным действием на гладкие мышечные клетки ЖКТ (мебеверин, пинаверия бромид). К группе блокаторов быстрых натриевых каналов клеточной мембраны миоцита относится препарат мебеверин (Дюспаталин), механизм действия которого сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате нарушается фосфорилирование миозина и прекращается сокращение мышечного волокна. Кроме того, препарат блокирует пополнение внутриклеточных депо ионами кальция, что, в конечном итоге, приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации, что предупреждает развитие длительной релаксации миоцита. Препарат назначается по 1 капсуле 2 раза в день за 20 минут до еды.
На конечном этапе сбалансированная работа гладкомышечного аппарата зависит от концентрации ионов кальция в цитоплазме миоцита. Ионы кальция поступают в миоцит через специализированные мембранные каналы. Открытие кальциевых каналов приводит к увеличению концентрации кальция, образованию комплекса актин–миозин и сокращению гладких мышц, а блокирование каналов сопровождается, соответственно, уменьшением концентрации кальция в миоците и его расслаблением. Ранее было обращено внимание на то, что антагонисты кальция, используемые для лечения сердечно-сосудистых заболеваний (нифедипин и верапамил), оказывали релаксирующее влияние на гладкие мыщцы ЖКТ. Это послужило поводом для создания группы современных эффективных миотропных спазмолитиков — селективных блокаторов кальциевых каналов гладких мышц ЖКТ. Классическим представителем этой группы является пинаверия бромид. Пинаверия бромид впервые был зарегистрирован в 1975 году и с тех пор во всем мире препарат ежегодно назначается примерно трем миллионам пациентов. В настоящее время он реализуется более чем в 60 странах. В России препарат зарегистрирован под названием Дицетел.
Дицетел является антагонистом кальция с высокоселективным спазмолитическим действием в отношении гладких мышц кишечника. Это определяет его терапевтическое применение при боли в животе, кишечной дисфункции и кишечном дискомфорте, обусловленных СРК. В настоящее время благодаря результатам электрофизиологических и фармакологических исследований идентифицировано по крайней мере четыре типа кальциевых каналов: L, T, P, N. Каналы L-типа находятся на поверхности цитоплазматической мембраны гладкомышечных клеток и состоят из нескольких субъединиц, из которых наиболее важной является альфа1-субъединица. Альфа1-субъединица канала L-типа может открываться за счет разности потенциалов на поверхности клеточной мембраны (нейрональный контроль) или опосредованно в присутствии пищеварительных гормонов и медиаторов. Исследованиями с использованием методик клонирования ДНК и полимеразной цепной реакции было продемонстрировано, что структура альфа1-субъединицы кальциевого канала клеток кишечника отличается от таковой альфа1-субъединицы кальциевых каналов в клетках других тканей. Дицетел имеет высокое сродство к изоформе альфа1-субъединицы кальциевого канала, преимущественно локализованной в клетках кишечника, что подчеркивает высокую селективность препарата в отношении данного органа мишени [5]. Таким образом, Дицетел обладает уникальным двойным терапевтическим эффектом: не только спазмолитическим действием, но и способностью снижать висцеральную чувствительность. Эти эффекты реализуются как за счет блокады потенциалзависимых и рецептор-управляемых кальциевых каналов гладкомышечных клеток толстой кишки, так и за счет снижения чувствительности рецепторов кишечной мускулатуры к гастроинтестинальным гормонам и медиаторам, таким как холецистокинин и субстанция P [6].
Фармакодинамика пинаверия бромида, терапевтические эффекты:
- пинаверия бромид обладает максимальным сродством к гладкомышечным клеткам толстой кишки;
- значительно укорачивает время транзита по толстой кишке, преимущественно за счет увеличения скорости пассажа через нисходящую и ректосигмоидальную зоны толстой кишки;
- при диарее препарат не увеличивает подвижность толстой кишки;
- ингибирование не усиливается при повторном стимулировании и отличается тем, что не зависит от напряжения;
- препарат можно применять в течение длительного времени, не опасаясь развития гипотонии кишечника.
На протяжении последних 20 лет эффективность Дицетела по купированию симптомов СРК при всех подтипах оценена в многочисленных многоцентровых, открытых, сравнительных и плацебо-контролируемых исследованиях как в России, так и за рубежом. Оценка эффективности Дицетела как со стороны исследователей, так и пациентов продемонстрировала высокую частоту хороших и очень хороших результатов по купированию основных симптомов СРК: абдоминальной боли, запора, диареи, вздутия живота. Препарат эффективно и быстро купирует боль, вызванную спастическими сокращениями кишечной стенки, и восстанавливает кишечный транзит.
Отмечена хорошая переносимость препарата, с минимальным количеством побочных эффектов. Метаанализ 26/23 исследований сгруппировал различные спазмолитики по наличию у них побочных реакций в сравнении с плацебо. Дицетел был признан средством, обладающим лучшей переносимостью, чем гиосцин, тримебутин, циметропия бромид, отилония бромид, эфирное масло перечной мяты, дицикломина бромид [7]. Дицетел не взаимодействует с вегетативной нервной системой и поэтому не обладает антихолинергическими побочными эффектами, тем более при использовании терапевтических доз. В связи с этим препарат может применяться у пациентов с СРК, имеющих сопутствующую гипертрофию предстательной железы, задержку мочи или глаукому. В отличие от стандартных антагонистов кальция, Дицетел в терапевтических дозах не обладает сердечно-сосудистыми эффектами. Это обусловлено очень низким уровнем его системной абсорбции, преимущественно гепатобилиарной экскрецией и высокой специфичностью в отношении как гладкомышечной ткани кишечника, так и подтипов кальциевых каналов. Дицетел назначается по 100 мг × 3 раза в день во время еды. Дицетел можно комбинировать с объемными слабительными (лактулоза, полиэтиленгликоль, псилиум) при лечении больных СРК с запорами. При СРК с преобладанием диареи эффективность Дицетела может быть увеличена комбинацией с обволакивающими препаратами и адсорбентами.
При наличии метеоризма к Дицетелу могут присоединяться препараты симетикона — диметикона, что увеличит эффективность лечения пациентов с СРК.
Лечение больных СРК с преобладанием запоров
При СРК с запорами, если отсутствует эффект диеты (увеличение потребления диетических волокон до 25 г/сут) и миотропных спазмолитиков, в схему лечения включают осмотические слабительные препараты, среди которых наилучшим образом зарекомендовали себя лактулоза, магнезиальное молочко, Псиликон-Псилиум, Макрогол 4000 и др. Раздражающие слабительные для лечения СРК с запорами противопоказаны, поскольку могут провоцировать спастические сокращения кишки и усиливать болевой синдром [8].
Лечение больных СРК с преобладанием диареи
Если у больного наблюдается незначительное увеличение частоты стула, возможно применение адсорбентов — карбоната кальция, активированного угля, дисмектита по 3 г в день в виде суспензии. Однако необходимо учитывать, что антидиарейное действие этих препаратов наступает не ранее чем через 3–5 дней. При неэффективности комбинированного назначения спазмолитиков и адсорбентов и значительном увеличении частоты стула может быть назначен Лоперамид. Лоперамид относится к агонистам m-опиатных рецепторов, что определяет его способность в подавлении быстрых пропульсивных сокращений кишечника и ведет к замедлению транзита каловых масс. Это сопровождается снижением пассажа жидкой части химуса, вследствие чего повышается реабсорбция жидкости и электролитов в кишечнике. Начальная доза Лоперамида для взрослых составляет 4 мг (2 капсулы). Поддерживающая доза не должна превышать максимально допустимую суточную дозу для взрослых — 16 мг (8 капсул).
Лечение больных СРК с преобладанием метеоризма
Неотъемлемыми и тягостными для пациента симптомами СРК являются вздутие или ощущение абдоминального растяжения, а также отрыжка и избыточное отделение газа через прямую кишку. Данные симптомы имеют минимальную интенсивность в утренние часы и усиливаются в вечернее время. В основе их формирования лежит не столько увеличение объема внутрипросветного газа, сколько снижение толерантности к растяжению кишечной стенки. Основными причинами избыточного содержания газа в кишке является увеличение его продукции кишечной микрофлорой, замедление транзита в результате спастической дискинезии, а также нарушение всасывания кишечной стенкой в кровь, в частности, при быстром транзите в период диареи.
Если в клинике СРК преобладают жалобы на вздутие и метеоризм, при адекватной оценке роли газообразования в каждом конкретном случае показано назначение препаратов, механизм действия которых основан на ослаблении поверхностного натяжения пузырьков газа в пищеварительном тракте, что обеспечивает резорбцию и свободное выделение газов. Одним из таких симптоматических препаратов для уменьшения газов в кишечнике является симетикон. При метеоризме назначают по 2 капсулы симетикона 3–5 раз в сутки. Одновременное назначение спазмолитиков улучшает транзит газа по кишке. Следует учитывать, что в патогенезе избыточного газообразования существенную роль играет нарушение микрофлоры кишечника.
Коррекция кишечной микрофлоры
В последнее время накопилось большое количество данных, свидетельствующих о роли нарушения кишечной микрофлоры в формировании СРК и СРК-подобных нарушений [9]. Особенно это актуально для больных с постинфекционным СРК, у которых симптомы развились после перенесенных острых кишечных инфекций [10, 11].
Результаты экспериментальных и клинических исследований показали, что изменение состава и мест обитания кишечной микрофлоры сопровождается нарушениями двигательной активности и сенсорной чувствительности кишечника, что лежит в основе формирования симптоматики кишечной диспепсии, включающей абдоминальные боли, нарушения стула, метеоризм и др. [12, 13]. При СРК с диареей ускоренный транзит химуса по кишке, обусловленный повышением пропульсивной активности продольного мышечного слоя, сопровождается нарушением процессов гидролиза и всасывания за счет кратковременного контакта ингредиентов пищи с ферментами. Это создает условия для развития избыточного бактериального роста, повышения продукции и снижения абсорбции кишечного газа в кровь. Замедленный транзит кишечного содержимого за счет гипертонуса циркулярной мускулатуры (спастическая дискинезия) толстой кишки с развитием запора сопровождается повышением внутрипросветного давления не только в толстой, но и в тонкой кишке и двенадцатиперстной кишке, а также в желудке. Длительный стаз кишечного содержимого приводит к нарушению количественного и качественного состава кишечной микрофлоры.
При наличии избыточного бактериального роста в кишечнике, выраженном метеоризме, при выявлении условно-патогенной микрофлоры в посевах кишечного содержимого лекарственную терапию, независимо от типа СРК, рекомендуется дополнить назначением одного или двух семидневных курсов кишечных антисептиков широкого спектра действия (Альфа-нормикс (рифаксимин), фуразолидон, нифуроксазид, Сульгин (сульфагуанидин) и др. в общепринятых дозах), со сменой препарата в очередном курсовом лечении и последующим использованием пробиотиков (Бифиформ, Линекс и др.).
Психологическое лечение
Психологическое лечение должно использоваться тогда, когда симптомы СРК рефрактерны к медикаментозному лечению или имеются свидетельства, что стрессовые и психологические факторы способствуют обострению желудочно-кишечных симптомов. Понимание больным необходимости такого лечения является важным фактором успешности терапии. Лечение подбирается с участием психотерапевта. При СРК обычно назначаются трициклические антидепрессанты или селективные ингибиторы захвата серотонина. Целью назначения таких препаратов являются: 1) лечение психической коморбидности [14]; 2) изменение физиологии ЖКТ (висцеральной чувствительности, моторики и секреции) [15]; 3) снижение центральной перцепции боли [16]. Важно понимать, что антидепрессанты назначаются при СРК как препараты, непосредственно снижающие висцеральную гиперчувствительность, и лишь во вторую очередь для купирования депрессивных симптомов, вызываемых болью. Такая терапия должна продолжаться 6–12 месяцев до момента снижения и определения поддерживающей дозы [17].
При СРК также используются разнообразные дополнительные лечебные процедуры — лечебная физкультура, физиотерапия, гипнотерапия, методы, основанные на принципе биологической обратной связи, и групповое межличностное лечение.
Литература
- Drossman D. A., Camilleri M., Mayer E. A., Whitehead W. E. AGA technical review on irritable bowel syndrome // Gastroenterology. 2002; 123: 2108–2131.
- Farrokhyar F., Marshall J. K., Easterbrook B. et al. Functional Gastrointestinal Disorders and Mood Disorders in Patients with Inactive Inflammatory Bowel Disease: Prevalence and Impact on Health // Inflamm Bowel Dis. 2006; 12 (1): 38–45.
- Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process // Gastroenterology. 2006; 130 (5).
- Яковенко Э. П., Агафонова Н. А., Яковенко А. В., Иванов А. Н., Прянишникова А. С., Краснолобова Л. П. Роль моторных нарушений в механизмах формирования клинических проявлений синдрома раздраженной кишки (СРК) и СРК-подобных нарушений // Вопросы терапии. Consilium Medicum. 2011; 1: 69–73.
- Morel N., Buryi V., Feron O., Gomez J. P., Christen M. O., Godfraind T. The action of calcium channel blockers on recombinant L-type calcium channel α1-subunits // Br J Pharmacol. 1998; 125: 1005–1012.
- Christen M. O. Pinaverium bromide: A calcium antagonist with selectivity for the gastrointestinal tract // Today’s Therapeutic Trends. 1995; 13 (2): 47–62.
- Poynard T., Naveau S., Mory B., Chaput J. C. Meta-analysis of smooth muscle relaxants in the treatment of irritable bowel syndrome // Aliment Pharmacol Ther. 2001; 15: 355–360.
- Ramkumar D, Rao S. S. Efficacy and safety of traditional medical therapies for chronic constipation: systematic review // Am J Gastroenterol. 2005; 100: 936–971.
- Григорьев П. Я., Яковенко Э. П. Синдром раздраженного кишечника, ассоциированный с дисбактериозом // Consilium medicum. 2003. Т. 2, № 7. С. 305–307.
- Yakovenko E., Grigoriev P., Tcherenchimediins at al. Is irritable bowel syndrome (IBS) related to altered gut flora? // Gut. 1997. Vol. 41, suppl. 3. P.A. 123.
- Парфенов А. И., Ручкина И. Н., Осипов Г. А. Висмута трикалия дицитрат в лечении больных постинфекционным синдромом раздраженного кишечника // Рус. мед. журн. 2006. Т. 8, № 2. С. 78–81.
- Dunlop S. P., Jenkins D., Spiller R. S. Distinctive clinical, psychological and histological features of postinfective irritable bowel syndrome // American J Gastroenterology. 2003. Vol. 98, № 7. P. 1578–1583.
- Tazume S., Ozawa A., Yamamoto T. at al. Ecological study on the intestinal bacteria flora of patients with diarrhea // Clin Infect Dis. 1993; 16. Suppl 2: S77–S82.
- Lancaster-Smith M. J., Prout B. J., Pinto T. et al. Influence of drug treatment on the irritable bowel syndrome and its interaction with psychoneurotic morbidity // Acta Psychiatr Scand. 1982; 66: 33–41.
- Gorard D. A., Libby G. W., Farthing M. J. G. Effect of a tricyclic antidepressant on small intestinal motility in health and diarrhea-predominant irritable bowel syndrome // Dig Dis Sci. 1995; 40: 86–95.
- Mertz H., Fass R., Kodner A. et al. Effect of amitryptiline on symptoms, sleep, and visceral perception in patients with functional dyspepsia // Am J Gastroenterol. 1998; 93: 160–165.
- Onghena P., Houdenhove B. V. Antidepressant-induced analgesia in chronic non-malignant pain: a meta-analysis of 39 placebo-controlled studies // Pain. 1992; 49: 205–219.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







