Боль в спине — одно из наиболее распространенных болезненных состояний, выявляемое при осмотре у 12–30% населения. Примерно у 10% пациентов развивается хроническая боль в спине [1]. Боль в спине оказывает неблагоприятное влияние на психологическое благополучие пациентов, вызывая состояние стресса, депрессии и тревоги [2], а хронизация болевого синдрома представляет собой серьезную проблему для общественного здоровья вследствие изнурительного течения болезни и неблагоприятных социально экономических последствий [3]. Несмотря на то, что потенциальные причины боли многочисленны, они в значительной степени связаны с дегенерацией ткани межпозвонкового диска (МПД) [4–5]. В настоящее время хирургическое лечение является единственным доступным видом медицинского вмешательства в целях устранения возможных источников боли и восстановления биомеханической функции дисков. Однако интерес к разработке альтернативных методов лечения, в частности биологических методов восстановления ткани МПД, неуклонно растет [6].
МПД представляет собой фиброхрящевую структуру, которая находится между позвонками и благодаря которой позвоночник обладает стабильностью и гибкостью. В каждом диске коллагеновое фиброзное кольцо включает в себя расположенное по центру сильно гидратированное студенистое ядро, эти структуры отделены от смежных тел позвонков тонким слоем гиалинового хряща, хрящевыми концевыми пластинками [7].
Студенистое ядро состоит из коллагена II типа и эластиновых волокон, заключенных в аггрекансодержащий гель. Фиксированная плотность заряда молекул аггрекана в студенистом ядре создает высокое осмотическое давление, что обеспечивает высокую степень гидратации студенистого ядра и позволяет поддерживать высоту МПД, а также приводит к перераспределению нагрузки по концевой пластинке [8, 9]. Клетки студенистого ядра обладают низкой плотностью, но происходят из клеток хорды, а затем на фоне созревания приобретают хондроцитоподобные черты [8]. Фиброзное кольцо состоит из 15–25 ламелей (концентрических колец) с параллельным расположением коллагеновых волокон в каждой ламели и перпендикулярным расположением коллагеновых волокон между соседними ламелями, что обеспечивает прочность на растяжение [10]. Внешняя часть фиброзного кольца содержит фибробластоподобные продолговатые тонкие клетки, в то время как клетки, расположенные внутри фиброзного кольца, имеют более округлую форму и похожи на хондроциты.
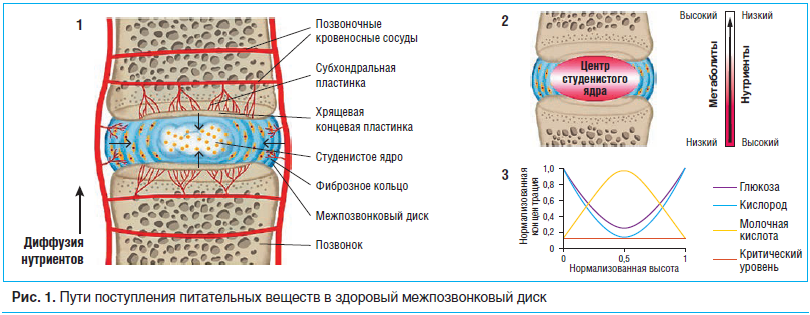
Биомеханическая роль МПД определяется организацией и свойствами его макромолекулярных компонентов, которые синтезируются и поддерживаются с помощью небольшой популяции клеток-резидентов; соответственно, клеточная активность важна для сохранения диска в нормальном здоровом состоянии [11].
Содержание статьи
- 1 Нормальное старение межпозвонкового диска
- 2 Механизмы дегенерации МПД
- 3 Этиология дегенерации МПД
- 4 Обеспечение питательными веществами здоровых дисков
- 5 Нарушение кровоснабжения позвонков
- 6 Нарушение кровоснабжения концевой пластинки
- 7 Увеличение потребности клеток в питательных веществах
- 8 Методы улучшения регенерации МПД
- 9 Заключение
Нормальное старение межпозвонкового диска
МПД подвергается возрастным изменениям раньше многих других тканей организма с нарастанием гистоморфологических и функциональных изменений. Возрастные изменения МПД представляют собой нормальный процесс, в то время как дегенерация диска — патологическое состояние, которое приводит к структурным нарушениям и может вызывать преждевременное старение диска [12]. Хрящевые концевые пластинки обладают низкой проницаемостью и кровоснабжением, что на фоне старения приводит к изменению микроокружения МПД и стимуляции катаболических процессов [10]. Общее содержание протеогликанов в МПД снижается на фоне старения, приводя к снижению гидратации МПД и в результате к изменению его биомеханических свойств. Коллагеновые волокна II типа в студенистом ядре и фиброзном кольце замещаются волокнами I типа [13, 14]. В студенистом ядре начинает накапливаться желтый пигмент, и постепенно ядро становится трудноотличимым от фиброзного кольца.
Механизмы дегенерации МПД
Этиология дегенерации МПД
Как уже было сказано, процесс дегенерации МПД начинается раньше, чем в любой другой ткани организма, а термин «дегенерация диска» охватывает вариабельный диапазон морфологических и биохимических изменений [15].
Дегенерацию МПД связывают со сложным взаимодействием средовых и генетических факторов. Данный процесс включает в себя прогрессивное снижение поступления питательных веществ к тканям диска, а также изменение состава внеклеточного матрикса, что приводит к ослаблению тканей и изменению клеточного метаболизма. Сниженное поступление питательных веществ отрицательно влияет на способность диска к поддержанию состава внеклеточного матрикса, а также к снижению концентрации кислорода, при этом также снижается уровень pH [16]. Кальцификация концевых пластинок также приводит к снижению кровотока. Недостаточность питания нарушает способность МПД реагировать на повышение нагрузки или травму. Структурные повреждения со временем нарастают и ускоряют процесс дегенерации [17]. Причины дегенерации диска плохо изучены, однако исследования показали, что основную роль в ее развитии играет генетический компонент [18].
Выявлено несколько категорий генов, вносящих вклад в дегенерацию МПД. Эти гены группируют по выполняемой в МПД функции. Полиморфизмы генов аггрекана (ACAN), COL1, COL9, COL11, FN, HAPLN1, тромбоспондина, белка промежуточного слоя хряща (CILP) и аспорина (ASPN) оказывают влияние на структуру МПД [19]. Полиморфизмы генов ферментов катаболизма MMP1, MMP2, MMP3, PARK2 и PSMB9 и антикатаболических тканевых ингибиторов металлопротеиназ, регулирующие катаболические процессы, могут вносить вклад в дегенерацию МПД [19]. Указанные полиморфизмы влияют на тонкий баланс медиаторов анаболизма и катаболизма в ткани МПД. Все факторы, способствующие активации воспалительного каскада, ускоряют процесс дегенерации МПД, нарушая баланс анаболических и катаболических процессов [20]. Полиморфизмы генов ИЛ-1, ИЛ-6 и ЦОГ-2 также связаны с дегенерацией МПД [21, 22].
В патогенез дегенерации МПД вносят вклад и средовые факторы. Ранее в качестве основного фактора риска дегенерации МПД рассматривали концепцию «износа и разрывов», предполагающую патогенную роль повторной физической нагрузки, однако близнецовые исследования продемонстрировали, что нагрузка играет незначительную роль в дегенерации диска [23]. Предполагается также роль ожирения в развитии дегенеративного процесса. В настоящее время существуют смешанные эпидемиологические данные относительно влияния ожирения на дегенеративный каскад. Современные исследования демонстрируют, что ИМТ >25 кг/м2 является независимым фактором риска появления рентгенографических признаков дегенерации МПД, а ожирение в молодом возрасте — мощным фактором риска увеличения числа МПД, подверженных дегенерации в будущем [24]. Согласно другой гипотезе сердечно-сосудистые заболевания и атеросклероз, связанные с ожирением, гомологичны по патогенезу атеросклерозу сосудов позвоночного столба и результирующей активации дегенеративного каскада. Другие исследования указывают на взаимосвязь ожирения и значительного повышения уровня ИЛ-6 и провоспалительных каскадов во всем организме, что может вносить вклад в воспалительный путь дегенерации МПД [25].
Считается, что независимо от начального триггера дегенерация зависит от дисковых клеток [26]. В нормальном диске скорости макромолекулярного синтеза и деградации сбалансированы, но, когда преобладают процессы деградации, ткань утрачивает организационную и биомеханическую функцию [27].
Обеспечение питательными веществами здоровых дисков
Поддержание оптимальной среды метаболизма питательных веществ для выживания и функционирования дисковых клеток является особой проблемой, поскольку МПД составляют самую большую бессосудистую ткань в организме [28].
Хотя клетки внешнего фиброзного кольца получают свои питательные вещества (и элиминируют их метаболиты) из капилляров мягких тканей, окружающих диск, большинство клеток внутри диска кровоснабжаются только через капилляры, берущие начало в телах позвонков, проникающие через субхондральную пластинку и заканчивающиеся петлями, прилежащими к хрящевой концевой пластинке [29]. Питательные вещества перемещаются главным образом путем диффузии [28] из капилляров через хрящевую концевую пластинку и плотную дисковую матрицу в ячейки диска; продукты обмена двигаются в обратном направлении. Следовательно, последующие градиенты концентрации определяются балансом между скоростью поступления питательных веществ и потреблением данных питательных веществ клетками (рис. 2.1). Таким образом, минимальные концентрации глюкозы, кислорода и других питательных веществ находятся в центре диска. Эти концентрации должны превышать критический порог для того, чтобы клетки оставались жизнеспособными и активными [30].
Баланс между доставкой питательных веществ и их потреблением неустойчив (рис. 2.2), и, если какой-либо параметр нарушен, концентрация питательных веществ и рН (вследствие накопления метаболитов) в дисках может понижаться до уровней, которые отрицательно влияют на клеточную активность и даже жизнеспособность клеток (рис. 2.3) [30, 31].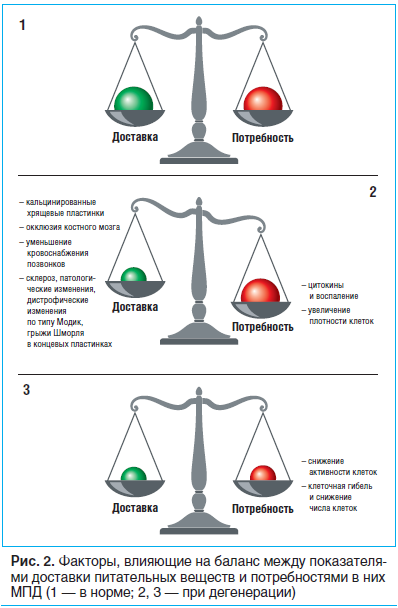
Большинство дисковых клеток зависят от капилляров, выходящих из тел позвонков, снабжающих их питательными веществами; однако в процессе дегенерации запускаются механизмы, нарушающие нормальное питание клеток.
Нарушение кровоснабжения позвонков
Атеросклероз артерий, питающих поясничный отдел позвоночника, связан с дегенерацией дисков [32]. К дегенерации дисков также приводят болезнь Гоше, серповидноклеточная анемия и кессонная болезнь, которые отрицательно влияют на микроциркуляцию и, следовательно, уменьшают поступление питательных веществ в МПД [33]. Поскольку капилляры экспрессируют мускариновые рецепторы, факторы, которые влияют на периферическую микроциркуляцию (например, воздействие вибрации и вазоактивных веществ) могут ограничивать транспорт питательных веществ в диски [34].
Нарушение кровоснабжения концевой пластинки
Поступление питательных веществ в большинство клеток диска должно проходить через концевую пластинку позвонка (как субхондральную, так и хрящевую концевую), а в дисках, подверженных дегенерации, этот путь может быть затруднен. Окклюзия свободных пространств костного мозга, приводящая к потере контакта между капиллярами и хрящевой концевой пластинкой, увеличивается прямо пропорционально степени дегенерации диска, равно как и кальцификация хрящевой концевой пластинки [35], что препятствует диффузии растворенных веществ из капилляров в диск [36]. Другие дегенеративные особенности концевой пластинки, такие как склероз, дистрофические изменения по типу Модик, грыжи Шморля и поражения концевой пластинки [37], также могут отрицательно влиять на поступление питательных веществ.
Увеличение потребности клеток в питательных веществах
Как и снижение скорости транспорта в клетки МПД, увеличение клеточной потребности, обусловленное более высокой плотностью клеток [38] или повышенной скоростью потребления питательных веществ клетками [39], может снизить концентрацию питательных веществ в МПД ниже критического уровня. Факторы роста и цитокины, такие как ИЛ-1b, которые экспрессируются в больших количествах во время дегенерации диска [40], также могут индуцировать заметное увеличение скорости потребления глюкозы [41] и выработки молочной кислоты хрящевыми клетками [42].
Таким образом, имеющиеся данные свидетельствуют о том, что сниженное поступление питательных веществ к дисковым клеткам (либо в результате нарушения доставки, либо в результате повышенного потребления) — распространенное явление при дегенерации МПД с последующим неблагоприятным воздействием на клеточную активность и жизнеспособность.
Методы улучшения регенерации МПД
На сегодняшний день стратегии регенерации тканей диска сосредоточены на клеточных подходах с использованием или без использования специализированных биоматериалов или факторов роста [43]. Хотя эти подходы кажутся эффективными в условиях in vitro и в исследованиях на животных, дегенерация диска у людей обычно сопровождается уменьшением обеспечения диска питательными веществами, следовательно, потеря питательных веществ может ограничить эффективность данных методов лечения.
Стратегии биологической регенерации МПД основаны на предположении о том, что дегенерация возникает из-за неправильного поведения клеток.
Многочисленные подходы к восстановлению МПД включают в себя имплантацию в поврежденный диск активных клеток (как клеток диска, так и стволовых клеток) как таковых либо встроенных в соответствующий биоматериал-носитель [44, 45].
Другой вариант предусматривает изменение активности оставшихся клеток-резидентов дегенерированного диска путем внутридисковой инъекции соответствующих факторов или с использованием методов генной терапии [46, 47].
Кроме того, предложено восстанавливать функцию дегенерированного диска путем трансплантации цельного диска. Однако попытки создать цельный МПД методами тканевой инженерии еще не увенчались успехом, прежде всего из-за трудностей регенерации фиброзного кольца [48], а также сложности васкуляризации каждого конкретного диска и тела позвонка [49].
Все описанные подходы к регенерации диска имеют одно важное условие: успешное долгосрочное восстановление диска подразумевает, что эндогенные или имплантированные клетки остаются живыми и активными. Хотя этого можно легко добиться в условиях in vitro и в исследованиях на животных, но насколько это осуществимо в дегенерированных МПД человека, пока неизвестно.
В настоящее время для лечения дегенеративных изменений МПД на фоне остеохондроза применяют препараты из группы хондропротекторов.
Одним из наиболее часто назначаемых хондропротекторов является препарат Алфлутоп. Алфлутоп — оригинальный инъекционный хондропротектор, представляющий собой биоактивный концентрат из 4 видов мелкой морской рыбы. В его состав входят гликозаминогликаны (глюкуроновая кислота, хондроитин-4-сульфат и хондроитин-6-сульфат, кератан-сульфат, дерматан-сульфат), аминокислоты и микроэлементы.
В исследованиях in vitro применение Алфлутопа способствовало значительному увеличению количества клеток в фазах репликации и митоза клеточного цикла. Кроме того, он увеличивал индекс пролиферации хондробластов на 64% (в концентрации 0,2%), получены данные о восстановлении количества и функциональной активности хондроцитов. Алфлутоп ингибирует активность гиалуронидазы на 83% и стабилизирует внеклеточный матрикс, индуцирует ингибирование активных форм кислорода, т. е. увеличивает антиоксидантную активность и снижает оксидативный стресс. Уровень внутриклеточного пероксида водорода снижается на 52%, внутриклеточного супероксиданиона — на 32%.
Противовоспалительный эффект препарата осуществляется через подавление активности генов ИЛ-1, ИЛ-6 на 16% и ИЛ-8 на 35%, он на 56% ингибирует активность сосудистого эндотелиального фактора роста, инициирующего ангиогенез и являющегося независимым фактором деструкции при остеоартрозе.
Кроме того, Алфлутоп снижает экспрессию аггреканазы на 70% и способствует защите межклеточного матрикса; усиливает экспрессию гена SOX9 на 58%, что способствует дифференцировке хондроцитов, синтезу коллагена и внеклеточного матрикса, а также стимулирует синтез аггрекана на 60% и гиалуронана на 39%, что благоприятно для восстановления структурной целостности хряща [50–52].
Алфлутоп изучен не только in vitro, но и в клинических исследованиях. В исследованиях Л.И. Алексеевой и соавт. [53, 54] лечение препаратом достоверно замедляло сужение суставной щели. Уровень маркера деградации хряща CTX-II имел тенденцию к снижению через 3 мес. лечения Алфлутопом, которая сохранялась до конца исследования, в группе плацебо уровень CTX-II не менялся. К концу исследования на фоне приема Алфлутопа отмечено достоверно большее снижение боли по шкале WOMAC, чем в группе плацебо. Суммарный индекс WOMAC в конце исследования в группах различался: в группе Алфлутопа достоверное снижение суммарного индекса WOMAC наблюдалось уже на 2-м визите, в то время как в группе плацебо — лишь на 4-м визите. Полученные достоверные данные служат доказательством несомненного модифицирующего действия препарата на симптомы заболевания.
В двойном слепом плацебо-контролируемом исследовании О.С. Левина и соавт. [55] препарат назначали при вертеброгенной люмбоишиалгии хронического течения на фоне спондилоартроза. Сравнивали эффективность внутримышечного и паравертебрального способов введения Алфлутопа. Авторы делают вывод о статистически значимом снижении интенсивности болевого синдрома при паравертебральном введении по сравнению с плацебо.
Имеющиеся данные о высокой клинической эффективности и безопасности препарата Алфлутоп позволяют рекомендовать его в качестве базисной терапии у больных с такими костно-мышечными нарушениями, как гонартроз, спондилоартроз, тендиниты, энтезиты, в т. ч. у больных с коморбидностью при необходимости длительной терапии остеоартроза и ограничении приема НПВП.
Интересным фактом представляется наличие у Алфлутопа яркого раннего анальгезирующего эффекта, что отличает его практически от всех известных в РФ инъекционных препаратов, относящихся к классу хондропротекторов. Наш 15-летний опыт использования Алфлутопа показал анальгезирующий эффект у 47,3% пациентов сразу после первой блокады, у остальных — после 2-го и 3-го введения. При этом лечебный эффект нарастал в течение лечебного курса [56].
Представляет интерес применение Алфлутопа в нейрохирургии [57] у больных с остеохондрозом поясничного отдела позвоночника, осложненным корешковым и дискогенным болевыми синдромами. Пациентам под контролем внутридискового давления выполняли пункционную нуклеопластику с последующим введением Алфлутопа: в ближайшем послеоперационном периоде проводили 5 паравертебральных блокад с Алфлутопом с интервалом 2 дня. Через 12 мес. хорошие результаты были достигнуты у 92% больных, осложнений не наблюдалось. Авторы делают вывод, что дополнительное введение Алфлутопа в полость диска патогенетически обосновано и оказывает стимулирующее действие на регенеративные процессы при любом типе МПД. У больных после гидродискэктомии введение Алфлутопа предотвращало развитие послеоперационной внутридисковой гипертензии.
Заключение
Понимание механизмов дегенерации МПД необходимо для разработки стратегий лечения, направленных на биологическое заживление и репарацию МПД. Степень выраженности дегенерации МПД определяет подходящий характер вмешательства; кроме того, различные подходы к лечению могут иметь разную эффективность в зависимости от этапа активации дегенеративного каскада. Процесс дегенерации МПД сложен и определяется разнообразными факторами, поэтому способы обращения вспять этого процесса должны быть также разнообразными и варьировать в зависимости от фенотипа болезни и степени ее прогрессирования [58–63].
За последнее десятилетие интерес к клеточному восстановлению МПД способствовал развитию исследований биологии МПД и значительно расширил наши знания в этой области, о чем свидетельствует успешное лечение животных благодаря грамотному использованию факторов роста, клеток и биологических материалов.
В качестве стартового препарата в терапии дегенеративно-дистрофических заболеваний позвоночника и боли в спине можно рекомендовать Алфлутоп, его симптомомодифицирующие и структурно-модифицирующие эффекты нашли подтверждение в исследованиях, проведенных in vitro и плацебо-контролируемых клинических исследованиях. Препарат способствует стойкому уменьшению болевого синдрома, увеличению подвижности позвоночника и расширению функциональных возможностей пациентов с хронической люмбоишиалгией, достоверно повышает порог боли и ноцицептивного рефлекса до нормальных значений у пациентов с хроническими болями в нижней части спины после курса лечения.
Информация с rmj.ru






