Оценка видового состава изолятов Сandida species, выделенных из различных биотопов, и их чувствительности к антифунгальным препаратам
Введение
Проблема грибковых инфекций остается актуальной на протяжении многих десятилетий. Применение антибиотиков, зачастую необоснованное, иммунодефицитные состояния, возникающие в условиях интенсивных урбанистических нагрузок, применение пероральных контрацептивов, нарушение обмена веществ и функции эндокринной системы приводят к развитию предпосылок для формирования оптимальных условий для размножения грибковой флоры.
Грибы рода Candida (Candida spp.), входящие в состав микрофлоры организма человека, под действием неблагоприятных факторов, ослабляющих иммунную систему, становятся причиной воспалительного процесса. При этом повышаются адгезивные свойства грибов, которые прикрепляются к клеткам эпителия слизистых оболочек и колонизируют их. Чаще кандидозное поражение затрагивает только поверхностные слои слизистых, реже эпителиальный барьер преодолевается грибковыми клетками, и происходит инвазия возбудителя в подлежащие ткани, иногда сопровождающаяся гематогенной диссеминацией [1]. В связи с этим клинические проявления инфекции, вызванной грибами Candida spp., разнообразны: от локального поражения слизистых оболочек до тяжелых форм инвазивного кандидоза с полиорганным поражением.
Среди поверхностных форм кандидозной инфекции лидирующие позиции занимает поражение слизистой оболочки влагалища и вульвы — вульвовагинозный кандидоз (ВВК). В последние десятилетия увеличивается число пациенток с часто рецидивирующим течением данного заболевания, при котором требуется длительный прием противогрибковых препаратов. По данным Н.Н. Климко и соавт. [2], хронический рецидивирующий кандидозный вульвовагинит (ХРКВ), характеризующийся частыми (не менее 4 в течение года) рецидивами, является самым распространенным микотическим заболеванием среди женщин в России: более 2 млн российских женщин страдают ХРКВ, что составляет 2900 случаев на 100 тыс. населения. Персистирование Candida spp. на слизистых оболочках приводит к возможности формирования резистентности к лекарственным препаратам и селекции устойчивых штаммов и, как следствие, к проблеме при выборе терапии ВВК, увеличению длительности и стоимости лечения. Особенно серьезные проблемы в этом плане представляют штаммы Candida nоn-albicans, зачастую проявляющие более высокую устойчивость к традиционно используемым антимикотическим препаратам. Преобладание Candida albicans в этиологической структуре ВВК неоспоримо. Однако частота встречаемости указанных nоn-albicans видов Candida — C. krusei, C. glabrata, C. tropicalis, C. parapsilosis и др. как причины острого и хронического ВВК в последние годы заметно увеличивается. По данным ряда авторов, частота выделения nоn-albicans видов при ВВК составила: C. krusei — 5–19%, C. glabrata — 5,1–35,3%, C. parapsilosis — 14,2%, C. tropicalis — 0,4–12,9% [3–6]. В отдельных случаях отмечается, что до 55% возбудителей ВВК составили nоn-albicans виды [7]. C. krusei — редкая, но важная причина ВВК. В большинстве случаев патология, вызванная данным возбудителем, сопровождается рецидивирующими симптомами, с трудом поддающимися лечению. Исследователи указывают на тенденцию к данной инфекции у пожилых женщин, что, возможно, связано с повторными эпизодами ВВК, в связи с чем пациентки неоднократно получали курсовое лечение различными противогрибковыми средствами, преимущественно азолами, что привело к доминированию указанного возбудителя вследствие его резистентности к данным препаратам [8].
Орофарингеальный кандидоз, проявляющийся в виде воспаления слизистых оболочек полости рта, включая поверхность языка и губ, десны, небные миндалины и заднюю стенку глотки, — типичная локализация инфекции данной этиологии для иммунокомпрометированных лиц. По данным исследователей, в 2011 г. данная патология выявлена у 60 585 ВИЧ-инфицированных пациентов; причиной в 76,2–88,9% случаев является C. albicans [2, 9]. Опасность колонизации слизистых оболочек зева и носа определяется риском развития инвазивного кандидоза (ИК), который у ВИЧ-инфицированных лиц имеет тенденцию к острому генерализованному течению, сопровождающемуся летальностью.
По данным Глобального фонда по борьбе с грибковыми инфекциями (Global Action Fund for Fungal Infections, GAFFI), ежегодно ИК регистрируется у более 750 тыс. человек и является причиной летального исхода более 350 тыс. человек в мире [10]. При этом можно утверждать, что в настоящее время формируется тенденция к увеличению значимости в этиологической структуре ИК видов Candida non-albicans [11, 12]. Так, при оценке видовой структуры ИК [12] выявленная доля C. non-albicans как этиологического фактора — 70%, при этом 33% штаммов грибов были резистентны к флуконазолу или проявляли дозозависимую чувствительность.
Развитие резистентности к антимикотическим препаратам — закономерное явление, возникающее в процессе взаимодействия популяции грибов с противогрибковыми препаратами. Низкие показатели чувствительности изолятов C. albicans, выделенных от пациенток с ВВК, к флуконазолу обсуждаются в работе D. Marchaim et al.: только 32% штаммов проявляли чувствительность к данному антимикотику [13]. По данным других исследований, показатели чувствительности изолятов, выделенных из секрета влагалища, к флуконазолу составили 32,4%, к итроконазолу — 21,6%; 10,8% и 24,3% штаммов имели дозозависимую чувствительность к соответствующим антимикотикам [14].
По результатам российских исследований, к препаратам азолового ряда типичные патогены Candida spp. проявляют выраженную резистентность: от 52,1% штаммов
C. albicans, резистентных к клотримазолу, до 97,1% изолятов С. krusei, устойчивых к флуконазолу [5]. У представителей C. albicans наиболее часто резистентность фиксировалась к кетоконазолу и флуконазолу (76,9 и 82,2% штаммов соответственно).
С другой стороны, ряд исследователей подтверждает сохранение высокой чувствительности клинических изолятов Candida spp. к противогрибковым препаратам. Так, по данным Г.Р. Байрамовой, 97,7% штаммов C. albicans, выделенных при рецидивирующем ВВК, были чувствительны к наиболее часто используемым антимикотическим препаратам (итраконазолу, флуконазолу, кетоконазолу и миконазолу) [15]. Наряду с этим среди 34 штаммов C. non-albicans видов ко всем препаратам были чувствительны только 38,2%. Наименьший удельный вес чувствительных штаммов отмечен у С. glabrata и C. krusei (17,6% и 0% соответственно).
Аналогичные результаты получены при анализе данных международных и национальных проектов, изучавших формирование резистентности Candida spp. к азолам, проведенных в последние десятилетия [16], — чувствительность C. albicans к наиболее часто используемым азоловым антимикотикам установлена в диапазоне 90,2–94,4%. Отмечается, что одним из самых устойчивых к флуконазолу видов дрожжей был и остается C. krusei.
Цель исследования: изучить этиологическую структуру инфекций, вызываемых представителями Candida spp., по данным за 2017 г., проанализировать показатели чувствительности выделенных штаммов к наиболее часто используемым антимикотикам.
Содержание статьи
Материал и методы
Исследованы 9558 образцов биосубстратов у пациентов многопрофильных клиник (поликлиники и стационары) г. Перми. Изоляты Candida spp. были выделены из различных биологических материалов: отделяемое зева, носа, влагалища, цервикального канала, кал, отделяемое уха и др. Для видовой дифференциации Candida spp. использовали хромогенный агар (HiMedia Laboratories). Для оценки чувствительности выделенных штаммов грибов применяли диско-диффузионный метод. Посевы осуществляли на агар Сабуро (Россия). Использовали диски ДИ-ПЛС-50-01 (Россия), содержащие 80 ЕД нистатина, 40 мкг амфотерицина, 10 мкг клотримазола, 20 мкг кетоконазола и 40 мкг флуконазола. Инокулированные чашки с дисками инкубировали при температуре 25 °С±1 °С от 40 до 48 ч. Интерпретацию результатов осуществляли согласно инструкции производителя.
Результаты и обсуждение
Распределение частоты выделения различных представителей Candida spp. можно увидеть на рисунке 1. Наиболее значимым биоматериалом было отделяемое мочеполовых путей (МПП): влагалища, цервикального канала, уретры. Частота выделения представителей рода Candida из кала и отделяемого верхних дыхательных путей (ВДП) (слизь из зева, носа) была примерно одинаковой (15,1% и 15,9% соответственно).
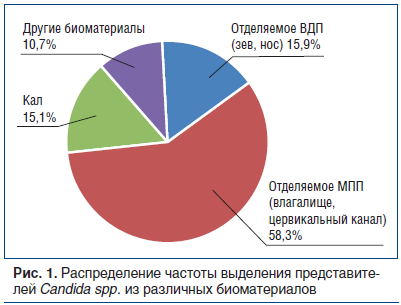
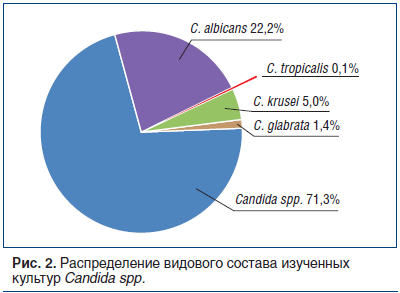
Важно отметить, что основная масса выделенных представителей рода Candida, вошедших в данное исследование, не была типирована до вида — 71,3%. Необходимость видовой идентификации возбудителя устанавливалась, с одной стороны, врачебными назначениями, с другой стороны — решением пациента; определяющим фактором во многих случаях становилась стоимость исследования. Среди типированных возбудителей ожидаемо преобладали изоляты
C. albicans (22,2%), C. tropicalis — наиболее редко встречаемый патоген — был выделен в 0,1% случаев (рис. 2).
Распределение нетипированных штаммов Candida spp. в зависимости от исследуемого биоматериала было следующим: в 70% случаев исследуемым материалом было отделяемое МПП, 16% — отделяемое ВДП, другие биоматериалы — 14%. При этом доля штаммов, не подвергшихся определению видовой принадлежности, выделенных из кала, чрезвычайно мала — 0,1%.
Видовое распределение выделенных штаммов в зависимости от биосубстрата представлено в таблице 1. При этом можно отметить тот факт, что взаимоотношения в тройке лидеров стабильны и не зависят от исследуемого биоматериала: на первом месте традиционно располагается C. albicans, далее С. krusei и C. glabrata. Безусловно, серьезной проблемой является отсутствие видовой идентификации Candida spp. при исследовании отделяемого ВДП и МПП (72,3–85,6%). Противоположная ситуация сложилась при выделении возбудителей рода Candida из кала — доля нетипированных штаммов составила всего 0,4%.
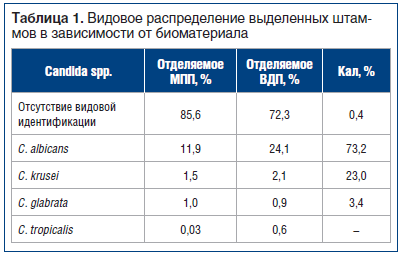
При оценке распределения указанных видов по частоте выделения среди идентифицированных возбудителей установлено, что доля C. albicans, изолированных из кала, составила 73,5%, из отделяемого МПП — 82,8%, ВДП — 86,9%. В группе Candida non-albicans лидировал вид С. krusei: 23,1% изолятов, выделенных из кала; 10,1% — из отделяемого МПП и 7,7% — из отделяемого ВДП. C. glabrata выделены в 3,4%, 6,8% и 3,2% случаев соответственно. Редко встречаемый вид C. tropicalis был выделен в 0,2% случаев из отделяемого МПП и в 2,3% случаев из отделяемого ВДП.
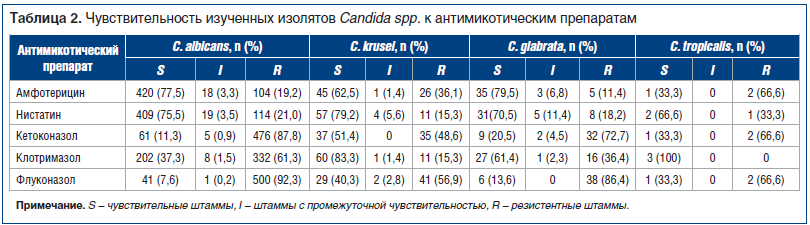
У большинства типированных возбудителей была определена чувствительность к наиболее часто используемым антимикотикам. Исключение составили изоляты, полученные из кала: из 765 штаммов чувствительность к антимикотикам была изучена лишь у 8. Усредненные данные о чувствительности отдельных видов Candida spp. представлены в таблице 2. У представителей C. albicans наиболее часто резистентность фиксировалась к кетоконазолу и флуконазолу: 83,3–100,0% штаммов, выделенных из различного биоматериала. Наиболее чувствительны представители данного вида к нистатину (50,0–77,1% изолятов) и амфотерицину (33,3–78,5%). Чувствительность к клотримазолу варьирует, однако можно отметить наиболее низкие показатели резистентности к данному препарату выделенных штаммов С. krusei — второго по частоте встречаемости патогена (5,9–19%), что имеет особое практическое значение в лечении поверхностных форм кандидоза, например ВВК, вызванного устойчивыми штаммами данного представителя Candida nоn-albicans. При этом выделенные изоляты С. krusei имели высокие показатели резистентности к флуконазолу и кетоконазолу: 52,9–75,0% и 30,8–75,0% штаммов соответственно. Помимо высокой чувствительности к клотримазолу (до 94,1% штаммов) данные изоляты проявляли чувствительность к нистатину (до 82,4%).
Профиль чувствительности изученных изолятов C. glabrata близок к таковому описанных представителей C. albicans: доля штаммов, чувствительных к амфотерицину, составила 83,0–85,7%, к нистатину — 66,7–85,7% штаммов. К клотримазолу были чувствительны 42,9–56,7% штаммов, полученных из отделяемого МПП и ВДП, и до 100% штаммов, выделенных из других биологических материалов. Максимальное количество резистентных штаммов выявлено по отношению к флуконазолу (57,1–100,0%) и кетоконазолу (76,7–85,7%).
Анализируя чувствительность изученных изолятов Candida nоn-albicans (табл. 2), можно прийти к выводу, что наиболее высокие показатели чувствительности к амфотерицину наблюдаются у штаммов C. glabrata и к клотримазолу у С. krusei и C. tropicalis.
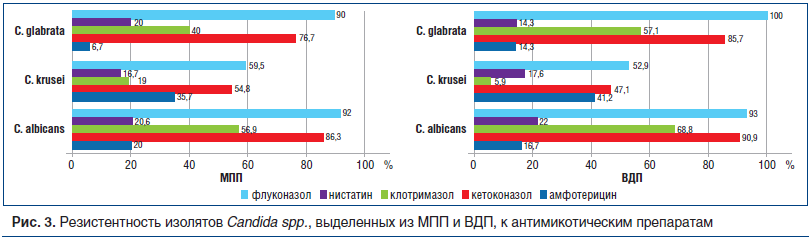
Данные о резистентности штаммов, выделенных из МПП и ВДП, представлены на рисунке 3. При анализе резистентности выделенных штаммов можно отметить, что из ВДП выделены изоляты C. albicans и C. glabrata в целом, обладающие несколько более высокой устойчивостью к изученным антимикотикам, в то время как из МПП получены более устойчивые изоляты С. krusei.
С практической точки зрения нарушение микробиоценоза МПП у женщин в первую очередь отражается на вульвовагинальной зоне и приводит к росту альтернативной микрофлоры. Особенно это касается грибов рода Candida spp., о чем может свидетельствовать появление вагинального зуда. В связи с этим является целесообразным включение в терапию для профилактического или лечебного применения антимикотиков, в частности препарата Клотримазол 2% крем вагинальный («Эспарма ГмбХ», Германия). Аппликации проводятся перед сном в положении лежа на спине, со слегка согнутыми ногами, препарат (около 5 г) следует вводить во влагалище с помощью входящих в комплект одноразовых аппликаторов, что делает применение крема более комфортным и предотвращает возможность реинфицирования.
Выводы
Таким образом, среди типированных возбудителей выявлено преобладание C. albicans независимо от биологического материала. Установлено наличие высокой устойчивости выделенных изолятов к наиболее часто применяемым производным имидазола и триазола. При этом у большинства штаммов C. nоn-albicans сохраняется чувствительность к клотримазолу (например, Клотримазол 2% крем вагинальный, «Эспарма ГмбХ», Германия), что особенно важно при лечении поверхностных форм кандидоза.
Выявлена высокая частота выделения штаммов, не подвергшихся видовой идентификации и, как следствие, определению чувствительности к противогрибковым препаратам, что вызывает особую тревогу вследствие использования эмпирического лечения, которое может способствовать развитию резистентности изолятов. Помимо этого, данный подход существенно затруднит изучение эпидемиологических показателей распространенности кандидоза.
Информация с rmj.ru





