Введение
Вирус папилломы человека (ВПЧ) является возбудителем одной из наиболее распространенных инфекций, передаваемых половым путем, среди молодых женщин. Персистенция папилломавирусной инфекции (ПВИ) с экспрессией генов онкобелков вызывает изменения многослойного плоского эпителия, что является непосредственной причиной развития рака шейки матки, а также некоторых видов рака влагалища и вульвы, ануса, головы и шеи [1].
Распространенность рака шейки матки в 2020 г. в мире составила 604 127 случаев, став причиной 341 831 смерти, стандартизованная по возрасту заболеваемость составила 13,3 случая, а смертность — 7,2 случая на 100 000 женщин [2]. В России в структуре злокачественных новообразований рак шейки матки составляет 4,6% [3].
Изменения шейки матки, обусловленные персистенцией ПВИ, возникают в переходной зоне, области стыка многослойного плоского и цилиндрического эпителия. При плоскоклеточном интраэпителиальном поражении низкой степени (LSIL) отмечается активная репликация ВПЧ при незначительных изменениях эпителиальных клеток, в случае же плоскоклеточного интраэпителиального поражения высокой степени (HSIL) интенсивность репликации ВПЧ снижается, повышается экспрессия генов онкобелков ВПЧ (E6/E7), что сопровождается нарушением клеточного цикла и процессов пролиферации, дифференцировки и апоптоза инфицированных клеток [4, 5].
Длительной персистенции ПВИ способствует локальная иммуносупрессия, вызываемая ВПЧ. Так, ВПЧ оказывает влияние на паттернраспознающие рецепторы (PRR) антигенпрезентирующих клеток и связанные с ними пути передачи сигнала, нарушая распознавание вируса иммунной системой и ингибируя синтез интерферона (ИФН) [6]. Онкобелок Е5 может напрямую подавлять передачу сигнала от рецепторов ИФН в ядра инфицированных клеток. Кроме того, ВПЧ влияет на миграцию, созревание и дифференцировку дендритных клеток: онкобелок Е2 препятствует их миграции, а Е6 — их функционированию. Персистенции ПВИ также способствует нарушение ответа Т-хелперов с последующим истощением субпопуляции CD8+ Т-лимфоцитов [7–10].
Онкобелки E6/E7 повышают экспрессию интерлейкина (ИЛ) 6 в кератиноцитах, подавляя экспрессию белка р53 — естественного супрессора промотора ИЛ-6, способствуя развитию воспалительной реакции и прогрессии плоскоклеточного интраэпителиального поражения. Онкобелки Е5, Е6 и Е7 способны активировать сигнальные пути транскрипционного фактора κB (NF-κB), повышая активность циклооксигеназы 2 (ЦОГ-2) и поддерживая хроническое воспаление. Кроме того, онкобелки ВПЧ активируют транскрипционный фактор АР-1 (активирующий протеин 1), участвующий в гиперпродукции ЦОГ-2. Данный процесс сопровождается продукцией простагландина Е2, который оказывает потенциально неблагоприятные эффекты на эпителий шейки матки — стимулирует пролиферацию, ангиогенез и ингибирует апоптоз [11, 12]. Хроническое воспаление ассоциировано с повышением уровня оксида азота (NO) и индуцируемой синтазы NO. Показано, что в клетках, инфицированных ВПЧ, NO может вызывать повреждения ДНК и снижение уровня экспрессии генов белков-супрессоров опухолевого роста р53 и pRb (белок ретинобластомы) [13]. Следовательно, помимо хронического воспаления, в прогрессировании плоскоклеточного поражения при ПВИ может играть роль оксидативный стресс (ОС).
Во-первых, онкобелки ВПЧ индуцируют ОС, вызывающий перекисное окисление липидов и повреждение клеток. Во-вторых, ОС, вызванный экзогенными факторами (курение; инфекции, передаваемые половым путем; коинфекция), облегчает интеграцию вирусного генома в геном хозяина — активные формы кислорода, наряду с NO, вызывают двуцепочечные разрывы ДНК хозяина, обеспечивая тем самым сайты интеграции вирусного генома [14]. В дальнейшем онкобелки Е6 и Е7 поддерживают образование активных форм кислорода и азота путем активации НАДФН-оксидазы, стимулируя транслокацию регуляторных субъединиц НАДФН-оксидазы к мембране клеток с формированием активных комплексов [15]. Накопление индуцированных НАДФН-оксидазной активностью повреждений ДНК приводит к формированию мультимерных комплексов (инфламмасом) и еще большему повышению уровня провоспалительных цитокинов (ИЛ-1β, ИЛ-1α, ИЛ-18), которые способствуют формированию хромосомных аберраций и эпигенетических изменений ДНК, приводящих к злокачественной трансформации клеток [16].
Учитывая патогенетические особенности прогрессирования ВПЧ-ассоциированных плоскоклеточных интраэпителиальных поражений шейки матки, а именно локальную иммуносупрессию, провоспалительное микроокружение и ОС, можно ожидать, что перспективным будет применение активированной глицирризиновой кислоты (ГК, Эпиген Интим спрей 0,1%) при ВПЧ-ассоциированной патологии шейки матки, так как этот препарат обладает противовирусным, противовоспалительным и иммуностимулирующим действием1.
Внутриклеточно противовирусное действие ГК реализуется путем ее ингибирующего действия в отношении протеинкиназы С и казеинкиназы II, участвующих в фосфорилировании вирусных белков [17]. На уровне транскрипции ГК способна ингибировать транскрипционные факторы АР-1 и NF-κB, а на уровне трансляции — снижать уровень экспрессии неструктурного вирусного белка Nsp2, препятствуя не только репликации вирусов, но и сборке готовых вирусных частиц [18].
Иммуностимулирующее действие ГК проявляется повышением числа и активности Т-лимфоцитов, уровня экспрессии маркеров созревания дендритных клеток, усилением синтеза γ-ИФН, ИЛ-4 и ИЛ-2, недостаток которых отмечается при ПВИ. ГК стимулирует иммунный ответ Тh1-типа, дисфункция которого имеет место при персистенции ПВИ [19, 20].
Противовоспалительное действие ГК сопряжено с антиоксидантным действием и характеризуется подавлением продукции фактора некроза опухоли α, провоспалительных цитокинов (ИЛ-1, ИЛ-6) [18]. ГК ингибирует деградацию ингибитора κB (IκB) и последующую транслокацию NF-κB в ядро, в результате угнетается синтез провоспалительных цитокинов и молекул межклеточной адгезии [21]. ГК ингибирует сигнальные пути, участвующие в воспалительной реакции (MAPK/ERK) [12]; она способна блокировать ЦОГ-2, тем самым снижая синтез простагландина E2, а также ингибировать воспаление, опосредованное амфотерином [22]. ГК активирует сигнальный путь редокс-чувствительного фактора транскрипции Nrf2 через связывание с активным центром белка Keap1, что приводит к снижению внутриклеточного уровня активных форм кислорода [18].
Антипролиферативное действие ГК опосредуется снижением экспрессии генов белков, ответственных за инициацию деления клеток (циклин-зависимой киназы 4, циклина D1), повышением экспрессии белка р21, ингибирующего клеточный цикл, и белка-супрессора опухолевого роста р53, что приводит к остановке клеточного цикла избыточно пролиферирующих клеток [23]. В экспериментальном исследовании на культуре клеток аденокарциномы шейки матки линии Hela было показано, что антипролиферативное действие ГК усиливается эстрадиолом (в концентрации 1 мкМ) и ослабляется тестостероном (в концентрации 1 мкМ и 10 мкМ) [24]. У женщин репродуктивного возраста (фолликулярная фаза менструального цикла) концентрации эстрадиола в сыворотке крови равны 228–400 пмоль/л, свободного тестостерона — 0,5–2,5 нмоль/л, при этом в зоне трансформации многослойного плоского эпителия шейки матки отмечается высокая экспрессия генов рецепторов стероидных гормонов [25, 26]. На основании полученных данных можно предположить, что наибольшую эффективность от применения препарата ГК следует ожидать у женщин репродуктивного возраста при нормальных уровнях половых стероидных гормонов, а у пациенток с гиперандрогенными состояниями эффект может быть менее выраженным.
Цель исследования: оценить эффективность препарата активированной ГК у пациенток с ВПЧ-ассоциированной патологией шейки матки с учетом уровня половых стероидных и гонадотропных пептидных гормонов.
Материал и методы
Дизайн исследования: проспективное наблюдательное исследование с участием 51 пациентки с ВПЧ-ассоциированной патологией шейки матки (ASCUS, LSIL, HSIL по классификации Бетесда). База проведения исследования: гинекологическое отделение ГКБ № 1 имени Н.И. Пирогова.
Критерии включения в исследование: женщины от 18 до 45 лет включительно, наличие ВПЧ-ассоциированной патологии шейки матки согласно цитологическому заключению (ASCUS — атипические клетки плоского эпителия неясного значения, LSIL, HSIL по системе Бетесда (2014)), отсутствие вакцинации против ВПЧ в анамнезе, отсутствие клинических признаков гиперандрогении (вирилизация, андроген-зависимая дермопатия (акне, гирсутизм, алопеция), желание пациентки участвовать в исследовании и наличие информированного письменного согласия.
Критерии невключения: известная непереносимость препарата Эпиген Интим спрей 0,1%, клинические и/или лабораторные признаки гиперандрогении (вирилизация, андроген-зависимая дермопатия (акне, гирсутизм, алопеция), уровень общего тестостерона свыше 1,72 нммоль/л), тяжелые сопутствующие заболевания, делающие невозможным выполнение процедур протокола; злокачественные новообразования внутренних и наружных половых органов на момент исследования и в течение последних 5 лет до начала исследования в анамнезе; участие в других клинических исследованиях в течение 3 мес. до включения в исследование, неспособность следовать процедурам протокола исследования, а также любые другие сопутствующие медицинские или серьезные психические состояния, которые делают пациентку непригодной для участия в исследовании или ограничивают правомерность получения информированного согласия.
Критерии преждевременного завершения исследования: появление у пациентки вышеперечисленных критериев невключения во время проведения исследования, желание пациентки прекратить участие в исследовании, медицинские показания (например, хирургическая операция), отмена препарата Эпиген Интим спрей 0,1% лечащим врачом (с указанием причины отмены), выявленная в ходе исследования некомплаентность, нарушение пациенткой протокола исследования.
Обследование женщин включало сбор анамнеза, гинекологический осмотр, кольпоскопическое исследование, микроскопическое исследование вагинального отделяемого, цитологическое исследование эпителия шейки матки, ВПЧ-ПАП-тест жидкостный с определением коэкспрессии онкобелков p16/Ki67 эпителия шейки матки (далее — ВПЧ-ПАП-тест), оценку гормонального статуса (лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), эстрадиол, прогестерон, тестостерон общий в сыворотке крови) однократно на 2–4-й день менструального цикла.
Кольпоскопическое исследование проводили с использованием кольпоскопа Karl Kaps GmbH & Co, Germany с 7–15–30-кратным увеличением. Слизистую шейки матки исследовали без обработки и после нанесения 3% раствора уксусной кислоты и затем 2% водного раствора Люголя (проба Шиллера). При кольпоскопии намечали участки прицельного забора материала для последующей биопсии при наличии показаний. Кольпоскопическое заключение формулировали в соответствии с Международной классификацией кольпоскопических терминов, одобренной IFCPC (International Federation of Cervical Pathology and Colposcopy — Международная федерация патологии шейки матки и кольпоскопии).
Забор материала для ВПЧ-ПАП-теста выполняли цитощеткой Rovers Cervex-Brush Combi в контейнер с транспортной средой для жидкостной цитологии. Исследование выполняли на базе ФБУН ЦНИИ Эпидемио-логии Роспотребнадзора. Результаты цитологического исследования оценивали согласно системе Бетесда. Вирусная нагрузка ранжировалась следующим образом: <3 lg/105 клеток — клинически малозначимая, 3–5 lg/105 клеток — клинически значимая, >5 lg/105 — высокая вирусная нагрузка.
Все пациентки получали препарат Эпиген Интим спрей 0,1% 3 р/сут в течение 30 дней с момента включения в исследование. При наличии показаний (HSIL / цервикальная интраэпителиальная неоплазия III степени (CIN III)) выполняли конизацию шейки матки. Оценку эффективности лечения проводили через 90±7 дней после начала терапии на основании динамики результатов ВПЧ-ПАП-теста. Дополнительно оценивали динамику кольпоскопической картины. Контроль безопасности и переносимости препарата проводили на протяжении всего периода его использования. Пациенток информировали о необходимости явиться на незапланированный визит в случае нежелательной реакции, на повторном визите в ходе сбора жалоб также уточнялись данные о переносимости препарата.
Этические нормы и правила. Исследование выполнено в соответствии с принципами Хельсинкской декларации Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека», правилами надлежащей клинической практики (ICH GCP), действующими порядками и стандартами оказания медицинской помощи и другими регуляторными требованиями, применимыми к проведению клинических исследований и наблюдательных программ в Российской Федерации. Исследование одобрено локальным этическим комитетом ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (протокол № 214 от 24 января 2022 г.). Пациентки, включенные в исследование, подписали информированное согласие на участие в исследовании до начала любых процедур, связанных с исследованием.
Статистический анализ. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводили с использованием программы IBM SPSS Statistics v.26 (разработчик — IBM Corporation). Категориальные данные описывали с указанием абсолютных значений и процентных долей. Гипотезу о нормальности распределения проверяли по одновыборочному критерию Колмогорова — Смирнова. В случае нормального распределения количественные показатели представляли как среднее значение (M) и стандартное отклонение (SD), при ненормальном — как медиану (Me) и нижний и верхний квартиль [Q1; Q3]. При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовали критерий Уилкоксона. Сравнение бинарных показателей, характеризующих две связанные совокупности, выполнялось с помощью теста МакНемара. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Медиана возраста обследованных пациенток составила 36 [30; 39] лет, медиана индекса массы тела — 22,31 [20,32; 24,24] кг/м2. Гормональный статус на момент включения в исследование: медиана эстрадиола 38 [33; 44] пг/мл, ЛГ — 4,6 [4,2; 4,8] мМЕ/мл, ФСГ — 4,8 [4,6; 5,2] мМЕ/мл, тестостерона общего — 0,8 [0,6; 0,8] нмоль/л, средний уровень прогестерона 1,3±0,5 нмоль/л, что соответствовало нормальным показателям половых стероидных гормонов у женщин с учетом возраста и фазы менструального цикла. Уровни половых стероидных и гонадотропных пептидных гормонов в подгруппах пациенток в зависимости от результатов цитологического заключения представлены в таблице. Отмечена тенденция к снижению уровня эстрадиола в подгруппе пациенток с HSIL (p=0,453).
![Таблица. Уровни половых стероидных и гонадотропных пептидных гормонов в подгруппах пациенток в зависимости от результатов цитологического заключения, Me [Q1; Q3] Table. Levels of sex steroid and gonadotropin-releasing hormones in subgroups of female patie Таблица. Уровни половых стероидных и гонадотропных пептидных гормонов в подгруппах пациенток в зависимости от результатов цитологического заключения, Me [Q1; Q3] Table. Levels of sex steroid and gonadotropin-releasing hormones in subgroups of female patie](https://medblog.su/wp-content/uploads/2024/06/Otsenka-effektivnosti-primeneniya-aktivirovannoj-glitsirrizinovoj-kisloty-u-patsientok-s-VPCH-assotsiirovannymi.png)
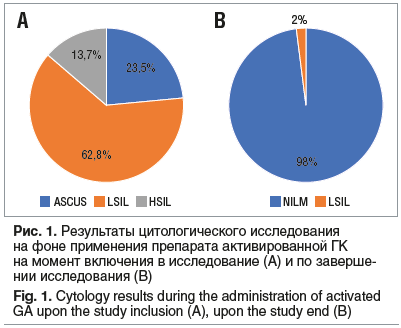
Согласно результатам цитологического исследования эпителия шейки матки у 12 (23,5%) пациенток диагностирован ASCUS, у 32 (62,8%) — LSIL, у 7 (13,7%) — HSIL. У 18 (35,3%) пациенток отмечена высокая, клинически значимая вирусная нагрузка ВПЧ высокого риска (ВПЧ-ВР). У 7 (13,7%) пациенток обнаружено два и более штаммов ВПЧ. Коэкспрессия онкобелков p16/Ki67 обнаружена у 7 (13,7%) пациенток, из них гистологическое подтверждение тяжелой дисплазии (CIN III) получено в 5 (71,4%) случаях.
По результатам микроскопического исследования вагинального отделяемого у 7 (13,7%) пациенток обнаружены признаки кандидозного вульвовагинита, у 6 (11,8%) — бактериального вагиноза, у остальных 38 (74,5%) пациенток патологии не выявлено.
По результатам кольпоскопического заключения сопутствующий кондиломатоз половых органов (шейка матки, влагалище и/или вульва) установлен у 18 (35,3%) пациенток, признаки хронического цервицита — у 30 (58,8%), эктопия/эктропион — у 22 (43,1%), лейкоплакия шейки матки и/или вульвы — у 32 (62,7%).
Через 90 дней от начала наблюдения по результатам цитологического исследования эпителия шейки матки у 50 (98,0%) пациенток установлено отсутствие интраэпителиального поражения шейки матки (NILM) с отсутствием коэкспрессии онкобелков p16/Ki67, у 1 (2,0%) пациентки (уровень эстрадиола 38 пг/мл) — LSIL с коэкспрессией онкобелков p16/Ki67 в единичных клетках плоского эпителия на фоне снижения вирусной нагрузки (рис. 1, 2). Данной пациентке рекомендована конизация шейки матки.
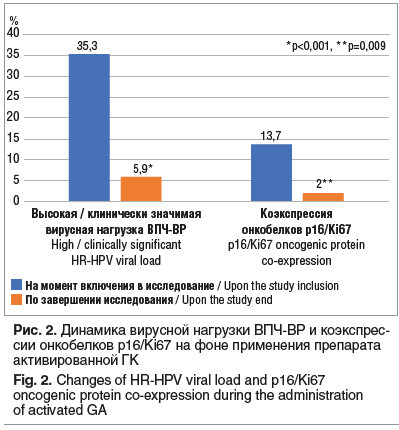
У 48 (94,1%) пациенток не выявлено ДНК ВПЧ-ВР, у 1 (2,0%) — сохранялась высокая вирусная нагрузка, у 2 (3,9%) — клинически значимая вирусная нагрузка (p<0,001) (см. рис. 2).
По результатам кольпоскопического заключения сопутствующий кондиломатоз половых органов обнаружен у 1 (2,0%) пациентки (p<0,001), признаки хронического цервицита — у 5 (9,8%) (p<0,001).
В ходе настоящего исследования было установлено, что уровень эстрадиола в подгруппе HSIL был ниже по сравнению с подгруппами ASCUS и LSIL, что может указывать на то, что более низкий уровень эстрадиола коррелирует с тяжестью плоскоклеточного интраэпителиального поражения шейки матки. Для уточнения данной гипотезы необходимы дальнейшие исследования.
В связи с ранее полученными экспериментальными данными относительно влияния уровня половых стероидных гормонов на антипролиферативное действие ГК [24] в настоящее исследование не включали пациенток с клиническими и/или лабораторными признаками гиперандрогении. Данный подход может обусловливать достигнутую высокую клиническую эффективность лечения ВПЧ-ассоциированной патологии шейки матки: эффективность по результатам цитологического исследования составила 98,5%, эффективность в снижении вирусной нагрузки ВПЧ-ВР — 83,3%, по показателю коэкспрессии онкобелков р16/Ki67 (в сочетании с конизацией шейки матки при наличии показаний) — 85,7%.
Отмечена хорошая переносимость препарата Эпиген Интим спрей 0,1%. Нежелательных явлений в ходе исследования не зарегистрировано.
В проведенных ранее исследованиях без учета гормонального статуса пациенток эффективность применения препарата Эпиген Интим спрей 0,1% при ВПЧ-ассоциированной патологии шейки матки составила: по результатам цитологического исследования 62,5–93,3%, по снижению вирусной нагрузки ВПЧ-ВР 46,7–88% [27–29].
Оценка влияния препарата активированной ГК на уровень коэкспрессии онкобелков р16/Ki67 выполнена впервые. Патогенетическим обоснованием проведения данной работы послужили продемонстрированные ранее изменения на уровне протеома, липидома и оксидативного статуса цервикальной зоны [27, 28, 30]. Так, на фоне применения активированной ГК методом электронного парамагнитного резонанса выявлено значимое снижение интенсивности сигналов пероксидрадикалов (LOO-), супероксидрадикалов (О2-) при одновременном повышении активности кислой фосфатазы на 54,4±5,9% (p<0,01), миелопероксидазы на 63,9±6,4% (р<0,01) и неспецифической эстеразы более чем в 2 раза (p<0,001) [27]. На уровне протеома цервико-вагинальной жидкости применение активированной ГК привело к снижению уровня провоспалительных белков (компонент C3 системы комплемента, α1-кислотный гликопротеин 1, богатый лейцином α2-гликопротеин, протеинкиназа М-дзета, α1-антитрипсин), увеличению уровня белков, участвующих в иммунном ответе (тиредоксин, протектин, эластаза нейтрофилов) [28]. На уровне липидома цервико-вагинальной жидкости на фоне применения активированной ГК выявлены изменения в метаболизме сфинголипидов, глицерофосфолипидов и церамидов, что ассоциировано с улучшением цитологической картины [30].
Ограничением данного исследования является малое число наблюдений, особенно пациенток с цитологическим заключением о наличии HSIL.
Выводы
-
При оценке уровня половых стероидных и гонадотропных пептидных гормонов у пациенток с ВПЧ-ассоциированными поражениями шейки матки было установлено, что уровень эстрадиола у пациенток с HSIL ниже по сравнению с пациентками с ASCUS и LSIL (32 [32,0; 36,0] пг/мл против 40 [34,5; 45,5] и 40 [33,0; 44,0] пг/мл соответственно). Для уточнения взаимосвязи уровня эстрадиола и результатов цитологического заключения необходимы дальнейшие исследования с бóльшим числом наблюдений.
-
Применение препарата активированной ГК у пациенток репродуктивного возраста с ВПЧ-ассоциированными поражениями шейки матки без клинических и/или лабораторных признаков гиперандрогении позволило достичь высоких показателей эффективности: эффективность по результатам цитологического исследования составила 98,5%, эффективность в снижении вирусной нагрузки ВПЧ-ВР — 83,3%, по показателю коэкспрессии онкобелков р16/Ki67 — 85,7%.
1Инструкция по медицинскому применению препарата Эпиген Интим. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4cbb4446-774f-40fe-a33b-c799d0819a40 (дата обращения: 24.04.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Мандрыкина Жанна Анатольевна — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-5702-3412.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Ибрагимова Динара Мурадовна — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-5350-7409.
Казиева Милана Давудова — старший лаборант кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Филимонова Марианна Сергеевна — аспирант кафедры молекулярной фармакологии и радиобиологии им. академика П.В. Сергеева медико-биологического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Шимановский Николай Львович — д.м.н., профессор, член-корр. РАН, заведующий кафедрой молекулярной фармакологии и радиобиологии им. академика П.В. Сергеева медико-биологического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-8887-4420.
Ахметгалиев Артур Ринатович — к.м.н., ассистент кафедры акушерства и гинекологии им. проф. В.С. Груздева ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 49.
Контактная информация: Филимонова Марианна Сергеевна, e-mail: 1622840@mail.ru.
Источники финансирования: лабораторное исследование ВПЧ-ПАП-тест жидкостный с определением коэкспрессии онкобелков p16/Ki67 эпителия шейки матки выполнялось на базе ФБУН ЦНИИ Эпидемиологии Роспотребнадзора при финансовой поддержке ООО «ИНВАР».
Конфликт интересов отсутствует.
Статья поступила 23.03.2024.
Поступила после рецензирования 16.04.2024.
Принята в печать 30.04.2024.
ABOUT THE AUTHORS:
Zhanna A. Mandrykina — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5702-3412.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-7830-2290.
Dinara M. Ibragimova — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-5350-7409.
Milana D. Kazieva — Senior Assistant at the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation.
Marianna S. Filimonova — postgraduate student of the Department of Molecular Pharmacology and Radiobiology
named after Academician P.V. Sergeev, Faculty of Medicine and Biology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation.
Nikolay L. Shimanovsky — Dr. Sc. (Med.), Professor, corresponding member of the Russian Academy of Sciences, Head of the Department of Molecular Pharmacology and Radiobiology named after Academician P.V. Sergeev, Faculty of Medicine and Biology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-8887-4420.
Artur R. Akhmetgaliev — C. Sc. (Med.), Assistant Professor of the Department of Obstetrics and Gynecology named after Professor V.S. Gruzdev, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation.
Contact information: Marianna S. Filimonova, e-mail: 1622840@mail.ru.
Financial Disclosure: the laboratory study of liquid-based HPV-PAP test with the determination of the p16/Ki67 oncogenic protein co-expression in the cervical epithelium was performed on the basis of the Central Research Institute of Epidemiology of Federal Service for the Oversight of Consumer Protection and Welfare (Rospotrebnadzor) supported by INVAR LLC.
There is no conflict of interest.
Received 23.03.2024.
Revised 16.04.2024.
Accepted 30.04.2024.
Информация с rmj.ru



