Введение
Пандемия новой коронавирусной инфекции (COVID-19) была объявлена ВОЗ 11 марта 2020 г. Ограничительные меры, развернутые с целью сокращения социальных контактов, широкое использование средств индивидуальной защиты, массовое обследование для выявления бессимптомных носителей SARS-CoV-2, развернутое во многих странах, в том числе и в Российской Федерации, позволили существенно снизить темпы распространения инфекции в первом году пандемии [1]. Достаточно быстро стало очевидным, что данные меры не только оказали положительное влияние на распространение SARS-CoV-2, но и значительно снизили циркуляцию других респираторных вирусов. Наиболее существенным явилось сокращение числа случаев гриппа и респираторно-синцитиальной вирусной инфекции с марта 2020 г. как в Северном, так и в Южном полушарии.
Содержание статьи
Респираторно-синцитиальная инфекция в период пандемии COVID-19
Респираторно-синцитиальный вирус (РСВ) является наиболее частой причиной острых инфекций нижних дыхательных путей в педиатрической популяции: почти 33,8 млн случаев среди детей в возрасте до 5 лет во всем мире, из которых более 3 млн (10%) требуют госпитализаций, а от 66 тыс. до 199 тыс. случаев заканчиваются летальным исходом. Из общего числа госпитализированных по поводу РСВ-инфекции более 40% составляют младенцы младше 2 мес.., а 99% смертей происходят в развивающихся странах [2]. Однако РСВ является не только педиатрической проблемой, но и причиной заболеваемости и смертности среди пожилых людей (>65 лет) и пациентов с ослабленным иммунитетом [3].
Респираторно-синцитиальный вирус представляет собой оболочечный одноцепочечный РНК-вирус семейства Pneumoviridae, геном которого кодирует 11 белков, при этом внешние гликопротеины G и F являются основными вирусными антигенами [4]. В Северном полушарии сезон РСВ-инфекции начинается в ноябре и заканчивается в марте с пиками в январе и феврале, а в Южном полушарии он длится с июня по сентябрь. Эпидемические подъемы заболеваемости РСВ-инфекцией обусловлены сложным взаимодействием между климатом, вирусом и хозяином. Низкие температуры стабилизируют липидную оболочку РСВ, высокая влажность способствует осаждению тяжелых капель на поверхности и сохранению жизнеспособности вируса, а длительное пребывание в помещениях больших коллективов людей облегчает передачу РСВ [5, 6]. Факторами, способствующими ежегодным вспышкам РСВ-инфекции, является всеобщая восприимчивость, а также циркуляция в когортах наиболее восприимчивых лиц, что обеспечивает сохранение вируса в межсезонье.. Так, низкие концентрации РСВ могут выявляться в течение всего года у взрослых с хронической обструктивной болезнью легких (ХОБЛ) [7]. РСВ выявлялся в течение всего года также у детей с иммунодефицитными состояниями [8]. Эти резервуары РСВ обеспечивают непрерывную, низкоуровневую и бессимптомную репликацию вируса, которая при благоприятных климатических факторах вызывает местные эпидемии.. Одновременное выделение различных штаммов РСВ в отдаленных географических областях подтверждает гипотезу о том, что эпидемии обусловлены локально распространяющимися вариантами вируса, а не распространением одного вида между смежными районами [9].
Известно, что почти все дети переносят первую и наиболее тяжелую РСВ-инфекцию в возрасте до 2 лет, а в более позднем возрасте переносят заболевание в более легкой форме [10]. Основной причиной, объясняющей повторное инфицирование РСВ, является слабый и непродолжительный иммунный ответ: у младенцев иммунная система все еще развивается, а незрелость врожденного ответа может привести к недостаточному адаптивному ответу и неполноценной иммунологической памяти [11]. Наличие материнских антител IgG к РСВ у новорожденных и младенцев может быть очень важным фактором, но их роль все еще остается спорной. Присутствие антител IgG к РСВ у младенцев может влиять на вирус-индуцированную иммуногенность, но, с другой стороны, трансплацентарный перенос защитных материнских антител может помочь предотвратить тяжелые заболевания у младенцев [12, 13].
Пандемия COVID-19 в Северном полушарии совпала с пиком эпидемии респираторных инфекций, вызванных вирусами гриппа и РСВ.. В Северном полушарии введение ограничений с марта 2020 г. совпало с резким сокращением числа случаев инфицирования РСВ. Сообщения из Италии, Финляндии, Бельгии, Великобритании и США свидетельствовали о внезапном и более раннем завершении сезона эпидемии РСВ, начиная с марта 2020 г., по сравнению с предыдущими годами, в последующие месяцы случаев заболевания почти не было. В Южном полушарии ограничительные меры, связанные с пандемией COVID-19, применялись незадолго до зимы и сохранялись в течение разных периодов в соответствии с распространением SARS-CoV-2. Полное отсутствие случаев заболевания РСВ зимой 2020 г. (май — август) наблюдалось в Бразилии, Австралии, и даже после ослабления ограничений случаи РСВ-инфекции в этих странах не регистрировали до конца августа 2020 г..
Разумно предположить, что ограничительные меры, принятые для уменьшения распространения SARS-CoV-2, повлияли на другие респираторные вирусы со схожими путями заражения. Основными вмешательствами на глобальном уровне были изоляция дома, социальное дистанцирование, а также гигиена рук и обязательное ношение масок для лица.. Все эти мероприятия способствуют снижению передачи РСВ аэрозольным путем, а также контактным — через грязные руки и предметы обихода.. Как в Европе, так и в Австралии было выявлено лишь несколько случаев инфицирования РСВ даже после отмены ограничительных мер, когда сохранялись только требования к социальному дистанцированию, мытью рук и обязательному ношению масок для лица. Роль закрытия школ в снижении частоты респираторных инфекций противоречива. Данные из США, где ведется активный контроль распространения РСВ, показали, что открытие школ не было связано с увеличением числа инфицированных РСВ [14, 15]. Аналогичные данные поступили из Финляндии, где уровень РСВ-инфекции оставался низким даже после открытия школ и детских садов весной 2020 г. Объяснение этого явления могло заключаться в том, что даже когда дети возвращались в школу, гигиена рук и социальное дистанцирование сохранялись.. Кроме того, детям с легкими респираторными симптомами (например, ринитом) было запрещено посещать школу, что снижало возможную циркуляцию вирусов, отличных от SARS-CoV-2. Более того, в отличие от риновируса, здоровые дети школьного возраста не являются основным резервуаром РСВ, обнаруживаемого круглый год только у взрослых с ХОБЛ или у детей с иммунодефицитом [16, 17]. Среди других факторов, способствующих снижению частоты выявления РСВ, может быть вирусная интерференция, описанная ранее при взаимодействии между вирусом гриппа и другими респираторными вирусами, и аналогичный процесс мог произойти между SARS-CoV-2 и РСВ [18]. Эта гипотеза подтверждается низким уровнем коинфекции SARS-CoV-2 и другими респираторными вирусами [19]. В отсутствие эпидемий крайне важно оценить, распространяется ли РСВ между бессимптомными резервуарами. Аналогичное снижение инфицирования было обнаружено и для вируса гриппа, что подтверждает, что ограничительные меры повлияли на респираторные вирусы с аналогичными путями заражения. Риновирус, однако, подвергался меньшему влиянию ограничений, и в последнее время сообщалось о росте его выявляемости в разных странах, что может быть, в частности, обусловлено безоболочечной структурой вируса, которая не изменяется при мытье рук, и наличием резервуаров среди детей.
Данные о распространенности РСВ в 2020–2021 гг. в Российской Федерации в целом совпадают с динамикой в других странах Старого и Нового Света (рис.. 1). В период ежегодного сезонного подъема заболеваемости ОРВИ доля РСВ варьировала от 3% до 6,2%. Введение локдауна 25.03.2020 совпало с сезонным снижением заболеваемости РСВ. Последующие 1,5 года наблюдения демонстрируют низкий уровень циркуляции возбудителя — в осенне-зимне-весенний период 2020–2021 гг. доля положительных результатов обследования методом ПЦР на наличие РНК РСВ не превышала 1,1%.
![Рис. 1. Динамика доли РСВ в структуре ОРВИ в 2020–2021 гг. по данным ПЦР-диагностики в базовых лабораториях двух национальных центров по гриппу ВОЗ в РФ (по [20]) Fig. 1. Changes in the proportion of RSV among ARIs in 2020-2021 based on PCR performed in b Рис. 1. Динамика доли РСВ в структуре ОРВИ в 2020–2021 гг. по данным ПЦР-диагностики в базовых лабораториях двух национальных центров по гриппу ВОЗ в РФ (по [20]) Fig. 1. Changes in the proportion of RSV among ARIs in 2020-2021 based on PCR performed in b](https://medblog.su/wp-content/uploads/2021/12/ostrye-respiratornye-infektsii-i-gripp-v-period-pandemii-covid-19-k-chemu-gotovitsya-v-sezone-2021-2022-gg-usenko-d-v-thakushinova-n-h-shaturina-t-t-ledenko-l-a-bevzenko-o-v.png)
Какими бы ни были причины исчезновения РСВ в 2020 г., последствия в будущем могут быть непростыми. В Российской Федерации уже в осеннем сезоне 2021 г. частота обнаружения РСВ выросла до 4–6%, увеличилась и частота тяжелых форм РСВ-инфекции у госпитализируемых детей, что свидетельствует об активизации эпидемического процесса.. По данным D.A. Foley et al. [21], в Австралии средний возраст инфицированного РСВ населения (18,4 мес.) стал значительно выше, чем в предыдущие эпидемические сезоны. В этой публикации подчеркивается риск будущих изменений в эпидемиологии РСВ и возможность возникновения масштабных эпидемий, когда ограничительные меры будут отменены.. Снижение передачи РСВ приведет к увеличению восприимчивой когорты детей. Младенцы, рожденные от матерей, у которых не укрепился иммунитет к РСВ, не будут защищены. Таким образом, существует риск того, что, когда РСВ снова будет активно циркулировать, как в Западной Австралии, он обнаружит большую когорту иммунологически наивных людей и вызовет серьезные эпидемии. Согласно предсказаниям математической модели, чем дольше меры контроля будут сдерживать распространение РСВ, тем масштабнее будут эпидемии в будущем [22]. С учетом высокой смертности от РСВ-инфекции не только среди младенцев, но и среди пожилых людей необходимы усилия для предотвращения глобальной эпидемии РСВ-инфекции в будущем [23].
Грипп в период пандемии COVID-19
Наряду со снижением частоты РСВ-инфекции, за период пандемии COVID-19 во всем мире на 99% снизилось число диагностированных случаев инфекции вирусом гриппа [24, 25]. С начала 2020 г. во время сезонов гриппа в Южном и Северном полушариях глобальные показатели смертности от гриппа упали до рекордных значений. В настоящее время есть опасения, что такое низкое количество зарегистрированных случаев гриппа более 1 года делает прогнозы на предстоящий год неопределенными. Одни эпидемиологи прогнозируют сохранение низких показателей, а другие ожидают глобальной пандемии вариантов гриппа A.
Ежегодные вспышки и эпидемии во время «сезона гриппа» или случайные пандемии обусловлены гриппом A [26]. Вспышки гриппа B происходят каждые 2–4 года. В естественном резервуаре птиц имеется 16 подтипов вируса H и 9 подтипов вируса N, но только 3 подтипа гемагглютинина способны вызывать респираторную инфекцию у человека: H1, H2 и H3. К последней пандемии, вызванной штаммом вируса гриппа А/H1N1 в 2009–2010 гг., привела реассортация 2 штаммов свиного гриппа, 1 человеческого штамма и 1 птичьего штамма.. Есть опасения, что штамм вируса гриппа H5N1 может повторить адаптацию в 1918 г. и вызвать новую пандемию гриппа [27]. Свиньи рассматриваются как основной «реактор» появления новых пандемических штаммов вируса гриппа, поскольку их эпителиальные клетки трахеи экспрессируют рецепторы, имеющие высокое сродство к вирусам гриппа птиц и человека. Новые штаммы, возникающие в результате антигенного сдвига, часто появляются в Юго-Восточной Азии, где близость людей, птиц и свиней может стимулировать изменение разнообразия вирусов.
В 2021 г. глобальная и текущая оценка вариантов вируса зоонозного гриппа ВОЗ выявила варианты птичьего гриппа A (H5), варианты свиного гриппа A (H1) и другие варианты зоонозного гриппа [28]. С мая 2021 г. зарегистрированы изолированные инфекции вируса гриппа A (H5N6). 18 февраля 2021 г. Российская Федерация уведомила ВОЗ о выявлении вируса птичьего гриппа A (H5N8) у 7 пациентов.. Большинство зарегистрированных случаев птичьего гриппа A (H5) среди людей были связаны с контактом с домашней птицей. Например, 9 июня 2021 г. в Китае было зарегистрировано два случая заражения человека гриппом A (H9N2). Однако 27 мая 2021 г. в США был зарегистрирован случай заражения человека вирусом варианта гриппа свиней A (H1N2). В июне 2021 г. также были зарегистрированы случай из Тайваня и случай из Канады вариантного вируса гриппа A (H1N2). Все эти недавние варианты вируса гриппа были подтверждены с помощью проверенных методов секвенирования генома и полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). Все вышесказанное наглядно демонстрирует вероятность осложнения эпидемической ситуации и требует усиления мониторинга, особенно в период мнимого благополучия. Одновременно остаются вопросы об эффективности современных вакцин против гриппа и их соответствии новым циркулирующим вариантам вируса гриппа. Нельзя не учитывать и факт снижения популяционного иммунитета населения в связи со снижением циркуляции вируса гриппа и других респираторных вирусов.
Один из дискуссионных вопросов прогнозирования сценария эпидемического сезона острых респираторных инфекций — как «поведет» себя вирус гриппа в сезоне 2021–2022 гг.? Было предложено несколько сценариев [29]. Во-первых, сезонный грипп может вернуться с теми же вариантами, что и в конце 2019 г. Этот сценарий был бы оптимальным, поскольку современные вакцины будут обеспечивать надежную противовирусную защиту. Однако он наименее реалистичен, поскольку количество вирусов гриппа, выделенных с апреля 2020 г., ограниченно.. Во-вторых, сезонный грипп может вернуться, но некоторые варианты исчезнут, особенно если у них нет крупных зоонозных резервуаров.. Третий и наиболее тревожный сценарий заключается в том, что этот сезон гриппа может быть вызван появлением нового штамма зоонозного гриппа, способного привести к новой вирусной пандемии. Вне зависимости от варианта развития эпидемиологической ситуации по гриппозной инфекции, ключевое значение отводится эффективному мониторингу за циркуляцией возбудителя, своевременной специфической профилактике, особенно в контингентах групп риска развития тяжелых его форм, и ранней эффективной противовирусной терапии.
Современные принципы противовирусной терапии гриппа и ОРВИ
В соответствии с действующими методическими рекомендациями Министерства здравоохранения «Лекарственная терапия острых респираторных вирусных инфекций (ОРВИ) в амбулаторной практике в период эпидемии COVID-19» [30] в настоящее время обоснована комплексная терапия ОРВИ, включающая этиотропное лечение противовирусными препаратами прямого действия в сочетании с иммунокорригирующей терапией. При этом важно отметить, что иммуномодулирующие препараты не заменяют противовирусные препараты прямого действия.
Приходится констатировать, что, несмотря на разнообразие представленных в группе «противовирусные препараты» лекарственных средств, число препаратов прямого противовирусного действия ограниченно, а с учетом возрастных ограничений не превышает 5–6 (табл. 1).
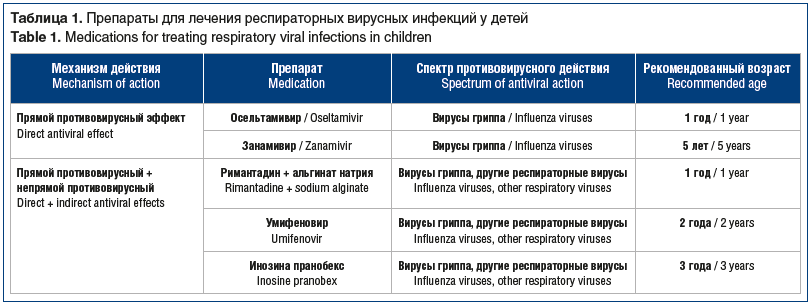
Препараты — ингибиторы нейраминидазы, осельтамивир и занамивир, эффективны только при инфекции вируса гриппа. Их раннее применение (в первые 48 ч от начала заболевания) способствует достоверному сокращению продолжительности всех основных симптомов гриппа. Осельтамивир разрешен к применению детям в возрасте старше 1 года, занамивир применяется в виде ингаляции через дискхалер в возрасте старше 5 лет. Препарат противопоказан лицам с бронхиальной астмой и при наличии бронхообструкции в анамнезе.
Одной из актуальных проблем противовирусной терапии респираторных инфекций является резистентность циркулирующих штаммов.. В настоящее время мониторинг ведется лишь в отношении вируса гриппа. Было установлено, что с ноября 2007 г. по март 2009 г. доля осельтамивир-резистентных штаммов среди подтипа H1N1 выросла до 100%, а доля штаммов, резистентных к адамантановым препаратам, достигала 90–100%. Однако появление в циркуляции пандемического штамма A(H1N1)pdm09 вытеснило осельтамивир-резистентные вирусы.
Одним из решений проблемы резистентности вируса гриппа к адамантановым препаратам (амантадин, римантадин) явилась их комбинация с альгинатом натрия, что позволило добиться как прямого противовирусного, так и интерферон-индуцирующего действия, активирующего неспецифическую противовирусную защиту, а также существенно снизить токсичность. В свете последних методических рекомендаций данный подход представляется оправданным, учитывая неспецифичность клинических проявлений респираторных инфекций различной этиологии. Полимерный препарат Орвирем® (римантадин + альгинат натрия), разрешенный детям с 1 года, обладая свойствами римантадина, способствует подавлению репродукции вирусов гриппа типа А, РСВ и вирусов парагриппа, возбудителей краснухи и кори, а также гриппа типа В и коронавирусной инфекции [31, 32]. В оригинальных исследованиях было показано, что использование пептидов и некоторых других биологических молекул, введенных в адамантановый карбоцикл методами пептидного синтеза, может в значительной мере расширить поиск наиболее подходящего блокатора канала М2 вируса гриппа, тем самым решая проблему преодоления резистентности вирусов гриппа к адамантанам [33]. Полимерная форма противовирусного препарата на основе римантадина в сочетании с альгинатом натрия в виде сиропа позволяет значительно расширить спектр его фармакологических свойств, поскольку включенный в его состав альгинат натрия — низкомолекулярный модифицированный полисахарид, обладает иммуномодулирующими, адсорбирующими и дезинтоксикационными свойствами и дает возможность применять препарат при ОРВИ различной этиологии, способствуя усилению антитоксической активности и более продолжительной (в десятки раз), чем у римантадина, циркуляции в плазме крови [34].
Как было показано при изучении лечебной эффективности комбинации римантадина и альгината натрия, у пациентов с ОРВИ на 2-й день приема препарата имело место достоверное повышение содержания спонтанного и сывороточного IFN-α и -γ, а также (в 1,5 раза) активности их индуцированной продукции [35]. Указанная фармакологическая форма обеспечивает постепенное поступление препарата в кровь, пролонгированную циркуляцию в организме и создание постоянной концентрации препарата в крови. Это позволяет уменьшить дозировку и, следовательно, значительно сократить риск развития нежелательных явлений, определив его хорошую переносимость и высокую комплаентность.. Показана способность комбинации римантадина и альгината натрия оказывать лечебное действие не только при гриппе, но и при других ОРВИ, что было доказано и при лечении детей, в том числе раннего возраста (≥1 года) [36–38].
В настоящее время в качестве перспективной рассматривается комбинированная противовирусная терапия ОРВИ с использованием препаратов, обладающих разными механизмами и точками приложения противовирусного действия.
Заключение
Таким образом, острые респираторные инфекции в период пандемии COVID-19 не потеряли своей актуальности.. Регистрируемый сегодня сезонный подъем заболеваемости РСВ, в том числе в старших возрастных группах, — наглядный тому пример.. В отношении активности вируса гриппа в настоящее время возможны различные сценарии. Однако очевидно, что ключевым фактором успешности лечебных мероприятий является ранняя противовирусная терапия, направленная на различные этапы жизненного цикла респираторных вирусов, и оптимизация иммунологической реактивности.
Благодарность
Авторы и редакция благодарят ООО «Зентива Фарма» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
Acknowledgment
The authors and Editorial Board are grateful to LLC Zentiva Pharma for providing full-text foreign articles required to write the review.
Сведения об авторах:
Усенко Денис Валериевич — д.м.н., ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, заведующий образовательным центром; Россия, 111123, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0001-5232-7337.
Тхакушинова Нафисeт Хусейновна — д.м.н., заведующая кафедрой детских инфекционных болезней ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4; главный врач ГБУЗ «СКДИБ»; 350012, Россия, г. Краснодар, ул. Красных Партизан, д. 6/5; ORCID iD 0000-0002-1447-275х.
Шатурина Тамара Темуровна — аспирант кафедры детских инфекционных болезней ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4; врач-педиатр, заведующая организационно-методическим отделом ГБУЗ «СКДИБ»; 350012, Россия, г. Краснодар, ул. Красных Партизан, д. 6/5; ORCID iD 0000-0002-1010-8272.
Леденко Лариса Алексеевна — ассистент кафедры детских инфекционных болезней ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4; заместитель главного врача по медицинской части ГБУЗ «СКДИБ»; 350012, Россия, г. Краснодар, ул. Красных Партизан, д. 6/5; ORCID iD 0000-0002-2023-6382.
Бевзенко Олег Владимирович — к.м.н., доцент кафедры детских инфекционных болезней ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4; заместитель главного врача по организационно-методической работе ГБУЗ «СКДИБ»; 350012, Россия, г. Краснодар, ул. Красных Партизан, д. 6/5; ORCID iD 0000-0002-0275-9817.
Контактная информация: Усенко Денис Валериевич, e-mail: dusenko@rambler.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует..
Статья поступила 23.08.2021.
Поступила после рецензирования 15.09.2021.
Принята в печать 08.10.2021.
About the authors:
Denis V. Usenko — Dr. Sc. (Med.), leading researcher of the Clinical Division of Infectious Disorders, Head of the Educational Center, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0001-5232-7337.
Nafiset Kh. Tkhakushinova — Dr. Sc. (Med.), Head of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; Head Doctor, Specialized Clinical Children’s Infectious Hospital; 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-1447-275х..
Tamara T. Shaturina — postgraduate student of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; pediatrician, Head of the Organizational and Methodical Department, Specialized Clinical Children’s Infectious Hospital; 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-1010-8272.
Larisa A. Ledenko — assistant of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; Deputy Head Doctor for Medical Work, Specialized Clinical Children’s Infectious Hospital; 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-2023-6382.
Oleg V. Bevzenko — C. Sc. (Med.), associate professor of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; Deputy Head Doctor for Organizational and Methodical Work, Specialized Clinical Children’s Infectious Hospital’ 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-0275-9817.
Contact information: Denis V. Usenko, e-mail: dusenko@rambler.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.08.2021.
Revised 15.09.2021.
Accepted 08.10.2021.
.
Информация с rmj.ru






