
Горелов Александр Васильевич, чл.-корр. РАН, д.м.н., профессор, заместитель директора по научной работе ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека в своем выступлении представил результаты метаанализа контролируемых клинических исследований препарата Полиоксидоний® в терапии инфекционно-воспалительных заболеваний органов дыхания у детей.
Согласно государственному докладу «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году» заболеваемость острыми респираторными инфекциями (ОРИ) составила 20 985,88 на 100 тыс. населения. Дети в возрасте до 6 лет переносят ОРИ в 5 раз чаще взрослых, из общего числа переболевших дети в возрасте 1–2 лет составили 112 987,86 случая на 100 тыс. детей, 3–6 лет —106 996,16 случая на 100 тыс. детей [1].
Ведущее значение в патогенезе ОРИ и гриппа имеет синдром общей интоксикации, проявляющийся лихорадкой, ознобом, головной болью, болью в мышцах и суставах, слабостью. Важную роль в развитии данного симптома играют токсины как экзогенной (бактериальные, вирусные, грибковые), так и эндогенной природы (липополисахариды [ЛПС], продукты деградации клеток пораженных инфекцией тканей).
Интоксикация сопровождается нарушением реологии крови, дегидратацией, повышением температуры тела, сердечно-сосудистыми нарушениями, а возможным ее исходом может быть инфекционно-токсический или гиповолемический шок. Стратегия ведения пациента с ОРИ должна быть нацелена не только на снятие симптомов, но и на ликвидацию звеньев патогенеза синдрома общетоксической интоксикации. Необходимо обеспечить снижение уровня экзо- и эндотоксинов, с одной стороны, за счет их сорбции и удаления из организма, с другой стороны — за счет предупреждения их формирования, т. е. обеспечивая гибель и элиминацию инфекционного возбудителя и подавление образования нейтрофильных внеклеточных ловушек (НВЛ). Одновременно с этим необходим контроль над продукцией провоспалительных цитокинов, с которыми связано развитие «цитокинового шторма».
Инфекционный токсикоз — это неспецифический клинический симптомокомплекс, развивающийся в организме в ответ на воздействие инфекционного агента с нарушением гомеостаза и сознания. Нарушение сознания отличает инфекционный токсикоз от интоксикации [2].
Можно выделить два периода течения токсикоза.
Период генерализованной реакции, который имеет следующие варианты:
токсикоз с энцефалитическим синдромом;
токсическая энцефалопатия — нейротоксикоз;
кишечный токсикоз;
токсикоз с обезвоживанием (токсикоз с интестинальным синдромом);
токсикоз Кишша (гипермотильный токсикоз);
молниеносная форма токсикоза;
синдром Уотерхауса — Фридериксена (токсикоз с острой надпочечниковой недостаточностью).
Период локализации патологического процесса, который имеет следующие варианты:
синдром Рея (токсикоз с печеночной недостаточностью);
синдром Гассера / гемолитико-уремический синдром (токсикоз с острой почечной недостаточностью);
токсикосептическое состояние.
Клинические проявления инфекционного токсикоза, по мнению профессора А.В. Горелова, зависят от характера инфекционного процесса и его этиологии.
Установлено, что интоксикация организма при инфекционном процессе усугубляется неадекватной реакцией нейтрофилов в ответ на патоген, исходом которой является образование суицидальных НВЛ [3].
Поражение иммунокомпетентных клеток при вирусных инфекциях сопровождается нарушением работы эпителия респираторного тракта, уменьшением количества Т-клеток, нарушением их функции, гиперактивацией B-клеток, снижением функциональной активности фагоцитов и плазматических клеток, увеличением содержания T-reg-клеток [2]. Таким образом, эффективность клеточной составляющей иммунной системы снижается, а стратегия ведения пациентов с ОРИ должна быть направлена как на снятие симптомов, таких как снижение температуры, уменьшение головной боли, боли в мышцах, так и на купирование интоксикации [2].
Крайне важно для достижения контроля над воспалением при ОРИ, помимо снижения интоксикации, добиться элиминации возбудителя и продуктов его жизнедеятельности, восстановления структуры и функций поврежденных органов и тканей.
Для этих целей в отношении симптоматической и этиотропной терапии в настоящее время существуют обоснованные рекомендации, основанные на убедительной доказательной базе клинических исследований. Что касается патогенетически обоснованной детоксицирующей терапии, то рекомендации ограничиваются обильным питьем и, при необходимости, проведением инфузионной терапии с целью нормализации водно-электролитного, кислотно-щелочного баланса организма и коррекции патологических потерь жидкости организмом или их предотвращения [4]. Особое место в терапии пациентов с ОРИ занимает иммунокоррекция, в связи с чем А.В. Горелов представил азоксимера бромид — препарат с высоким профилем безопасности, который обладает комплексным действием: иммуномодулирующим, детоксицирующим и противовоспалительным [4]. Иммуномодулирующее действие связано с повышением фагоцитарной активности макрофагов и нейтрофилов [5, 6], ускорением созревания дендритных клеток и их миграцией в лимфоидные органы с последующим развитием адаптивного иммунного ответа, сопровождающегося высоким уровнем продукции антител и нормализацией показателей Т-клеточного звена (СD3+, СD4+, СD8+), повышением активности натуральных киллеров, снижением образования НВЛ [7]. Выраженные детоксицирующие свойства обусловлены высокой абсорбционной способностью азоксимера бромида, благодаря которой он способен связывать токсины и выводить их из организма. Противовоспалительное действие связано с нормализацией синтеза про- и противовоспалительных цитокинов, снижением синтеза IL-6.
Профессор А.В. Горелов представил результаты метаанализа данных клинических исследований, целью проведения которого была обобщенная оценка клинической эффективности азоксимера бромида при лечении инфекционно-воспалительных заболеваний дыхательных путей у детей и подростков [4].
Первым этапом был проведен поиск всех клинических исследований препарата азоксимера бромид в русско-язычных и международных источниках в электронных базах данных, таких как: PubMed, Embase, Cochrane Library, eLibrary, научная электронная библиотека «Киберленинка». Поиск осуществлялся с использованием ключевых слов: «азоксимера бромид», «инфекция дыхательных путей» и «дети» (до марта 2019 г.). В результате поиска исследований и последующего их анализа были отобраны пять клинических исследований (табл. 1), включавших данные 540 пациентов в возрасте 3–18 лет, соответствовавших критериям отбора:

сравнительные контролируемые клинические исследования инфекционно-воспалительных заболеваний дыхательных путей;
участники: дети с диагнозом «респираторные инфекционно-воспалительные заболевания: ОРВИ, ОРЗ, пневмония» в возрасте от 3 до 18 лет;
путь введения препарата — пероральный, сублингвальный или интраназальный;
время начала приема исследуемого препарата: с первого дня в составе комплексной терапии;
в исследовании должны сравниваться применение стандартной симптоматической терапии инфекционно-воспалительных заболеваний дыхательных путей (с применением плацебо или без него) и применение азоксимера бромида на фоне стандартной симптоматической терапии;
критерии оценки эффективности, используемые в исследовании: сроки нормализации температуры тела, продолжительность отдельных симптомов респираторных инфекционно-воспалительных заболеваний.
Основную группу составили 334 пациента с инфекционно-воспалительными заболеваниями дыхательных путей, которым был назначен азоксимера бромид в составе комплексной терапии; 206 человек составили группу контроля.
Полученные результаты статистического анализа показали значимые, имеющие клиническое значение различия по срокам нормализации температуры тела при сравнении группы терапии азоксимера бромида с контрольной группой, как при применении модели случайных эффектов (обобщенная разница составила 1,92 дня в пользу терапии исследуемым препаратом; 95% доверительный интервал [ДИ] -3,16; -0,67), так и при использовании модели фиксированных эффектов (обобщенная разница 1,4 дня в пользу применения исследуемого препарата; 95% ДИ -1,65; -1,15) [4].
Применение азоксимера бромида приводило к уменьшению длительности лихорадки и интоксикации по сравнению с показателями у пациентов из контрольной группы (обобщенная разница составила 0,73 дня в пользу применения исследуемого препарата (95% ДИ -0,81; -0,65) [8–11], сокращению продолжительности головной боли (обобщенная разница -0,53 дня, 95% ДИ -0,91; -0,15) [4, 6, 10, 12], боли в суставах и мышцах на 1,59 дня в сравнении с контрольной группой (обнаруженное различие статистически значимо, 95% ДИ -2,19; -1,003), а также снижению продолжительности клинических симптомов острого воспаления верхних дыхательных путей на 1,23 дня в сравнении с контрольной группой; обнаруженное различие статистически значимо (95% ДИ 1,32; 1,14).
Таким образом, включение азоксимера бромида в комплексное лечение респираторных заболеваний позволяет лучше контролировать симптомы интоксикации, снижать тяжесть течения инфекционно-воспалительного процесса, оказывая положительное влияние на иммунные механизмы и практически не вызывая при этом побочных эффектов.
Профессор А.В. Горелов подчеркнул, что позитивные эффекты, зафиксированные в данном исследовании, послужили основанием того, что Полиоксидоний® (азоксимера бромид) одобрен Минздравом России для проведения международного многоцентрового плацебо-контролируемого клинического исследования (ММКИ) III фазы в лечении COVID-19.

Профессор Университета Монпелье и Института рака св. Екатерины (Франция) иммунолог Жан-Франсуа Росси выступил с докладом, в котором отметил, что в терапии COVID-19 необходимо учитывать потребность в комплементарной терапии для этих пациентов. Для этого имеется ряд препаратов, в т. ч. широко известные иммуноадъюванты. Они используются в вакцинах, а также при определенных обстоятельствах для пациентов в качестве терапии. Одним из них является азоксимера бромид, разработанный российской фармацевтической компанией «НПО Петровакс Фарм», который может быть как компонентом вакцины, так и использоваться для лечения инфекционно-воспалительных заболеваний. Подобные препараты активируют созревание дендритных клеток, которые задействованы в презентации антигена. Они не токсичны для NK-клеток, повышают их способность к дегрануляции, что является критически важным в противовирусном иммунном ответе.

Жан-Франсуа Росси отметил, что допустимо использование азоксимера бромида для лечения различных инфекционных заболеваний. Этот препарат был применен в таких странах, как Словакия и Россия, в т. ч. получен первый успешный опыт его применения в Словакии при коронавирусной инфекции COVID-19. На сегодняшний день международное многоцентровое двойное слепое плацебо-контролируемое адаптивное рандомизированное сравнительное исследование эффективности и безопасности препарата Полиоксидоний®, лиофилизат для приготовления раствора для инъекций 6 мг, в терапии госпитализированных пациентов с COVID-19 стартовало в России. Заявка на проведение клинического исследования препарата у пациентов с COVID-19 рассматривается в Министерстве здравоохранения Франции, готовится подача документов в Словакии. Жан-Франсуа Росси подчеркнул, что возлагает большие надежды на результаты исследования и ожидает возможности подтвердить, что азоксимера бромид способен укрепить иммунитет и помочь в борьбе с коронавирусной инфекцией.
Президент Словацкого общества инфекционистов, член Национальной кризисной клинической команды и советник премьер-министра по COVID-19 профессор Павол Ярчушка представил данные о заболеваемости и смертности от коронавирусной инфекции в Словакии. Профессор Павол Ярчушка отметил, что в Словакии на 20 мая 2020 г. самая низкая заболеваемость и смертность от данной инфекции в Европе. Так, заболеваемость составила 267 случаев на 1 млн населения, а смертность — 5 случаев на 1 млн населения. Данные показатели могут объясняться тем, что еще до выявления первого пациента в Словакии была создана национальная команда врачей-клиницистов, разработаны клинические рекомендации по комплексному ведению пациентов с COVID-19, которые обновляются еженедельно. Созданы эпидемиологические инструменты и способы оценки, достаточное количество инструкций и рекомендаций как для госпитализированных, так и для пациентов, получающих медицинскую помощь амбулаторно, для лабораторных исследований, для оценки эпидемиологических показателей, а также для широких масс населения. Клинические рекомендации по комплексному ведению пациентов с COVID-19 включают азоксимера бромид в дозе 12 мг/сут внутримышечно.
Профессор Павол Ярчушка отметил работу Войтеха Тона из Брно, которая посвящена иммунному ответу, COVID-19 и применению азоксимера бромида при коронавирусной инфекции.
В Словакии в настоящее время используется опросник для проспективной оценки результатов лечения пациентов с COVID-19 с применением азоксимера бромида. Также ведется активная подготовка к запуску многоцентрового рандомизированного двойного слепого клинического исследования, результаты которого в дальнейшем будут использованы для регистрации препарата в Европейском агентстве лекарственных средств.

Продолжила симпозиум Анна Николаевна Галустян, к.м.н., доцент, заведующая кафедрой фармакологии с курсом клинической фармакологии и фармакоэкономики ФГБОУ ВО СПбГПМУ Минздрава России, выступившая с докладом о влиянии нейтрофильных внеклеточных ловушек на течение острой респираторной вирусной инфекции.
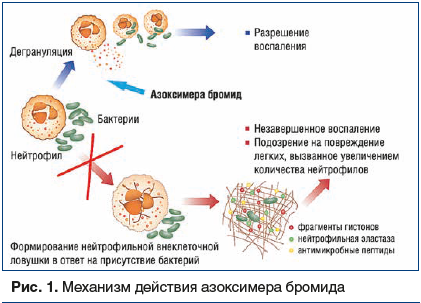
А.Н. Галустян отметила, что в течение последних десятилетий ОРВИ стали протекать достаточно специфично. В ситуации с появлением нового респираторного вируса SARS-CoV-2, вызывающего заболевание COVID-19 различной степени тяжести у пациентов разных возрастных групп и с сопутствующей патологией, продемонстрирована ведущая роль защитных иммунных механизмов у каждого отдельно взятого индивидуума и популяции в целом. Исторически нейтрофильные гранулоциты, составляющие от 50 до 70% популяции лейкоцитов, рассматривались в качестве клеток системы врожденного иммунитета против широкого спектра микроорганизмов [13]. В процессе развития инфекционного воспаления нейтрофилы в зависимости от природы сигнала активации и стоящих перед ними эффекторных задач используют различные стратегии антимикробной защиты (рис. 1) [14]: фагоцитоз, дегрануляция и нетоз, протекающий с формированием НВЛ, с помощью которых осуществляется противобактериальная, противогрибковая и противовирусная защита организма. Нетоз был открыт в 2004 г. Volker Brinkmann et al. и представляет собой основной тип клеточной смерти нейтрофилов наравне с апоптозом и некрозом. Нетоз может протекать по двум сценариям: суицидальному, сопровождающемуся гибелью нейтрофилов, и прижизненному, без гибели нейтрофилов [15]. При нетозе нейтрофил проходит следующие стадии:
деконденсации хроматина;
наработки активных форм кислорода (АФК);
дегрануляции;
выброса ДНК-сети (ДНК-ловушки), связанной с АФК, гистонами, миелопероксидазой и другими молекулами, повреждающими патоген.
Патогены «запутываются» в сетях и гибнут. Нейтрофильные ДНК-ловушки связаны с патогенезом различных состояний, таких как сепсис, ревматоидный артрит и другие аутоиммунные заболевания. Другие клетки крови, такие как моноциты, эозинофилы, базофилы, также имеют подобный механизм, называемый этозом (от англ. ETosis (от ET — Extracellular Trap)) [16].
Помимо защитного действия компоненты НВЛ могут оказывать повреждающее действие на собственные клетки организма.
Некоторые вирусы, отметила А.Н. Галустян, стимулируют образование НВЛ, вместе с тем в процессе эволюции многие возбудители респираторных инфекций развили способность уклонения от воздействия НВЛ. В этой ситуации НВЛ становится бесполезной против возбудителя, при этом вещества, содержащиеся в НВЛ, токсичны не только для инфекционных агентов, но и для собственных клеток организма. Токсичные компоненты НВЛ повреждают эндотелий сосудов, что приводит к повышению их проницаемости. НВЛ могут вызвать повреждение эпителия дыхательных путей и воспалительные реакции, индуцировать образование слизи, усилить гиперсекрецию и ремоделирование дыхательных путей, вызывая усиление аллергического воспаления, что ведет к нарастанию симптомов воспаления и утяжелению течения ОРВИ и гриппа [17]. НВЛ в сочетании с индуцированной нейтрофилами продукцией слизи приводят к обструкции дыхательных путей и дыхательной недостаточности [18].
L. Zhu et al. (2018) показывают, что у пациентов с тяжелым течением гриппа наблюдается повышение уровня НВЛ в плазме в сравнении с данным показателем у пациентов с гриппом умеренной степени тяжести. Высокий уровень НВЛ коррелирует с тяжестью заболевания. Таким образом, НВЛ может быть ключевым фактором прогнозирования неблагоприятного исхода у данной группы пациентов [19].
Большинство наблюдений свидетельствуют, что баланс между положительной защитной и отрицательной цитотоксической ролью НВЛ смещается в сторону последней. Это делает НВЛ мишенью при разработке новых подходов к лечению и профилактике инфекционно-воспалительных заболеваний респираторного тракта [7]. Идеальным является такой вариант, при котором нивелируются патогенные, но сохраняются защитные, положительные свойства нейтрофилов. Азоксимера бромид удовлетворяет таким требованиям, т. к. проявляет эффективность при инфекционно-воспалительных заболеваниях вирусной, бактериальной и грибковой этиологии. Азоксимера бромид подавляет формирование НВЛ и стимулирует фагоцитоз (рис. 1) [20].
Б.В. Пинегин и соавт. (2019) показали, что in vitro азоксимера бромид способен подавлять формирование НВЛ, снижая способность активированных нейтрофилов выделять макромолекулярные комплексы, которые состоят из ДНК и гранулярных, ядерных и цитоплазматических белков, в т. ч. антимикробных, одинаково токсичных как для прокариотических, так и для эукариотических клеток [7]. Подавление формирования НВЛ повышает активность фагоцитоза, снижая инфекционную нагрузку благодаря противовоспалительному и детоксицирующему эффекту, а также облегчает тяжесть течения процесса. Этот механизм действия азоксимера бромида объясняет его клиническую эффективность в терапии острых и хронических инфекционно-воспалительных заболеваний респираторного тракта [7], а использование противовирусной и иммуномодулирующей терапии, как известно, является основной стратегией лечения респираторных вирусных инфекций [21].
А.Н. Галустян привела результаты исследования Е.И. Исаевой (2019), согласно которым противовирусный эффект азоксимера бромида в отношении риновируса, размножение которого происходит преимущественно на слизистой носоглотки [22], обосновывает местное применение данного препарата (интраназально или подъязычно) в стартовой терапии ОРВИ, сопровождающейся катаральными явлениями в области носоглотки. Активность в отношении метапневмовируса, парагриппа, гриппа А и В, обладающих высокой тропностью к слизистой оболочке нижних отделов респираторного тракта [23], обосновывает применение парентеральных, пероральных и ректальных лекарственных форм азоксимера бромида, обеспечивающих системный эффект. Системное действие препарата также оправдано при выраженной интоксикации и частых рецидивирующих инфекциях, а в случае невозможности применения пероральных форм обоснован прием азоксимера бромида в виде суппозиториев [24].
Сохраняя все свойства иммуномодулятора, азоксимера бромид является мощным детоксикантом, что связано с особенностью строения молекулы — большим количеством активных групп на ее поверхности, которые интенсивно адсорбируют циркулирующие в крови растворимые токсические субстанции и микрочастицы, снижая концентрацию токсических веществ в крови.
Антиоксидантный эффект азоксимера бромида обусловлен [25]:
способностью к перехвату в водной среде активных форм кислорода, супероксидного аниона, перекиси водорода, гидроксильного радикала;
уменьшением концентрации каталитически активного двухвалентного железа, приводящего к ингибиции перекисного окисления липидов;
подавлением спонтанной и индуцированной люминол- и люцигенинзависимой хемилюминесценции, что важно при гнойно-септических состояниях [26].
Нормализация синтеза про- и противовоспалительных цитокинов под воздействием азоксимера бромида, повышение устойчивости клеток к цитотоксическому воздействию обеспечивают противовоспалительное действие препарата, что незаменимо для купирования катаральных симптомов, характерных для клиники ОРИ.
В конце своего выступления А.Н. Галустян подчеркнула полиэффект при лечении препаратом Полиоксидоний®. Благодаря комплексу свойств этот препарат помогает справиться с вирусной инфекцией и улучшить самочувствие ребенка с первых дней лечения. Согласно рекомендациям Российской ассоциации аллергологов и клинических иммунологов данный препарат может назначаться без предварительного изучения иммунного статуса, а введение его в комплексную терапию инфекционно-воспалительных заболеваний позволяет уменьшить количество этиотропных и симптоматических препаратов и снизить токсичность лечения. Азоксимера бромид входит в список ЖНВЛП.
В заключение А.В. Галустян отметила, что применение азоксимера бромида является обоснованным для лечения ОРВИ, в т. ч. у детей с неблагоприятным преморбидным фоном, для лечения респираторных заболеваний верхних дыхательных путей с выраженной тяжестью симптомов, заболеваний околоносовых пазух, внутреннего и среднего уха, рецидивирующей герпетической инфекции [27], при риске осложненного течения инфекционного заболевания, а также в профилактических и иммунореабилитационных программах для пациентов с рекуррентными инфекциями органов дыхания.
Показан благоприятный профиль безопасности препарата Полиоксидоний®. Он одобрен Минздравом для проведения международного клинического исследования при лечении коронавирусной инфекции.

Завершила симпозиум Сусанна Михайловна Харит, д.м.н., профессор, руководитель отдела профилактики инфекционных заболеваний ФГБУ ДНКЦИБ ФМБА России, представившая доклад о роли адъювантов в составе вакцин против гриппа.
Профессор С.М. Харит отметила, что несмотря на многолетнюю работу по снижению инфекционной заболеваемости, инфекции продолжают составлять большую долю в структуре заболеваемости взрослых и детей.
Вспышки управляемых инфекций могут быть обусловлены рядом причин, таких как недостаточная эффективность вакцин, их недоступность, недоверие к вакцинации и отказ родителей проводить иммунизацию своих детей [28].
Иммунный ответ при вакцинации определяется множеством факторов: особенностями индивидуума (возраст, пол, генетические особенности, наличие сопутствующих заболеваний, хронических инфекций, применение антибиотиков, особенности микробиоты), факторами окружающей среды, особенностями самой вакцины. В популяции уровень антител после вакцинации неодинаков, есть люди с высоким и низким уровнем отвечаемости на конкретный антиген, а у некоторых индивидуумов ответ может не сформироваться. Понимание всех факторов влияния на формирование протективного иммунитета необходимо для повышения иммуногенности и эффективности вакцин и принятия решений о графиках вакцинации [29]. Для увеличения эффективности вакцин применяют разные технологии производства, для неживых вакцин уже более столетия используются адъюванты [30–32]. Самые ранние работы по оценке адъювантных свойств различных вакцин датируются 1889 г., когда Е. Roux и A. Yersin описали стимуляцию антителообразования при иммунизации животных дифтерийным антигеном в сочетании с хлористым кальцием [30]. С тех пор было разработано много более совершенных адъювантов, но поиск более безопасных и одновременно эффективных продолжается и сегодня. Значительное число вакцин до настоящего времени в качестве адъюванта содержат соединения алюминия, которые создают депо вакцины, вызывают местное воспаление, что приводит к активации антигенпрезентирующих клеток (АПК). Однако этот же механизм обусловливает местную реактогенность [29], возможность неспецифической поликлональной стимуляции [29], медленную деградацию, сопряженную с риском длительного локального воспаления [31], и даже риск развития аутоиммунных процессов [32]. Как бы то ни было, без адъювантов на основе алюминия многих современных вакцин просто не существовало бы.
В современный период важнейшим направлением вакцинологии является поиск и внедрение в практику новых адъювантов, действующих непосредственно на иммунокомпетентные клетки и стимулирующих формирование выраженного адаптивного иммунного ответа, позволяющих снизить количество антигена в составе вакцины. Сейчас на стадии клинических испытаний находится ряд адъювантов, способных не только усиливать поглощение антигена АПК или доставлять его в зоны локализации иммунокомпетентных клеток, но и выступать в качестве непосредственных иммуноактиваторов.
Новым водорастворимым синтетическим полимерным адъювантом, на сегодняшний день внедренным в клиническую практику, является азоксимера бромид, относящийся к классу гетероцепных полиаминов. Азоксимера бромид разработан и зарегистрирован в России более 20 лет назад. Он применяется для производства вакцины Гриппол® Плюс [33–36]. Вакцина обладает благоприятным профилем безопасности и хорошей иммуногенностью, что было продемонстрировано во всех исследованных группах населения, в т. ч. с низкой отвечаемостью. Это стало возможным именно благодаря адъюванту азоксимера бромиду, входящему в состав вакцины Гриппол® плюс. Включение адъюванта позволило уменьшить количество гемагглютинина (ГА) вируса гриппа до 5 мкг на каждый штамм вакцины, снизив реактогенность, при этом вакцина продолжала индуцировать гуморальный иммунный ответ, сопоставимый с таковым для традиционных инактивированных гриппозных вакцин, содержащих по 15 мкг ГА каждого штамма [37]. Хорошая переносимость вакцины Гриппол® плюс, достаточная иммуногенность, отсутствие негативного воздействия на общее состояние вакцинированных, а также на течение основного заболевания были подтверждены в систематическом обзоре и метаанализе клинических исследований вакцин группы Гриппол® независимой европейской компании Fluconsult. В метаанализ вошли 30 исследований, включивших более 11 тыс. человек, в т. ч. разных групп риска по гриппу (беременные и новорожденные от вакцинированных беременных; люди в возрасте 60 лет и старше с болезнями системы кровообращения; дети и взрослые с бронхиальной астмой и другими хроническими обструктивными заболеваниями дыхательных путей; дети с сахарным диабетом) [37]. Профессор С.М. Харит в заключение подчеркнула, что адъювантная платформа на основе азоксимера бромида, которая успешно реализована на примере противогриппозной вакцины Гриппол® плюс, имеет большие перспективы для будущих разработок. С.М. Харит также отметила, что сегодня в условиях пандемии COVID-19 возникает много вопросов, касающихся вакцинации. Однако, согласно рекомендациям ВОЗ, потенциальный контакт с инфекционным заболеванием не является противопоказанием для плановой иммунизации. Соответственно, пандемия не создает какие-либо специфические риски, связанные с вакцинацией. ВОЗ рекомендует проводить плановую вакцинацию в соответствии с календарем прививок даже во время пандемии.
Симпозиум проходил при поддержке ООО «НПО Петровакс Фарм».
.
Информация с rmj.ru






