Содержание статьи
Остеопороз – компонент сердечно-сосудистого континуума
А. Л. Верткин, доктор медицинских наук, профессор
А. В. Наумов, доктор медицинских наук
Е. И. Горулева, кандидат медицинских наук
Е. В. Адонина, кандидат медицинских наук
А. С. Скотников, кандидат медицинских наук
С. Р. Шакирова
Д. М. Заиченко
Н. Н. Владимирова
МГМСУ, Москва
Остеопороз — одно из «молодых» заболеваний в современной клинической практике. Однако «молодое» заболевание означает только то, что задумываться о наличии данной болезни у пациентов мы стали лишь последнее десятилетие. Однако в медицинской литературе начала и середины XX века мы встречаем термин «вдовий горб», который предполагает формирование кифосколиотической деформации грудного отдела позвоночника у пожилых женщин вследствие компрессионных переломов. Изучение этой проблемы стартовало в XIX веке, когда Charcot и Vulpian дали описание этой болезни, а Alwens W. в учебнике внутренней медицины представил клиническую картину сенильного остеопороза. Более 120 лет ученые и эксперты занимаются проблемой инволютивных и метаболических изменений в костной ткани, однако масштабы эпидемии данного заболевания нарастают в геометрической прогрессии. В начале второго десятилетия XXI века синонимом слова «болезнь» практически абсолютно становятся именно кардиоваскулярные болезни, распространенность которых в зависимости от возраста варьирует от 40% до 95%. В России из-за болезней системы кровообращения ежегодно умирает около 1,3 млн человек (56% всех случаев смерти), причем из болезней сердечно-сосудистой системы на долю ишемической болезни сердца (ИБС) приходится 47%, а цереброваскулярных заболеваний — 38%. Несомненно, что первостепенное значение в развитии и прогрессировании кардиоваскулярной патологии занимают артериальная гипертензия (АГ), ожирение и другие значимые риски.
Исследования второй половины ХХ века выдвинули концепцию «факторов риска». Факторы риска являются универсальными для таких заболеваний, как ИБС, цереброваскулярные заболевания, гипертоническая болезнь, хроническая сердечная недостаточность (ХСН). Убедительно доказана связь указанных заболеваний с гиперхолестеринемией или увеличением доли липопротеинов низкой плотности (ЛПНП), низким содержанием липопротеинов высокой плотности (ЛПВП), курением и сахарным диабетом, а также избыточным содержанием триглицеридов (ТГ), гомоцистеина, С-реактивного белка. Известно, что у лиц, длительно страдающих АГ, с гораздо большей частотой развиваются инфаркт миокарда (ИМ), инсульт, изменения сосудов глазного дна, ХСН и почечная недостаточность. Эта закономерность хорошо демонстрируется предложенной в 1991 г. Dzau и Braunwald схемой «сердечно-сосудистого континуума», представляющего собой цепь связанных между собой событий, начиная от факторов риска и заканчивая развитием тяжелой ХСН. Эта цепь может быть прервана на любом этапе развитием ИМ, инсульта, внезапной смертью. Но, с нашей точки зрения, одним из компонентов указанного сердечно-сосудистого континуума должен являться остеопороз, в первую очередь, по причине тесной патогенетической взаимосвязи с развитием сердечно-сосудистых заболеваний (ССЗ). При этом стоит выделить три направления патогенетической взаимосвязи потери минеральной плотности костной ткани (МПК) и кардиоваскулярной патологии:
- ССЗ и компоненты костного обмена;
- ССЗ и дефицит кальция;
- ССЗ и дефицит витамина D3.
ССЗ и компоненты костного обмена
По данным зарубежных публикаций у пациентов, перенесших остеопоретический перелом шейки бедра, в 70% имеется патология сердечно-сосудистой системы [1]. В нашей клинике таких пациентов было более 80%, при том, что ни один из них не знал о своем заболевании ранее и, соответственно, лечение и профилактику остеопороза не проходил [2]. Аналогичные данные приводит И. В. Буданова и соавт. (2005). Кардиоваскулярная патология ассоциирована с дефицитом оксида азота, роль которого не вызывает сомнений в патогенезе данных заболеваний, а развитие остеопороза связано с снижением синтеза и дифференцировки остеобластов [3–6]. Следует подчеркнуть, что ряд авторов относят потерю МПК к категории предикторов ССЗ, а именно поражений коронарных артерий [7] (рис. 1).
Это объясняется определенным сходством патогенеза ОП и атеросклероза, при которых поврежденные моноцитарные клетки в одном случае дифференцируются в сосудистой стенке в макрофагоподобные «пенистые» клетки, в другом — в остеокласты. Помимо этого костная и сосудистая ткани имеют ряд других общих морфологических и молекулярных свойств. Сосудистый кальцификат представлен теми же элементами, что и костная ткань: солями кальция, фосфатами, связанными с гидроксиапатитом, остеопонтином, костным морфогенным белком, матриксным Gla-белком, коллагеном типа I, остеонектином, остеокальцином и др. [8, 9].
Более того, стенка артерии, пораженной атеросклерозом, состоит из предшественников остеобластов, которые обладают способностью синтезировать минеральные компоненты, характерные для костной ткани. Особое значение имеет тот факт, что окисленные ЛПНП, принимающие участие в развитии атеросклеротического поражения сосудов [10], стимулируют минерализацию, опосредованную как костными остеобластами, так и остеобластоподобными клетками, изолированными из сосудистой стенки.
В ряде исследований отмечена общность патогенеза артериальной гипертензии и остеопороза. В частности, активность ренин-ангиотензиновой системы (РАС), с одной стороны, за счет влияния на локальный кровоток и кровоснабжение костей вызывает вазоконстрикцию микроциркуляторного русла, а с другой — оказывает непосредственное влияние на выработку ангиотензина ІІ. Последний является фактором роста, непосредственно стимулирующим пролиферацию остеокластов и увеличивающим уровень эндотелина-1, содержание которого при активации РАС увеличивается не только в эндотелии, но и в остеокластах [11]. Эти данные подтверждаются в клинике остеопротективным действием ингибиторов ангиотензинпревращающего фермента (АПФ) [12]. Эти препараты, подавляя активность ангиотензина ІІ, способствуют меньшей резорбции остеокластов костной ткани, снижая ее потери МПК [13].
ССЗ и дефицит кальция
Метаанализ результатов многочисленных проспективных контролируемых исследований показал, что потеря костной массы у лиц, получавших адекватное количество кальция, существенно ниже 1% в год, в то время как у лиц, не получавших кальций, она превышает 1% (р < 0,001). Достаточное потребление кальция — необходимое условие снижения риска остеопоретических переломов костей скелета, особенно в процессе старения организма. Тенденция к увеличению риска переломов при дефиците кальция сохраняется и после исключения потенциального влияния других факторов, способствующих развитию остеопороза (курение, прием алкоголя, физическая активность, масса тела и др.). В последние годы внимание исследователей обращено к изучению роли нарушений кальциевого гомеостаза в развитии не только остеопороза, но и других заболеваний, характерных для пожилого и старческого возраста, таких как атеросклероз, ИБС, гипертоническая болезнь, нарушение мозгового кровообращения, дегенеративные заболевания позвоночника (остеохондроз и спондилез) и суставов — остеоартроз. Эти заболевания, которые вместе с остеопорозом являются наиболее распространенными у пожилых людей, некоторыми авторами предложено определять как «кальций-дефицитные» болезни человека. Также известна роль кальция в ряде физиологических процессов, в т. ч. в сердечно-сосудистой и эндокринной системах (табл. 1).

Следовательно, дефицит кальция может играть одну из ключевых ролей в патогенезе кардиоваскулярной патологии, в первую очередь, с позиции дефицита электрической активности сердца и дисбаланса сосудистого тонуса. В то же время снижение синтеза инсулина, вследствие дефицита кальция, может быть дополнительным фактором развития и более неблагоприятного течения инсулинорезистентности.
ССЗ и дефицит витамина D3
Витамин D и его активные метаболиты являются структурными единицами гормональной системы, регулирующей фосфорно-кальциевый обмен. В организме путем сложных превращений в печени и почках холекальциферол преобразуется в более активные метаболиты, способные регулировать всасывание солей кальция и фосфора в тонком кишечнике, реабсорбцию в почках и отложение их в костях. Известно, что многокомпонентную регуляцию фосфорно-кальциевого гомеостаза в основном осуществляют паратгормон, витамин D и кальцитонин. При нарушениях гомеостаза кальция и фосфора действие перечисленных веществ на клетки-мишени различных органов (костный мозг, желудочно-кишечный тракт, печень, почки) способствует быстрому восстановлению оптимального уровня кальция вне и внутри клеток организма.
Все компоненты метаболизма витамина D, а также тканевые ядерные рецепторы к 1 альфа,25-дигидроксивитамин D3 (D-гормону), получившие название рецепторов к витамину D (РВD), объединяют в эндокринную систему витамина D, функции которой состоят в способности генерировать биологические реакции более чем в 40 тканях-мишенях за счет регуляции РВD’ми транскрипции генов (геномный механизм) и быстрых внегеномных реакций, осуществляемых при взаимодействии с РВD, локализованными на поверхности ряда клеток. За счет геномных и внегеномных механизмов D-эндокринная система осуществляет реакции поддержания минерального гомеостаза (прежде всего в рамках кальций-фосфорного обмена), концентрации электролитов и обмена энергии. Кроме того, она принимает участие в поддержании адекватной минеральной плотности костей, метаболизме липидов, регуляции уровня АД, росте волос, стимуляции дифференцировки клеток, ингибировании клеточной пролиферации, реализации иммунологических реакций (иммунодепрессивное действие).
Значительное количество исследований зарубежных авторов показывает взаимосвязь дефицита витамина D3 с заболеваниями, непосредственно не связанными с костной тканью. Несомненна связь дефицита витамина D3 с ССЗ и АГ. Снижение концентрации витамина D связано с увеличенным риском метаболического синдрома, включая АГ. Нормализация уровня витамина D может снижать систолическое артериальное давление и таким образом уменьшить риск ССЗ. Также в исследованиях продемонстрировано, что коррекция дефицита витамина D3 предотвращает дальнейшую гипертрофию кардиомиоцитов у больных с АГ (Park et al., 1999).
Поскольку дефицит витамина D влияет на кардиотонические свойства и сосудистую модернизацию, АГ, возможно, увеличивает отрицательные воздействия дефицита витамина D на сердечно-сосудистую систему. Кроме того, экспериментальные и клинические данные предполагают, что дефицит витамина D непосредственно вызывает развитие АГ. Экспериментальные исследования указывают, что витамин D участвует в регулировании активации ренина и образовании ангиотензина, непосредственно подавляя чрезмерную экспрессию ренина.
Для определения распространенности остеопороза у больных с ССЗ нами было выполнено исследование. Были выделены две группы пациентов. В I группу было включено 396 пациентов, в том числе 342 с АГ и 54 с ИБС. Среди них было 346 женщин (87,4%) и 50 мужчин (12,6%) в возрасте 61,6 ± 9,4 года (табл. 2). В исследование не включались больные с нарушениями ритма сердца, ХСН 3–4 ФК (по NYHA), острыми формами ИБС и нарушениями мозгового кровообращения.
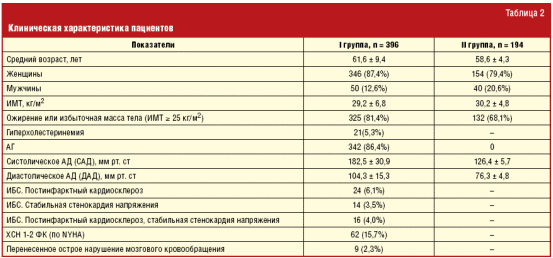
Во II группу (контрольную) было включено 194 (154 женщины и 40 мужчин) пациента без соматической патологии, средний возраст которых составил 58,6 ± 4,3 года. Пациенты всех групп были сопоставимы по возрасту (однако в группе контроля пациенты были несколько моложе), половому составу и ИМТ. Пациентам с АГ было проведено суточное мониторирование АД (СМАД) до и после 12 месяцев лечения с помощью прибора ТМ-2421 (AND, Япония) по стандартной методике с измерением АД в дневное и ночное время с интервалом 15 и 30 минут соответственно. Определялись средние значения САД, ДАД и пульсовое артериальное давление (ПАД) (за сутки, дневные и ночные часы); индексы времени (ИВ) САД и ДАД — процент измерений АД, превышающего пороговое значение — 140/90 мм рт. ст. днем и 120/80 мм рт. ст. ночью (за сутки, дневные и ночные часы); вариабельность (В) САД и ДАД (за сутки, дневные и ночные часы); степень ночного снижения (СНС) САД и ДАД; величина утреннего подъема (ВУП) САД и ДАД — по разнице между максимальным и минимальным АД в период с 4 до 10 ч. Анализировались данные, включающие в себя не менее 86% эффективных измерений. С учетом результатов СМАД были оценены и суточные кривые (профили) АД, что позволило определить у больных типы СПАД — dippers, over-dippers, non-dippers и night-peakers. В результате оказалось, что из 97 пациентов с типом СПАД dippers было 65 человек (67,0%), non-dippers — 19 (19,6%), оver-dippers — 4 (4,1%), night-peakers — 9 (9,3%). Пациентам с ИБС было проведено холтеровское мониторирование ЭКГ с использованием программно-аппаратного комплекса Schiller Microvit MT 100 (Швейцария). Исследование осуществлялось по стандартной методике с непрерывной записью трех отведений в течение 24 часов. Из 54 пациентов с ИБС у 20 (37,1%) были выявлены ишемические изменения, в том числе у 17 (85,0%) — сопровождающиеся стенокардией. По данным ЭхоКГ, проведенного с использованием ультразвуковой диагностической системы ACUSON Sequoia 512 (США) из 54 пациентов с ИБС у 40 (74,1%) были выявлены зоны гипо- и акинеза. Гипертрофия миокарда левого желудочка была диагностирована у 72 (74,2%) из 97 пациентов с АГ. Изучение липидного профиля проведено у 590 пациентов с оценкой показателей общего холестерина, ТГ, ЛПНП, ЛПВП. Исследование выполнено на автоматических биохимических анализаторах MARS (Infopia, Ю. Корея) и Express plus (Bayer, Германия), с использованием коммерческих реактивов HUMAN и Diasys (Германия), а также CORMAY (Польша). Нормальные значения содержания липидов в плазме крови определены в Европейских рекомендациях по профилактике сердечно-сосудистых заболеваний III пересмотра (2003 г.) В соответствии с ними гиперхолестеринемия была выявлена у 21 (5,3%) пациента. Помимо этого у всех оценивался уровень болевого синдрома в спине по визуально-аналоговой шкале (ВАШ), где пациент самостоятельно отмечал уровень интенсивности болевого синдрома в интервале от 0 до 100. У пациентов обеих групп анализировалась встречаемость факторов риска остеопороза по международному минутному тесту.
Факторы риска остеопороза достаточно часто встречались у пациентов обеих групп. В I группе (больные с ССЗ) у 343 пациентов (86,6%) выявлены факторы риска, в группе контроля — у 157 (81,4%). При этом примерно с одинаковой частотой встречались дефицит половых гормонов, злоупотребление алкоголем, длительный прием кортикостероидных гормонов, наличие переломов у кровных родственников, поносы. В то же время такие факторы риска, как перенесенные атравматические переломы и снижение роста более чем на 3 см чаще диагностированы у пациентов I группы. Так, перенесенные атравматические переломы диагностированы у 22,3% пациентов I группы и у 8,8% во II группе (р < 0,05), а снижение роста более чем на 3 см в 38,3% и в 22,7% соответственно (р < 0,05).
У 285 (72%) пациентов I группы наблюдался болевой синдром в спине, в том числе на фоне сопутствующей АГ у 248 (72,5%) и ИБС — у 37 (68,5%). Во II группе боль в спине была выявлена лишь у 112 (57,7%) человек. Интенсивность болевого синдрома, оцененная по ВАШ, оказалась значительно выше в І группе, а именно у пациентов с ИБС. По результатам визуальной оценки рентгенограмм у пациентов I группы в 67 (16,9%) случаях обнаружены клиновидные деформации тел L1-L4 позвонков, во II группе у 13 (11,6%). Несмотря на прямую зависимость развития остеопороза от возраста пациентов, распространенность заболевания у пациентов с кардиоваскулярной патологией во всех возрастных группах оказалась в два раза выше, чем в группе контроля (соответственно у 178 (44,9%) и у 39 (20,1%)). В возрасте 40–49 лет остеопороз диагностирован у 6 (16,2%) пациентов I группы и у 2 (5,5%) — II, 50–59 лет — у 35 (28,7%) и у 13 (17,6%), 60–69 лет — у 69 (52,3%) и у 13 (39,4%), 70–79 лет — у 58 (72,5%) и у 5 (38,5%), старше 80 лет — в 75% и в 50% соответственно. Следует отметить, что у больных в возрасте старше 80 лет низкая МПК выявлена у всех пациентов I группы (табл. 3). Более того, среднее значение Т-критерия также было наименьшим в этой группе, особенно низким он был у пациентов с ИБС -1,9 ± 1,1 SD (ВМD 0,382 ± 0,111 г/см2) и АГ -1,6 ± 1,3 SD (ВМD 0,405 ± 0,107 г/см2), у пациентов II группы Т-критерий составил -1,1 ± 1,2 SD (ВМD 0,424 ± 0,091 г/см2).
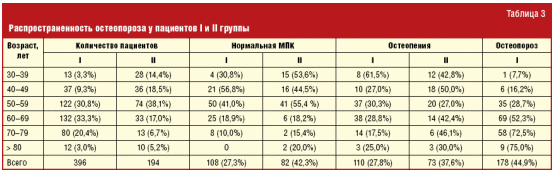
Таким образом, факторы риска остеопороза одинаково часто встречались у лиц I и II группы, 86,6% и 84,4% соответственно. Однако перенесенные атравматические переломы и снижение роста более чем на 3 см в большей частоте случаев отмечаются у пациентов I группы. Болевой синдром в нижней части спины чаще выявляется у пациентов I группы, при этом примерно в каждом 4 случае он обусловлен остеопоретическими клиновидными деформациями тел позвонков. Распространенность остеопороза у пациентов I группы в целом составила 44,9%, у пациентов II группы — 20,1%. При этом остеопороз наиболее часто диагностируется у пациентов с ИБС.
При корреляционном анализе (Spearman) зависимости Т-критерия и среднесуточного САД и ДАД у пациентов I группы не выявлено (r = -0,08, р < 0,05; r = 0,02, р < 0,05). Тем не менее, у пациентов с неконтролируемым лечением (в качестве эффективного лечения АГ выбран критерий частоты неосложненных гипертонических кризов (ГК) в неделю) выявлено, что у пациентов с ГК не чаще одного раза в неделю (рис. 2) среднее значение Т-критерия составляет -1,1 ± 0,7 SD, а при трех и более гипертонических кризах -3,2 ± 0,9 SD (р = 0,007).
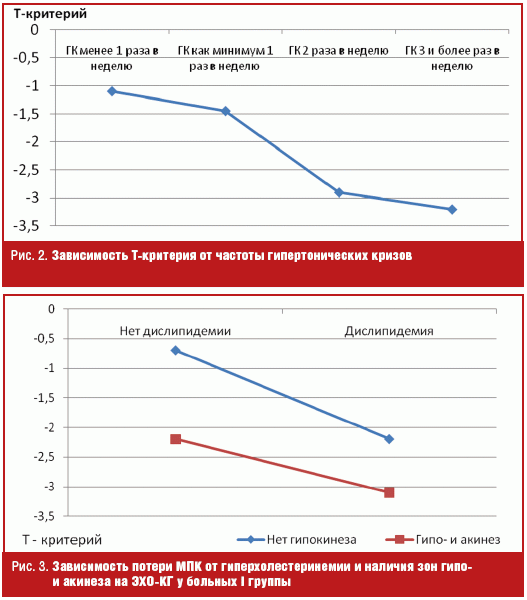
У 72 пациентов I группы при наличии гипертрофии левого желудочка (ГЛЖ) среднее значение Т-критерия составило -2,2 ± 1,1 SD, а без ГЛЖ — -1,1 ± 0,8 SD, р < 0,05. У 21 пациента I группы с гиперхолестеринемией значение Т-критерия было значительно ниже по сравнению с 21 пациентом, выбранным методом пар с нормальным уровнем липидов крови (р = 0,03). При сочетании гиперхолестеринемии и нарушений сократимости миокарда (проявление перенесенного ИМ) потеря МПК существенно больше, р = 0,04 (рис. 3).
Таким образом, уровень АД, вероятно, не является дополнительным фактором, влияющим на потерю МПК. Однако наличие органных поражений у пациентов с кардиоваскулярной патологией прогностически менее благоприятно для потери МПК. Касаясь фармакологической коррекции, следует в первую очередь обсуждать восполнение дефицита кальция и витамина D3. Необходимо отметить, что большинство экспертов считают недостаточным фармакотерапевтический потенциал нативных препаратов витамина D для активного влияния на патологические процессы и отдают приоритет активным метаболитам — кальцитриолу или синтетическому 1альфа-производному активного метаболита витамина D — альфакальцидолу. При этом стоит отметить, что большинство опубликованных рандомизированных клинических исследований (РКИ) и метаанализов подчеркивают эффективность комбинированных препаратов кальция и витамина D3. С практической точки зрения необходимо соблюдение еще одного критерия выбора препарата — высокого содержания D3 в препарате (не менее 800 МЕ). Это соответствует и позиции Международного фонда остеопороза, который в мае 2010 г. опубликовал экспертный консенсус:
Уровень в крови 25 (OH)D: не менее 75 нмоль/л, не менее 30 нг/мл.
Дозы витамина — 800–1000 МЕ (50 нг).
При ожирении, остеопорозе, недостаточном пребывании на солнце — 2000 МЕ.
Однако, как видно из рекомендаций консенсуса Международного фонда остеопороза, при выявлении последнего доза витамина D3 должна повышаться до 2000 МЕ.
Здесь необходимо остановиться на комбинированном препарате кальция, алендроната и колекальциферола — Осталон Кальций-Д. Применение данного препарата является патогенетически обоснованным и с позиции остеопороза, и с учетом влияния коррекции дефицита витамина D3 на течение соматической патологии. Следует упомянуть, что контролируемые исследования алендроната проведены у разных групп пациентов, в том числе у мужчин, при разных формах остеопороза, тогда как для ибандроната и золендроната — лишь для лечения постменопаузального остеопороза (у Акласты для старшей возрастной группы). Существует как минимум 11 РКИ, посвященных оценке эффективности алендроната. Наиболее крупными и значимыми являются исследования FOSIT, FIT и 10?летнее исследование. Алендронат показал высокую эффективность: МПК повысилась во всех областях измерения — от 5,4% в шейке бедра до 13,7% в позвоночнике (уровень доказательности А), частота переломов позвоночника снизилась на 47%, новых множественных переломов позвонков (2 и более) — на 90%, переломов бедра — на 51–56%, предплечья на 48%, прогрессирование деформаций позвонков уменьшалось у 64% больных (уровень доказательности А). Имеются бесспорные доказательства влияния длительного ежедневного приема 10 мг алендроната на снижение частоты переломов (уровень доказательности А). В метаанализе, представленном J. A. Kanis, J. E. Brazier, M. Stevenson, N. W. Calvert, M. Lloyd Jones (2002), указано достаточно значимое снижение относительного риска переломов всех локализаций.
В рандомизированных плацебо-контролируемых исследованиях показано, что прием 70 мг алендроната 1 раз в неделю эквивалентен ежедневной дозе препарата 10 мг, лучше переносится и удобен в применении (уровень доказательности В). На биопсийном материале не выявлено признаков остеомаляции. Нежелательные явления со стороны верхних отделов желудочно-кишечного тракта (эзофагит, эрозии, геморрагии, рефлюкс, гастрит, язва желудка и др.) отмечались в меньшей степени при приеме 70 мг алендроната (уровень доказательности В). Кроме того, возможность «редкого», не ежедневного, приема бисфосфонатов, в т. ч. 70 мг алендроната 1 раз в неделю, бесспорно, повышает комплаенс пациентов.
При наличии остеопороза или высокого риска остеопоротических переломов, в комплексной терапии боли необходимо назначение комбинированных препаратов кальция с витамином D3, а также алендроната в комбинации с витамином D3. Это обусловлено, в первую очередь, недостаточным содержанием витамина D3 в комбинированных препаратах с кальцием. При том что, как показано выше, назначение высоких доз D3 является патогенетически обоснованным при лечении как ССЗ, так и остеопороза.
Литература
- Diamond H., Thornley S., Smerdely R. P. 1997.
- Верткин А. Л., Моргунов Л. Ю., Наумов А. В., Полупанова Ю. С., Горулева Е. И., Аринина Е. Н., Банникова М. Б., Халваши Р. З., Ронзин А. В., Руденко Л. В. Остеопороз у пациентов с соматической патологией в зависимости от пола // Остеопороз и остеопатия. 2007, № 1, с. 25–28.
- Van’t Hof R. J., Macphee J., Libouban H., Helfrich M. H., Ralston S. H. Regulation of bone mass and bone turnover by neuronal nitric oxide synthase // Endocrinology. 2004; 145: 5068–5074.
- Hao Y. J., Tang Y., Chen F. B., Pei F. X. Different doses of nitric oxide donor prevent osteoporosis inovariectomized rats // Clin Orthop. 2005; 435: 226–231.
- Caballero-Alias A. M., Loveridge N., Lyon A., Das-Gupta V., Pitsillides A., Reeve J. NOS isoforms in adult human osteocytes: multiple pathways of NO regulation? // Calcif Tissue Int. 2004; 75: 78–84.
- Pan W., Quarles L. D., Song L. H., Yu Y. H., Jiao C., Tang H. B., Jiang C. H., Deng H. W., Li Y. J., Zhou H. H., Xiao Z. S. Genistein stimulates the osteoblastic differentiation via NO/cGMP in bone marrow culture // J Cell Biochem. 2005; 94 (2): 307–316.
- Marcovitz P. A., Tran H. H., Franklin B. A., O’Neill W. W., Yerkey M., Boura J., Kleerkoper M., Dickinson C. Z. Usefulness of bone mineral density to predict significant coronary artery disease // Am J Cardiol. 2005, 96: 1059–1063.
- Shanahan C. M. et al. High expression of genes for calcification-regulating proteins in human atherosclerotic plaque // J. Clin. Invest. 1994, № 93, p. 2393–2402.
- Giachelli C. M., Bae N., Almeida M. et al. Osteopontin is elevated during neointima formation in rat arteries and is a novel component of human atherosclerotic plaque // J Clin. Invest. 1993, № 92, р. 1686–696.
- Witztum J. L., Steinberg D. Role of oxidized low density lipoprotein in atherogenesis // J. Clin. Invest. 1991, № 88, р. 1785–1792.
- Sasaki T., Hong M. H. 1993.
- Stimpel M., Jee W. S. S., Yamamoto N. et al. 1995.
- Hatton R., Stimpel M., Chambers T. J. 1997.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






