Введение
Туберкулез легких (ТБ) является социально значимой инфекцией, которая передается воздушно-капельным путем. Заражению ТБ подвержены социально незащищенные слои населения, при отсутствии лечения или поздно начатом лечении это заболевание ведет к инвалидизации и преждевременной смертности [1–3].
Несмотря на высокую значимость этой инфекции, нельзя приуменьшать роль коморбидных и полиморбидных заболеваний, значительно ухудшающих и без того неблагоприятный прогноз. Коморбидность, согласно определению А.Р. Файнштейна, есть проявление дополнительного клинического состояния, которое существует или возникает на фоне текущего заболевания [4]. Сопутствующая патология у больных ТБ встречается примерно в 51% случаев. Из них хронические гепатиты составляют 38,9%, хроническаяобструктивная болезнь легких (ХОБЛ) — 37,8%, сердечно-сосудистые заболевания (ССЗ) — 17,8%, сахарный диабет — 15,6%, заболевания ЖКТ — 15,6% [5, 6]. Коморбидность с ХОБЛ и ССЗ занимает второе и третье место соответственно среди всех сопутствующих патологий при ТБ, причем ишемическая болезнь сердца (ИБС) среди ССЗ стоит на втором месте (12%) после артериальной гипертензии. Коморбидное сочетание ТБ с ХОБЛ и ИБС является, по сути, инвалидизирующим, а в некоторых случаях — и смертельным.
По литературным данным, от 30% до 45% больных ТБ имеют ХОБЛ [7, 8]. При наличии ХОБЛ у пациента риск заболевания ТБ увеличивается в 14,4 раза [7]. В ряде исследований показано, что при коморбидности ТБ и ХОБЛ смертность повышалась в 5 раз [8, 9], причем в половине случаев имелись еще коморбидные ССЗ. Проблема излечения ТБ у коморбидных пациентов является особенно актуальной в эпидемиологически неблагоприятных по ТБ регионах, к которым относится Сибирский федеральный округ, и требует дальнейшего изучения.
ТБ, ХОБЛ и ИБС, встречаясь у одного пациента, являются взаимно отягчающими заболеваниями, каждое из которых в равной степени может отрицательно влиять на течение другого [3, 10].
Одна из теорий взаимного отягощения — это теория эндотелиальной дисфункции [11]. Токсико-аллергические изменения при ТБ характеризуются появлением сосудистых микроциркуляторных изменений с преимущественным преобладанием экссудативной тканевой реакции и, как следствие, развитием дистрофических и некротических процессов в сосудах. Сосудистый эндотелий легких в норме продуцируют мощные вазодилататоры, регулирующие работу сократительных гладкомышечных клеток. При альвеолярной гипоксии и падении парциального напряжения кислорода в крови наступает ухудшение освобождения релаксирующего фактора, что оказывает отрицательное регулирующее влияние на сосуды [11].
Согласно другой теории выделяют иные патофизиологические факторы, посредством которых туберкулезная инфекция как системный процесс может привести к ССЗ [12]. Они включают в себя системное воспаление, которое при хроническом течении со временем приводит к образованию атеросклеротических бляшек и их разрыву [12]. В частности, воспалительные процессы усиливают секрецию растворимых молекул адгезии лейкоцитов, которые способствуют прикреплению моноцитов к эндотелиальным клеткам [13]. Считается, что последующая трансформация моноцитов в макрофаги в сочетании с поглощением холестериновых липопротеинов одновременно инициирует и ускоряет рост атеросклеротической жировой бляшки. По мере прогрессирования атеросклеротических бляшек они становятся покрытыми «шапкой» гладкомышечных клеток и богатой коллагеном матрицы, которая может разрываться при срабатывании различных воспалительных стрессоров. В случае ТБ лица с активным заболеванием имеют повышенный уровень провоспалительных цитокинов, которые ассоциированы с повышенным риском развития ССЗ [14]. В частности, интерлейкин-6 ассоциирован с инсулинорезистентностью, дислипидемией и эндотелиальной дисфункцией, а также ингибирует липазу липопротеидов и стимулирует липолиз, экспрессируется в жировых отложениях и атероматозной «шапочке», что позволяет предположить роль этого провоспалительного цитокина в прогрессировании атеросклероза [14].
В современных рекомендациях имеется достаточно данных с высокой степенью доказательности по вопросам лечения отдельных нозологий (ХОБЛ, ИБС, ТБ), которые обязательны к применению при ведении пациентов с этими нозологиями. Проблема же ведения коморбидной категории больных недостаточно изучена и аргументирована в выборе средств, нуждается в детализации и дополнительной разработке. Это обусловлено также тем, что лечение больных ТБ требует длительного, непрерывного и одновременного приема нескольких антибактериальных препаратов, которые, помимо терапевтического эффекта, нередко оказывают повреждающее действие непосредственно на миокард, ухудшая гемодинамические параметры [15], усугубляя ишемию миокарда. До настоящего времени остаются малоизученными варианты терапии ИБС, ее эффективность и переносимость на фоне одновременного лечения впервые выявленного ТБ и ХОБЛ. Цель данного исследования — оптимизация терапии ИБС у коморбидных пациентов с ТБ, ИБС и ХОБЛ.
Материал и методы
Нами проведено простое сравнительное проспективное исследование на базе БУЗОО «КПТД». Продолжительность периода наблюдения составила 3 мес. Исследование было выполнено в соответствии со стандартами Надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России.
Критериями включения являлись наличие впервые выявленного ТБ, наличие ХОБЛ средней и тяжелой степени, наличие хронической формы ИБС в виде стабильной стенокардии II или III функционального класса (ФК) по Канадской классификации, подписанное информированное согласие на участие в исследовании.
Критериями исключения были внелегочный ТБ, наличие ВИЧ, гепатита, наличие эндоваскулярного стентирования сосудов в анамнезе, наличие острого инфаркта миокарда в анамнезе, наличие других заболеваний, проявляющихся стенокардией (пороки сердца, кардиомиопатии, системные васкулиты, анемия), диагностированная ранее артериальная гипертензия, нежелание пациентов участвовать в исследовании.
В исследование были включены 68 пациентов (48 [70,5%] мужчин, 20 [29,5%] женщин) с ТБ, ХОБЛ и ИБС. Средний возраст пациентов составил 65,35±9,9 года. Диагноз ХОБЛ и ИБС был выставлен ранее, на предшествующих этапах. Нашей основной задачей было в период госпитализации в противотуберкулезный диспансер (ПТД) пациентов с первичным ТБ подобрать и провести адекватную эффективную антиишемическую терапию с минимизацией побочных эффектов так, чтобы с одновременно проводимой терапией ХОБЛ и ТБ было достигнуто сокращение сроков бактериовыделения. Инфильтративный ТБ был у 60 больных (88,2±3,9%), очаговый ТБ — у 6 больных (8,8±3,4%), диссеминированный ТБ — у 1 больного (1,5±1,5%), фиброзно-кавернозный ТБ — у 1 больного (1,5±1,5%). Пациенты получали лечение в соответствии с I и III режимами химиотерапии. ХОБЛ средней тяжести констатирована у 55 пациентов, тяжелой степени — у 13 пациентов. Все они получали антихолинергические препараты длительного действия. Пациенты со среднетяжелой ХОБЛ получали длительно действующие антихолинергические препараты (тиотропия бромид 18 мкг, по 1 дозе 1 р/сут). Пациенты с тяжелой ХОБЛ получали комбинированные бронхолитические препараты: длительно действующие β2-агонист и длительно действующие антихолинергик — олодатерол + тиотропия бромид 2,5 + 2,5 мг, по 2 дозы 1 р/сут.
В зависимости от характера назначенной индивидуализированной антиишемической терапии пациенты были разделены на 4 группы (n=17 в каждой), в которые в равных долях попали пациенты с тяжелой и среднетяжелой ХОБЛ. Все 4 группы пациентов были сопоставимы по возрасту, полу и тяжести сопутствующей патологии.
Подбор терапии проводили согласно клиническим рекомендациям по лечению пациентов со стабильной ИБС [16]. Для терапии пациентов со стабильной ИБС применялись лекарственные средства, имеющиеся в наличии в ПТД: бисопролол, амлодипин, верапамил, нитросорбид, триметазидин. Возможности применения препаратов других групп, в частности ингибиторов If-каналов или верапамила пролонгированного действия, были ограничены списком средств, закупаемых в ПТД.
Бисопролол и верапамил назначались методом титрования до достижения клинического эффекта (переход стенокардии напряжения ФК II–III в ФК I) и/или проявления побочных эффектов, приводящих к снижению дозы или отмене препарата. Бисопролол назначали в стартовой дозе 5 мг/сут, при хорошей переносимости дозу увеличивали через 1–2 нед. на 2,5 мг, доходя через 2–3 нед. до дозы 10 мг/сут. Каждую неделю по клиническим данным принималось решение о достаточности антиишемического эффекта бисопролола в достигнутой дозе. При появлении побочных эффектов бисопролола в виде усиления (появления) кашля или одышки доза уменьшалась до предыдущей. В случае сохранения стенокардии ФК II–III и/или сохранения побочных эффектов принимали решение о замене бисопролола на верапамил в стартовой дозе 40 мг 3 р/сут.
Титрация дозы верапамила начиналась с 40 мг 3 р/сут. Еженедельно дозу увеличивали на 40 мг утром, на следующей неделе — 40 мг в обед и на 4-й неделе — 40 мг вечером, так что через 4 нед. достигали дозы 80 мг 3 р/сут. При титрации дозы бисопролола и верапамила ежедневно контролировали уровень АД, еженедельно проводили ЭКГ в покое для оценки частоты ритма, длительности атриовентрикулярной и желудочковой проводимости.
Пациенты из 1-й группы получали бисопролол и амлодипин (10 мг/сут) однократно (Б+А), из 2-й группы — бисопролол и нитросорбид (10 мг за 30 мин до ожидаемой нагрузки 2–3 р/сут с еженедельными перерывами в 2 дня) (Б+Н), из 3-й группы — бисопролол и триметазидин (80 мг/сут однократно) (Б+Т), из 4-й группы — верапамил и триметазидин (80 мг/сут однократно) (В+Т).
Лечение проходило в условиях стационара, все препараты выдавались пациентам средним медицинским персоналом и принимались в присутствии медработника. Вся терапия была контролируемой, включая антиишемическую, противотуберкулезную и терапию ХОБЛ.
Для оценки клинической эффективности различных вариантов антиишемической терапии использованы следующие показатели, отражающие уровень физической активности пациентов и степень насыщения кислородом крови пациента с коморбидной бронхолегочной и сердечно-сосудистой патологией:
количество таблеток нитроглицерина в неделю как показатель количества приступов загрудинных болей в неделю;
расстояние, которое пациент преодолевает до возникновения приступа загрудинных болей (соответствует функциональному классу стенокардии);
сатурация артериальной крови, измеренная методом пульсоксиметрии (SpO2).
Все пациенты, включенные в исследование с впервые выявленным ТБ, являлись бактериовыделителями, в связи с чем мы были ограничены диагностическими возможностями отделения функциональной диагностики ПТД. Всем пациентам проводилось суточное мониторирование ЭКГ по Холтеру в начале терапии и через 3 мес. регулярного приема антиишемических препаратов для сравнения по группам наблюдения. Для анализа были взяты показатели минимальной, максимальной и средней ЧСС, вариабельность ритма (циркадный индекс), динамика сегмента ST (для анализа была выбрана только диагностически значимая депрессия ST более 2 мм) как показатель, который быстрее других может изменяться при применении антиишемической терапии. Данный метод был выбран как информативный, доступный и воспроизводимый в условиях БУЗОО «КПТД». В связи с наличием бактериовыделения у пациентов ПТД не было возможности применить наиболее объективный метод изучения ишемии миокарда — пробу с физической нагрузкой в условиях диагностического центра и других специализированных клиник.
Статистическую обработку данных проводили с помощью программного пакета Statistica 8.0 (StatSoft, Inc., USA). Результат записывали в абсолютных цифрах, учитывая, что количество пациентов в 4 группах одинаковое (n=17). Запись средних значений производилась как Ме; 25,0–75,0, где Ме — медиана, 25,0 — нижний% квартиль; 75,0 — верхний% квартиль. Для оценки достоверности различий показателей между группами использовали непараметрические критерии Z-Test Wald-Wolfowitz, χ2 с поправкой Йетса (учитывая малое количество пациентов в группах). При сравнении параметров внутри одной группы до и после лечения использовался Z-критерий (Wilcoxon). Уровень статистической значимости при проверке нулевой гипотезы принимали соответствующим р<0,05.
Результаты и обсуждение
На момент включения в исследование достоверных различий при попарном сравнении групп по ФК стенокардии, количеству приступов в неделю, уровню физической активности и показателям мониторирования ЭКГ по Холтеру не было (табл. 1). Сравнительный анализ эффективности терапии представлен в таблицах 1, 2 и 3.
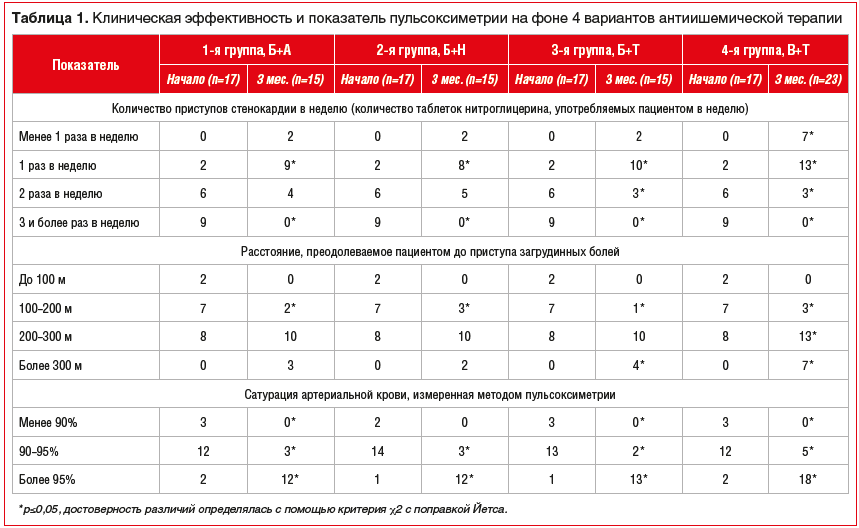

На фоне проводимой терапии имелась положительная динамика по минимизации количества приступов загрудинных болей в неделю при увеличении расстояния, которое пациент может преодолеть до возникновения приступа (см. табл. 1). Именно триметазидин показал наилучшую переносимость и оказывал положительное влияние на физическую активность пациентов в условиях гипоксии. Возможно, он также действовал как сердечный цитопротектор в условиях химиотерапии противотуберкулезными средствами, имеющими кардиодепрессивный эффект [15]. У пациентов из групп 1 и 2 (Б+А и Б+Н соответственно) отмечались эпизоды гипотонии, связанные, по-видимому, с однонаправленным действием препаратов в отношении АД.
Для оценки ЧСС как основного целевого показателя на фоне лечения β-блокатором были проанализированы данные ЭКГ-мониторирования по Холтеру до лечения и спустя 3 мес. (табл. 2).
На момент включения в исследование статистически значимых различий при попарном сравнении групп по уровню показателей ЧСС не было. Через 3 мес. терапии во всех группах была получена положительная динамика с различной степенью снижения ЧСС в группах с достижением целевых значений (см. табл. 2). Снижение ЧСС происходило как в покое, так и при физической нагрузке, что отражали показатели минимальной, средней и максимальной ЧСС. Статистически значимое урежение ЧСС отметили у пациентов из 3-й (Б+Т) и 4-й групп (В+Т) терапии (см. табл. 2). Данные изменения можно объяснить фармакологическим эффектом используемых препаратов: бисопролол и верапамил урежают ЧСС, а нитросорбид вызывает учащение ЧСС, амлодипин и триметазидин не влияют на ЧСС.
В группах, получающих бисопролол в комбинации с амлодипином или нитросорбидом, отсутствовали статистически значимые различия в снижении ЧСС за 3 мес. терапии. По-видимому, бисопролол и верапамил имеют примерно одинаковый эффект в отношении ЧСС у данной категории пациентов, что соответствует литературным данным [17, 18], однако лучшая переносимость верапамила позволяет достичь больших дозировок и более выраженного снижения ЧСС у данной категории коморбидных пациентов.
Необходимо отметить, что у 16 из 51 (31,4%) пациента, получавшего бисопролол, на различных этапах проводили коррекцию терапии. После достижения дозы 7,5–10 мг/сут остановка титрации и снижение дозы до 5–7,5 мг/сут в связи с появлением или усилением кашля и/или одышки (проявлений бронхообструкции) имели место у 16 пациентов, причем все пациенты страдали тяжелой ХОБЛ и разными формами ТБ. В стационаре такая коррекция была возможной, поскольку осмотр пациента проводили ежедневно. Потребовалась отмена бисопролола у 6 пациентов (по 2 больных из 1-й, 2-й и 3-й групп; 6/51 [11,8%]) с коморбидной бронхолегочной патологией в связи с усугублением бронхообструкции в виде усиления кашля и/или одышки. Из них 4 пациентам была остановлена титрация на дозах 5 мг/сут или 7,5 мг/сут без достижения антиангинального эффекта; эти пациенты были переведены на терапию верапамилом. Еще 2 пациентам пришлось снизить дозу бисопролола с 10 мг до 5 мг, а затем отменить препарат из-за сохранения кашля и также перейти на терапию верапамилом. Использование верапамила 3 р/сут в условиях стационара ПТД показало преимущества в плане переносимости терапии и ее эффективности — удовлетворительный клинический и ритм-урежающий эффект в терапевтической дозе 180–240 мг/сут. Случаев отмены верапамила из-за побочных эффектов (снижение АД или удлинение атриовентрикулярной проводимости) не было. Можно предположить, что такой эффективности верапамила при 3-кратном применении в сутки удалось добиться благодаря тому, что пациенты получали лечение в условиях стационара и принимали препараты в присутствии медицинских работников. В амбулаторных условиях необходимость принимать препарат 3 р/сут может снизить эффективность терапии из-за недостаточной комплаентности. В амбулаторных условиях может быть рекомендовано применение верапамила в лекарственной форме «таблетки пролонгированного действия».
Еще одним специфическим признаком проявления ишемии у пациентов с ИБС являлась горизонтальная или косонисходящая депрессия сегмента ST глубиной не менее 0,1 мВ, продолжительностью не менее 0,06–0,08 с от точки J в одном и более ЭКГ-отведений. Для объективизации ишемических изменений нами проанализирована частота встречаемости эпизодов депрессии ST (2 и более мм) при холтеровском мониторировании ЭКГ.
На следующем этапе исследования мы провели сравнительный анализ эффективности антиишемической терапии в группах сравнения по влиянию различных сочетаний препаратов на частоту эпизодов ишемии по результатам мониторирования ЭКГ по Холтеру (табл. 4).
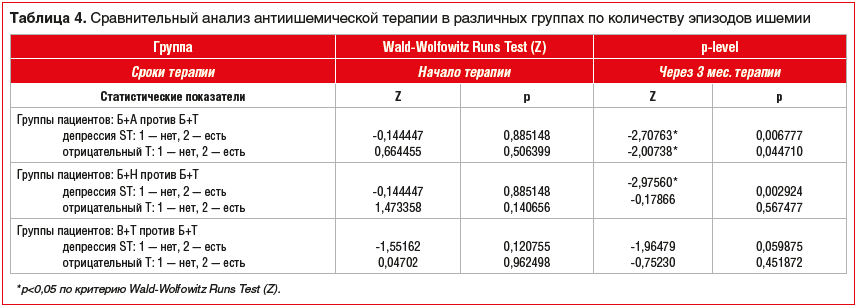
Статистически значимые различия в пользу урежения эпизодов ишемии получены при попарном сравнении в пользу группы пациентов, получавших Б+Т, в сравнении с группами, получавшими Б+А и Б+H. Также статистически значимые различия получены в пользу В+Т против Б+Т.
Использование триметазидина в сочетании с β-адреноблокаторами (БАБ) или верапамилом для данной категории коморбидных пациентов является оптимальным с точки зрения урежения ритма и минимизации эпизодов депрессии сегмента ST по ЭКГ как проявления ишемии миокарда. Верапамил в дозах 180–240 мг/сут в комбинации с триметазидином 80 мг/сут (В+Т) имели одинаковый положительный антиишемический эффект с терапией Б+Т при условии достижения дозы бисопролола 7,5 мг/сут и более в комбинации с триметазидином 80 мг/сут. В то же время при нарастании бронхолегочных симптомов, связанных с увеличением дозы бисопролола, верапамил имел явные преимущества. Схема лечения В+Т имела наилучшую переносимость у коморбидных пациентов (ХОБЛ + ТБ) при достаточных ритмурежающем и антиангинальном/антиишемическом эффектах.
Триметазидин, в отличие от нитратов и других антиангинальных средств, не влияет на гемодинамические параметры (АД и ЧСС), что улучшает переносимость терапии и повышает приверженность пациентов лечению. Защитное действие, которое оказывает триметазидин на кардиомиоциты в условиях ишемии, носит комплексный характер. Триметазидин частично переключает энергетический обмен с окисления длинноцепочечных жирных кислот на окисление глюкозы, что оптимизирует использование кислорода и увеличивает синтез АТФ в условиях ишемии, а также способствует быстрой нормализации кислотно-щелочного равновесия и запасов креатинфосфата при восстановлении кровотока в коронарных сосудах [19].
Верапамил в сравнении с бисопрололом также обладает рядом преимуществ у пациентов с коморбидной бронхолегочной патологией, способствуя урежению ЧСС, антиангинальному и кардиопротективному эффектам без усугубления бронхообструктивного синдрома. По литературным данным, селективные β1-адреноблокаторы и недигидропиридиновые антагонисты кальция обладают сопоставимым антиангинальным и антиишемическим действием без отрицательного влияния на бронхиальную проходимость [16–18]. Кроме того, отмечается, что при длительном приеме БАБ возможно их положительное влияние на восстановление функции эндотелия как прогностически благоприятного компонента. Следовательно, длительное использование селективных β1-адреноблокаторов у пациентов с коморбидной бронхолегочной и сердечно-сосудистой патологией возможно при удовлетворительной переносимости с ожидаемым прогностически благоприятным действием на функции эндотелия.
Для дигидропиридиновых антагонистов кальция (амлодипин) известен эффект бронходилатации и снижения давления в малом круге кровообращения, что имеет особенные преимущества в лечении данной категории коморбидных пациентов. Однако комбинация амлодипина с бисопрололом в нашем исследовании у коморбидных пациентов с ТБ, ХОБЛ и ИБС не показала преимуществ, по-видимому, вследствие нивелирования бисопрололом указанных эффектов амлодипина. Комбинация Б+А усиливала гемодинамические побочные эффекты снижения АД, что в отсутствие артериальной гипертензии у пациентов приводило к эпизодам гипотонии и тахикардии, не требующим отмены препаратов.
При оценке влияния антиангинальной/антиишемической терапии на эффективность химиотерапии ТБ у коморбидных пациентов с ТБ, ХОБЛ и ИБС были получены следующие данные. По результатам 3 мес. терапии негативация мазка достигнута у 7 (41,2%) пациентов в группе Б+А, 8 (47,1%) пациентов в группе Б+Н, 11 (64,7%) пациентов в группе Б+Т и 10 (58,8%) пациентов в группе В+Т. Отмечено, что при адекватной и хорошо переносимой антиангинальной терапии (В+Т и Б+Т) положительная динамика в лечении ТБ отмечалась быстрее, вследствие чего у более чем 50% пациентов (58,8–64,7%) отмечена негативация мазка через 3 мес. терапии: это произошло в группах пациентов, получавших терапию на основе триметазидина в комбинации с верапамилом или бисопрололом (В+Т или Б+Т).
Заключение
Оптимальное лечение ИБС на сегодняшний день определяется как лечение, которое контролирует симптомы и предотвращает связанные с ИБС кардиальные события при максимальной приверженности пациента лечению и минимальных побочных эффектах. Кроме того, важнейшим аспектом лечения пациентов с ТБ, ИБС и ХОБЛ являлось выздоровление от ТБ. Необходимо также учитывать, что сама химиотерапия ТБ токсически действует на сердечно-сосудистую систему, ухудшая гемодинамические параметры и усиливая ишемические проявления [15].
Положительный эффект был получен во всех 4 группах лечения: Б+А, Б+Н, Б+Т, В+Т. Это связано с назначением адекватной терапии согласно клиническим рекомендациям по лечению стабильной ишемической болезни сердца 2019 г. [16]. Другим положительным аспектом лечения в условиях стационара являлась его контролируемость медицинским персоналом, что обеспечивало регулярный прием препаратов больными. Верапамил в дозе 180–240 мг/сут в комбинации с триметазидином 80 мг/сут (В+Т) имели примерно одинаковый положительный антиангинальный/антиишемический эффект в сравнении с режимом терапии Б+Т при условии достижения дозы бисопролола 7,5 мг/сут и более в комбинации с триметазидином 80 мг/сут. В то же время при нарастании бронхолегочных симптомов, связанных с увеличением дозы бисопролола, верапамил имеет явные преимущества. Терапия верапамилом с триметазидином имела наилучшую переносимость у пациентов с ТБ, ИБС и ХОБЛ при достаточных ритмурежающем и антиангинальном/антиишемическом эффектах. Вероятнее всего, у пациентов с бронхолегочной патологией, получавших противотуберкулезные препараты, которые сами по себе могут нарушать работу сердца и оказывать дополнительное повреждающее действие на сосудистую стенку, назначение триметазидина оказывало цитопротективное действие на миокард в условиях гипоксии. К положительным свойствам триметазидина можно отнести и отсутствие дополнительных гемодинамических эффектов, приводящих к гипотонии и тахикардии, как в случае комбинаций Б+А и Б+Н. Эффективное лечение пациента со стенокардией высокого ФК с устранением повседневных симптомов ишемии миокарда на основе триметазидина в комбинации с верапамилом или бисопрололом позволяло не только улучшить субъективное состояние пациентов, но и напрямую способствовало повышению комплаентности пациентов, в т. ч. в лечении ТБ, с достижением негативации мазка в течение 3 мес. более чем у половины больных (58,8–64,7%). Таким образом, можно предположить, что эффективная антиангинальная терапия способствовала в итоге более быстрому абациллированию пациентов.
.
Информация с rmj.ru






