Содержание статьи
Особенности метаболизма эндотоксинов у детей с хроническими вирусными гепатитами и возможности терапии
Е. А. Жукова, доктор медицинских наук, профессор
Е. И. Шабунина, доктор медицинских наук, профессор
С. В. Романова, кандидат медицинских наук
М. В. Грошовкина
Л. В. Коркоташвили, кандидат биологических наук
Т. А. Видманова, кандидат медицинских наук
ФГБУ ННИИДГ МЗ РФ, Нижний Новгород
Проблема хронического поражения печени является одной из наиболее сложных в гастроэнтерологии. Несмотря на достигнутый значительный прогресс в диагностике, терапии и профилактике хронических вирусных гепатитов C (ХГС) и В (ХГВ), они продолжают оставаться серьезной медико-социальной проблемой в современном мировом здравоохранении. Это обусловлено их широким распространением среди взрослого и детского населения [1–4], трудностями и недостаточной эффективностью терапии, тяжелыми последствиями данных заболеваний с развитием цирроза печени и гепатоцеллюлярной карциномы у 20–60% больных [5, 6], приводящими к ранней инвалидизации и смерти молодого населения.
Одну из ведущих ролей в развитии патологического процесса при гепатитах различной, в том числе и вирусной этиологии играет эндогенная интоксикация, отражая формирование определенного метаболического ответа организма на воздействие агрессивного фактора. Основной причиной высокого катаболического пула веществ низкой и средней молекулярной массы служит несостоятельность детоксицирующей функции печени. Считается, что при ее нарушении изменяется активность ферментов, принимающих участие в обезвреживании различных метаболитов с их накоплением в крови [7–9].
Вопросы патогенеза и коррекции эндотоксикоза широко рассмотрены в литературе при различных нозологиях, в том числе при патологии печени [10, 11], однако в детском возрасте его аспекты разработаны недостаточно и представлены лишь в единичных исследованиях [12].
Целью настоящего исследования явилось оценить состояние детоксицирующей функции печени и способы коррекции при ХГС и ХГВ в детском возрасте.
Материалы и методы исследования
В данном проспективном открытом клиническом исследовании участвовали дети в возрасте от 6 до 17 лет с хроническими вирусными заболеваниями печени, из них 35 человек с ХГВ и 54 пациента с ХГС. Исследование проводилось в Клинике патологии верхних отделов пищеварительного тракта ФГБУ ННИИДГ МЗ РФ с разрешения Локального этического комитета. Все пациенты и их родители дали информированное согласие на проведение обследования и использование их медицинской документации. Полученные результаты сопоставлялись с данными группы сравнения, в которую входили дети 6–17 лет, относящиеся к 1-й и 2-й группам здоровья. При анализе данных также использовались нормативы биохимических показателей, разработанные научными сотрудниками института [13].
Диагноз хронического гепатита устанавливался на основании клинических и общепринятых лабораторно-инструментальных исследований. Всем больным проводили биохимические и иммунологические анализы крови. Для верификации диагноза определяли серологические маркеры вируса гепатита В (НВV) и вируса гепатита С (НСV), наличие ДНК и РНК этих вирусов выявляли с помощью полимеразной цепной реакции.
Состояние детоксицирующей функции печени оценивалось по ряду биохимических параметров. Пул веществ низкой и средней молекулярной массы (МСМ) выявлялся по методу М. Я. Малаховой [14]. В его основе лежит осаждение крупномолекулярных белков плазмы крови раствором трихлоруксусной кислоты (ТХУ) 150 г/л и регистрации спектральной характеристики водного раствора супернатанта в зоне длин волн от 238 до 296 нм.
Активность алкогольдегидрогеназы (АДГ) определялась по методу A. Shimasue, M. Murakami, T. Tsubokuro, основанному на определении количества образующегося НАДН в реакции этанола с никотинадениндинуклеотидом (НАД) [15].
Активность альдегиддегидрогеназы (АцДГ) определялась прямой реакцией по методу Б. М. Кершенгольц и Е. В. Серкиной [16], в основе которого лежит изменение оптической плотности в результате взаимодействия АцДГ плазмы крови с ацетальдегидом в начале реакции, через 30 (Е30) и 60 (Е60) минут.
У 40 детей в возрасте от 6 до 17 лет с хроническим гепатитом С (ХГС) и хроническим гепатитом В (ХГВ) было оценено детоксицирующее действие различных терапевтических комплексов, из них 20 человек наряду с применением гепатопротекторов и иммунокорректоров получили терапию с включением лактулозы, 20 пациентов принимали метадоксин. Дети сравниваемых групп были сопоставимы между собой до начала лечения по основным параметрам: возрасту, полу, давности и фазе заболевания, активности воспалительного процесса в печени. В данные группы вошли больные, не получавшие в том момент противовирусного лечения, а именно — закончившие курс противовирусной терапии, не ответившие на интерферонотерапию, имеющие рецидив или прорыв вирусной репликации, либо имеющие противопоказания к назначению парентеральных интерферонов.
Статистическая обработка полученных результатов проведена с использованием программы Statistiсa 6.0. Количественные показатели представлены в виде среднего арифметического значения (М) + стандартной ошибки средней (m). Достоверность различий между группами определялась с применением критерия Стьюдента. Статистически значимыми считали различия при р < 0,05 [17].
Результаты и их обсуждение
Среди наблюдаемых детей преобладали больные 13–17 лет (53%), средняя давность заболевания при НСV- и НВV-инфекциях составила 6,9 ± 0,5 года. У большинства больных с хроническими вирусными гепатитами определялась репликация вируса — у 70% РНК HCV+, у 77% — ДНК HBV+ в сыворотке крови. Более чем у половины детей присутствовала активность патологического процесса в печени.
Результаты клинико-лабораторных сопоставлений показали, что у больных хроническими заболеваниями печени определялись изменения параметров, характеризующих эндотоксикоз, таких как молекулы низкой и средней молекулярной массы. Кроме того, выявлялся дисбаланс активности ферментов детоксикации. Установлено, что при хронических гепатитах показатели эндогенной интоксикации характеризовались превышением их уровня в плазме со снижением на эритроцитах и неизмененным содержанием в моче по сравнению с нормой (табл. 1). Так, МСМ в плазме составили при ХГС 9,32 ± 0,29 у.е. (р = 0,000), ХГВ 10,31 ± 0,42 у.е. (р = 0,000). Их величина в эритроцитах и моче колебалась соответственно от 20,16 ± 0,67 у.е. до 21,19 ± 0,87 у.е. (р = 0,000 — р = 0,000) и от 20,00 ± 1,49 у.е. до 23,13 ± 1,85 у.е. (р = 0,165 — р = 0,933). Максимальное повышение содержания МСМ в плазме регистрировалось при наличии виремии и биохимической активности (табл. 2). В фазу реактивации ХГС и репликации ХГВ оно составило 9,72 ± 0,31 у.е. и 10,63 ± 0,44 у.е., а при отсутствии возбудителя — 8,05 ± 0,51 у.е. (р = 0,034) и 8,59 ± 0,79 у.е. (р = 0,04). При активном гепатите значения МСМ в плазме при НСV-инфекции были на уровне 9,81 ± 0,35 у.е., а при более низкой ферментемии соответственно 8,37 ± 0,41 у.е. (р = 0,032) (табл. 3). Это свидетельствует о нарастании эндотоксикоза в присутствии вирусов в крови и высоких значениях аланинаминотрансферазы, что требует медикаментозной коррекции.

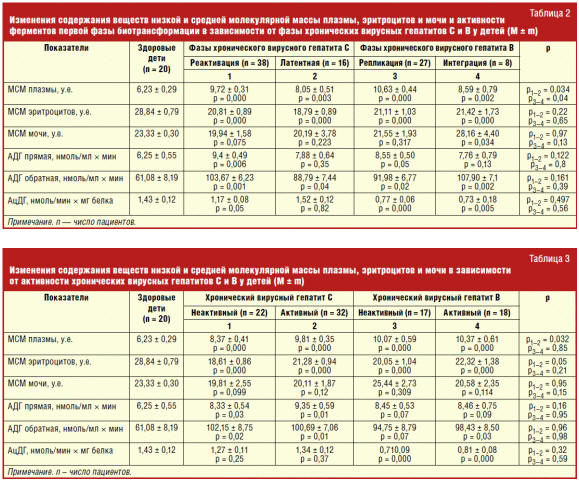
Следовательно, у детей с хроническими вирусными гепатитами преимущественное накопление метаболитов происходит в плазме крови. При оценке выраженности эндотоксикоза следует, прежде всего, ориентироваться именно на величину МСМ в плазме, так как они отражают активность воспалительного процесса в печени и уровень виремии при изучаемых заболеваниях.
Наряду с маркерами эндотоксикоза у пациентов с хроническими гепатитами была рассмотрена активность ферментов детоксикации.
У детей с ХГС и ХГВ определялось увеличение активности прямой АДГ в сыворотке крови. Значения фермента превышали уровень здоровых детей только при наличии виремии и не зависели от степени цитолиза. Аналогично этому отмечалось повышение АДГ в обратной реакции, не связанное с наличием вирусов в крови и выраженностью воспалительного процесса как при ХГС, так и ХГВ (табл. 1–3).
Описанные изменения уровня фермента, по-видимому, взаимосвязаны с синдромом эндогенной интоксикации, на что указывала корреляция значений прямой АДГ с уровнем МСМ в плазме (R = 0,23; р = 0,045). Увеличение ее активности в обеих реакциях приводит к повышенной выработке альдегидов и спиртов и тем самым способствует поддержанию эндотоксикоза.
Определенный интерес представляет изучение АцДГ, поскольку она способна необратимо обезвреживать токсичные продукты. Впервые отмечено, что при ХГВ содержание АцДГ в сыворотке крови отчетливо уменьшалось независимо от фазы и активности процесса, тогда как при НСV-инфекции низкие значения уровня фермента регистрировались только при виремии (табл. 1–3). Подобное уменьшение активности АцДГ, по-видимому, способствует накоплению метаболитов в крови. Таким образом, у детей с хронической НВV-инфекцией определена выраженная депрессия данного фермента, причиной которой может быть снижение компенсаторных возможностей системы детоксикации, обусловленное выраженным воспалительно-деструктивным процессом в печени с накоплением токсических метаболитов. Они способны, в свою очередь, оказывать отрицательное влияние на обезвреживающую способность гепатоцита. По-видимому, при ХГС функция немикросомального окисления альдегидов детоксицирующей системы более сохранна, что может объясняться особенностями действия РНК-вируса на клетки печени.
Имеющий место дисбаланс ферментов первой фазы биотрансформации у детей с хроническими вирусными гепатитами, взаимосвязанный с эндогенной интоксикацией, указывает на необходимость коррекции терапии у данного контингента больных.
В этом плане перспективным является оценка влияния на биохимические нарушения новых схем комплексной терапии с использованием препаратов лактулозы и метадоксина, которые относятся к дезинтоксикационным и гепатопротективным средствам, повышают устойчивость печени к патологическим воздействиям, усиливают ее обезвреживающую функцию путем активации различных ферментных систем, тем самым замедляя прогрессирование заболевания. В частности, лактулоза, оказывая гипоаммониемическое, слабительное, гиперосмотическое действие, способствует выведению продуктов распада белка, преимущественно аммиака, и за счет этого уменьшает его содержание в крови. Метадоксин действует сразу на несколько механизмов детоксикации — обезвреживания аммиака, систему биотрансформации и инактивацию желчных кислот. Препарат активирует ферменты первой фазы биотрансформации, ускоряя процессы окисления и элиминации этанола и ацетальдегида, нормализует баланс свободных ненасыщенных жирных кислот в плазме, препятствует возникновению структурной дегенерации гепатоцитов, подавляет синтез фибронектина и коллагена, снижает вероятность развития фиброза печени [18, 19].
Пациенты с ХГС и ХГВ были разделены на две группы. Дети первой группы (20 человек) получали в составе комплексной терапии лактулозу в возрастной дозировке 5–15 мл 1 раз в сутки. Больным второй группы (20 пациентов) назначали метадоксин по 500 мг ежедневно 2 раза в день. Продолжительность лечения составила 1 месяц.
У детей, принимавших лактулозу, уровень МСМ в крови и моче не имел выраженной динамики. Содержание МСМ в плазме сохранялось повышенным — 8,94 ± 0,72 у.е. (р = 0,000). Ферменты первой фазы биотрансформации также не изменялись в процессе лечения с сохранением высокой активности АДГ в прямой и обратной реакциях. Таким образом, прием лактулозы в течение 1 месяца не позволил скорректировать нарушения показателей системы детоксикации.
У пациентов на фоне терапии с включением метадоксина отмечалась выраженная позитивная динамика показателей эндотоксикоза, характеризующаяся достоверным снижением концентрации МСМ в плазме крови с 10,66 ± 0,47 у.е. до 7,70 ± 0,52 у.е. (р = 0,006) (табл. 4). Ферменты биотрансформации имели разнонаправленные изменения: активность прямой АДГ в сыворотке крови во время лечения оставалась увеличенной. При этом данный фермент в обратной реакции и АцДГ сыворотки крови достигали нормальных значений. Следует отметить, что активность последней значительно возрастала с 0,93 ± 0,10 нмоль/мин × мг белка до 1,69 ± 0,09 нмоль/мин × мг белка (р = 0,000) и к окончанию курса терапии не отличалась от уровня здоровых детей (р = 0,091).
Поскольку АцДГ способна окончательно переводить альдегиды в нетоксичные кислоты, увеличение ее уровня должно способствовать улучшению метаболического статуса организма. Таким образом, дезинтоксикационное действие препарата проявлялось как в снижении концентрации веществ низкой и средней молекулярной массы, так и в нормализации активности ферментов первой фазы биотрансформации (табл. 4).

При индивидуальном анализе было установлено, что наиболее выраженный положительный эффект от применения метадоксина был отмечен у детей с исходно более низкой активностью АцДГ (ниже нормы более чем на 50%) и сопровождался улучшением функционального состояния печени по традиционным биохимическим показателям. Представленные результаты применения данных схем свидетельствуют о положительном влиянии комплексной терапии с использованием дезинтоксикационных лекарственных средств на систему обезвреживания у больных ХГС и ХГВ.
Выводы
Таким образом, результаты динамического наблюдения за детьми с хроническими вирусными гепатитами С и В свидетельствовали о значительных изменениях метаболического статуса организма и систем обезвреживания с нарастанием эндотоксикоза и дисбаланса ферментов биотрансформации. Большинство выявленных изменений в системах детоксикации наблюдались не только при активации заболеваний, но и при отсутствии цитолиза и виремии при ХГС и ХГВ. Это указывает на стойкость патологического процесса в печени и возможность его рецидивирования.
У детей с хроническими гепатитами установлена взаимосвязь уровня компонентов эндогенной интоксикации с изменениями активности ферментов биотрансформации.
Отмечено, что при выявлении у детей с ХГС и ХГВ повышенного уровня эндогенной интоксикации и дисбаланса ферментов биотрансформации, в составе комплексной терапии оправдано применение гепатопротективных препаратов, обладающих дезинтоксикационным действием. Наиболее отчетливый метаболический эффект был отмечен при использовании метадоксина, что выражалось в уменьшении уровня молекул средней массы в плазме крови и нормализации ферментов первой фазы биотрансформации.
Литература
- Гепатиты. Рациональная диагностика и терапия. Под ред. Михаэля Фукса; пер. с нем. под ред. А. О. Буеверова. М.: ГЭОТАР-Медиа; 2010.
- Нисевич Н. И., Гусева Н. А., Гаспарян М. О., Чаплыгина Г. В. Хронические гепатиты В и дельта у детей: течение и отдаленные исходы // Детские инфекции. 2002. № 1. 14–17.
- Учайкин В. Ф., Нисевич Н. И. Вирусные гепатиты у детей. М.: Новая волна, 2003.
- Strader D. B., Wright T., Thomas D. L. et al. Diagnosis, management, and treatment of hepatitis C // Hepatology. 2004; 39 (4): 1147–1171.
- Арямкина О. Л. Хроническая HBV- и HCV-инфекция и рак печени: клинико-эпидемиологические и дифференциально-диагностические параллели // Эпидемиол. инфекц. болезни. 2006. № 2. 36–39.
- Бессонова Е. Н. Возможности противовирусной терапии у больных циррозом печени в исходе НСV-инфекции // Росс. журн. гастроэнтерол., гепатол., колопроктол. 2011. № 4. 43–51.
- Габина С. В., Коркоташвили Л. В., Переслегина И. А. и др. Детоксицирующая функция печени по данным фармакокинетики антипирина при заболеваниях органов пищеварения у детей // Эфферентная терапия. 2005. Т. 11. № 2. 14–17.
- Ипатов Ю. П., Комарова Л. Г., Переслегина И. А., Шабунина Е. И. Ключи к проблеме гастроэнтерологических заболеваний у детей. Нижний Новгород: Изд-во Волго-Вятской академии государственной службы. 1997.
- Малахова М. Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме // Эфферентная терапия. 2000. Т. 6. № 4. 3–14.
- Парменова Л. П. Эндогенная интоксикация у детей с заболеваниями верхних отделов пищеварительного тракта // Педиатрия. 2004. № 2. 15–19.
- Хохлова Н. И., Толоконская Н. П., Лапицкая Н. М., Пупышев А. Б., Гончарова И. А. Критерии оценки эндогенной интоксикации у больных острым вирусным гепатитом В // Инфекционные болезни. 2007. № 2. 11–15.
- Романова С. В. и др. Нарушения детоксицирующей функции печени и их коррекция при хроническом гепатите В у детей // Сибирский журнал гастроэнтерологии и гепатологии. 2001. № 12, 13. 191.
- Шабунина Е. И., Комарова Л. Г., Коркоташвили Л. В. Справочник по лабораторной диагностике в педиатрии. Нижний Новгород: Изд-во Волго-Вятской академии государственной службы. 2004.
- Малахова М. Я. Методы биохимической регистрации эндогенной интоксикации (сообщение первое) // Эфферентная терапия. 1995. № 1. 38–41.
- Соколова Л. Я. Диагностика и биокоррекция нарушений антиинфекционного гомеостаза в системе «мать — дитя»: книга для практического врача. Нижний Новгород: Изд-во Нижегородской государственной медицинской академии. 2004.
- Соловьева А. Н. Активность альдегиддегидрогеназы печени и эритроцитов крыс в норме и при ожоговой токсемии: Автореф. дис. … канд. мед. наук. Нижний Новгород. 2005.
- Реброва О. Ю. Статистический анализ медицинских данных. М.: Медиа Сфера. 2006.
- Буеверов А. О. Место гепатопротекторов в лечении заболеваний печени // Болезни органов пищеварения. 2001. Т. 3. № 1. 16–18.
- Сафонова С. А., Гершанович М. Л. Метадоксил в лечении гепатотоксического действия цитостатиков // Вопросы онкологии. 2005. Т. 51. № 5. 599–600.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







