Ключевые слова: кандидозный кольпит, резистентность к антимикотикам, фунгицидный эффект сертаконазола, антимикробная и противоэритематозная активность, Залаин®.
Для цитирования: Тихомиров А.Л., Сарсания С.И., Манухин И.Б., Казенашев В.В., Тускаев К.С., Юдина Т.А. Особенности лечения кандидозного кольпита // РМЖ. Мать и дитя. 2017. №26. С. 1977-1982
Tikhomirov A.L.1, Sarsania S.I.2, Manukhin I.B.1, Kazenashev V.V.1, Tuskayev K.S.2, Yudina Т.A.3
1 Moscow State Medical Stomatological University named after А.I. Evdokimov
2 Federal Center for Reproduction “Santa Maria”, Moscow
3 Multidisciplinary medical holding company «SM-Clinic», Moscow
The feature of candida colpitis (CC) is its high frequency, the prolonged course, frequent recurrence, the possibility of spreading to other organs and systems with the development of generalized forms of candidiasis, high resistance of pathogens to antimycotic drugs, difficulties in applying the therapy in pregnant women. CC accounts for 30-45% of the vaginal and vulval infections. The paper presents the pathogenesis and clinical picture of the three forms of CC: carriage of candidosis, acute form of CC, chronic (recurrent) CC. The issue of CC therapy and the problem of resistance to this therapy is highlighted. Fungistatic, not fungicidal, mechanism of action of drugs predetermines the possibility of developing resistance to antimycotics. An important task is to use the most effective antimycotics with an adequate spectrum of action to exclude possible relapses after treatment of acute CC. The drug of choice is sertaconazole (benzothiophene and imidazole derivative) because it is an effective antimycotic with an adequate spectrum of action and the possibility of convenient use (once for a course of treatment) is. The drug meets all the necessary requirements of antimycotics for the CC treatment, it is convenient to use (1 vaginal suppository for treatment) and is safe in clinical practice.
Key words: candida colpitis, resistance to antimycotics, fungicidal effect of sertaconazole, antimicrobial and anti-erythematous activity, Zalain®.
For citation: Tikhomirov A.L., Sarsania S.I., Manukhin I.B. et al. Features of candida colpitis treatment // RMJ. 2017. № 26. P. 1977–1982.
Статья посвящена особенностям лечения кандидозного кольпита. Показано, что рациональным выбором эффективного антимикотика адекватного спектра действия с возможностью удобного использования (однократного на курс лечения) является сертаконазол (Залаин).
Содержание статьи
- 1 Введение
- 2 Патогенез кандидозного кольпита
- 3 Клиническая картина кандидозного кольпита
- 4 Лечение кандидозного кольпита
- 5 Проблема резистентности к терапии
- 6 Выбор антимикотика для лечения кандидозного кольпита
- 7 Клинические наблюдения
- 8 Пациентка В., 28 лет (беременность 17–18 нед., обострение хронического КВ).
Введение
Кандидозный кольпит (КК) рассматривается в группе инфекций, характеризующихся патологическими вагинальными выделениями. Особенностями данной инфекции являются высокая частота, длительное течение, частое рецидивирование процесса, возможность распространения на другие органы и системы с развитием генерализованных форм кандидоза, высокая резистентность возбудителей к антимикотическим препаратам, трудности в применении терапии у беременных женщин и новорожденных. КК занимает одно из ведущих мест в структуре акушерско-гинекологической заболеваемости и является одной из наиболее частых причин обращения женщин за медицинской помощью. Частота КК за последние 10 лет почти удвоилась и составляет 30–45% в структуре инфекционных поражений влагалища и вульвы. При беременности заболеваемость возрастает примерно на 10–20% и является одной из причин развития осложнений. КК обнаруживают у 30% онкологических больных и у 64% больных с различными эндокринными нарушениями. Значительное учащение случаев КК обусловлено действием ряда предрасполагающих факторов, таких как длительный (а иногда и бесконтрольный) прием антибиотиков, кортикостероидов, цитостатиков, оральных контрацептивов, лучевая терапия; нарушение обмена веществ и функции эндокринной системы (гипо- и диспротеинемия, гипергликемия, грубые длительные погрешности в питании, хронические заболевания желудочно-кишечного тракта, дисфункция щитовидной
и половых желез, надпочечников и т. д.); гипо- и авитаминозы, нарушение витаминного баланса; дисбактериоз
на фоне хронических заболеваний желудочно-кишечного тракта, нарушений диеты; иммунодефициты, развившиеся на фоне инфекционного или гематологического заболевания, онкологического процесса, интоксикации и т. д.
Патогенез кандидозного кольпита
Патогенез КК сложен и недостаточно изучен. Учитывая тот факт, что штаммы C. albicans, выделенные у больных КК и у носителей, существенно не различаются по ряду биохимических характеристик, можно сделать заключение о ведущей роли состояния макроорганизма в развитии кандидозного вульвовагинита (КВ), а не свойств возбудителя. Триггером развития заболевания является не изменение свойств гриба, а снижение резистентности организма хозяина. Грибы рода Candida могут быть выделены из влагалища практически здоровых женщин при отсутствии клинических признаков КК (носительство). При определенных условиях под действием экзогенных и/или эндогенных факторов эти грибы становятся патогенными, вызывая заболевание. Однако четкие критерии разграничения носительства и стертых форм патологии отсутствуют. По мнению некоторых авторов, при наличии существенных факторов риска, например, при беременности, всякое обнаружение во влагалище грибов рода Candida свидетельствует о наличии КК, а не о носительстве. Это подтверждается результатами исследования, в котором только у 2% беременных с высевами C. albicans из влагалища было установлено отсутствие каких-либо патологических изменений [1].
Потенциально в развитии кандидозной инфекции различают следующие этапы: адгезия грибов к поверхности слизистой оболочки → колонизация грибами слизистой оболочки → инвазия в эпителий, преодоление эпителиального барьера слизистой оболочки, попадание в соединительную ткань собственной пластинки, преодоление тканевых и клеточных защитных механизмов → проникновение в сосуды и гематогенная диссеминация с поражением различных органов и систем, однако при КК инфекционный процесс чаще затрагивает поверхностные слои эпителия влагалища. В силу существующего на этом уровне динамического равновесия между микроорганизмами (грибами), которые стремятся, но не могут проникнуть в более глубоко расположенные слои слизистой оболочки, и макроорганизмом, который пытается, но не способен полностью элиминировать возбудитель, инфекция может персистировать годами. А сдвиги этого равновесия могут привести либо к обострению заболевания, либо к ремиссии или выздоровлению. На рисунке 1 представлены пути передачи и факторы риска КВ.
Клиническая картина кандидозного кольпита
В настоящее время различают 3 основные клинические формы КВ:
– кандидоносительство;
– острая форма КВ;
– хронический (рецидивирующий) КВ.
Кандидоносительство характеризуется отсутствием симптомов заболевания. Однако при микробиологическом исследовании в отделяемом влагалища в небольшом количестве (Сandida при отсутствии псевдомицелия. Бессимптомное носительство Сandida отмечается у 15–20% небеременных женщин репродуктивного возраста. При бессимптомном носительстве большинство из дрожжеподобных грибов находятся в фазе бластоспоры. Клинические проявления заболевания связаны с переходом в гифальную фазу.
Острая форма КК характеризуется ярко выраженной клинической картиной: гиперемия, отек, обильные или умеренные творожистые выделения из половых путей, высыпания в виде везикул на коже и слизистых оболочках вульвы и влагалища. При микробиологическом исследовании в отделяемом влагалища дрожжеподобные грибы рода Сandida присутствуют в высоком титре (>104 КОЕ/мл). Длительность заболевания острой формой кандидоза не превышает 2 мес.
Хронический КВ характеризуется длительностью заболевания более 2 мес. На коже и слизистых оболочках вульвы и влагалища преобладают вторичные элементы в виде инфильтрации, лихенизации и атрофичности тканей.
После завершения курса лечения, несмотря на отрицательные результаты культурального исследования, эрадикация микроорганизма может быть неполной. Это может привести к возникновению рецидивов, при этом этиологическую роль в их развитии обычно играет тот же штамм. Рецидивирующий КВ определяется как 4 или более обострения заболевания, доказанных микологически, в течение 12 мес. Развивается примерно у 5% пациенток с КК. При этом у 50% женщин с рецидивирующим КВ симптомы заболевания появляются в интервале от нескольких дней до 3 мес. после успешного излечения острой формы.
Хроническое и рецидивирующее течение объясняется некоторыми авторами глубоким проникновением гриба в клетки многослойного эпителия и образованием фагосом, в которых морфологически не измененные кандиды могут длительное время существовать и даже размножаться, будучи защищенными от действия лекарственных препаратов. По мнению ряда авторов, причиной рецидива КК может быть снижение чувствительности грибов Сandida к противогрибковым препаратам. По мнению других авторов, причинами рецидивирующего КВ являются изменения в локальном и клеточном иммунитете на уровне слизистой оболочки влагалища. Меньшее значение имеют гуморальный и врожденный иммунитет. Т1- и Т2-опосредованные клеточные реакции коррелируют с резистентностью и предрасположенностью к кандидозу слизистых оболочек. Реактивность
Т1-типа с продукцией стимулирующих макрофагов и полиморфноядерных лимфоцитов, а также IgА слизистой оболочки являются доминирующими реакциями во влагалище. Они поддерживают бессимптомную колонизацию кандид. Реактивность Т2-типа с образованием интерлейкина (ИЛ) 4–6, ИЛ-10, IgG, гистамина и простагландина Е2 преобладает в тех случаях, когда эндогенные и экзогенные факторы приводят к увеличению числа микроорганизмов C. albicans. Этот ответ «выключает» защитные реакции Т1-типа и запускает реакции гиперчувствительности немедленного типа [2]. Candida из фазы бластоспоры переходит в фазу гифы, и возникает инвазия эпителия. Определенное значение в развитии рецидивирующего КВ имеют факторы вирулентности Candida, среди которых выделяют чувствительность к антимикотикам, трансформацию бластоспор C. albicans в гифы. Распространение кандидозного вульвовагинита, вызванного дрожжевыми грибами, отличными от C. albicans, привело к появлению термина «non-albicans кандидоз» (НАК). Некоторые исследователи склонны относить НАК к осложненному КВ, мотивируя это частой ассоциацией НАК с хроническим рецидивирующим течением заболевания, трудно излечиваемого традиционными антимикотическими препаратами. Отличная от C. albicans этиология отмечается чаще у женщин старше 35 лет. Имеется ряд клинико-эпидемиологических и лабораторных характеристик, позволяющих клиницисту диагностировать НАК. Подобный диагноз можно предположить у больных с рецидивами КВ после неоднократного применения антимикотиков, у пациенток, предъявляющих жалобы на зуд при незначительных выделениях из половых путей, у пациенток с проявлениями бактериального вагиноза или при обнаружении сопутствующей инфекции, передаваемой половым путем, а также в случае отсутствия псевдомицелия грибов при микроскопии вагинального мазка.
Лечение кандидозного кольпита
Проблема резистентности к терапии
Одним из вопросов, важных для гинекологов, сталкивающихся с проблемой КВ, является причина резистентности к терапии. Среди известных видов Candida 20 патогенны для человека, из которых 8 чаще выделяются от больных кандидозом, а 4 признаны главными возбудителями: Candida albicans, Candida tropicalis, Candida рarapsilosis, Candida glabrata. Основная причина, которая заставляет обращать внимание на этиологическую неоднородность кандидоза, – это устойчивость части видов к антимикотическим препаратам. Для понимания причин устойчивости к антимикотикам необходимо вспомнить о механизмах их действия. В большинстве случаев это фунгистатический эффект, благодаря которому антимикотики не убивают, а лишь останавливают размножение грибов, за счет чего колонии возбудителя со временем погибают. Данный фунгистатический, а не фунгицидный механизм и предопределяет возможность развития устойчивости. Несмотря на бурное развитие фармакологической индустрии, огромный выбор антимикотических препаратов, проблема лечения КВ не теряет своей актуальности. Учитывая высокую частоту заболевания, длительное течение, частое рецидивирование процесса, можно предположить, что, вероятнее всего, в основе лежит несовершенный подход к лечению данного заболевания.
Выбор антимикотика для лечения кандидозного кольпита
Необходимость использования наиболее эффективных антимикотиков адекватного спектра действия для исключения возможных рецидивов после лечения острого КВ является важной задачей. Данным требованиям соответствует препарат Залаин® – антимикотик сертаконазол, производное бензотиофена и имидазола, выпускаемый в виде вагинального суппозитория. По механизму действия Залаин® оказывает не только фунгистатическое, но и фунгицидное воздействие на возбудителя. Дополнительный фунгицидный механизм действия обусловлен наличием в структуре препарата, помимо азолового кольца, бензотиофена. Азоловая структура препятствует синтезу эргостерина (эргостерол), одного из основных компонентов мембраны грибковой клетки, обусловливая тем самым фунгистатический эффект. Непосредственной мишенью для действия азолов является фермент С-14a-деметилаза ланостерола, участвующий в синтезе эргостерола. Для того чтобы ингибиторы эргостеролового синтеза оказывали свое действие, необходимы их проникновение внутрь грибковой клетки, накопление в достаточной концентрации, перемещение к микросомам, на которых расположен фермент-мишень, и связь с этим ферментом. Соответственно, в развитии устойчивости могут быть задействованы механизмы снижения концентрации препарата в клетке за счет сокращения его поступления или, наоборот, усиленного выведения из клетки, разрушение или химическая модификация препарата на его пути к мишени, нарушенное взаимодействие с мишенью за счет ее видоизменения или исчезновения. Кроме этого, существуют адаптационные механизмы, при которых количество ферментов-мишеней возрастает до такой степени, что препарата для связи с ними не хватает, а также запасные пути метаболизма [3]. Бензотиофен в составе сертаконазола вызывает разрыв плазматической мембраны грибковой клетки, что и приводит к ее гибели, т. е. оказывает фунгицидное действие. Бензотиофен обладает высокой липофильностью, чем усиливает проникновение сертаконазола в ткани. Благодаря такому механизму действия риск развития рецидивов при лечении КВ является минимальным. Механизм действия препарата Залаин® представлен на рисунке 2.
Помимо высокоэффективного антимикотического действия (на все виды грибов рода Candida и другие патогенные дрожжевые грибы: Torulopsis, Trichosporon, Malassezia, Pityrosporymorbicular, дерматофиты: Trichophyton, Microsporum, Epidermophiton, филаментные грибы-оппортунисты: Scopulariopsis, Altermania, Acremonium, Aspergillus, Fusarius) Залаин® обладает широким спектром действия на неспецифическую флору: Streptococcus spp., Stahpillococcus spp., Proteus spp., Bacteroides spp., E. сoli. Сертаконазол при местном применении обладает нулевой биодоступностью, не обнаруживается в плазме и моче, в связи с чем возможно его применение во время беременности (рис. 3). Прием Залаина приводит к излечению КК, которое характеризуется быстрым исчезновением симптомов и клинических проявлений заболевания и отрицательным результатом микроскопического исследования влагалищных мазков и культурального анализа [4]. По данным В.Н. Серова (2014) [5], эффективность терапии Залаином составила 100% у 84 пациенток с КК, ранее без существенного эффекта использовавших терапию как местными, так и системными антимикотиками (клотримазол, флуконазол, натамицин, кетоконазол, эконазол, миконазол). Имеется также возможность комбинированной терапии Залаина с системными антимикотиками при рецидивах, наблюдается эффективность использования крема Залаин® при признаках распространения КК на кожу вульвы и баланопостите у полового партнера [6]. При КК у беременных Залаин® изучали В.Е. Радзинский, И.М. Ордиянц (2006). Регресс симптомов на 2-е сут отмечен у 73,3% пациенток, клиническое излечение через 7 дней – у 86,7%, через 14 дней – у 100% беременных с КК, т. е. лишь в 13,3% наблюдений потребовалось использование 2 свечей Залаина [7].
КК – распространенный пример биопленочной инфекции, в которой грибы рода Candida выступают в роли оппортунистов, участвуя в формировании биопленок другими микроорганизмами – инициаторами построения биопленок [8]. В этом отношении доказанная антимикробная активность Залаина (грибы, стрептококки, гарднереллы, стафилококки, энтерококки, бактероиды, трихомонады) повышает результативность лечения КК (рис. 4).
Кроме этого, установлено, что препарат уменьшает клинические проявления воспаления на 40% по сравнению с контролем за счет продукции оксида азота (универсальный эндотелиальный релаксирующий фактор – противоэритематозное, противоотечное действие), который ингибирует активность 5-циклооксигеназы, липооксигеназы – ингибирует метаболизм арахидоновой кислоты в очаге воспаления, что было доказано в экспериментах на лабораторных животных (рис. 5). 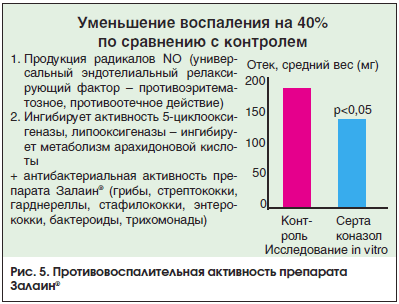
При этом у препарата Залаин® отсутствует системная абсорбция – препарат можно применять длительно без негативных последствий для организма. Использование Залаина не нарушает защитный механизм вагинального биотопа – препарат не ингибирует рост Lactobacillus, а значит, нет «эффекта пинг-понга»: был кандидоз – стал вагиноз [9].
Ниже представлены клинические примеры использования препарата Залаин® при КК.
Клинические наблюдения
Пациентка С., 38 лет (хронический рецидивирующий КВ).
Обратилась с жалобами на периодический зуд в области наружных половых органов и влагалища, сухость, жжение.
Из анамнеза: менструации с 14 лет, установились сразу, умеренные, регулярные, безболезненные, через 28–30 дней, 5–6 дней. Половая жизнь с 18 лет, вне брака, количество половых партнеров – более 10, в настоящее время 1 половой партнер в течение 10 лет. Беременность – 2: роды – 0, аборт – 1 (2003 г.), без осложнений, выкидыш – 1 (2015 г.) на сроке 8 нед. c диагностическим выскабливанием слизистой полости матки. Контрацепция: оральные контрацептивы в течение жизни. В настоящее время не использует. В беременности заинтересована.
Экстрагенитальные заболевания: хронический тонзиллит. Хронический колит (2002 г.). Аутоиммунный тиреоидит (2007 г.). Железодефицитная анемия.
Гинекологические заболевания: в период с 1999 по 2003 г. трихомониаз, хламидиоз, герпесвирусные инфекции, бактериальный вагиноз, КВ. С 2004 г. КВ с обострением практически перед каждой менструацией (около 9 эпизодов за год). Лечение.
В 2005 г. эктопия шейки матки. Вирус папилломы человека (ВПЧ) (16-й тип). В 2006 г. электроэксцизия шейки матки.
В 2009 г. аденомиоз. Миома матки малых размеров. В 2009
и 2012 гг. раздельное диагностическое выскабливание слизистой полости матки по поводу патологии эндометрия (железисто-фиброзные полипы эндометрия).
Подробнее об эпизодах КВ: первый эпизод КВ в 2004 г. после незащищенного полового контакта с новым половым партнером. Гинекологом поставлен диагноз «КВ. Бактериальный вагиноз?». Лечение: метронидазол, нистатин свечи, таблетки. Отмечен положительный терапевтический эффект, но перед очередной менструацией вновь ощутила зуд, появились творожистые выделения, жжение. В течение 1 года практически ежемесячно появлялись симптомы рецидивирующего КВ. Лечение: системные антимикотики, свечи, кремы (флуконазол, комплексные препараты, нистатин, кетоконазол, клотримазол). В этот период активно использовала комбинированные оральные контрацептивы (КОК). Очередным лечащим врачом рекомендована отмена КОК, которая привела к ремиссии заболевания на 3 мес. Далее эпизоды КВ отмечались от 4 до 6 в год, лечение отличалось лишь длительностью и комбинацией вышеперечисленных препаратов. Обострения провоцировались изменением питания, климатом, морской водой. В эти периоды пациентка постоянно самостоятельно принимала различные антимикотики.
В 2005 г. после появления контактного кровотечения в женской консультации диагностировали дисплазию шейки матки, ВПЧ 16-й тип. Лечение не проводилось. Лишь после увеличения частоты обострений КВ до 1–2 эпизодов в месяц в 2006 г. обратилась на кафедру медицинского университета, где было проведено комплексное лечение КВ с последующей электроэксцизией шейки матки и назначением противовирусного препарата по стандартной схеме.
Лечение КК: 1 свеча Залаин® во влагалище + флуконазол в/в капельно в течение 5 дней (в рамках научного исследования). На фоне терапии было отмечено улучшение состояния уже на 2-е сут. В последующем проведено лечение шейки матки с учетом менструального цикла с противовирусным стандартным протоколом. После вышеописанного комплексного лечения обострений у данной пациентки не было вплоть до 2015 г., когда на фоне беременности появились бело-желтоватые творожистые выделения, зуд. Совместно с противовоспалительным антибактериальным лечением после инструментального удаления неразвивающейся беременности назначен флуконазол 150 мг на 2-е и 5-е сут проводимой терапии. После восстановления менструального цикла вновь появились симптомы КВ (периодический зуд в области наружных половых органов и влагалища, сухость, жжение) перед каждой менструацией в течение 2–3 дней, которые самостоятельно купировались после окончания кровянистых выделений. При появлении вышеописанных жалоб пациентка вновь обратилась к врачу. Проведено бимануальное, бактериоскопическое, бактериологическое исследование. При осмотре область половых губ – с элементами лихенизации, слизистая вульвы и влагалища гиперемирована, суховата, выделения скудные, серо-зеленоватого цвета. Бактериоскопическое/бактериологическое исследования: обнаружены дрожжеподобные грибы рода Сandida; флора палочковая скудная. Candida albicans 104; Candida glabrata 106; лактобактерии 102. Клинический диагноз: хронический рецидивирующий КВ. Аденомиоз. Миома матки малых размеров.
С учетом данных анамнеза, проведенного дообследования пациентке проведено лечение препаратом Залаин® – 1 влагалищная свеча 1 раз в 7 дней, дважды. На область лихенизации и в пределах 1 см здоровой кожи – тонким равномерным слоем крем Залаин® 2 раза в день, в течение 4 нед.
Отмечен положительный терапевтический эффект через 2 дня после начала лечения. Проведен контроль лечения через 2 нед. после окончания терапии. Полное клиническое излечение подтверждено лабораторными данными.
В настоящее время прошло 6 мес. после окончания терапии. В течение последних 2 мес. были смена климата, изменение питьевого и пищевого рациона, рецидива КВ нет.
Пациентка В., 28 лет (беременность 17–18 нед., обострение хронического КВ).
На учете в женской консультации по месту жительства. Обратилась с жалобами на умеренный зуд во влагалище, творожистые обильные выделения. При разговоре угрюма, готова расплакаться. На вопрос о причине такого настроения отвечает, что «устала лечить эти грибы и боится последствий, как в прошлую беременность».
Из анамнеза: менструации с 12 лет, установились сразу, умеренные, регулярные, безболезненные, через 28 дней, 4–5 дней. Половая жизнь с 20 лет, в браке (первый), половой партнер один с начала половой жизни по настоящее время.
Беременность – 2-я настоящая. Роды – 1 в 2015 г., преждевременное излитие околоплодных вод на сроке 37 нед., гипоксия плода. Родоразрешение путем кесарева сечения.
Экстрагенитальные заболевания: отрицает.
Аллергический анамнез – тержинан (покраснение, отек слизистых).
Гинекологические заболевания: в 2015 г. острый КВ во время беременности с последующим обострением около 8 раз за весь период беременности.
В 2015 г. раздельное диагностическое выскабливание слизистой полости матки по поводу плацентарного полипа.
На руках заключение УЗИ (2 дня назад), результаты бактериоскопического, бактериологического, цитологического, ПЦР-исследований, на основании которых поставлен диагноз «хронический рецидивирующий КВ» (Candida albicans 106). Отмечено также при УЗИ наличие «взвеси» в околоплодных водах.
Данное обострение – третье за весь период настоящей беременности. Лечение проводили натамицином (таблетки – 7 дней, свечи – 6 дней), клотримазолом (свечи – 5 дней). Терапевтический эффект – на 2-е сут, исчезновение симптомов – на 3–4-е сут. Между первым и вторым обострением прошел 1 мес., после последнего лечения прошло 18 дней.
Лечащим врачом женской консультации назначен вновь курс натамицина, от чего пациентка отказалась и решила получить консультацию в другом учреждении.
С учетом данных анамнеза, проведенного бимануального исследования, психоэмоционального состояния беременной, результатов представленных исследований было проведено лечение: Залаин® 1 свеча во влагалище с дополнительным самоконтролем наличия/отсутствия вышеописанных жалоб. При сохранении жалоб был рекомендован второй прием влагалищной свечи с последующим клиническим и лабораторным контролем. Однако пациентка для самоуспокоения обратилась вновь через 1 нед. Со слов пациентки, улучшение самочувствия произошло через
1,5 дня, с полным исчезновением симптомов к 4 сут. При разговоре расслаблена, улыбается. При осмотре слизистые вульвы, влагалища, шейки матки визуально не изменены, выделения и окраска слизистых оболочек соответствуют беременности. Повторного введения препарата Залаин® не требуется. Для подтверждения полного клинического выздоровления рекомендована лабораторная диагностика по месту жительства через 14 дней.
Высокая клиническая эффективность сертаконазола (более 95%), короткий курс лечения и удобство применения (однократное интравагинальное введение 300 мг сертаконазола – 1 свеча на ночь), отсутствие побочных эффектов и системного воздействия, широкий спектр действия, безрецептурная продажа в аптеках, возможность использования при беременности и лактации позволяют считать Залаин® одним из препаратов первого выбора для эффективного лечения острого вульвовагинального кандидоза, в т. ч. в сочетании с неспецифическим вагинитом.
Литература
1. Кубась В.Г. Этилогия, патогенез и лабораторная диагностика кандидоза: Методические рекомендации. 2006 [Kubas’ V.G. Jetilogija, patogenez i laboratornaja diagnostika kandidoza: Metodicheskie rekomendacii. 2006 (in Russian)].
2. Genital yeast infection,candidosis. CDC. 2006.
3. Сергеев А.Ю., Маликов В.Е., Жариков Н.Е. Этиология вагинального кандидоза и проблема устойчивости к антимикотикам. Национальная академия микологии, серия «Медицинская микология». 2001; вып. 4 [Sergeev A.Ju., Malikov V.E., Zharikov N.E. Jetiologija vaginal’nogo kandidoza i problema ustojchivosti k antimikotikam. Nacional’naja akademija mikologii, serija «Medicinskaja mikologija». 2001; vyp. 4 (in Russian)].
4. Манухин И.Б., Захарова Т.П., Фириченко С.В. и др. Диагностика и лечение урогенитальных инфекций в акушерстве и гинекологии: Учебное пособие для врачей. М., 2013. С. 96 [Manuhin I.B., Zaharova T.P., Firichenko S.V. i dr. Diagnostika i lechenie urogenital’nyh infekcij v akusherstve i ginekologii // Uchebnoe posobie dlja vrachej. M., 2013. S. 96 (in Russian)].
5. Серов В.Н. Проблемы вульвовагинального кандидоза в гинекологической практике // Русский медицинский журнал. 2014. № 6. С. 418–422 [Serov V.N. Problemy vul’vovaginal’nogo kandidoza v ginekologicheskoj praktike // Russkij medicinskij zhurnal. 2014. № 6. S. 418–422 (in Russian)].
6. Хамаганова И.В. Местная терапия вульвовагинального кандидоза // Акушерство и гинекология. 2012. № 4 (2). С. 123–125 [Hamaganova I.V. Mestnaja terapija vul’vovaginal’nogo kandidoza // Akusherstvo i ginekologija. 2012. № 4 (2). S. 123–125 (in Russian)].
7. Радзинский В.Е., Ордиянц И.М. Профилактика послеродовых инфекций у беременных с кандидозным вагинитом // Гинекология. 2006. № 4. С. 51–53 [Radzinskij V.E., Ordijanc I.M. Profilaktika poslerodovyh infekcij u beremennyh s kandidoznym vaginitom // Ginekologija. 2006. № 4. S. 51–53 (in Russian)].
8. Peters B.M., Jabra-Rizk M.A., Leid J.G. et al. Microbial interactions and differential protein expression in Staphylococcus aureus and Candida albicans dual-species biofilms // FEMS Immunol Med Microbiol. 2010. Vol. 59. P. 493–503.
9. Palacin C., Sacristan A., Ortiz J.A. In vitro comparative study of the fungistatic and fungicidal activity of sertaconazole and other antifungals against Candida albicans II Arzneim.Forsch // Drug Res. 1992. Vol. 42. P. 711–714.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





